- Урок 28. Химические свойства воды – HIMI4KA
- Взаимодействие с оксидами неметаллов
- Взаимодействие с металлами
- Химические свойства металлов
- 1. Взаимодействие металлов с неметаллами
- 2. Взаимодействие металлов с водой
- 3. Взаимодействие металлов с растворами солей
- 4. Взаимодействие металлов с растворами щелочей
- 5. Взаимодействие металлов с кислотами
- Общие химические свойства металлов — урок. Химия, 9 класс
- Урок химии в 8 классе "Химические свойства воды. Применение"
- Гагарина Т. | Химические свойства воды. 8 класс | Журнал «Химия» № 19/2009
- Т.В.ГАГАРИНА, учитель химии и биологии Кадетской школы-интерната № 10 (Москва)
- Химические свойства металлов
- Сегодня мы с вами изучим общие химические свойства металлов.
- В реакциях металлы проявляют восстановительные свойства, то есть они отдают электроны и превращаются в положительные ионы, сами при этом окисляются.
- Сначала разберём реакции металлов с простыми веществами – неметаллами.
- Например, с кислородом взаимодействуют практически все металлы, кроме золота и платины, при этом образуются оксиды.
Щелочные и щелочноземельные металлы при обычной температуре легко окисляются на воздухе, поэтому их обычно хранят в закрытых сосудах или под слоем масла.
Так, в реакции лития с кислородом воздуха образуется оксид лития, при этом литий повышает свою степень окисления с 0 до +1, а кислород понижает свою степень окисления с 0 до -2, литий является восстановителем, а кислород – окислителем, четыре атома лития отдают по одному электрону молекуле кислорода.
В реакции кальция с кислородом, кальций также повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2. Металл кальций выступает в роли восстановителя, а кислород – в роли окислителя, при этом два атома кальция отдают по два электрона молекуле кислорода. В результате реакции образуется оксид кальция.

Такие металлы, как алюминий, цинк, свинец при обычной температуре реагируют с кислородом воздуха, покрываясь тонкой плёнкой оксида, которая защищает их от дальнейшего окисления. Слой оксида, образующегося на поверхности алюминия, настолько тонок, что металл не теряет своего блеска.
Так, в реакции алюминия с кислородом, образуется оксид алюминия, алюминий повышает свою степень окисления с 0 до +3, являясь при этом восстановителем, а кислород, наоборот, понижает свою степень окисления с 0 до -2.
В этой реакции четыре атома алюминия отдают по три электрона молекуле кислорода.
Многие металлы взаимодействуют с кислородом при нагревании: например, медь при нагревании на воздухе чернеет, так как покрывается плёнкой чёрного оксида меди два.
В этой реакции медь выступает в роли восстановителя и повышает свою степень окисления с 0 до +2, а кислород – окислитель, понижает свою степень окисления с 0 до -2. При этом два атома меди отдают по два электрона молекуле кислорода.
При прокаливании железа образуется железная окалина – это смешанный оксид, который состоит из оксида железа два и оксида железа три.
Железо, в данном случае, является восстановителем, оно повышает свою степень окисления с 0 до +2 и +4, значит, железо – это восстановитель, а кислород – окислитель, он понижает свою степень окисления с 0 до -2. В этой реакции три атома железа отдают восемь электронов молекуле кислорода.

А вот магний при поджигании на воздухе сгорает яркой вспышкой, образуя оксид магния.
Магний также является восстановителем, потому что повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2 и является окислителем. В результате реакции образуется оксид магния, а два атома магния отдают по два электрона молекуле кислорода.

- Таким образом, большинство металлов реагируют с кислородом с образованием оксидов, активные металлы вступают во взаимодействие с кислородом при обычных условиях, менее активные при нагревании, а такие, как золото или платина не реагируют с кислородом.
- Металлы в этих реакциях являются восстановителями и, соответственно, повышают свою степень окисления, а кислород является окислителем и понижает свою степень окисления.
- С серой все металлы, кроме золота, способны взаимодействовать при незначительном нагревании, образуя сульфиды:
В реакции натрия с серой образуется сульфид натрия, натрий повышает свою степень окисления с 0 до +2, он является восстановителем, сера является окислителем и понижает свою степень с 0 до -2. В результате взаимодействия два атома натрия отдают по одному электрону молекуле серы.
В реакции кальция с серой образуется сульфид кальция, кальций также повышает свою степень окисления с 0 до +2, являясь при этом восстановителем, а сера понижает свою степень окисления с 0 до -2 и является окислителем, при этом, каждый атом кальция отдаёт по два электрона молекуле серы.
А в реакции железа с серой образуется сульфид железа два. Здесь также железо является восстановителем, повышает свою степень окисления с 0 до +2, а серя, являясь окислителем, понижает свою степень окисления с 0 до -2. Каждый атом железа здесь отдаёт по два электрона молекуле серы.

Если смешать небольшое количество порошка алюминия с порошком серы и нагреть сверху смесь пламенем лучинки, то в результате бурной реакции образуется сульфид алюминия:
Алюминий выступает в роли восстановителя и повышает свою степень окисления с 0 до +3, а сера понижает свою степень окисления с 0 до -2 и является окислителем. В этой реакции два атома алюминия отдают по три электрона молекуле серы.

Таким образом, с серой при определённых условиях реагируют все металлы кроме золота, в результате этого взаимодействия образуются сульфиды, в которых степень окисления серы равна мину двум. В этих реакциях металлы выступают в роли восстановителей, а сера – в роли окислителя.
C фтором, хлором, бромом и йодом – металлы реагируют с образованием галогенидов.
Так, в реакции алюминия с йодом образуется йодид алюминия, а катализатором в этой реакции является вода.
В этой реакции алюминий также повышает свою степень окисления с 0 до +4, являясь при этом восстановителем, а йод является окислителем и понижает свою степень окисления с 0 до -1. При этом два атома алюминия отдают по три электрона молекуле йода.
Таким образом, в реакциях с галогенами, металлы являются восстановителями и повышают свою степень окисления, а сами галогены являются окислителями и понижают свою степень окисления, при этом металлы окисляются, а галогены восстанавливаются. В результате этих реакций образуются галогениды.
Металлы не только реагируют с неметаллами – простыми веществами, но и вступают в реакции со сложными веществами.
Например, с водой эффективно реагируют щелочные и щелочноземельные металлы. Если натрий поместить в ёмкость с водой, в которую добавили несколько капель фенолфталеина, то он будет двигаться по поверхности воды, бурно реагируя с ней. При этом выделяется водород и образуется гидроксид натрия, окрашивающий фенолфталеин в малиновый цвет.
Металлический натрий выступает в качестве восстановителя, он повышает свою степень окисления с 0 до +1, а ионы водорода выступают в качестве окислителя и водород понижает свою степень окисления с +1 до 0. В этой реакции два атома натрия отдают по одному электрону ионам водорода.
Некоторые металлы взаимодействуют с водой при определённых условиях, например, цинк – при нагревании, железо – в раскалённом виде с парами воды. При этом образуются оксиды металлов и выделяется водород.
Так, в реакции с цинком образуется оксид цинка и водород. Цинк при этом, являясь восстановителем, повышает свою степень окисления с 0 до +2 и отдаёт по два электрона ионам водорода.
Катионы водорода выступают в роли окислителя и понижают свою степень окисления с +1 до 0.
В реакции с железом, аналогично, железо является восстановителем, повышает свою степень окисления с 0 до +2 и +3, при этом три атома железа отдают по восемь электронов ионам водорода, а ионы водорода понижают свою степень окисления с +1 до 0 и являются окислителями.
- Если металл стоит в ряду активности после водорода, то он не вытесняет водород из воды ни при каких условиях.
Таким образом, щелочные и щелочноземельные металлы реагируют с водой с образованием щелочей, при этом выделяется водород, некоторые металлы реагируют с водой только при нагревании, при этом образуются оксиды и выделяется водород, а металлы, стоящие в ряду активности после водорода не реагируют с водой. В этих реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли окислителя.
Металлы реагируют и с кислотами. Активность металлов при взаимодействии с растворами кислот зависит от положения металла в ряду активности. Металлы, стоящие в ряду активности до водорода, способны вытеснять водород из разбавленных растворов кислот.
- Следует учитывать и следующее металл реагирует с кислотой:
- · металл должен стоять в ряду активности до водорода
- · если образуется растворимая соль
- · концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами, при этом водород не выделяется
- · на щелочные металлы это правило не распространяется, так как они реагируют активно с водой, а речь в данном случае идёт о растворах кислот
- Например, в реакции магния с раствором серной кислоты, магний выступает в роли восстановителя, а ионы водорода в качестве окислителя.
При этом магний повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Каждый атом магния отдаёт по два электрона ионам водорода.
- Металлы, стоящие в ряду активности после водорода, к такому взаимодействию не способны:
- Например, медь стоит в ряду активности после водорода, поэтому она не реагирует с раствором соляной кислоты.
Если налить в две пробирки растворы кислот: в первую – раствор соляной кислоты, во вторую – раствор серной кислоты, а затем поместить в каждую по грануле цинка, то в результате у нас появляются пузырьки газа и в первой, и во второй пробирке. Значит, цинк стоит в ряду активности металлов до водорода, поэтому он способен вытеснять водород из раствора кислот.
Цинк в обеих реакциях является восстановителем, он повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0, при этом выступая в роли окислителя. В этих двух реакциях атом цинк отдаёт по два электрона ионам водорода.
- Следует помнить, что металлы, стоящие в ряду активности до водорода, реагируют с растворами кислот, но в результате этих реакций должна образоваться растворимая соль, на щелочные металлы эти правила не распространяются, концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами.
- Металлы реагируют с растворами солей, при этом нужно также использовать ряд активности металлов: более активный металл способен вытеснять другой металл из раствора соли, однако при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, потому что они реагируют с водой, а реакции эти протекают в растворе.
Если в две пробирки налить раствора сульфата меди (II) и поместить в первую кусочек железа, а во вторую гранулу цинка, то реакция будет у нас идти в двух пробирках. На кусочке железа и грануле цинка оседает медь и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на жёлтую, во второй – с голубой на более светлую.
В этой реакции железо выступает в роли восстановителя, само при этом окисляясь. Атомы железа превращаются в ионы железа. Ионы меди выступают в роли окислителя, они восстанавливаются, превращаясь в атомы меди. В результате окислительно-восстановительной реакции электроны от атомов железа переходят к ионам меди.
- Во второй реакции, в роли восстановителя выступает цинк, сам он окисляется, атомы цинка превращаются в ионы цинка, ионы меди выступают в роли окислителя, ионы меди восстанавливаются и превращаются в атомы меди, электроны от атомов цинка переходят к ионам меди.
- Следовательно, металлы реагируют и с растворами кислот, но нужно помнить, что каждый металл вытесняет из раствора соли другой металл, стоящий правее него в ряду напряжений металлов, при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, так как они реагируют с водой.
- Сделаем вывод:
- · металлы реагируют с простыми веществами, такими, как:
- · кислород
- · сера
- · галогены
- · со сложными:
- · вода
- · кислоты
- · соли
Урок 28. Химические свойства воды – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.

При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).

При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):

Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам.
Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах.
Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
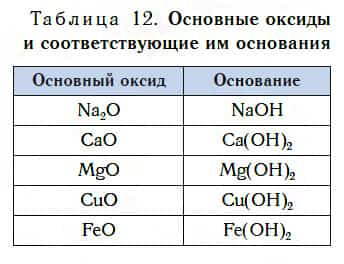
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
- В этих реакциях выделяется водород и образуются растворимые в воде основания.
- Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
- Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химические свойства металлов
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
Ме – ne = Men+
1. Взаимодействие металлов с неметаллами
- а) Взаимодействие металлов с водородом.
- С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
- Например:
- 2Na + H2 = NaH
- Ca + H2 = CaH2
- Образуются нестехиометрические соединения с ионной кристаллической структурой.
- б) Взаимодействие металлов с кислородом.
- Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
- Пример:
- 2Na + O2 = Na2O2 (пероксид)
- 4K + O2 = 2K2O
- 2Mg + O2 = 2MgO
- 2Cu + O2 = 2CuO
- в) Взаимодействие металлов с галогенами.
- Все металлы реагируют с галогенами с образованием галогенидов.
- Пример:
- 2Al + 3Br2 = 2AlBr3
- В основном это ионные соединения: MeHaln
- г) Взаимодействие металлов с азотом.
- С азотом взаимодействуют щелочные и щелочноземельные металлы.
- Пример:
- 3Ca + N2 = Ca3N2
- Mg + N2 = Mg3N2 – нитрид.
- д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды.
Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
4Al + 3C = Al4C3
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой
- Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
- Na + 2H2O = H2↑ + 2NaOH
- Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Zn + CuSO4= Cu0↓ + ZnSO4
= – 0,76 B., = + 0,34 B.
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
- Пример:
- Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
- 1 Zn0 + 4OH– – 2e = [Zn(OH)4]2– окисление
- Zn0 – восстановитель
- 1 2H2O + 2e = H2 + 2OH– восстановление
- H2O – окислитель
- Zn + 4OH– + 2H2O = [Zn(OH)4]2– + 2OH– + H2↑
- Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
- 4Nb +5O2 +12KOH = 4K3NbO4 + 6H2O
5. Взаимодействие металлов с кислотами
- Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
- По активности металлы условно делятся на активные, средней активности и малоактивные.
- Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H+. При взаимодействии с металлами выделяется кислород (H2↑).
С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
- H2S↑ – c активными металлами
- 6+ +8е
- H2SO4 +6е S0↓ – с металлами средней активности
- SO2↑ – c малоактивными металлами
- NH3 ( NH4NO3 )– c активными металлами
- 5+ +8e
- HNO3 +4,5e N2O, N2 – с металлами средней активности
- разб.
- +3e
- NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe2+, Cr → Cr2+. При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe3+, Cr → Cr3+, при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Общие химические свойства металлов — урок. Химия, 9 класс
Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества, обладающие металлическими свойствами, в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются свойства восстановителя).
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
1. В ряду активности восстановительные свойства металлов снижаются. Самые сильные восстановительные свойства у первых металлов ряда.2. Более активный металл может вытеснить из растворов солей металлы, расположенные в ряду активности после него.3. Металлы, расположенные в ряду активности до водорода, вытесняют его из растворов кислот.
4. Щелочные и щелочноземельные металлы в водных растворах сначала вступают в реакцию с водой.
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется оксид магния:
2Mg0+O02→2Mg+2O−2.
Видеофрагмент:
| Горение магния в воздухе |
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия:
2Na0+Cl02→2Na+1Cl−1.
3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
Zn0+S0→Zn+2S−2.
Видеофрагмент:
| Взаимодействие цинка с серой |
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
- Например, при взаимодействии лития с азотом образуется нитрид лития:
- 6Li0+N02→2Li+13N−3.
- При взаимодействии кальция с фосфором образуется фосфид кальция:
- 3Ca0+2P0→Ca+23P−32.
- Взаимодействие со сложными веществами
1. Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных условиях, образуя растворимое в воде основание (щёлочь) и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и водород:
2Na0+2H+12O−2→2Na+1O−2H+1+H02.
Видеофрагмент:
| Взаимодействие натрия с водой |
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe3O4 и водород:
3Fe0+4H+12O−2→Fe+2O−2⋅Fe+32O−23+4H02.
2. Mеталлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной кислотой образуются сульфат алюминия и водород:
2Al0+3H+12S+6O−24→Al+32(S+6O−24)3+3H02.
Видеофрагмент:
| Реакция алюминия с серной кислотой |
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди((II)) образуются сульфат железа((II)) и медь:
Fe0+Cu+2S+6O−24→Fe+2S+6O−24+Cu0.
Видеофрагмент:
| Взаимодействие железа с сульфатом меди |
Урок химии в 8 классе "Химические свойства воды. Применение"
- Урок в 8 классе
- Тема «Химические свойства воды. Применение воды»
- Учитель химии
- ФГКОУ КК СК РФ
- г. Севастополя,
Зубенко В.А.
Тема: Химические свойства воды. Применение.
- Цель урока: повторить физические свойства воды и изучить химические свойства, значение воды для живых организмов, а так же выяснить экологические проблемы, связанные с загрязнением воды.
- Задачи урока:
- Образовательные: сформировать знания учащихся о зависимости свойств воды, от состава и строения закрепить знания о типах химических реакций, начать формировать представления о важнейших классах неорганических соединений: основаниях.
Развивающие: развивать наблюдательность, память при просмотре компьютерной презентации и проведении демонстрационного эксперимента. Развивать умение сравнивать, прогнозировать, обобщать и делать выводы. Развивать информационную культуру учащихся.
- Воспитательные: воспитывать бережное и экономное отношение к водным ресурсам, продолжить экологическое просвещение школьников, прививать заботу к окружающей среде и своему здоровью, развивать чувство прекрасного.
- Формируемые компетенции:
- учебно-познавательная компетенция: развитие умений сравнивать, анализировать, доказывать, составлять схемы на основе работы с текстом, быть способными решать следующие жизненно-практические задачи: умение давать оценку состояния окружающей среды, выдвижение своих идей по охране водных ресурсов родного края;
- информационная компетенция: развитие умения анализировать и отбирать необходимую информацию, умения готовить и делать сообщения, умения пользоваться Интернатом для поиска учебной информации;
- коммуникативная компетенция: развитие умений вести беседу, диалог, задавать вопросы.
- Формы организации работы детей: групповая (просмотр презентации, практическая работа, решение задач), индивидуальная (беседа, работа с рабочей тетрадью), проблемное обучение (решение проблемных вопросов).
- Оборудование: Компьютер.
- Метапредметные связи: химия, биология, география, экология, литература, русский язык, физика.
- Ход урока:
- 2. Диктант
- В организме человека воды содержится … (65%)
- Химическая формула воды… (Н2О)
- Максимальная плотность воды при t = 40C… (1 г/см3)
- Метод определения состава вещества … (анализ)
- Получение сложных веществ из более простых …(синтез)
- Температура кипения воды … (1000С)
- Температура замерзания воды …(00С)
- Можно ли назвать природную воду чистым веществом …(нет)
- Процесс очищения воды от растворенных в ней веществ … (дистилляция)
- Насыщение воды кислородом… (аэрация)
Взаимопроверка и обсуждение
- – за 10 вопросов 4 – за 6-9 вопросов 3 – за 1 – 5 вопросов
3.Изучение новой темы: «Химические свойства воды. Применение».
( видеоролики)
Подготовка и организация восприятия нового материала. До 18 века предполагалось, что вода является элементарным веществом. Лавуазье отнёс воду к соединениям. Эта мысль развилась, когда Лавуазье наблюдал за работой кузнеца: после охлаждения раскаленного железа в воде поверхность железа окислилась и образовалась железная окалина.
- О чем сегодня пойдет речь на уроке? (обсуждение)
- Послушайте как красиво о воде пишут поэты:
- В кружево будто одеты
- Деревья, кусты, провода.
- И кажется сказкою это,
- А все это просто вода.
- Безбрежная ширь океана
- И тихая заводь пруда,
- Каскад водопада и брызги фонтана,
- А в сущности, это вода.
- Высокие волны вздымая,
- Бушует морская вода,
- И топит, и губит, играя,
- Большие морские суда.
- Вот белым легли покрывалом
На землю родную снега…
- А время придет — все растает,
- И будет простая вода.
- А. Фет
- Химические свойства воды определяются особенностями ее строения.
- Вода довольно устойчивое вещество, она начинает разлагаться на водород и кислород при нагревании по крайней мере до 2000°С ( происходит термическая диссоциация) или под действием ультрафиолетового излучения (фотохимическая диссоциация).
2H2O = 2H2 + О2 Видео «Электролиз воды»
- Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и I I(А) группах (щелочные и щелочноземельные металлы) и алюминий. В результате образуются основание и газ водород.
- Щелочные металлы – это I(А) группа – Li, Na, K, Rb, Cs, Fr
- Щелочноземельные металлы – это II(А) – Ca, Sr, Ba, Ra (Be, Mg не относятся)
- Me + H2O = Me(OH)n + H2 (р. замещения)
Образующееся сложное вещество гидроксид (основание), а выделяющийся газ это водород . Растворимые в воде основания называются щелочами. Объяснение алгоритма составления формул оснований согласно валентности и правила названий оснований.
Внимание! Алюминий и магний ведут себя также.
Алюминий: 2Al + 6H2O = 2Al(OH)3+3H2
Магний (в горячей воде): Mg + 2H2O =t°C= Mg(OH)2+H2
- Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
- Металлы средней активности, стоящие в ряду активности до (Н2) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
- Me + Н2О = МехОу + Н2 (р. замещения)
- Например, бериллий с водой образует амфотерный оксид: Be + H2O = BeO + H2
- Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H2O ≠ нет реакции
(Валентность металла можно легко определить по ряду активности металлов, над их символом стоит значение, например, +2, это означает, что валентность этого металла равна 2).
- Взаимодействие воды c неметаллами
- Cl2 + H2O = HCl + HClO
- C + H2O =t°С = CO + H2
- Si + 2H2O =t°С = SiO2 + 2H2
- 6. Взаимодействие с оксидами
- а) Взаимодействие с основными оксидами
- С водой взаимодействуют только основные оксиды активных металлов, которые расположены в I(А) и II(А) группах, кроме Ве и Mg.
- Реакция соединения протекает при обычных условиях, при этом образуется растворимое основание – щёлочь.
- H2O + ОКСИД МЕТАЛЛА = Ме(ОН)n (р. соединения)
- Na2O + H2O = 2NaOH
- BaO + H2O = Ba(OH)2
- Al2O3 + H2O ≠ нет реакции
- BeO + H2O ≠ нет реакции
- MgO + H2O ≠ нет реакции Видео «Взаимодействие оксидов металлов с водой»
- б) Взаимодействие кислотных оксидов с водой.
Кислотные оксиды реагируют с водой все. Исключение составляет только SiO2.
При этом образуются кислородсодержащие кислоты (см. таблицу кислот). Во всех кислотах на первом месте расположен водород, поэтому уравнение реакции записывают так:
- H2O + ОКСИД НЕМЕТАЛЛА = Hn A (р. соединения)
- Внимание! SiO2 + H2O ≠ нет реакции
- Видео «Взаимодействие кислотных оксидов с водой»
Гагарина Т. | Химические свойства воды. 8 класс | Журнал «Химия» № 19/2009
Это третий урок в разделе «Растворы. Вода».
Цель урока. Осмысление учащимися представлений о воде как о химическом веществе.
Задачи урока. Обучающие.
Cформировать представления о химических свойствах воды на основе химических экспериментов; сформировать понятия об активности металлов, реакции среды, индикаторе; продолжить формирование представлений о таких классах неорганических веществ, как щелочи и кислоты; продолжить формирование практических умений обращения с химическим оборудованием и реактивами.
Развивающие. Развивать познавательные умения: наблюдать и фиксировать данные эксперимента, сравнивать, выделять главное, обобщать, делать выводы; развивать методические навыки работы с учебником, тетрадью.
Воспитывающие. Воспитывать аккуратность и привычку соблюдать правила техники безопасности при выполнении эксперимента; воспитывать объективную самооценку, организационные навыки и навыки самостоятельной работы; воспитывать коммуникативные умения.
- Содержание урока.
- Опорные элементы содержания, изученные ранее: простые и сложные вещества, признаки химических реакций, типы химических реакций, оксиды.
- Новые элементы содержания: активность металлов, индикаторы, классификация оксидов на основные и кислотные, основания, кислоты.
- Дополнительными элементами содержания являются экспериментальные факты, полученные в ходе выполнения лабораторных опытов.
Между элементами содержания прослеживается логическая связь: от выяснения различия свойств основных и кислотных оксидов до получения оснований и кислот. Для изучения содержания используется опытно-экспериментальный подход.
Структура урока.
1. Определение цели урока. Для учащихся целью является постановка проблемы – выяснить опытным путем, с какими из известных им веществ будет взаимодействовать вода.
2. Изучение нового материала. Форма проведения урока: самостоятельная познавательная деятельность учащихся в парах, диалог с учителем. Методы обучения: исследовательский, словесный.
3. Закрепление нового материала проводится в виде выполнения самостоятельной работы: дополнить схемы уравнений реакций по химическим свойствам воды. В ходе урока учащиеся осуществляют взаимоконтроль при заучивании новых понятий, а также самоконтроль выполнения самостоятельной работы по образцу, данному на доске.
4. Подведение итогов урока осуществляется в форме выводов о химических свойствах воды, а также в форме рефлексивного самоанализа учащихся.
5. Инструктаж к домашнему заданию.
Организация познавательной деятельности.
Положительная мотивация обучения достигается за счет эмоционального поддержания интереса в ходе выполнения эксперимента. На уроке обеспечивается ситуация реализации социальных и личностных возрастных мотивов подростка за счет общения при работе в парах, взаимопомощи, создания ситуации успешности, возможности работать в индивидуальном темпе.
- Для активизации познавательной деятельности и поддержания внимания используются приемы наглядности и разнообразия форм деятельности: работа с учебником, лабораторная работа, работа в тетради; демонстрационный эксперимент, фрагмент видеофильма.
- В ходе урока учащимися используются такие мыслительные приемы, как наблюдение, анализ, сравнение, формулирование выводов.
- Приемами, способствующими запоминанию информации, являются проговаривание друг другу основных формулировок новых понятий и выполнение самостоятельной работы.
- Особенности взаимодействия учителя и учащихся.
Роль учителя заключается в организации самостоятельной познавательной деятельности и координации парной работы учащихся, оказании необходимой помощи. Большая часть времени работы на уроке – продуктивная деятельность учащихся. Стиль общения – доброжелательность в сочетании с требовательностью. Учитель организует работу, оказывает индивидуальную помощь, контролирует работу учащихся.
- Общие результаты проведенного урока.
- Достигнута основная дидактическая цель.
- Наиболее значимые положительные результаты урока:
- – все учащиеся были активно включены в познавательную деятельность;
- – большинство учащихся справились с заданиями и сформулировали правильные выводы;
- – урок вызвал у детей положительный эмоциональный интерес.
- По причине слабого развития навыков учебной деятельности в данном классе и медленного темпа работы этот урок проводился за 1,5 учебных часа.
- Некоторым детям необходима была помощь учителя, чтобы понять, что от них требуется.
- В дальнейшем при проведении данного урока необходимо более тщательно и рационально составлять пары детей, работающих вместе: более сильный ученик помогает более слабому.
Оборудование и реактивы. Н а с т о л е у ч и т е л я: видеопроектор, кассета с фрагментом видеофильма; воронка, пробирка, лучинка, спички; пробирка с литием, вода.
- Н а с т о л а х у ч а щ и х с я: инструктивная карта, планшетки для опытов с малыми количествами веществ, кусочки металлов: литий, цинк, медь; капельница с водой, полоски универсальной индикаторной бумаги, порошки оксида кальция, оксида железа(III), оксида меди(II), стаканчик с водой.
- ХОД УРОКА
- Инструктивная карта с заданиями выдается на каждый стол, обучаемые работают самостоятельно, учитель дает комментарии и оказывает при необходимости помощь.
- На доске заготовлены вопросы для организации рефлексивного самоанализа урока учащимися.
- 1. Выберите утверждение, соответствующее вашему представлению об усвоении изученного материала:
- а) могу воспроизвести только часть изученной темы;
- б) могу полностью воспроизвести изученный материал;
- в) могу применять новую полученную информацию в других ситуациях.
- 2. Выберите утверждение, соответствующее вашей работе на уроке:
- а) испытывал серьезные затруднения (укажите – какие);
- б) испытывал небольшие затруднения (укажите – какие);
- в) не испытывал затруднений.
Работа на уроке по учебнику: Рудзитис Г.Е., Фельдман Ф.Г. Химия-8 (М.: Просвещение, 2008).
- Инструктивная карта урока
- Новые понятия: активность металлов, индикаторы, классификация оксидов на основные и кислотные, основания, кислоты.
- Для изучения нового материала необходимо вспомнить:
- 1) простые и сложные вещества (с. 17);
- 2) признаки химических реакций (с. 11);
- 3) типы химических реакций (с. 41);
4) какие вещества называются оксидами (с. 57).
Изучение нового материала (работа в па'рах)
1. Взаимодействие воды с металлами при комнатной температуре.
а) Проведите о п ы т 1 (с малыми количествами вещества). В ячейки с кусочками металлов (литием, цинком, медью) накапайте воды. Наблюдения запишите в табл. 1 (второй и третий столбцы).
Таблица 1
| Исходные вещества | Признаки реакции | Вывод о возможности реакции | Изменение цвета индикатора, среда раствора |
| Li + H2O | |||
| Zn + H2O | |||
| Cu + H2O |
Н о в а я и н ф о р м а ц и я. Металлы, взаимодействующие с водой при комнатной температуре, называются активными.
- Запишите эту информацию в тетрадь и запомните!
- Расскажите друг другу.
- б) Посмотрите д е м о н с т р а ц и о н н ы й о п ы т: собираем выделяющийся в результате взаимодействия лития с водой газ и проверяем его с помощью зажженной лучинки.
- Сделайте вывод: выделяющийся газ – ………………………… .
в) Исследуйте среду растворов в ячейках, получившихся в опыте 1, с помощью полосок универсального индикатора. Определите по прилагаемой схеме среду раствора. Запишите результаты в табл. 1.
Н о в а я и н ф о р м а ц и я. Существуют вещества, которые в разной среде: нейтральной, кислой, щелочной – изменяют свою окраску, они называются индикаторами.
Запишите эту информацию в тетрадь и запомните!
Расскажите друг другу.
г) Выпишите из учебника (с. 85) уравнение реакции взаимодействия лития с водой. Укажите тип реакции.
……………………………………………………………………………… .
Сформулируйте вывод № 1. Вода при комнатной температуре взаимодействует с …………… металлами, при этом образуется раствор …………. и газ – ………… .
2. Взаимодействие воды с оксидами металлов.
а) Проведите о п ы т 2. В пробирки с оксидом кальция, оксидом железа(III) и оксидом меди(II) прилейте немного воды. Потрогайте ладонью пробирки (определите изменение температуры). Затем исследуйте растворы в пробирках универсальным индикатором. Наблюдения запишите в табл. 2.
Таблица 2
| Исходные вещества | Признаки реакции | Вывод о возможности реакции | Изменение цвета индикатора, среда раствора |
| CaO + H2O | |||
| Fe2O3 + H2O | |||
| CuO + H2O |
б) Выпишите из учебника (с. 85) уравнение реакции взаимодействия оксида кальция с водой. Укажите тип реакции.
……………………………………………………………………………… .
Сформулируйте вывод № 2. Вода при комнатной температуре взаимодействует с оксидами ………………. металлов, при этом образуется раствор …………………………… .
3. Взаимодействие воды с оксидами неметаллов.
а) Посмотрите видеоэксперимент «Взаимодействие воды с оксидом фосфора». Наблюдения запишите в табл. 3.
Таблица 3
| Исходные вещества | Продукт реакции | Изменение окраски индикатора, среда раствора |
Выпишите из учебника (с. 85) уравнение реакции взаимодействия воды с оксидом фосфора. Укажите тип реакции.
……………………………………………………………………………… .
Сделайте вывод № 3. Вода при комнатной температуре взаимодействует почти со всеми оксидами …………… , при этом образуются растворы ………………………. .
4. Взаимодействие воды с менее активными металлами при повышенной температуре.
а) Прочитайте текст учебника на с. 86 пункт 2.
б) Выпишите уравнение реакции. Укажите тип реакции.
……………………………………………………………………………… .
Сформулируйте вывод № 4. Вода взаимодействует с менее активными ………………. при высокой температуре, при этом образуется ……………… металла и выделяется газ – …………………….. .
5. Взаимодействие воды с неметаллами при повышенной температуре.
а) Прочитайте текст учебника с. 86 пункт 3.
б) Выпишите уравнение реакции. Укажите тип реакции.
……………………………………………………………………………… .
Сформулируйте вывод № 5. Вода при высокой температуре взаимодействует с некоторыми ………………………….. , при этом продуктами реакции могут быть ………………………. .
6. Разложение воды под действием электрического тока.
а) Прочитайте текст учебника с. 86 пункт 3.
б) Выпишите уравнение реакции. Укажите тип реакции.
……………………………………………………………………………… .
Сформулируйте вывод № 6. Вода под действием электрического тока ………………. , при этом образуются газы – ……………….. и ………………………….. .
Закрепление нового материала (самостоятельная работа)
• Исходя из полученной новой информации, дополните словами схемы:
1) вода + активный металл —> ………………. + ……………………………. ;
2) вода + оксид активного металла —> …………………………… ;
3) вода + оксид неметалла —> ………………………………………… ;
4) вода + менее активный металл ……………………. + ………………………. ;
5) вода ………………………. + ………………………… .
• Перечислите, для получения каких веществ можно использовать воду?
……………………………………………………………………………………………… .
Домашнее задание. Прочитайте § 29, с. 84–87, по схеме на с. 87 составьте рассказ о значении воды в природе, быту, промышленности.
Т.В.ГАГАРИНА, учитель химии и биологии Кадетской школы-интерната № 10
(Москва)






