- Определение коррозии
- Химическая
- Электрохимическая
- Методы защиты от коррозии
- Химические покрытия
- Электрохимическая защита
- Основные методы борьбы с коррозией металлов
- Антикоррозийные методы
- Виды процесса разрушения металлов
- Типы ржавчины
- Химическая и электрохимическая коррозия
- Сферы применения коррозийно-устойчивых сплавов
- Ущерб, ущерб
- Грунтовка от коррозии
- ПОИСК
- Коррозия металла – что это такое и как с ней бороться?
- Грунтовка от коррозии
- Коррозия металлов и методы борьбы с ней
- Удаление коррозии – шпаклевки
- Краски против коррозии
- Коррозия в неэлектролитных жидкостях
- Общие сведения
- Способы защиты от коррозии
- Коррозия металлов под землей
- Способы борьбы с ржавчиной
- Механический способ удаления ржавчины
- Удаление ржавчины с помощью химических средств
- Народные средства для удаления ржавчины
Коррозия (от позднелатинского corrōsiōn «грызть, жевать») представляет собой постепенно развивающийся процесс поверхностного повреждения металлов, обладающих способностью активно реагировать с кислородом.
Один из наглядных примеров этого явления – коррозия металла из-за образования оксида железа Fe2O3 или ржавчины.
Характерно, что два остальных окисла железа – закись FeO и закись-окись Fe3O4 — обладают значительно меньшей корродирующей способностью, причём Fe3O4 при некоторых условиях может даже играть роль твёрдой смазки.
Теория коррозии предполагает, что для начала разрушения металла необходимо наличие четырёх основных компонентов:
-
Катода.
-
Анода.
-
Электрического соединения, которое существует между катодом и анодом.
-
Электролита или любой другой токопроводящей среды, облегчающей направленное перемещение ионов.
Обычное образование ржавчины на стали можно рассматривать как электрическую батарейку. Когда атомы металлов подвергаются воздействию окружающей среды, которая содержит кислород, металл производит электроны. Это действие можно локально ограничить, чтобы создать трещину или микроуглубление.
С развитием процесса коррозия распространяется на прилегающую территорию, что приведет к общему ухудшению состояния поверхности.
Ограниченная (точечная) коррозия способна вызвать усталость металла – снижение его прочностных характеристик, а имеющиеся коррозионные агенты, например, морская вода, могут привести к прогрессирующему росту трещины.

Теория коррозии утверждает также, что интенсификации поверхностного разрушения металла способствуют микроструктурные изменения, возникающие при повышенных температурах, в частности, при сварке. Это объясняется повышенными значениями энергии активации, из-за чего количество ионов, проводящих электрический ток, лавинообразно возрастает.
Определение коррозии
Коррозия — это постепенное разрушение объектов, обычно металлов, вызванное активной окружающей средой-электролитом и химической реакцией окисления.
Суть коррозионного процесса – наличие постоянно действующей анодной реакции. Она вызывается за счёт растворения металла, который генерирует электроны.
Часть энергии активации дополнительно расходуется на другой процесс, называемый катодной реакцией. Эти два процесса уравновешивают произведенные заряды.
Зоны, вызывающие эти процессы, могут быть расположены близко или далеко друг от друга, в зависимости от ситуации.
Электроны, генерируемые в процессе, должны потребляться посредством катодной реакции. Ионы водорода и электроны вступают в реакцию с образованием атомарного, а затем и газообразного водорода.
Однако водород является сильнейшим восстановителем, поэтому дальнейшую коррозию можно предотвратить, создав на поверхности металла тонкую газовую плёнку. Она служит поляризатором, уменьшающим контакт металла с водой и уменьшающим коррозию.
Таким образом, всё, что разрушает барьерную плёнку, увеличивает скорость коррозии.
Основными факторами, определяющими интенсивность процесса, являются:
- Скорость;
- Температура;
- Уровень возникающих механических и термических напряжений;
- Характер протекающих химических реакций.
Коррозия сдерживает внедрение в производство новых металлических материалов и причиняет значительный ущерб экономике.
Классификация всех коррозионных явлений может быть произведена по следующим параметрам:
- По степени равномерности. Различают поверхностную коррозию, которая равномерно уменьшает толщину поверхности, и неравномерную коррозию – точечную или язвенную;
- По интенсивности воздействия на металл. Например, избирательная коррозия разрушает только определённые структурные составляющие, а контактная воздействует на менее коррозионно стойкие («неблагородные») составляющие пар трения;
- При межкристаллитной коррозии разрушение происходит по границам зёрен и распространяется вглубь металла.
- Фреттинг-коррозия, когда два контактирующих между собой тела совершают относительно друг друга колебательные движения малой амплитуды (не более 100 мкм).
При одновременном воздействии растягивающих напряжений и агрессивной среды наблюдается коррозионное растрескивание межкристаллитного или транскристаллитного характера, а при наложении знакопеременных напряжений начинается коррозионно-усталостное разрушение. Защита металлов от коррозии, таким образом, предполагает также и одновременное уменьшение износа деталей.

Далее рассматриваются основные явления, которые происходят в повреждающихся зонах при различных видах коррозии.
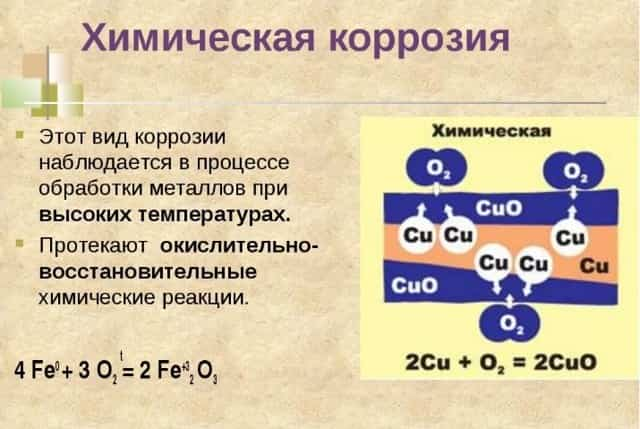
Химическая
Химическая коррозия относится к постепенному разрушению поверхности металла из-за реакции поверхности с веществами во внешней среде. Она происходит в результате окисления металла кислотами с образованием оксидов.
Высокотемпературный вариант заключается в воздействии на металл сухих газов. Все металлы в сухом воздухе покрыты очень тонким (2…10 мкм) слоем оксидов. Этот слой образуется при очень высоких температурах, когда реакция с кислородом воздуха идёт без каких-либо ограничений.
При комнатной температуре реакция останавливается, поскольку оксидная плёнка становится слишком тонкой.
В случае, например, с алюминием, такая плёнка, состоящая из оксида Al2O3, эффективно защищает поверхность алюминиевой посуды, поскольку коррозионная стойкость чистого алюминия невысока.
Химическая коррозия начинается в месте, где металл находится под давлением и изолирован от циркуляции воздуха. Это побуждает ионы металлов растворяться во влажной среде, что в конечном итоге ускоряет реакцию между ними и водой. В результате реакции образуются водные оксиды (известные при взаимодействии с железом как ржавчина) и свободные ионы.
Электрохимическая
Для моделирования процесса необходимо рассмотреть железную пластину, покрытую любым электропроводящим покрытием, например, оксидной окалиной, которая образовалась во время высокотемпературной обработки.
При погружении пластины в раствор хлорида натрия, обнаруживается, что, если повредить целостность окалины, в этом месте ржавление железа пойдёт значительно быстрее.
Электрохимическая коррозия наиболее достоверно объясняет ржавление железа в аэробных условиях.
Теория электрохимической коррозии предполагает наличие дополнительных химических реакций:
- Fe → Fe ++ + 2e−, — анодная реакция;
- 2e− + O + H2O → 2OH− — катодная реакция.
Когда ионы металла растворяются, их заряд уравновешивается ионами хлорида, которые мигрируют в область атаки, притягиваясь образующимися ионами положительного заряда. Хлорид железа растворяется в воде, но это не создаёт препятствий для дальнейшей коррозии, поскольку раствор хлорида железа вследствие гидролиза очень кислый.
По мере того, как ионы Fe ++ удаляются из этого места, они сталкиваются с гидроксильными ионами, которые либо присутствуют в воде естественным образом, либо образуются в результате катодной реакции. Результатом является образование и осаждение гидроксида железа Fe (OH)2.
Далее, в присутствии растворённого кислорода, он быстро окисляется до оксигидроксида железа FeOOH.
Таким образом, при электрохимической коррозии происходят три реакции, причём в трёх разных местах. Анодная происходит в зонах потери металла, катодная – там, где растворённый в воде кислород может принимать электроны, а сама твёрдая окалина формируется в местах механических повреждений на поверхности изделия.
В последнее время выделяют ещё один вид коррозии – механохимическую, которая происходит в результате динамического взаимодействия контактирующих элементов окружающей среды в условиях высоких контактных давлений.
Методы защиты от коррозии
Ржавчина и другие коррозионные проявления могут приводить к проблемам с безопасностью, нарушать целостность производственного оборудования и расходных материалов. Даже плановое техническое обслуживание по удалению и устранению ржавчины увеличивает эксплуатационные затрат. Отработано ряд способов, используя которые, можно минимизировать коррозию.
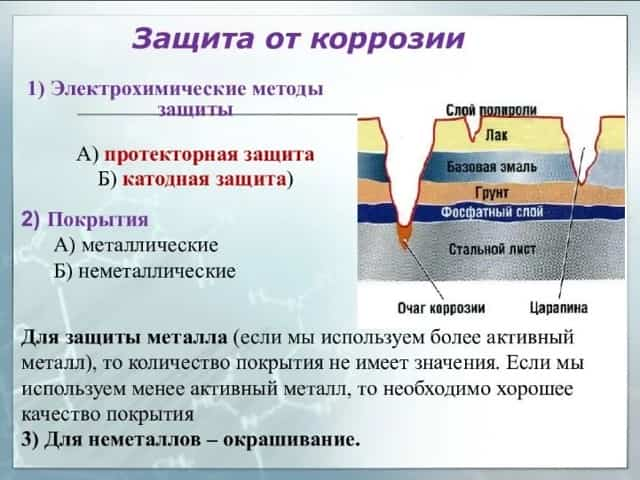
Эти методы предотвращения коррозии заключаются в погружении стали в расплав металла, электрический потенциал которого меньше, чем железа (чем больше разница, тем эффективнее покрытие).
Практическое применение находят гальванические покрытия цинком или оловом, а также диффузионные покрытия никелем, хромом, кремнием или алюминием. По сравнению с другими методами защиты от коррозии гальванизация известна более низкими начальными затратами, устойчивостью и универсальностью.
Поскольку расход металла-протектора довольно велик, преимущество получают технологии, отличающиеся экономичностью используемых компонентов и прочностью создаваемых покрытий. Первым в этом списке находится цинкование. Железо в стали вступает в реакцию с цинком, образуя прочное покрытие из сплава, которое служит защитой.
Один из самых простых способов предотвратить коррозию — использовать защитные покрытия из неметаллов — краски, пластика, воска или порошка. Порошки, включая эпоксидную смолу, нейлон и уретан, наносятся на металлическую поверхность и нагреваются до стадии расплавления, образуя тонкую плёнку.
Краска действует как покрытие, защищающее металлическую поверхность от электрохимического заряда, который исходит от коррозионно опасных соединений.
Обычно используют комбинацию различных слоёв краски, которые выполняют разные функции.
Грунтовка действует как ингибитор, промежуточный слой увеличивает общую толщину краски, а финишный слой обеспечивает устойчивость к факторам окружающей среды.
Химические покрытия
Относятся к методам временной антикоррозионной защиты стали, например, во время пластического деформирования при повышенных температурах. Наибольшее распространение получили технологии фосфатирования и оксалатирования.
При фосфатировании поверхность покрывают сплошным слоем фосфатных солей железа и марганца, а при оксалатировании – водорастворимыми солями щавелевой кислоты.
Фосфатирование используется для обработки нелегированных сталей, оксалатирование – легированных. Покрытие прочно сцепляется с поверхностью, способствуя снижению трения и уменьшению износа инструмента.
После окончания штамповки покрытие удаляют.
Заключается в специальном легировании стали элементами, повышающими её коррозионную стойкость. Если это возможно, то в механическую систему, которая работает в условиях повышенной температуры и влажности, вводят смазку, содержащую противокоррозионные компоненты (восстановители).
Элементом, который положительно влияет на коррозионную стойкость стали, является хром. Для реализации этого эффекта сталь должна содержать не менее 13% хрома. Каждые дополнительные 5% хрома обеспечивают еще лучшую коррозионную стойкость.

Никель — второй важный элемент для улучшения коррозионной стойкости стали, причём добавка никеля приводит также к стабилизации аустенита. Третьим важным элементом повышения коррозионной стойкости является молибден. Однако его добавки повышают коррозионную стойкость только нержавеющих сталей с достаточным содержанием хрома и никеля.
Электрохимическая защита
Процесс коррозии, которая возникает при контакте двух разных металлов, находящихся в электролите, можно остановить использованием системы катодной защиты.
Для реализации метода активные центры на поверхности металла необходимо преобразовать в пассивные путем предоставления электронов из другого источника (обычно используют аноды, прикрепленные к поверхности).
Металлы, используемые для анодов — алюминий, магний или цинк.
Катодная защита очень эффективна в бытовой технике, однако аноды необходимо часто проверять, что увеличивает расходы на техническое обслуживание.
Основные методы борьбы с коррозией металлов
Коррозия представляет процесс разрушения металлов и сплавов под воздействием агрессивной внешней среды.
Ржавчина образуется на поверхности железа в результате химических, электрохимических и физико-химических реакций.
Комплекс антикоррозийных мероприятий предполагает проведение анализа качества материалов, причин коррозии, глубины поражения металла. Только потом выбираются методы борьбы с коррозией.
- Определение вида металла: черный или цветной, сплав металлов.
- Вид коррозии на поверхности металла: химический, электрохимический.
- Условия проведения антикоррозийной обработки металла (открытое, закрытое помещение, температурные условия, влажность и т.д.).
- Какому виду обработки подлежит металл.
- Выбор материалов для антикоррозийной обработки.
Антикоррозийные методы
- Покраска изделия ЛКМ. Один из самых доступных распространенных видов защиты металла от ржавчины. Предполагает предварительное обезжиривание и очищение поверхности. Нанесение эмалей или лака на металл можно проводить с помощью кисточки, валика или распылителя.
- Смазывание силиконовой смазкой.
Использование силиконовых смазок дает возможность защитить края металлических изделий и всю поверхность от проникновения влаги. Таким образом, металл полностью защищен от контакта с влагой и не подвергается коррозии.
- Грунтовка. Все виды грунтовки, как предварительного слоя перед покраской, создают на металле невидимый слой, не пропускающий влаги.
Грунтовка наносится после предварительного обезжиривания и очистки поверхности от ржавчины, жирных пятен и грязи. Грунтовка обеспечивает последующую адгезию ЛКМ с поверхностью изделия, защищает от проникновения влаги и кислорода, замедляет коррозию.
- Покрытие металлом.
На поверхность черных металлов наносят легкий слой другого металла с антикоррозийной стойкостью разными способами.
- Гальванический метод борьбы с коррозией. Перед обработкой металлический предмет надо обезжирить и очистить от грязи.
Метод гальваники предполагает химическую реакцию электролиза водного раствора солей металла, используемого для создания верхнего слоя. Накладывается антикоррозийный вид металла (хром, никель, свинец и т.д.).
- Метод оксидирования. Обезжиренный и очищенный металлический предмет опускают в ванную с электроподогревом и наполнителями.
Поверхность постепенно покрывает оксидная пленка.
- Метод фосфатирования тоже проводится способом погружения металлического предмета в ванную. В подогретой воде растворяется фосфористая соль. В результате образуется прочная водонепроницаемая пленка.
- Легирование металлов улучшает антикоррозийные свойства.
Процедура легирования предполагает введение в существующий состав разных примесей, как металлических, так и неметаллических.
Все методы борьбы с коррозией направлены на создание защитного барьера для металлов, продолжения периода их эксплуатации, экономии средств на замену деталей и проведение ремонта.
Виды процесса разрушения металлов
Коррозию металлов ученые разделили на два вида:
Станок с ЧПУ по металлообработке
- Химическая коррозия металлов;
- Электрохимическая коррозия.
Первый вид коррозии еще называют газовым, это связано с тем, что часто данный процесс происходит под воздействием газовых составляющих, которые находятся в окружающей среде, но при этом высокая температура обязательный фактор.
Агрессивные среды также могут вызвать химическую коррозию металла. И все же главная отличительная черта химической коррозии – это отсутствие электрического тока в системе, где она образуется.
- Продукты окисления, образующиеся на поверхности металла, служат толчком к разрушению самого металла
- Ко второму виду коррозии металлов относится коррозия, где процесс разрушения происходит под воздействием электрического тока.
- Здесь необходимо дать пояснения и привести примеры, которые точно раскроют процесс электрохимической коррозии металлов.
- Начнем с примеров. Любые виды металлических конструкций, расположенных
- В грунтах;
- Воде морской или пресной;
- В атмосфере;
- Закрытые пленкой, где образуется влага.
Узлы и детали машин и механизмов, работающих в охлаждающих жидкостях, растворах, предназначенных для технических нужд и так далее. Это все подвержено электрохимической коррозии металлов.
Как было сказано выше, данный процесс происходит на поверхности металла. И здесь главную роль играют электроны, которые под воздействием определенных химических реакций переносятся от одной среды в другую.
Точнее сказать, между двумя веществами, одним из которых является металл, а с другой стороны выступают, к примеру, вода или грунт, образуется электрический ток, разделяющий вещества на катоды и аноды. Особенно это сильно заметно, если металл имеет примеси и различные включения, то есть масса металла является неоднородной.
И здесь участки металла, разделенные примесями, создают катодные и анодные зоны, которые в свою очередь и разрушают сам металл.
Из школьного курса химии можно вспомнить один опыт, где простой стальной гвоздь, обмотанный медной проволокой, опускали в раствор поваренной соли. Через пару дней гвоздь начинал сильно ржаветь.
Опыт показывал, как происходит процесс коррозии металлов. В данном случае роль анода выполняет гвоздь, а роль катода – медная проволока.
В процессе химической реакции, а раствор поваренной соли – это прекрасный электролит, происходит передача электронов от гвоздя (железо) к меди.
Электроны в данном случае выступают в роли ионов. Перешедшие в раствор ионы двигаются к медной проволоке, где и разряжаются.
Медь набирает отрицательный потенциал, который со временем выравнивается с гвоздем. И здесь коррозия металла, в данном случае гвоздя, прекращается.
Оборудование применяемое в гальванике
К сожалению, все металлические детали подвержены коррозии
Электрохимическая коррозия металла в основном зависит от присутствия влаги. Но, к примеру, атмосферная коррозия будет также зависеть от качества самого металла.
Трещины, шероховатость поверхности и другие дефекты будут только ускорять процесс коррозии.
А почвенная коррозия металлов сделает любой трубопровод, не защищенный специальной изоляцией, негодным. И для этого понадобится всего несколько месяцев.
Ведь в почве большое количество не только влаги, но и различных химически активных элементов, которые создают повышенную кислотную среду.И сегодня защита трубопроводов – это неотъемлемая часть в строительной области.
Необходимо отметить и блуждающие токи, которые создают все условия для образования коррозии металлов. Здесь необходимо отметить:
- Линии электропередач;
- Электроустановки;
- Железная дорога, которая работает на электрическом токе;
- И так далее.
Типы ржавчины
В большей степени коррозии подвержено железо. С точки зрения химии ржавчина — это окислительный процесс (как и горение). Элементы возникающие при окислении в кислородной среде называются Оксиды. Можно выделить 4 основных типа.
1. Желтая ржавчина — химическая формула FeO(OH)H2O (оксид железа двухвалетный). Возникает во влажной, недонасыщенной кислородом среде. Часто встречается под водой. В природе существует в виде минерала вюстита, при этом являясь монооксидом (те содержит 1 атом кислорода).
2. Коричневая ржавчина — Fe2O3 (двойной оксид железа): растет без воды и встречается редко.
3. Черная ржавчина — Fe3O4 (оксид железа четырех валентый). Образуется при малом содержании кислорода и без воды поэтому стабильна и распространяется очень медленно. Этот оксид является ферромагнетиком (при определенных условиях обладает намагниченностью в отсутствие внешнего магнитного поля), поэтому потенциально применим для создания сверх-проводников.
4. Красная ржавчина — химическая формула Fe2O3•H2O (оксид железа трехвалентный). Возникает под воздействием кислорода и воды, самый частый тип, процесс протекает равномерно и затрагивает всю поверхность.
В отличии от всех вышеперечисленных не столь опасных для железа видов окисления этот в своей толще образует гидроксид железа, который, начиная отслаиваться, открывает для разрушения все новые слои металла. Реакция может продолжатся до полного разрушения конструкции.
Применяется при выплавке чугуна и как краситель в пищевой промышленности. Встречается в природе в естественном виде под названием гематид.
Несколько видов ржавления могут протекать одновременно, не особо мешая друг другу.
Химическая и электрохимическая коррозия
Железо ржавеет, если в нем есть добавки и примеси (например, углерод) и при этом контактирует с водой и кислородом. Если же в воде растворена соль (хлорида натрия и калия), реакция становится электрохимической и процесс ржавления ускоряется.
Массовое применение этих солей как в бытовой химии так и для борьбы с льдом и снегом делают электрохимическую коррозию очень распространенным и опасным явлением: потери в США от использования солей в зимний период составляют 2,5 млрд. долларов.
При одновременном воздействии воды и кислорода образуется гидроксид железа, который, в отличие от оксида, отслаивается от металла и никак его не защищает. Реакция продолжается либо до полного разрушения железа, либо пока в системе не закончится вода или кислород.
Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла.
В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге).
Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Разновидности и особенности пилок для электролобзика
Сферы применения коррозийно-устойчивых сплавов
Получаемые сплавы с примесью титана активно применяют в аэрокосмической промышленности и рекреационных сферах, мельхиора – в медицине, латуни – в химической промышленности и машиностроении.
В целом, комбинируя различные металлы в разном соотношение можно получить огромное количество коррозионно-стойкий сплавов, пригодных для использования в ряде сфер деятельности современного человека.
Мы — продавцы металлопроката — как никто сталкивается с этим наваждением — ржавиной. И мы точно знаем вред от коррозии. В этой статье мы скажем несколько слов об этой проблеме, ее проявлениях, ее масштабах.
Ущерб, ущерб
Все видели эти оранжево-бурые или желтоватые пятна ржавчины на металлических деталях. Экономический ущерб от коррозии металлов огромен.
В США и Германии подсчитанный ущерб от коррозии и затраты на борьбу с ней составляют примерно 3 % ВВП.
При этом потери металла, в том числе из-за выхода из строя конструкций, изделий, оборудования, составляют до 20 % от общего объема производства стали в год. По России точные данные о потерях от коррозии не подсчитаны.
Доподлинно известно, что именно проржавевшие металлоконструкции стали причиной обрушения нескольких мостов в Соединенных Штатах, в том числе с многочисленными человеческими жертвами. Крайне неприятен и экологический вред: утечка газа, нефти при разрушении трубопроводов приводит к загрязнению окружающей среды.
Грунтовка от коррозии
Что может нам предоставить предварительное грунтование металла? Все просто и практично. Грунтовка позволяет производителю металлических деталей или конструкций складировать продукцию и хранить изделия до востребования.
Некоторые виды грунтовки предназначены для предварительной обработки поверхности металла перед финишной покраской. Коррозия металла останавливается сразу послу грунтования поверхности.
В зависимости от составов грунтовки, ее могут применять в следующих условиях:
- Ингибирирующие;
- Изолирующие – основное свойство грунта, уберечь поверхность от влаги и перекрыть доступ кислорода к поверхности;
- Фосфатирующие – чаще всего используются для оцинкованной стали, листовой металл с таким типом грунтовки улучшает свою адгезию к краскам;
- Пассивирующие – понижают активность химических составов;
- Протекторные – повышают защитные свойства за счет входящих в ее состав высокодисперсионных порошков.
ПОИСК
СПОСОБЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ В МОРСКОЙ ВОДЕ [c.
403]
Электрохимическая защита металлов от коррозии направлена на снижение силы тока, возникающего при электрохимической коррозии, методом катодной поляризации (приложение внешнего напряжения к корродирующей системе) или методом протекторной защиты (к защищаемой поверхности присоединяют протектор, изготовленный из металла с более отрицательным потенциалом, чем у металла основной конструкции). Устройство катодной поляризации с источником постоянного тока в условиях нефтебаз опасно в пожарном отношении, а протекторная защита не уменьшает количество загрязнений, поступающих в масла, так как протектор, защищая металл основной конструкции, сам в процессе эксплуатации подвергается разрушению, сопровождаемому образованием солей и гидроокисей металла, из которого он изготовлен. В связи с этим методы электрохи- [c.100]
Наконец, одним из практических методов защиты металлов от коррозии является создание условий, уменьшающих или полностью исключающих возможность протекания коррозионного процесса (применение защитных газовых атмосфер, обескислороживание воды, катодная защита), которые могут быть рассчитаны с помощью термодинамики. [c.11]
Глава XX. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ ОБРАБОТКОЙ КОРРОЗИОННОЙ СРЕДЫ [c.309]
За последние годы разработан метод защиты металлов от коррозии наложением анодной поляризации. Этот метод применим лишь к металлам и сплавам, способным пассивироваться при смещении их потенциала в положительную сторону, т. е.
к металлам, анодная поляризационная кривая которых подобна приведенной на рис. 23.2.
При достижении области пассивного состояния скорость растворения металла может резко упасть и оказаться меньшей, чем скорость его саморастворения в отсутствие внешней поляризации. [c.504]
Защита металлов от коррозии обработкой коррозионной среды [c.310]
На практике предпринимались попытки защиты металла от коррозии соединениями зольных отложений нанесением на стали защитных покрытий. Исследовались гальванические, диффузионные, керамические и металлокерамические покрытия. Однако все покрытия быстро разрушались вследствие несплошности [c.177]
- МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ [c.501]
- ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ В НЕЙТРАЛЬНЫХ ЭЛЕКТРОЛИТАХ [c.247]
- Анодная электрохимическая защита металлов от коррозии [c.321]
- ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ В ТОПЛИВАХ И СМАЗОЧНЫХ МАТЕРИАЛАХ [c.278]
Защита металлов от коррозии является весьма сложной и трудно разрешимой задачей. Достаточно эффективным средством защиты является покрытие поверхности металлов продуктами нефтепереработки и нефтехимического синтеза. [c.229]
Учебное пособие для студентов металлургических вузов и факультетов. Может быть полезно инженерно-техническим работникам проектных организаций, исследовательских институтов, металлургических заводов, предприятий химической промышленности, занимающимся защитой металлов от коррозии. [c.2]
Наиболее распространенным методом защиты металлов от коррозии в морской воде являются лакокрасочные покрытия на виниловой (этинолевые краски), фенолформальдегидной (краски АИШ), каменноугольной, битумной основе. Для подготовки металлической поверхности под покрытия применяют холодное фос- [c.403]
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ В РАСПЛАВЛЕННЫХ СОЛЯХ [c.413]
Для защиты металлов от коррозии в расплавленных солях могут быть использованы следующие методы [c.413]
Методы защиты металлов от коррозии 459 [c.459]
Глава XXI. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ ПОКРЫТИЯМИ [c.317]
Защита металлов от коррозии покрытиями [c.320]
Наконец, диаграммы Пурбе дают обоснование некоторых возможных методов защиты металлов от коррозии.
Так, согласно диаграмме, переход из области коррозии (точка Е — зона преобладания ионов Ре-+) в область устойчивости (зона преобладания металлического железа) может быть достигнут сдвигом потенциала системы в отрицательную сторону (движение от точки Е за горизонталь /), что составляет сущность широко расиростраиениого метода катодной защиты.
Из диаграммы также следует, что ири повышении рИ до известных пределов начинается образование новых твердых неметаллических фаз, которые, воз1шкая на поверхности feтaллa, могут. ащищать его от коррозии и переводить в состояние пассивности (движение от точки Е по горизонтали за кривую 4). [c.192]
Содержащиеся в оборотной воде соли и другие примеси вызывают коррозию оборудования. Хлориды ускоряют коррозию вследствие увеличения кислотности воды и их разрущающего действия на пассивирующие пленки сульфаты агрессивно действуют на бетон. Диоксид углерода замедляет образование защитных пленок.
Для защиты от коррозии в оборотных системах применяют различные ингибиторы. Процесс коррозии приостанавливают хромат и бихромат калия. Они же замедляют биологические обрастания. Для снижения коррозии воду обрабатывают также фосфатами, которые образуют пленку, изолирующую металл от воды.
В отличие от хроматов фосфаты благоприятствуют развитию биологических обрастаний, поэтому эти химикаты иногда применяют совместно. Один из способов защиты металла от коррозии — защитные покрытия смолами, красками, лаками и эмалями, однако они недолговечны и восстановить их можно только во время ремонта.
[c.86]
Защитой металлов от коррозии человечество занимается с очень давних пор, а начало научным исследованиям явлений окисления и растворения металлов было положено еще М. В. Ломоносовым.
Однако в самостоятельную научную дисциплину учение о коррозии и защите металлов начало складываться только в начале этого столетия и интенсивно развивается в течение последних десяг-тилетий благодаря трудам многих ученых. [c.10]
Отрицательный защитный эффект ограничивает возможности применения катодной электрохимической защиты металлов от коррозии, если металлы находятся в пассивном состоянии. С другой стороны, из рис. 216 следует, что катодная поляризация пере-пассивированного металла до значений потенциала между Упереп [c.320]
Методы защиты металлов от коррозии. Ввиду больших потерь металла, происходящих в результате коррозии металлических изделий, издавна принимались те или иные мерьг для ослабления коррозии.
Наиболее распространенные способы защиты металлов от коррозии заключаются в создании на поверхности изделия защитного покрытия, по возможности изолирующего металл от разрушающего действия окружающей среды, К таким [c.458]
Практические методы защиты металлов от коррозии, рассматриваемые в соответствующих главах этой книги, эф( оектив-ны также и по отношению к атмосферной коррозии черных металлов и в основном сводятся к торможению анодного пли катодного процесса. [c.182]
Для защиты металлов от коррозии в подземных условиях металлические покр ,1ТИЯ нашли весьма ограниченное применение вследствие их пористости. Известны только случаи применения горячего цинкования труб небольших диаметров. Испол1,зо-вание лакокрасочных покрытий для защиты подземных сооруже-1И1Й часто неэффективно (наблюдается отслаивание иленки, [c.195]
Красноярский В. В. Электрохимический метод защиты металлов от коррозии. Машги.ч, 1961. [c.309]
Защита металлов от коррозии обработной ко1)розионной среды [c.314]
Наибольший интерес в области защиты металлов от коррозии полимерами представляют пластические массы на основе фтороргаиических соединений.
Такие пластмассы, как политетрафторэтилен (фторопласт-4) и политрифторхлорэтилен (фторопласт-3), а также ряд сополимеров на основе политетрафторэтилена с другими фторорганнческими полимерами (фтористым винилиденом, гексафторнолипропиленом и др.
) обладают рядом столь ценных свойств (исключительно высокая химическая стойкость, высокая теплостойкость и др.), что это делает их непревзойденными материала.мн в антикоррозионной технике. [c.428]
Среди полимерных материалов, нашедших щирокое применение в антикоррозионной технике, наиболее старыми являются материалы и композиции на основе каучука, Особенно распространены методы защиты металлических ко1н трукций обкла,ц-ками из резины (гуммирование) эбониты — твердые резины— известны уже много десятилетий. В последние годы начинают применять для защиты металлов от коррозии новые д атериалы на основе каучуков и их производных, обладающие очень высокой эффективностью. [c.438]
Коррозия металла – что это такое и как с ней бороться?
Научно доказано, что основная часть известных металлов утрачивают свои свойства при длительном взаимодействии с атмосферными осадками, воздухом, прямым контактом с водой и химическими растворами.
Коррозия не щадит металлы в любых его интерпретациях, к примеру, атмосферная коррозия нещадно разрушает трубопроводы и металлоконструкции зданий, транспортные средства и оборудование.
Все это, как правило, приводит к масштабным затратам и нарушению эксплуатационным характеристикам.
На сегодняшний день к покрытию металлов уделяется особое внимание и ряд требований, которые обуславливают специфические свойства к поверхности для обработки. Методов борьбы с коррозией предостаточно, но самым доступным и эффективным считается обработка металла лакокрасочными материалами.
Грунтовка от коррозии
Что может нам предоставить предварительное грунтование металла? Все просто и практично. Грунтовка позволяет производителю металлических деталей или конструкций складировать продукцию и хранить изделия до востребования.
Некоторые виды грунтовки предназначены для предварительной обработки поверхности металла перед финишной покраской. Коррозия металла останавливается сразу послу грунтования поверхности.
В зависимости от составов грунтовки, ее могут применять в следующих условиях:
- Ингибирирующие;
- Изолирующие – основное свойство грунта, уберечь поверхность от влаги и перекрыть доступ кислорода к поверхности;
- Фосфатирующие – чаще всего используются для оцинкованной стали, листовой металл с таким типом грунтовки улучшает свою адгезию к краскам;
- Пассивирующие – понижают активность химических составов;
- Протекторные – повышают защитные свойства за счет входящих в ее состав высокодисперсионных порошков.
ЛЕКЦИЯ 10. Ковка. Горячая и холодная объемная штамповка.
Коррозия металлов и методы борьбы с ней
Коррозией называют разрушение металла под воздействием окружающей среды.
Виды коррозии. В зависимости от механизма процесса разрушения металла коррозия может быть химической и электрохимической.
Химическая
коррозия возникает при действии на металл сухих газов или жидкостей органического происхождения, которые не являются электролитами. Примером химической коррозии служит окисление металла при высоких температурах, в результате чего на его поверхности возникает продукт окисления – окалина. Данный вид коррозии встречается редко.
- Электрохимическая
- коррозия образуется в результате воздействия на металл электролитов (растворов кислот, щелочей и солей
- В металлах из-за наличия неоднородных структурных составляющих может возникнуть микрокоррозия.
- Распространяясь по границам зерен металла, она вызывает межкристаллическую коррозию.
- В зависимости от характера окружающей среды электрохимическая коррозия может быть:
- атмосферной,
- подводной
- почвенной,
- вызванной блуждающими токами.
Подводная коррозия возможна в металле строительных конструкций, погруженных в воду. Почвенная коррозия протекает при взаимодействии металла конструкций с почвой. Довольно распространена коррозия металла труб, металлического каркаса подземных сооружений от воздействия блуждающих токов, возникающих при близком расположении подземных кабелей, и рельсов трамвайных или железнодорожных путей.
Защита металла от коррозии.
Отделка древесины: шлифовка и покрытие лаком
Существуют различные методы защиты металлов от коррозии, Лакокрасочные покрытия –
наиболее распространенный вид антикоррозионной защиты металла. В качестве пленкообразующих материалов используют нитроэмали, нефтяные, каменноугольные и синтетические лаки, краски на основе растительных масел и др. Образующаяся при покрытии на поверхностях конструкций плотная пленка изолирует металл от воздействия окружающей его влажной среды.
- Неметаллические покрытия
- довольно разнообразны. К ним относят эмалирование, покрытие стеклом, цементно-казеиновым составом, листовым пластиком и плитками, напыление пластмасс
- Металлические покрытия
- наносят на металлы гальваническим, химическим, горячим, металлизацией и другими способами.
При гальваническом способе защиты на поверхности металла путем электролитического осаждения из раствора солей металлов создается тонкий защитный слой какого-либо металла. Химическая обработка поверхности металла – изделия погружают в ванну с расплавленным защитным металлом.
Металлизация –
распространенный способ защиты металлов в строительстве. Он состоит в нанесении сжатым воздухом тончайшего слоя распыленного расплавленного металла.
При защите легированием
в металл вводят легирующие элементы, повышающие сопротивление сплава коррозии. Защита от огня.
- Для защиты металлоконструкций наиболее перспективны вспучивающиеся покрытия или краски на основе полимерных связующих, которые при воздействии огня образуют закоксовавшийся вспененный расплав, препят-ствующий нагреву металла.
- Для повышения предела огнестойкости (600 °С) металлических, в том числе алюминиевых, конструкций применяют также асбестоцементные, асбестоперлитовые, асбестовермикулитовые покрытия, наносимые пневмонапылением.
- Новый вид огнезащиты – фосфатное покрытие толщиной 20-30 мм, представляющее собой стойкую (при 1000 °С) монолитную легкую массу.
Традиционные способы увеличения предела огнестойкости, использование облицовок и штукатурок из несгораемых огнезащитных материалов (кирпича, пустотелой керамики, гипсовых плит, растворов и др.).
Делаем самодельный электромотоблок
Удаление коррозии – шпаклевки
Когда коррозия металла достигает своей максимальной активности, место поражения обрабатывается преобразователями ржавчины, что способствует разрыхлению поврежденных областей.
В результате, это место можно легко почистить механическим способом и заполнить специальными шпаклевками по металлу. Обрабатывая шпаклевкой листовой металл, скрываются не только видимые повреждения, но и заполняются микротрещины, неровности, сколы и пр.
Шпаклевки можно наносить, как на грунтовки, так и на чистый металл, при этом данный материал очень хорошо сочетается с любыми лакокрасочными покрытиями.
Краски против коррозии
В современно мире, обработка металла лакокрасочными материалами может производиться, как на подготовленные, так и на рыхлые поверхности.
Современные краски содержат в своем составе активные вещества, ингибириторы коррозии, способные создать идеальную поверхность с максимальной защитой от дальнейшего разрушения. Грунтовки-эмали содержат в себе не только защитную функцию, но и декоративные качества.
Такие краски наносятся на металл, придавая ему не только защиту, но и если это продукция предприятия – товарный вид.
Коррозия в неэлектролитных жидкостях
Общие сведения
К жидким неэлектропроводным средам (а точнее, неэлектролитным жидкостям) можно отнести такие органические вещества, к примеру:
- Керосин.
- Бензол.
- Бензин.
- Хлороформ.
- Нефть.
- Спирты.
- Фенол.
- Тетрахлорид углерода.
Еще к таким жидкостям причисляют малое количество жидкостей неорганического типа, к примеру, жидкий бром и сера, которая расплавлена.
При этом следует отметить, что растворители органического типа сами по себе не будут вступать в реакцию с металлами, но, при наличие маленького объема примесей появляется интенсивный процесс взаимодействий.
Скорость коррозии увеличивают находящиеся в нефти элементов с содержанием серы.
Также, для усиления коррозийных процессов нужны высокие температуры. Влага будет интенсифицировать развитие коррозии по электромеханическому принципу. Еще одним фактором быстрого коррозийного развития – бром в жидком виде.
При нормальной температуре он особенно разрушительно будет воздействовать на высокоуглеродистые стали, титан и алюминий.
Менее существенно воздействие брома на никель и железо, а самую большую устойчивость к жидкому типу брома будут показывать тантал, свинец, платина и серебро.
Расплавленная сера будет вступать в агрессивные реакции практически со всеми металлами, и в первую очередь с оловом, свинцом и медью. На углеродистые марки титан и стали сера будет влиять меньше, а еще практически полностью разрушает алюминий.
Защитные действия для металлических конструкций, которые находятся в неэлектропроводных средах жидкого типа, проводят добавлением устойчивым к определенной среде металлом (к примеру, сталей с большим содержанием хрома).
Еще используются особые защитные покрытия (к примеру, в среде, где есть много серы, применяют алюминиевые покрытия).
Способы защиты от коррозии
Способы борьбы с коррозией будут включать в себя:
- Обработку главного металла защитным слоем (например, нанесение лакокрасочного материала).
- Применение ингибиторов (арсенитов или хроматов).
- Внедрение материалов, которые устойчивые к коррозийным процессам.
Подбор определенного материала будет зависеть от потенциальной эффективности (тут имеется виде финансовой и технологической) ее применения.
Современные принципы по защите металла от химической коррозии металла будут основаны на следующих методиках:
- Улучшение споротивляемости химического типа. Себя смогли успешно зарекомендовать устойчивые материалы (стекло, высокополимерный пластик и керамика).
- Изоляция материала от агрессивных сред.
- Уменьшение агрессивности технологической среды – в роли примеров таких действий можно выполнить нейтрализацию и удалить кислотность в коррозионой среде, а еще применять различные ингибиторы.
- Защита электрохимического типа (накладывание внешнего тока).
Указанные методики будут подразделяться на две группы:
- Повышение сопротивляемости химического типа и изолирование будет применяться до того, как металлическая конструкция запускается в использовании.
- Уменьшение агрессивности и защиты электрохимического типа применяется уже при применении изделий и металла. Использование обеих методик дает возможность внедрять новые защитные методы, и в результате защита будет обеспечиваться изменением эксплуатационных условий.
Одним из самых часто используемых методов защиты металла является антикоррозийное гальваническое покрытие, но это экономически нерентабельно при большой площади поверхности. Причина в больших тратах на процесс подготовки. Ведущее место среди методов по защите будет занимать покрытие металла лакокрасочным материалом.
Популярность такого способа борьба с коррозией обусловлена совокупностью факторов:
- Высокие свойства защиты (отталкивание жидкостей, гидрофобность, невысокая газовая проницаемость и паропроницаемость).
- Технологичность.
- Большие возможности для решений декоративного типа.
- Ремонтопригодность.
- Экономическая оправданность.
В то же время применение широкодоступных материалов тоже имеет недостатки:
- Неполное уважение поверхности металла.
- Нарушено сцепление покрытия с главным металлом, покрытием против коррозии, и начнет способствовать коррозии.
- Пористость, которая приводит к повышенному уровню проницаемости влаги.
И все-таки, окрашенная поверхность защищает металлы от процессов коррозии даже при локальном повреждении пленки, тогда как несовершенные покрытия гальванического типы способны даже ускорить коррозию.
Коррозия металлов под землей
Существует вред для металлов не только на поверхности, но и под землей. В настоящее время на некоторой глубине достаточно часто залегают металлические коммуникации, которых постепенно уничтожает электрокоррозия. Для борьбы с таким типом коррозии необходимо:
- Отстранять телекоммуникационные трасы от рельс электрифицированного транспорта (проблема в блуждающих токах);
- Увеличить сопротивление трубопровода и пространства в грунте;
- Монтаж изолирующих фланцев;
- Повышение электропроводимости трубопроводов и монтаж на сальниковых компенсаторах токопроводящих перемычек;
- Регулировать допустимое уравнивание потенциалов в сети параллельных трубопроводов.
- Установка поперечных перемычек.
Где бы не находился металлический элемент, на воздухе, под землей или в помещении, его в любом случае нужно обрабатывать. Правильно подобранные краски и их качество будет залогом успешного и недорогого способа борьбы с коррозией металла.
Способы борьбы с ржавчиной
Перед тем, как приступать к борьбе с коррозией, важно ознакомиться с наиболее популярными и эффективными методами удаления ржавчины.
Механический способ удаления ржавчины
Если вы по определенным причинам не хотите или не можете использовать химические средства, вам подойдёт механический метод удаления коррозии.
Ручные щетки.
Если площадь поверхности, с которой требуется удалить ржавчину небольшая, то, как правило, используют ручные щетки с металлическим ворсом. Различаются они между собой способом крепления ручки и жесткостью проволоки. Некоторые модели щеток имеют проволоку, покрытую латунью. Такие щетки считаются наиболее эффективными, поэтому специалисты советуют применять их для борьбы с коррозией.
Способы обработки оргстекла
Механические щетки.
Если у вас есть устройства, оснащённые пневматическим приводом, то можно очистить металл механическими щётками. Они могут быть как торцевыми, так и радиальными.
Как правило, такие щетки устанавливают в электро-дрели или шуруповерт современного типа. Хотя, вам может показаться, что работать с механическими щётками просто, это отнюдь не так.
В процессе работы инструмент сложно удержать, так как он постоянно вырывается из рук.
Поэтому важно использовать дополнительные направляющие, которые помогают удержать шуруповерт или дрель.
Алюминиевая фольга
Фольгу используют для удаления ржавчины на металлических поверхностях. Способ применения: разведите столовый уксус с теплой водой, обработайте фольгу получившимся раствором.
Удаление ржавчины с помощью химических средств
Столовый уксус
Если очистить от коррозии требуется небольшую металлическую деталь, то ее полностью помещают в раствор уксуса 9% на 20-30 минут. Затем достаньте из раствора и насухо протрите тряпкой. Если деталь большого размера, то очистить ее можно губкой смоченной в уксусе.
Важно: чтобы не повредить нежную кожу рук, работать необходимо в перчатках.
Лимонная кислота
Для удаления коррозии приготовьте специальный раствор. Смешайте лимонную кислоту с водой, добавьте небольшое количество поваренной соли, тщательно размешайте. Обработайте полученным средством проблемные места.
Пищевая сода
Смешайте пищевую соду с водой, должна получиться кашеобразная консистенция. Нанесите полученную массу на ржавчину, оставьте на 30 минут, удалите остатки средства с помощью сухой тряпки.
«Кока-кола»
Газировка отлично справляется с ржавчиной. Способ применения: перелейте газированный напиток в емкость, поместите в нее металлическое изделие, оставьте на 24 часа. Затем промойте изделие, отрите сухой тряпкой.
Соляная кислота
Соляную кислоту применяют не только для устранения ржавого налета, но и для предотвращения появления коррозии. После обработки соляной кислотой на поверхности изделия создается защитный слой. Важно соблюдать правила техники безопасности работая с соляной кислотой.
Перекись водорода
Перекись водорода не только удаляет коррозию с металлической поверхности, но и придает ей первоначальный блеск. Способ применения: смешайте 50 мл перекиси водорода с 200 мл нашатырного спирта.
Затем добавьте компоненты в один литр воды, тщательно размешайте. Полученный раствор нанесите на участок, который требуется очистить.
Средство оставьте на 25-30 минут, смойте теплой водой, тщательно протрите сухим полотенцем.
Народные средства для удаления ржавчины
Картофель
Для удаления коррозии с кухонных ножей разрежьте картофелину на две части. Обработайте поврежденные участки сырым картофелем. Прополосните теплой водой, протрите сухим полотенцем.






