- Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов
- Структура Периодической системы элементов
- Свойства Периодической системы элементов
- Элементы Периодической таблицы Менделеева
- Щелочные металлы
- Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс
- Щелочноземельные металлы
- Лантаноиды и актиноиды
- Переходные металлы
- Неметаллы
- Подгруппа углерода
- Подгруппа азота
- Подгруппа кислорода
- Галогены
- Инертные газы
- Таблица Менделеева для чайников – HIMI4KA
- Периодический закон
- Группы и периоды Периодической системы
- Свойства таблицы Менделеева
- Лантаниды (редкоземельные элементы) и актиниды
- Галогены и благородные газы
- Переходные металлы
- Металлоиды
- Постпереходными металлами
- Неметаллы
- Путешествие по таблице элементов: от водорода до оганесона • Библиотека
- 7 элементов в таблице Менделеева, которые здравому смыслу не оставляют ни единого шанса
- Цезий как эталон самого точного времени в мире
- Олово – элемент, который совершает самоубийство!
- Висмут
- Полуметаллы
- Группа элементов, металлов относящихся к Полуметаллам:
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде.
Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов.
Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему.
Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
- Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
- Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
 Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий.
Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку.
Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил.
Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
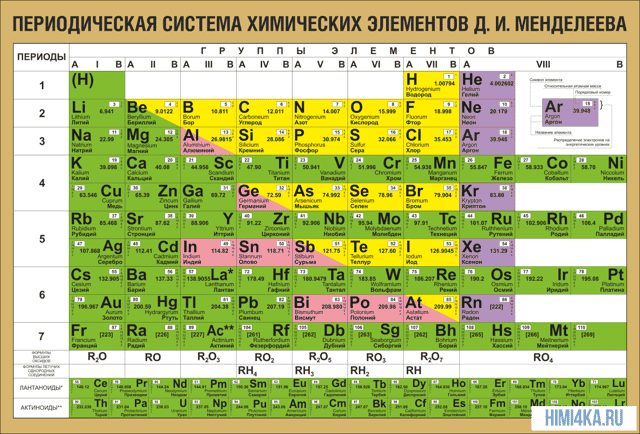
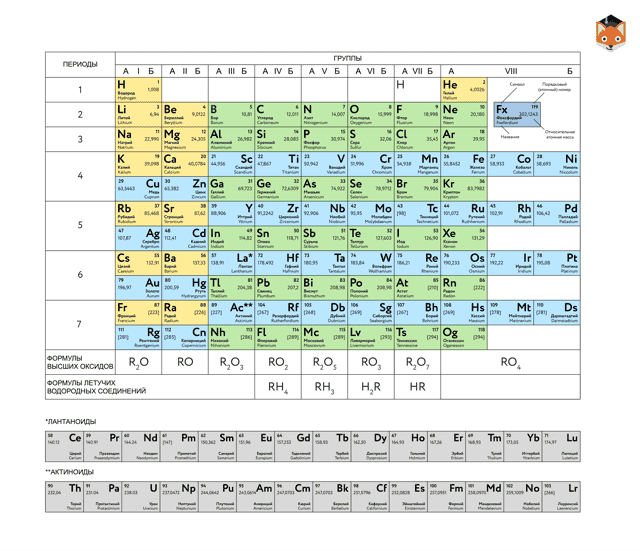 Периодическая таблица химических элементов
Периодическая таблица химических элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов.
В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп.
Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.

Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу.
Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов).
Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
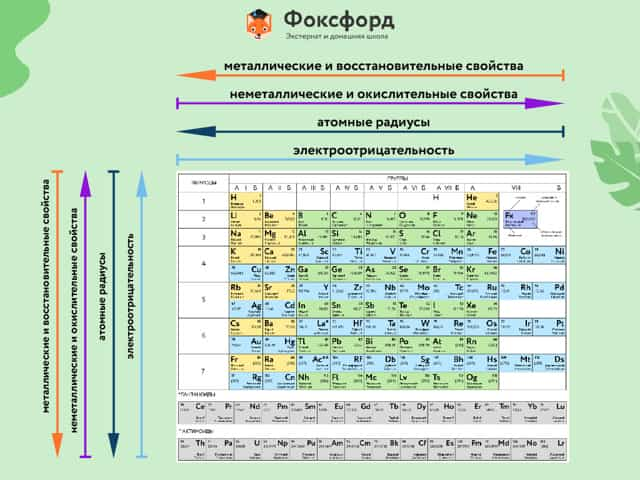
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы

Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс
Щелочноземельные металлы
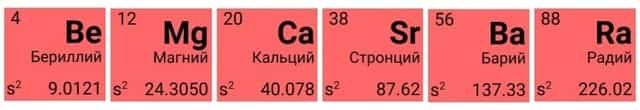
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.

Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
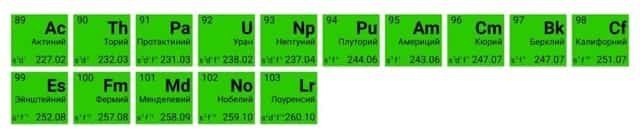
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы

Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот).
Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
Таблица Менделеева для чайников – HIMI4KA
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории.
Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная.
Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом.
Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу.
Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме.
Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп.
Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов.
Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений.
В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы.
Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
- Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
- Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
- В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию.
Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами.
По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы.
Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов.
Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке.
В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е.
ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску.
В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке.
Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Путешествие по таблице элементов: от водорода до оганесона • Библиотека
Периодическая таблица химических элементов по праву считается одним из величайших достижений химической науки. Сегодня она насчитывает почти вдвое больше элементов, чем полтора века назад, когда Дмитрий Иванович Менделеев опубликовал свой «Опыт системы элементов, основанный на их атомном весе и химическом сродстве».
Представим себе, что мы смогли проникнуть в наномир и познакомиться с элементами, «населяющими» современную таблицу.
В этом случае периодическая система предстала бы в виде высотного здания, имеющего семь «этажей» (периодов), 18 «блок-секций» (групп) которого насчитывают 118 уютных «квартир» (клеток).
Некоторые из жильцов — элементы-рекордсмены, многие могут рассказать о себе немало интересного, не без основания претендуя на звание «самый-самый».
В квартире под номером один живёт удивительный элемент — водород H. Он рекордсмен сразу в нескольких номинациях. Это и самый простой, и самый распространённый в природе элемент. На него приходится более 90% всех атомов видимой Вселенной.
В обычных условиях он существует в виде самого лёгкого газа: один литр его весит меньше 0,09 г. При охлаждении до −253°С водород переходит в жидкое состояние, превращаясь в самую лёгкую жидкость: десятилитровое ведро такой жидкости весило бы всего 708 г.
Водород — единственный химический элемент, все семь братьев-изотопов которого имеют собственные имена. Наиболее известные из них — протий (1H), дейтерий (2H или D) и тритий (3H или T). Имена других тяжёлых изотопов водорода сегодня редко используются. В недрах звёзд водород превращается в гелий.
В результате этой реакции выделяется огромное количество энергии, ничтожная часть которой (одна двухмиллиардная!) попадает на Землю. Благодаря этой энергии и существует жизнь на нашей планете, существуем мы.
Сосед водорода, занимающий квартиру номер два, инертный газ гелий He. Несмотря на то что элемент назван в честь греческого бога Солнца, вещество, состоящее из его атомов, — самая холодная жидкость на Земле: его температура кипения (−269°С) лишь на четыре градуса выше абсолютного нуля.
Это единственное простое вещество, температура плавления которого неизвестна: даже при абсолютном нуле оно остаётся жидким и переходит в твёрдое состояние лишь при давлении около 25 атм. Гелий — обладатель самого маленького атома: его радиус всего 31 пм (1 пикометр = 1 · 10−12 м).
Напротив, самыми «пышными формами» может похвастаться цезий Cs, проживающий в квартире номер 55. Его атомный радиус почти на порядок больше — 298 пм. К тому же цезий — самый мягкий металл, да ещё и редкого светло-золотистого цвета (как правило, все металлы серые). Впрочем, и самый твёрдый металл хром Cr имеет голубовато-серебристый цвет.
Способность цезия легко отдавать электрон внешнего энергетического уровня делает его ещё и самым активным металлом.
Самый лёгкий металл расположился этажом ниже под водородом. Это литий Li. Его плотность составляет всего 0,534 г/см3, он почти в два раза легче воды.
Самый тяжёлый металл — осмий Os — занимает квартиру номер 76. Изготовленный из него куб с ребром 1 м весил бы 22,59 т.
Он на сотые доли процента опережает своего соседа из квартиры 77 (иридий Ir) в борьбе за звание элемента с самой высокой плотностью.
Путешествуя по таблице элементов, мы непременно должны постучаться в дверь с номером шесть. Это апартаменты самого важного для жизни на Земле элемента — углерода C. Не случайно его называют «королём элементов» Периодической таблицы.
Именно углерод — основа всех органических соединений: от простеньких молекул углеводородов до сложнейших белковых нитей или двойной спирали ДНК. Этот химический элемент имеет несколько аллотропных модификаций — хорошо знакомые алмаз, графит, графен и фуллерены.
Среди последних наиболее знаменит бакминстерфуллерен, известный в мире под именами футболен, бакибол или просто фуллерен. Благодаря своей безукоризненной симметрии он, возможно, самая красивая молекула Вселенной.
Фантастическая красота углеродного кластера C60 настолько ослепительна, что поначалу ни физики, ни химики просто не могли поверить, что такая высокосимметричная молекула вообще может существовать. В 1996 году первооткрыватели фуллерена — Роберт Кёрл, Харольд Крото и Ричард Смолли — были удостоены Нобелевской премии по химии.
А полтора десятилетия спустя фуллерены были обнаружены в космическом пространстве. Сегодня это самые большие молекулы из всех, которые когда-либо находили за пределами Земли. Как знать, может быть, именно фуллерен принёс на Землю атомы или молекулы, благодаря которым зародилась жизнь на нашей планете.
Две соседние с углеродом квартиры занимают рекордсмены по распространённости. Азот N (элемент номер семь) — самый распространённый элемент в атмосфере (чуть более 78% по объёму).
Появившийся в атмосфере нашей планеты около двух миллиардов лет назад кислород (элемент номер восемь) держит пальму первенства по распространённости в литосфере (почти 49% по массе) и гидросфере Земли (86% веса всех океанов), а также в теле человека (около двух третей по массе).
Так, в 70-килограммовом представителе вида Homo Sapiens на долю кислорода O приходится почти 45 кг. Согласно данным журнала New Scientist, опубликованным в декабре 2005 года, эмпирическая формула человеческого тела имеет вид:
H15750 N310 O6500 C2250 Ca63 P48 K15 S15 Na10 Cl6 Mg3 Fe1.
В ней кислород уступает водороду по количеству атомов, но значительно превосходит его по массе.
Антиподы азота и кислорода занимают квартиры под номерами 85 и 86. Имя первого — астат At (от греческого αστατος — ‘неустойчивый’) — говорит само за себя: все его изотопы — короткоживущие (период полураспада самого устойчивого 210At составляет чуть более восьми часов). Именно поэтому астат самый редкий природный элемент Периодической таблицы.
По разным данным, его содержание в земной коре в любой конкретный момент времени не превышает одного грамма. Радон Rn, занимающий 86-ю квартиру, самый редко встречающийся в атмосфере элемент — его содержание в ней всего около 0,0000000000000000001%.
При стандартных температуре и давлении радон — самый тяжёлый из газообразных простых веществ: 1 литр его весит 9,73 г.
Несмотря на то что квартиры двух других элементов расположены на одной площадке (во втором периоде), их хозяева являют собой полную противоположность друг другу. В девятой квартире проживает самый электроотрицательный и самый активный из всех элементов-неметаллов — фтор F. Даже благородные газы — ксенон Xe и криптон Kr — пасуют перед этим химическим монстром.
В его атмосфере горит, казалось бы, самое несгораемое вещество — вода. Сила фтора как окислителя настолько велика, что кислород окисляется в его атмосфере, образуя фториды OF2, O2F2 и O3F2! Напротив, сосед фтора, проживающий в десятой квартире, — неон Ne славится своим олимпийским спокойствием и с недавних пор носит титул самого инертного химического элемента.
Это звание закрепилось за ним после того, как в марте 2018 года журнал American Scientist опубликовал ошеломляющую статью о способности гелия образовывать соединения с некоторыми элементами. Причём это происходит без образования классической химической связи, то есть без участия валентных электронов.
Напротив, ни одного устойчивого соединения неона до сих пор идентифицировать не удалось.
Квартиру номер 26 занимает один из семи металлов древности. Вероятно, железо Fe — самый первый металл, с которым познакомился человек. Это единственный химический элемент, имя которого по праву запечатлено в названии целой исторической эпохи — железного века.
Да и сегодня, в период широкого использования полимеров и искусственных материалов, железо по-прежнему верно служит человеку. По данным Королевского химического общества, его доля среди всех получаемых металлов достигает 90%.
Большая часть железа идёт на производство стали.
Чемпион по тугоплавкости при нормальных условиях — вольфрам W — проживает в квартире номер 74. Он начинает плавиться при 3422°С. Вольфрам — обладатель и самой высокой температуры кипения (5555°С), сравнимой с температурой поверхности Солнца.
Неподалёку от самого тугоплавкого расположился самый легкоплавкий металл ртуть Hg, находящийся в жидком состоянии при температуре выше −39°С. Это самый загадочный и необыкновенный металл, известный человеку с незапамятных времён. Алхимики рассматривали ртуть как главное действующее начало философского камня.
На протяжении тысячелетий ртуть пленяла и продолжает очаровывать людей своей красотой. Не случайно её нередко называют живым серебром (по-латыни — argentum vivum).
А настоящее серебро Ag расположилось в квартире номер 47. Благодаря наивысшей электропроводности и отражательной способности серебро давно с успехом используется в электронике, электротехнике и при изготовлении зеркал. По данным Института серебра (The Silver Institute, USA), мировой спрос на серебро в 2018 году вырос на 4%, а его добыча достигла почти 30 тысяч тонн.
- На земле весь род людской
Чтит один кумир священный,
Он царит над всей Вселенной, - Тот кумир — телец златой!
Вряд ли кому не известна ария Мефистофеля из оперы Шарля Гуно «Фауст». Это всё о нём, о жильце квартиры 79, именуемом золотом Au. Оно самое романтичное и самое кровавое, самое почитаемое и самое презренное, самое желанное и самое проклятое.
Получать золото, превращая в него другие металлы, было заветной мечтой алхимиков. Недаром они называли его «царём металлов», обозначая символом Солнца.
Причины такой магической притягательной силы золота связаны с его уникальными свойствами: оно химически стойко, обладает удивительной ковкостью (из кусочка золота массой 1 г можно вытянуть тончайшую проволоку длиной почти 3,5 км), имеет привлекательный цвет и практически вечно сохраняет блеск.
Никакой другой металл не может сравниться в этом отношении с золотом! Справедливости ради нужно отметить, что золото не столь благородно и при определённых условиях способно реагировать с некоторыми простыми веществами, а также со щелочами, с кислотами или их смесями, например с царской водкой — смесью (3:1 по объёму) концентрированных соляной и азотной кислот. Самый стойкий к кислотам металл — иридий Ir, что проживает в квартире 77: до сих пор неизвестно ни одной кислоты или их смеси, способных его растворить.
Бесспорно, золото издревле было и остаётся символом красоты, власти и богатства. Однако самым престижным считается его сосед, занимающий квартиру 78.
Серебристо-белая «госпожа» платина Pt входит в элитный клуб благородных металлов, будучи королевой ювелирного дела. По спросу платина опережает даже золото.
Это связано с её высокой химической устойчивостью к сильным кислотам и коррозии даже при высоких температурах. Именно поэтому она широко востребована и в научных исследованиях, и в промышленности.
Несмотря на то что серебро, золото и платина — мерила богатства, по стоимости они не идут ни в какое сравнение с некоторыми искусственно полученными металлами.
Самым дорогим химическим элементом считается один из изотопов калифорния 252Cf, за один грамм которого придётся выложить 27 миллионов долларов США! Его ежегодное производство составляет около 40 мкг, а общий мировой запас, вероятно, не превышает 8 г.
Уникальность калифорния ещё и в том, что он является очень мощным источником нейтронов, что позволяет использовать его в медицине и ядерной физике.
Что за волшебные звуки льются из квартиры номер 51? Здесь живёт известный с глубокой древности самый музыкальный химический элемент — сурьма Sb. В отличие от большинства металлов, сурьма при кристаллизации расплава расширяется.
Но любопытна другая её особенность: оказывается, при медленном охлаждении и застывании расплавленная сурьма издаёт восхитительные низкочастотные звуки, напоминающие «пение» тибетских колоколов и чаш или чарующее пение сирен.
Химический элемент менделевий Md с порядковым номером 101, синтезированный в 1955 году в Калифорнийской национальной лаборатории имени Эрнеста Лоуренса в Беркли и названный в честь создателя одного из первых вариантов Периодической таблицы, претендует на шутливое звание самого хулиганистого.
Дело в том, что рождения желанного атома ждут месяцами и даже годами, по эмоциональному состоянию оно сродни рождению ребёнка.
Поэтому легко понять радость коллектива исследователей во главе с Гленном Сиборгом, которому при бомбардировке изотопа эйнштейния 253Es ядрами гелия удалось получить семнадцать (!) атомов менделевия Md.
При этом американские учёные позволили себе такую шутку: счётчик, фиксирующий рождение атома нового элемента, они подсоединили к пожарной сигнализации, которая, естественно, срабатывала каждый раз, как только желаемая частица появлялась в реакторе. Так продолжалось до тех пор, пока пожарная служба не пресекла это «хулиганство».
Завершающий на сегодняшний день седьмой период таблицы элемент, имеющий порядковый номер 118, не только самый тяжёлый (по массе), но, вероятно, и самый скандальный. Дело в том, что его рождение связано с крупным научным скандалом.
В мае 1999 года физики всё той же лаборатории в Беркли опубликовали в журнале Physical Review Letters статью, в которой сообщили о получении желанного элемента. Когда их коллегам из Германии и Японии (а затем и в самом Беркли) не удалось воспроизвести результаты, возникли подозрения в достоверности полученных данных.
Два года спустя результаты были признаны сфальсифицированными, статья отозвана, а фальсификатор уволен.
Успешный синтез нового элемента осуществлён в 2002 и 2005 годах совместно американскими и российскими физиками под руководством Юрия Оганесяна. Три его атома просуществовали менее одной тысячной доли секунды.
В ноябре 2016 года новорождённому дано название «оганесон» Og.
Так были отмечены заслуги академика Оганесяна в открытии сверхтяжёлых элементов, а оганесон стал вторым (после сиборгия) элементом, названным в честь здравствующего учёного («Наука и жизнь» писала об этом в январе 2017 года, статья «Унуноктий стал оганесоном» ).
Сегодня физики и химики спорят, есть ли граница у периодической системы и сколько химических элементов может она содержать.
Мнения разделились: кто-то полагает, что таблица близка к завершению, кто-то надеется, что могут существовать элементы, имеющие порядковые номера 170 и более.
Сейчас начинается строительство восьмого этажа. Как знать, скольким новосёлам ещё предстоит обживать новые квартиры!
7 элементов в таблице Менделеева, которые здравому смыслу не оставляют ни единого шанса
Почти любой элемент в периодической таблице Менделеева удивителен и имеет долю сумасшествия. Сера, похоже, не принадлежит к сумасшедшему клубу. Но тем не менее факты о ней удивительно интересны.
Учтите, что вода – это H20. Это необходимо для жизни. Она не пахнет. Это жидкость.
Чуть ниже кислорода в периодической таблице находится сера. У нее, по логике, должны быть похожие свойства. Но это не так. Согласитесь, это поразительно. Но есть в нашем мире химии и более необычные элементы, которые могут удивить еще больше. Мы в 1Gai.Ru изучили всю таблицу Менделеева, отобрав для вас самые интересные факты о самых удивительных элементах.
Цезий как эталон самого точного времени в мире
Цезий – прекрасный пример управляемого хаоса. Этот элемент известен как радиоактивный отход от ядерных взрывов. Цезий является одним из пяти элементов, которые находятся в жидком состоянии при комнатной температуре.
- Но самое удивительное изменение состояния цезия происходит, когда вы помещаете его в воду. Вот что при этом происходит:
- Также у цезия электронные переходы настолько точны, что он стал использоваться в качестве основного стандарта для определения самого точного в мире времени.
- Так, секунда – это время, равное 9 192 631 770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133.
- Цезий применяется в атомных часах. Вот как они выглядят:
- hodinkee.com
Эти атомные часы настолько точны, что не потеряют ни секунды за 20 миллионов лет. Это безумие, как такой нестабильный элемент может быть использован, чтобы стать нашим точным определением времени.
Олово – элемент, который совершает самоубийство!
Олово (Sn) – это 50-й элемент периодической таблицы Менделеева.
drrajeshv.com
Олово издавна известно человечеству. Так, есть доказательства, что человек знал об олове уже в IV тысячелетии до нашей эры. Этот металл был очень дорог и мало кому доступен. Именно поэтому изделия из него редко встречаются среди римских и греческих древних находок. Примечательно, что об олове даже есть информация в Библии (Четвертой Книге Моисея).
Обычно олово существует в его так называемой бета-форме (олово белое β-форма). Олово в этой форме белое, блестящее и сохраняет свою форму.
Но когда температура опускается ниже 13 ° C, олово начинает менять свою красивую форму – переходит в альфа-форму (α-модификация серого олова), которая в основном представляет собой сероватый порошок.
Этот переход металлического олова в бесполезный пепел называется «оловянной чумой».
- Бета-форма
- Альфа-форма
Примечательно, что вокруг олова в нашем мире есть множество интересных легенд. Одна из самых интересных – это легенда о том, как свойства олова сыграли с Наполеоном Бонапартом злую шутку.
Легенда гласит, что это необычное химическое поведение олова способствовало падению императора Наполеона Бонапарта. В те времена олово использовалось для изготовления пуговиц и других застежек солдатской формы. Пока армия французов шла в сторону России, с пуговицами солдат было все порядке. Но все изменилось, когда солдаты ступили на российскую землю, где свирепствовали морозы.
Wikipedia
Вот тут-то и началась метаморфоза с оловянными пуговицами, которые начали разрушаться, в результате чего форма не могла согреть солдат. В действительности же олову требуется несколько месяцев, чтобы буквально уничтожить себя, преобразовавшись в другую форму. Но, с другой стороны, когда французы вторглись в Россию, температура была ниже минус 30 ° C.
Так что, как полагают некоторые историки и химики, это и послужило сильным толчком для перехода оловянных пуговиц в порошкообразную форму. Правда, все это исторически не подтверждено.
А согласитесь, легенда хорошая.
Ведь один факт, что легендарный Наполеон потерпел крах своей армии на территории России из-за проблем с форменным обмундированием и виной всему химические свойства олова… Звучит красиво!
Если вам интересно, вот видео, которое показывает переход олова из его бета-формы в альфа-форму:
Висмут
- Обычно это выглядит так:
- nexmetal.com
- Но при правильных условиях это может выглядеть так:
- Wikipedia
Полуметаллы
Полуметаллы, Полуметаллы. Полуметаллы (металлоиды, амфотерные металлы) — химические элементы, расположенные в периодической системе на границе между металлами и неметаллами. Для них характерно образование ковалентной кристаллической решётки и наличие металлической проводимости.
В физике твёрдого тела полуметаллами называются различные вещества, занимающие по электрическим свойствам промежуточное положение между металлами и полупроводниками.
К полуметаллам относят Bi, Sb, Po, иногда — As, Te, Ge, которые по своим химическим свойствам являются неметаллами, но по типу проводимости относятся к проводникам, а также Sn, имеющее полупроводниковую форму, и аллотропную модификацию углерода — графит.
Группа элементов, металлов относящихся к Полуметаллам:
Отличие от полупроводников полуметаллы обладают электрической проводимостью при абсолютном нуле температуры, и в отличие от металлов их проводимость с температурой возрастает.
Характерной особенностью полуметаллов является слабое перекрытие валентной зоны и зоны проводимости, что приводит, с одной стороны, к тому, что полуметаллы остаются проводниками электрического тока вплоть до абсолютного нуля температуры, а с другой стороны — с повышением температуры число носителей тока (электронов и дырок) возрастает, но всё-таки остаётся небольшим, достигая концентрации 1018—1020 см–3, или 10–3 на атом.
Носители тока в полуметаллах отличаются большой подвижностью и малой эффективной массой. Благодаря этому полуметаллы — наиболее подходящие объекты для наблюдения размерных эффектов, фазовых переходов полуметалл — диэлектрик в сильных магнитных полях и ряда других явлений.
Близки к группе неметаллы — химическим элементам с неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов.
Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
Нас находят по запросам: — полуметаллы — уровень ферми — полуметаллах — полуметалл и его свойства — химия и полуметаллы — Полуметаллы и физика — Физика твёрдого тела