- Азотная кислота — строение и химические свойства
- 1. Типичные свойства кислот:
- 2. Специфические свойства азотной кислоты как окислителя
- Окислительные свойства азотной кислоты | Дистанционные уроки
- Обсуждение: «Окислительные свойства азотной кислоты»
- Азотная кислота (HNO3)
- Азотная кислота. Общая характеристика, химические свойства
- Азотная кислота: свойства и все характеристики
- Получение азотной кислоты
- Химические свойства азотной кислоты
- Применение азотной кислоты
- Примеры решения задач
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
- В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
- NH3 + O2 → (кат. Pt) NO + H2O
- KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
- Кислотные свойства
- CaO + HNO3 → Ca(NO3)2 + H2O
- HNO3 + NaOH → NaNO3 + H2O
- Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑
- Термическое разложение
- Реакции с неметаллами
- Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.
- HNO3(конц.) + C → CO2 + H2O + NO2
- HNO3(конц.) + S → H2SO4 + NO2 + H2O
- HNO3(разб.) + S → H2SO4 + NO + H2O
- HNO3(конц.) + P → H3PO4 + NO2 + H2O
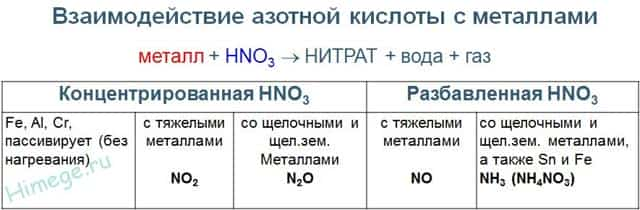
- Реакции с металлами
- Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
- Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
- С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
- Al + HNO3(конц.) ⇸ (реакция не идет)
- При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
- Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте. HNO3 → (hv) NO2 + H2O + O2
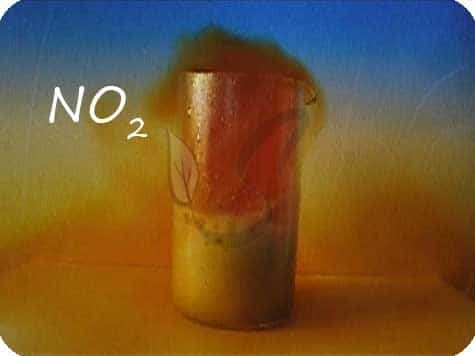
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
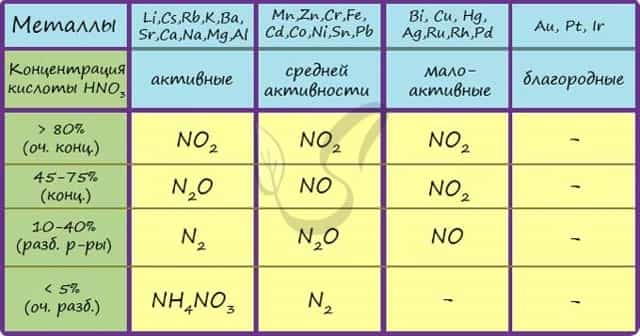
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
- Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
- Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
- В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
- MgO + HNO3 → Mg(NO3)2 + H2O
- Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O
- Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
- Реакции с металлами, основаниями и кислотами
- Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
- Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
- AgNO3 + KCl → AgCl↓ + KNO3
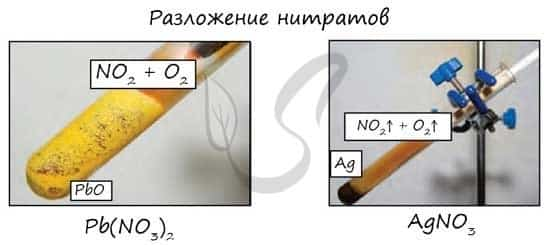
- Разложение нитратов
- Pb(NO3)2 → (t) PbO + NO2 + O2
- NaNO3 → (t) NaNO2 + O2
- Cu(NO3)2 → (t) CuO + NO2 + O2
- PtNO3 → (t) Pt + NO2 + O2
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.
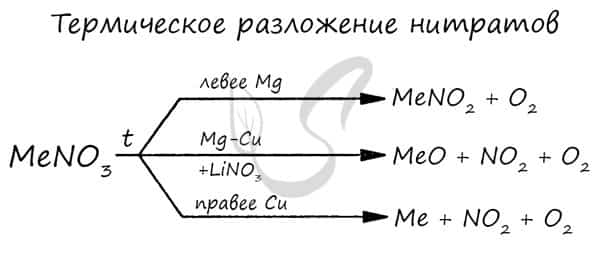
Азотная кислота — строение и химические свойства
Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде. ткип. = 83oC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
- 4HNO 3 = 4NO 2 + 2H 2 O + O 2 .
- Азотная кислота ядовита.
В растворе — сильная кислота; нейтрализуется щелочами, гидратом аммиака, реагирует с основными оксидами и гидроксидами, солями слабых кислот. Сильный окислитель; реагирует с металлами, неметаллами, типичными восстановителями.
Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th, U; не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. Не разрушает диоксид кремния.
Смесь концентрированных HNO3 и HCl («царская водка») обладает сильным окислительным действием (превосходит чистую HNO 3 ), переводит в раствор золото и платину. Еще более активна смесь концентрированных HNO3 и HF.
M r = 63, 01; d = 1, 503 (25) ; t пл = -41, 6 o C; t кип +82,6 o C (разл.).


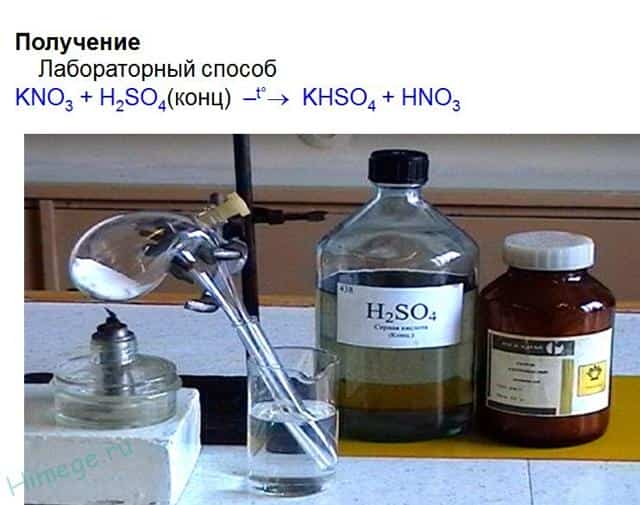
1. Типичные свойства кислот:
- 1) Взаимодействует с основными и амфотерными оксидами:
- 2HNO 3 + CuO = Cu(NO 3 ) 2 + H 2 O
- 6HNO 3 + Al 2 O 3 = 2Al(NO 3 ) 3 + 3H 2 O
- 2) С основаниями, амфотерными гидроксидами:
- HNO 3 + NaOH = NaNO 3 + H 2 O
- 2HNO 3 + Zn(OH) 2 = Zn(NO 3 ) 2 + 2H 2 O
- 3) Вытесняет слабые кислоты из их солей:
- 2HNO 3 + Na 2 CO 3 = 2NaNO 3 + H 2 O + CO 2
- 2HNO 3 + Na 2 SiO 3 = H 2 SiO 3 ↓+ 2NaNO 3
2. Специфические свойства азотной кислоты как окислителя
1) Взаимодействие азотной кислоты с металлами В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода.
Глубина восстановления нитрат-иона зависит от концентрации кислоты и от положения металла в электрохимическом ряду напряжений металлов. Возможные продукты взаимодействия металлов с азотной кислотой приведены в таблице ниже.
Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты .
-

-
- 4 HN +5 O 3( конц .) + Cu 0 = Cu +2 (NO 3 ) 2 + 2 N +4 O 2 + 2 H 2 O
- N +5 + 1e → N +4 2 окислитель, пр-с восстановления
- Cu 0 – 2e → Cu +2 1 восстановитель, пр-с окисления
- 8 HN +5 O 3( разб .) + 3 Cu 0 = 3 Cu +2 (NO 3 ) 2 + 2 N +2 O + 4 H 2 O
- N +5 + 3e → N +2 2 окислитель, пр-с восстановления
- Cu 0 – 2e → Cu +2 3 восстановитель, пр-с окисления
- 2) Проявляет окислительные свойства при взаимодействии с неметаллами:
- S + 6HNO 3 (конц) = H 2 SO 4 + 6NO 2 + 2H 2 O;
- B + 3HNO 3 = H 3 BO 3 + 3NO 2 ;
- 3P + 5HNO 3 + 2H 2 O = 5NO + 3H 3 PO 4 .
- 3) Азотная кислота окисляет сложные вещества:
- 6HI + 2HNO 3 = 3I 2 + 2NO + 4H 2 O;
- FeS + 12HNO 3 = Fe(NO 3 ) 3 + H 2 SO 4 + 9NO 2 + 5H 2 O.
- 4) Ксантопротеиновая реакция: Азотная кислота окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук – «ксантопротеиновая реакция»).
Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляют концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака (в щелочной среде) окраска переходит в оранжевую.
Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка. 
- 5) Окислительные свойства «царской водки»:
- Смесь концентрированных азотной и соляной кислот в объемном соотношении 1 : 3 обладает еще большей окислительной активностью, они могут растворять даже золото и платину:
- HNO 3 + 4HCl + Au = H[AuCl 4 ] + NO + 2H 2 O;
- 4HNO 3 + 18HCl + Pt = 3H 2 [PtCl 6 ] + 4NO + 8H 2 O
4HNO 3 = 4NO 2 + 2H 2 O + O 2 (комн., на свету).
HNO 3 + H 2 O = NO 3 – + H 3 O + .
HNO 3 (разб.) + NaOH = NaNO 3 + H 2 O ,
HNO 3 (разб.) + NH 3 · H 2 O = NH 4 NO 3 + H 2 O.
- 2HNO 3 (2-3%-я) + 8H 0 (Zn, разб. H 2 SO 4 ) = NH 4 NO 3 + 3H 2 O,
- 2HNO 3 (5%-я) + 8H 0 (Mg, разб. H 2 SO 4 ) = N 2 O ↑ + 5H 2 O,
- HNO 3 (30%-я) + 3H 0 (Zn, разб. H 2 SO 4 ) = NO 2 ↑ H 2 O,
HNO 3 (60%-я) + 2H 0 (Zn, разб. H 2 SO 4 ) = HNO 2 + H 2 O. (кат Pd)
2HNO 3 (конц.) +Ag = AgNO 3 + NO 2 ↑ + H 2 O.
- 8HNO 3 (разб.) + 3Cu = 3Cu(NO 3 ) 2 + 2NO↑ + 4H 2 O
- 10HNO 3 (разб.) + 4Mg = 4Mg(NO 3 ) 2 +N 2 O↑ + 5H 2 O (примесь H 2 )
- 12HNO 3 (разб.) + 5Sn — t —5Sn(NO 3 ) 2 + N 2 ↑ + 6H 2 O (примесь NO)
30HNO 3 (оч. разб.) + 8Al = 8Al(NO 3 ) 3 + 3 NH 4 NO 3 + 9H 2 O (примесь H 2 )
12HNO 3 (оч. разб.) + 5Fe = 5Fe(NO 3 ) 2 + N 2 ↑ + 6H 2 O (0-10 o C),
4HNO 3 (разб.) + Fe = Fe(NO 3 ) 3 + NO↑ + 2H 2 O.
4HNO 3 (конц., гор.) + Hg = Hg(NO 3 ) 2 + 2NO 2 ↑ + 2H 2 O,
8HNO 3 (разб., хол) + 6Hg = 3Hg 2 (NO 3 ) 2 + 2NO ↑ + 4H 2 O.
6HNO 3 (конц.) + S = H 2 SO 4 + 6NO 2 ↑ + 2H 2 O (кип.),
2HNO 3 (конц.) + 6HCl(конц.) = 2NO↑ + 3Cl 2 ↑ + 4H 2 O (100-150 o C).
HNO 3 (конц.) + 4HCl(конц.) + Au = H[AuCl 4 ] + NO↑ + 2H 2 O.
4HNO 3 (конц.) + 18HCl(конц.) + 3Pt = 3H 2 [PtCl 6 ] + 4NO↑ + 8H 2 O
4HNO 3 (конц.) + 18HF(конц.) + 3Si = 3H 2 [SiF 6 ] + 4NO↑ + 8H 2 O.
4HNO 3 (дымящ.) + P 4 O 10 = 2N 2 O 5 + 4HPO 3 (в атмосфере O 2 +O 3 )
Окислительные свойства азотной кислоты | Дистанционные уроки
Окислительные свойства азотной кислоты.
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.

- автор статьи — Саид Лутфуллин
- Азотная кислота – в любом виде (и разбавленная, и концентрированная) является сильным окислителем.
Причем, разбавленная восстанавливается глубже, чем концентрированная.
Окислительные свойства обеспечиваются азотом в высшей степени окисления +5
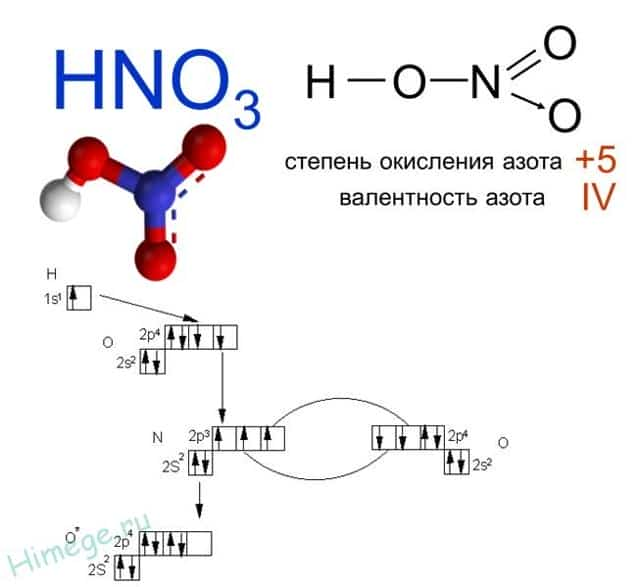
Какая валентность у азота в этом соединении? Вопрос очень хитрый, многие отвечают на него корректно. У азота в азотной кислоте валентность IV.
Атом азота не может образовать больше ковалентных связей, посмотрите на электронную диаграмму:
- Три связи с каждым атомом кислорода, и четвертая как бы распределяется, образуется полуторная связь. Таким образом, валентность азота IV, а степень окисления +5
- Первое самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии с металлами никогда не выделяется
- Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
- HNO3 + Ме → нитрат + H2O + продукт восстановленного азота
- Два нюанса:
1. Алюминий, железо и хром с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
- Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:
- Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
(Не все конечно, такие реакции вообще что угодно дать могут, но в ЕГЭ образуются только эти).
Определить какой именно продукт будет образовываться можно чисто логически:
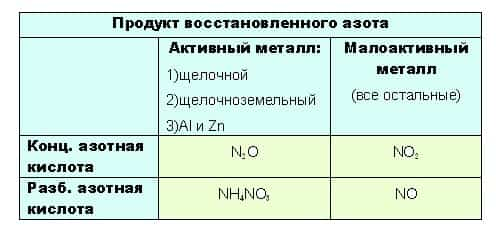
- до таких низких степеней окисления как -3 или +1, с образованием продуктов NH4NO3 или N2O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn. Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N2O, а при взаимодействии с разб. азотной кислотой NH4NO3.
- 4Ba + 10HNO3(конц.) → 4Ba(NO3)2 + 5H2O + N2O↑
- 4Ba + 10HNO3(разб.) → 4Ba(NO3)2 + 3H2O + NH4NO3
- 8Li + 10HNO3(конц.) → 8LiNO3 + 5H2O + N2O↑
- 8Li + 10HNO3(разб.) → 8LiNO3 + 3H2O + NH4NO3
- 8Al + 30HNO3(конц.) (t)→ 8Al(NO3)3 + 15H2O + 3N2O↑
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3
Остальные металлы восстанавливают азотную кислоту до +2 или +4, с образованием продуктов соответственно: NO или O2.
Разбавленная кислота восстанавливается глубже
- при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO. Ну а с конц. азотной NO2:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 4H2O + 2NO↑
- Fe + 6HNO3(конц.) (t)→ Fe(NO3)3 + 3H2O + 3NO2↑
- Fe + 4HNO3(разб.) → Fe(NO3)3 + 2H2O + NO↑
- (обратите внимание, что железо окисляется до высшей степени окисления)
- Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
- 3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO↑
- Если тяжело сразу понять всю логичность выбора, вот таблица:
- Азотная кислота окисляет неметаллы до высших оксидов.
- Так как неметаллы – не такие сильные восстановители, как активные металлы, азот может восстановиться только до +4, образовав NO2 или NO соответственно.
- При окислении неметаллов концентрированной азотной кислотой образуется бурый газ (NO2), а если кислота разбавленная, то образуется NO. Схемы реакций следующие:
- неметалл + HNO3(разб.) → соединение неметалла в высшей степени окисления + NO
- неметалл + HNO3(конц.) → соединение неметалла в высшей степени окисления + NO2
- C + 4HNO3(конц.) → CO2↑ + 2H2O + 4NO2↑
- 3C + 4HNO3(разб.) → 3CO2↑ + 2H2O + 4NO↑
- (угольная кислота не образуется, так как она не стабильна)
- P + 5HNO3(конц.) → H3PO4 + H2O + 5NO2↑
- 3P + 5HNO3(разб.) + 2H2O → 3H3PO4 + 5NO↑
- B + 3HNO3(конц.) → H3BO3 + 3NO2↑
- B + HNO3(разб.) + H2O → H3BO3 + NO↑
S + 6HNO3(конц.) → H2SO4 + 2H2O + 6NO2↑
S + 2HNO3(разб.) → H2SO4 + 2NO↑
- концентрированная азотная кислота окисляет сероводород. Окисление идет глубже при нагревании:
2HNO3(конц.) + H2S → S↓ + 2NO2 + 2H2O
H2S + 8HNO3(конц.) → H2SO4 + 8NO2↑ + 4H2O
- концентрированная азотная кислота окисляет сульфиды до сульфатов:
CuS + 8HNO3(конц.) → CuSO4 + 4H2O + 8NO2↑
- азотная кислота настолько сурова, что может окислить даже ГАЛОГЕН. Только один – иод. Разбавленная восстанавливается глубже: до +2, концентрированная до +4. А вот иод окисляется не до высшей степени окисления +7 (слишком круто), а до +5, образуя иодноватую кислоту HIO3:
10HNO3(конц.) + I2 (t)→ 2HIO3 + 10NO2↑ + 4H2O
10HNO3(разб.) + 3I2 (t)→ 6HIO3 + 10NO↑ + 2H2O
- концентрированная азотная кислота реагирует с хлоридами и фторидами. Только следует понимать, что с фторидами и хлоридами протекает обычная реакция ионного обмена с вытеснением галогеноводорода и образованием нитрата:
NaCl(тв.) + HNO3(конц.) → HCl↑ + NaNO3
NaF(тв.) + HNO3(конц.) → HF↑ + NaNO3
- А вот с бромидами и иодидами (и с бромоводородами, и с иодоводородами) протекает ОВР. В обоих случаях образуется свободный галоген, а азот восстанавливается до NO2:
8HNO3(конц.) + 6KBr(тв.) → 3Br2 + 4H2O + 6KNO3 + 2NO2↑
4HNO3(конц.) + 2NaI(тв.) → 2NaNO3 + 2NO2↑ + 2H2O + I2↓
- Образовавшийся иод окисляется дальше до иодноватой кислоты, поэтому реакцию можно записать сразу:
- 7HNO3(конц.) + NaI → NaNO3 + 6NO2↑ + 3H2O + HIO3
- То же самое происходит при взаимодействии с иодо- и бромоводородами:
- 2HNO3(конц.) + 2HBr → Br2 + 2NO2↑ + 2H2O
- 6HNO3(конц.) + HI → HIO3 + 6NO2↑ + 3H2O
Реакции с золотом, магнием, медью и серебром
Обсуждение: «Окислительные свойства азотной кислоты»
(Правила комментирования)
Азотная кислота (HNO3)
Особенностью азотной кислоты является то, что азот, входящий в состав NO3- имеет высшую степень окисления +5 и поэтому обладает сильными окислительными свойствами.
Максимальное значение электродного потенциала для нитрат-иона равно 0,96 В, поэтому азотная кислота – более сильный окислитель, чем серная. Роль окислителя в реакциях взаимодействия металлов с азотной кислотой выполняет N5+.
Следовательно, водород H2 никогда не выделяется при взаимодействии металлов с азотной кислотой (независимо от концентрации). Процесс протекает по схеме:
Me + HNO3 —> соль + вода + продукт восстановления HNO3
Продукты восстановления HNO3:
Обычно при взаимодействии азотной кислоты с металлом образуется смесь продуктов восстановления, но как правило, один из них является преобладающим. Какой из продуктов будет основным, зависит от концентрации кислоты и активности металла.
Концентрированная азотная кислота
Концентрированным считают раствор кислоты плотностью ρ > 1,25 кг/м3, что соответствует
концентрации > 40%. Независимо от активности металла реакция взаимодействия с HNO3 (конц.) протекает по схеме:
Me + HNO3(конц.) → соль + вода + NO2
С концентрированной азотной кислотой не взаимодействуют благородные металлы (Au, Ru, Os, Rh, Ir, Pt), а ряд металлов (Al, Ti, Cr, Fe, Co, Ni) при низкой температуре пассивируются концентрированной азотной кислотой. Реакция возможна при повышении температуры, она протекает по схеме, представленной выше.
- Примеры:
- Активный металл
- Al + 6HNO3(конц.) → Al(NO3)3 + 3H2O + 3NO2↑
- Металл средней активности
- Fe + 6HNO3(конц.) → Fe(NO3)3 + 3H2O + 3NO↑
- Металл малоактивный
- Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
- Разбавленная азотная кислота
- Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности металла, участвующего в реакции:
- Примеры:
- Активный металл
- 8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3
- Выделяющийся в процессе восстановления азотной кислоты аммиак сразу взаимодействует с избытком азотной кислоты, образуя соль – нитрат аммония NH4NO3:
- NH3 + HNO3 → NH4NO3.
- Металл средней активности
- 10Cr + 36HNO3(разб.) → 10Cr(NO3)3 + 18H2O + 3N2
Кроме молекулярного азота (N2) при взаимодействии металлов средней активности с разбавленной азотной кислотой образуется в равном количестве оксид азота (I) – N2O. В уравнении реакции нужно писать одно из этих веществ.
- Металл малоактивный
- 3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO
- «Царская водка»
«Царская водка» представляет собой смесь одного объема азотной кислоты и трех-четырех объемов концентрированной соляной кислоты, обладающую очень высокой окислительной активностью.
Такая смесь способна растворять некоторые малоактивные металлы, не взаимодействующие с азотной кислотой. Среди них и «царь металлов» — золото.
Такое действие «царской водки» объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила – NOCl:
- HNO3 + 3 HCl → Cl2 + 2 H2O + NOCl
- Хлорид нитрозила далее разлагается по схеме:
- 2 NOCl → 2 NO + Cl2
Хлор в момент выделения состоит из атомов. Атомарный хлор является сильнейшим окислителем, что и позволяет «царской водке» воздействовать даже на самые инертные «благородные металлы».
- Реакции окисления золота и платины протекают согласно следующим уравнениям:
- Au + HNO3 + 4 HCl → H[AuCl4] + NO + 2H2O
- 3Pt + 4HNO3 + 18HCl → 3H2[PtCl6] + 4NO + 8H2O
- На Ru, Os, Rh и Ir «царская водка» не действует.
Азотная кислота. Общая характеристика, химические свойства
Задания по подготовке к ЕГЭ по химии 27 февраля 2019 г., 2:45 
На этом уроке мы пройдем одно из важнейших веществ, широко используемое в химической промышленности, а также присутствующее практически во всех вариантах ЕГЭ по химии, — азотную кислоту.
Мало кто знает о том, что в зависимости от концентрации азотная кислота имеет различные внешние характеристики:
- 63% процентная HNO3, которая поступает в продажу, не дымит, представляет собой бесцветную жидкость, разбавленную водой;
- 86%— ная азотная кислота представляет собой красную дымящую жидкость (дымит красным цветом из-за тетраоксида азота — N2O4), имеет международное название RFNA (Red fuming nitric acid), используется в качестве ракетного топлива;
- 99,9% процентная HNO3 — WFNA (White fuming nitric acid) — белая дымящая азотная кислота, данный ранг вещества используется в индустрии взрывчаток, а также используется в ракетном топливе, кислота такой высокой концентрации, однако, безопаснее RFNA по причине отсутствия N2O4.
Важно! Концентрированная азотная кислота при попадании на кожу окрашивает ее в желтый цвет, смыть ее практически невозможно, она сама исчезнет через некоторое время — этот эффект называется ксантопротеиновая реакция.
В рамках подготовки к ЕГЭ мы пройдем основные химические свойства двух конфигураций азотной кислоты — концентрированной и разбавленной в виде таблиц.
Сначала необходимо знать способы получения азотной кислоты.
| Получение HNO3 | |
| Метод Оствальда | Метод Глаубера |
|
Ba(NO3)2 + H2SO4 (k.) = BaSO4 +2HNO3 (150 C) |
Теперь рассмотрим как реагирует HNO3 с металлами
| HNO3 + Meталл | |||
| Концентрированная | Разбавленная | ||
| Тяжелые металлы(Fe, Cu, Sn, Pb, Ni, Zn) | Металлы до Al(Ca, Na, Mg, Ba, K) | Тяжелые металлы(Fe, Cu, Sn, Pb, Ni, Zn) | Металлы до Al(Ca, Na, Mg, Ba, K) |
| NO2 | N2ONO2 |
|
N2ONH4NO3 |
| Cu + 4HNO3 (к.) = Cu(NO3)2 + 2NO2 + 2H2O;Zn + 4HNO3 (к.) = Zn(NO3)2 + 2NO2 + 2H2O. | 8Na +10HNO3 (к.) = 8NaNO3 + 2N2O + 5H2O;Mg +4HNO3 (к.) = Mg(NO3)2 + 2NO2 + 2H2O. | 3Сu + 8HNO3 (р.) = 3Cu(NO3)2 + 2NO+ 4H2O;4Zn + 10HNO3 (р.) = 4Zn(NO3)2 + NH4NO3 + 3H2O;Fe + 4HNO3 (р.) = Fe(NO3)3 + NO + 2H2O. | Mg +10HNO3 (р.) = 4Mg(NO3)2 + N2O + 5H2O;8Na +10HNO3 (р.) = 8NaNO3 +NH4NO3 + 2H2O. |
Азотная кислота реагирует также с неметаллами, как концентрированная, так и разбавленная и получением кислот и кислотных оксидов.
Важно! Si + HNO3 ≠
| HNO3 + Неметалл | |
| Концентрированная | Разбавленная |
| NO2 | NO |
| S + 6HNO3 (к.) = H2SO4 + 6NO2 + 2H2O;C + 4HNO3 (к.) = CO2 + 4NO2 + 2H2O;P (красн.) + 5HNO3 (к.) = H3PO4 + 5NO2 + H2O; I2 + 10HNO3 (к.) =2HIO3 + 10NO2 + 4 H2O. | S + 2HNO3 (р.) = H2SO4 + 2NO;3C + 6HNO3 (р.) = 3CO2 + 4NO + 2H2O;3P + 5HNO3 (р.) + 2H2O = H3PO4 + 5NO. |
Азотная кислота также активно взаимодействует со сложными веществами (основаниями, оксидами, солями).
| HNO3 + Сложное вещество | |
| Концентрированная | Разбавленная |
| 1) С основными оксидами:МеО + HNO3 (k.) ≠ |
|
| 2) С основаниями:Fe(OH)2 + 4HNO3 (k.) = Fe(NO3)3 + NO2 + 3H2O |
|
|
3) С кислотными оксидами:HемО + HNO3 (p.) ≠ |
|
|
| 5) С амфотерными оксидами:As2O3 + 4HNO3 (k.) + H2O = 2H3AsO4 + 4NO2 (кипячение) |
|
|
|
В конце урока хотелось вспомнить про такое вещество как «царская водка» — это смесь 1 моль азотной кислоты и 3 молей соляной кислоты (HCl); в таком соотношении эти кислоты способны растворить драгоценные металлы (Au, Pt), причем, основным действующим агентом является атомарный хлор, который образуется при окислении HCl азотной кислотой.
Au + 4HCl + HNO3 = H[AuCl4] + NO + 2H2O
При изучении этих таблиц, ты уже сможешь решать сложные задания второй части ЕГЭ, а также сформируешь правильное мышление относительно химических свойств многих веществ.
pangenes.ru © 2022

Азотная кислота: свойства и все характеристики
- На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары её образуют с влагой воздуха мелкие капельки тумана.
- Азотная кислота не отличается прочностью. Уже под влияние света она постепенно разлагается:
- 4HNO3 = 4NO2↑ + O2↑ + 2H2O.
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение.
Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
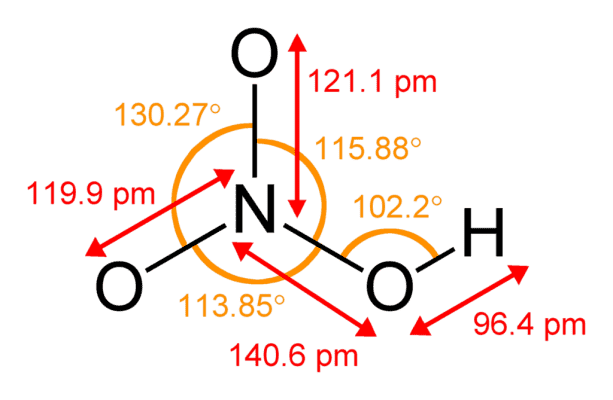
Рис. 1. Строение молекулы азотной кислоты.
Таблица 1. Физические свойства азотной кислоты.
| Молекулярная формула | HNO3 |
| Молярная масса, г/моль | 63 |
| Плотность, г/см3 | 1,513 |
| Температура плавления, oС | -41,59 |
| Температура кипения, oС | 82,6 |
| Растворимость в воде, г/100мл | смешивается |
Получение азотной кислоты
- Азотная кислота образуется в результате действия окислителей на азотистую кислоту:
- 5HNO2 + 2KMnO4 + 3H2SO4 = 5HNO3 + 2MnSO4 + K2SO4 + 3H2O.
- Безводная азотная кислота может быть получена перегонкой при пониженном давлении концентрированного раствора азотной кислоты в присутствии P4O10 или H2SO4 в полностью стеклянном оборудовании без смазки в темноте.
- Промышленный процесс производства азотной кислоты основан на каталитическом окислении аммиака над нагретой платиной:
- NH3 + 2O2 = HNO3 + H2O.
Химические свойства азотной кислоты
Азотная кислоты принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью диссоциирует на ионы. Её соли носят название нитраты.
HNO3↔H+ + NO3—.
Характерным свойством азотной кислоты является её ярко выраженная окислительная способность. Азотная кислота – один из энергичнейших окислителей.
Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор – в фосфорную.
Тлеющий уголек, погруженный в концентрированную HNO3, ярко разгорается.
- S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
- 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
- Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы – в оксиды.
- Концентрированная азотная кислота пассивирует некоторые металлы.
При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется диоксид азота. В случае более активных металлов – железа, цинка – образуется оксид диазота.
Сильно разбавленная азотная кислота взаимодействует с активными металлами – цинком, магнием, алюминием – с образованием иона аммония, дающего с кислотой нитрат аммония.
Обычно одновременно образуются несколько продуктов.
- Cu + HNO3 (conc) = Cu(NO3)2 + NO2↑ + H2O;
- Cu + HNO3 (dilute) = Cu(NO3)2 + NO↑ + H2O;
- Mg + HNO3 (dilute) = Mg(NO3)2 + N2O↑ + H2O;
- Zn + HNO3 (highly dilute) = Zn(NO3)2 + NH4NO3 + H2O.
- При действии азотной кислоты на металлы водород, как правило, не выделяется.
- S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
- 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
Смесь, состоящая из 1 объема азотной и 3-4 объемов концентрированной соляной кислоты, называется царской водкой.
Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» — золото.
Действие её объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила, NOCl:
HNO3 + 3HCl = Cl2 + 2H2O + NOCl.
Применение азотной кислоты
Азотная кислота – одно из важнейших соединений азота: в больших количествах она расходуется в производстве азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.






