- Понятие о шкале температур
- Температура плавления металлов
- Сплав Вуда
- Температура плавления неметаллов
- Заключение
- Пайка металлов с неметаллическими материалами
- Правила взаимодействия металлов с неметаллами
- Спаи между металлами, между металлами и неметаллами, между неметаллами (часть 1)
- 8. Плавление металлов и строение расплавов
- Строение древесины
- ЛЕКЦИЯ № 1. Строение древесины
- 2. Макроскопическое строение древесины
- 1. Строение металлов
- Свойства расплавов стекол
- § 3.3 Строение атомов и периодический закон Менделеева
- § 3.6 Строение ядер
- § 4.14 Строение вещества и химическая связь
- Глава 32 Строение Пространства – Времени
- 2. Зеренное строение металлов. Границы зерен и субзерен
- 10. Строение слитка и аморфные сплавы
Металлы обладают рядом оригинальных свойств, которые присущи только этим материалам. Существует температура плавления металлов, при которой кристаллическая решетка разрушается. Вещество сохраняет объем, но уже нельзя говорить о постоянстве формы.
В чистом виде отдельные металлы встречают крайне редко. На практике применяют сплавы. У них есть определенные отличия от чистых веществ.
При образовании сложных соединений происходит объединение кристаллических решеток между собой. Поэтому у сплавов свойства могут заметно отличаться от составляющих элементов.
Температура плавления уже не остается постоянной величиной, она зависит от концентрации входящих в сплав ингредиентов.
Понятие о шкале температур
Некоторые неметаллические предметы тоже обладают похожими свойствами. Самым распространённым является вода. Относительно свойств жидкости, занимающей господствующее положение на Земле, была разработана шкала температур. Реперными точками признаны температура изменения агрегатных состояний воды:
- Превращения из жидкости в твердое вещество и наоборот приняты за ноль градусов.
- Кипения (парообразования внутри жидкости) при нормальном атмосферном давлении (760 мм рт. ст.) принята за 100 ⁰С.
Внимание! Кроме шкалы Цельсия на практике измеряют температуру в градусах Фаренгейта и по абсолютной шкале Кельвина. Но при исследовании свойств металлических предметов другие шкалы используют довольно редко.
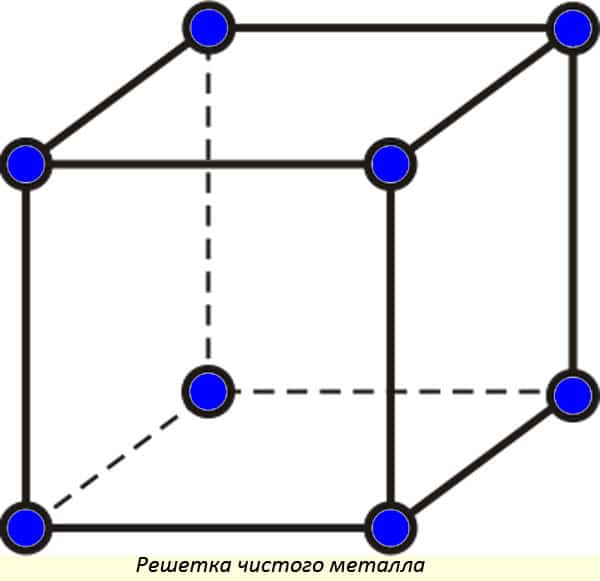
В идеальном виде принято считать, что металлам свойственна кубическая решетка (в реальном веществе могут быть изъяны). Между молекулами имеются равные расстояния по горизонтали и вертикали.
Твердое вещество характеризуется постоянством:
- формы, предмет сохраняет линейные размеры в разных условиях;
- объема, предмет не изменяет занимаемое количество вещества;
- массы, количество вещества, выраженное в граммах (килограммах, тоннах);
- плотности, в единице объема содержится постоянная масса.
При переходе в жидкое состояние, достигнув определенной температуры, кристаллические решетки разрушаются. Теперь нельзя говорить о постоянстве формы. Жидкость будет принимать ту форму, в какую ее зальют.
Когда происходит испарение, то постоянным остается только масса вещества. Газ займет весь объем, который будет ему предоставлен. Здесь нельзя утверждать, что плотность постоянная величина.
Когда соединяются жидкости, то возможны варианты:
- Жидкости полностью растворяются одна в другой, так себя ведут вода и спирт. Во всем объеме концентрация веществ будет одинаковой.
- Жидкости расслаиваются по плотности, соединение происходит только на границе раздела. Только временно можно получать механическую смесь. Перемешав разные по свойствам жидкости. Примером является масло и вода.
Металлы образуют сплавы в жидком состоянии. Чтобы получить сплав, каждый из компонентов должен быть в жидком состоянии. У сплавов возможны явления полного растворения одного в другом.
Не исключаются варианты, когда сплав будет получен только в результате интенсивного перемешивания.
Качество сплава в этом случае не гарантируется, поэтому стараются не смешивать компоненты, которые не позволяют получать стабильные сплавы.
Образующиеся растворимые друг в друге вещества при застывании образуют кристаллические решетки нового типа. Определяют:
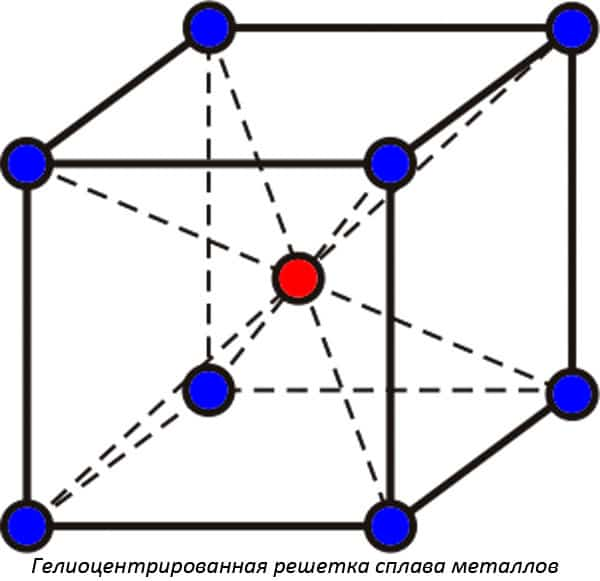
- Гелиоцентрированные кристаллические решетки, их еще называют объёмно-центрированными. В середине находится молекула одного вещества, а вокруг располагаются еще четыре молекулы другого. Принято называть подобные решетки рыхлыми, так как в них связь между молекулами металлов слабее.
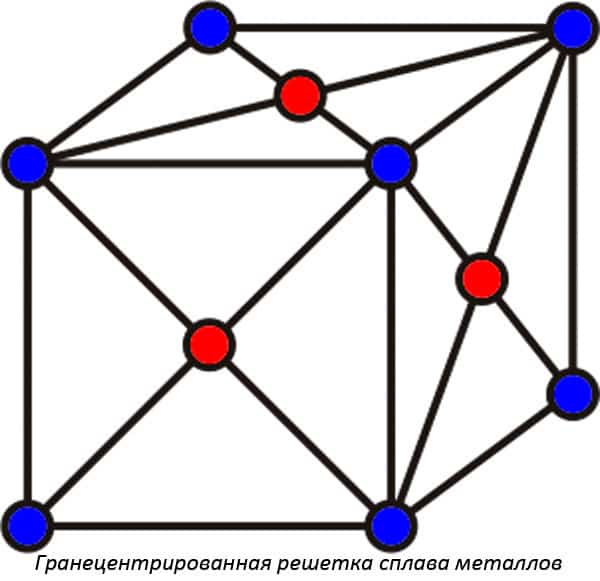
- Гранецентрированные кристаллические решетки образуют соединения, в которых молекулы компонента располагаются на гранях. Металловеды называют подобные кристаллические сплавы плотными. В реальности плотность сплава может быть выше, чем у каждого из входящих в состав компонентов (алхимики средних веков искали варианты сплавов, при которых плотность будет соответствовать плотности золота).
Температура плавления металлов
Разные вещества имеют различную температуру плавления. Принято делить металлы на:
- Легкоплавкие – их достаточно нагревать до 600 ⁰С, чтобы получать вещество в жидком виде.
- Среднеплавкие металлы расплавляются в диапазоне температур 600…1600 ⁰С.
- Тугоплавкими называют металлы, которые могут расплавляться при температуре более 1600 ⁰С.
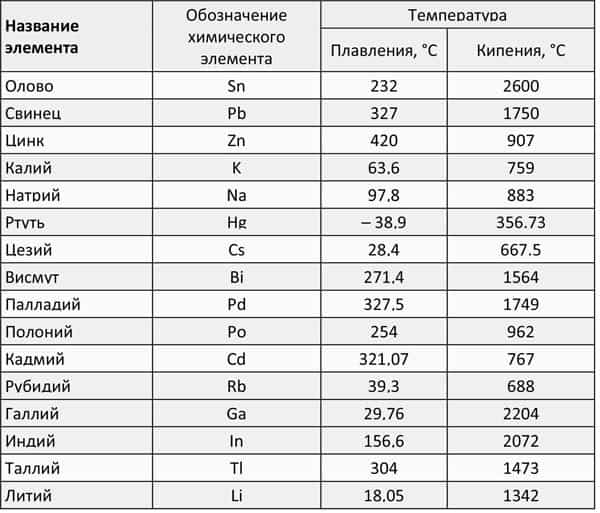
В таблице по возрастанию показаны легкоплавкие металлы. Здесь видно, что самым необычным металлом является ртуть (Hg). В обычных условиях она находится в жидком состоянии. Этот металл имеет самую низкую температуру плавления.
- Таблица 1, температуры плавления и кипения легкоплавких металлов:
- Таблица 2, температуры плавления и кипения среднеплавких металлов:
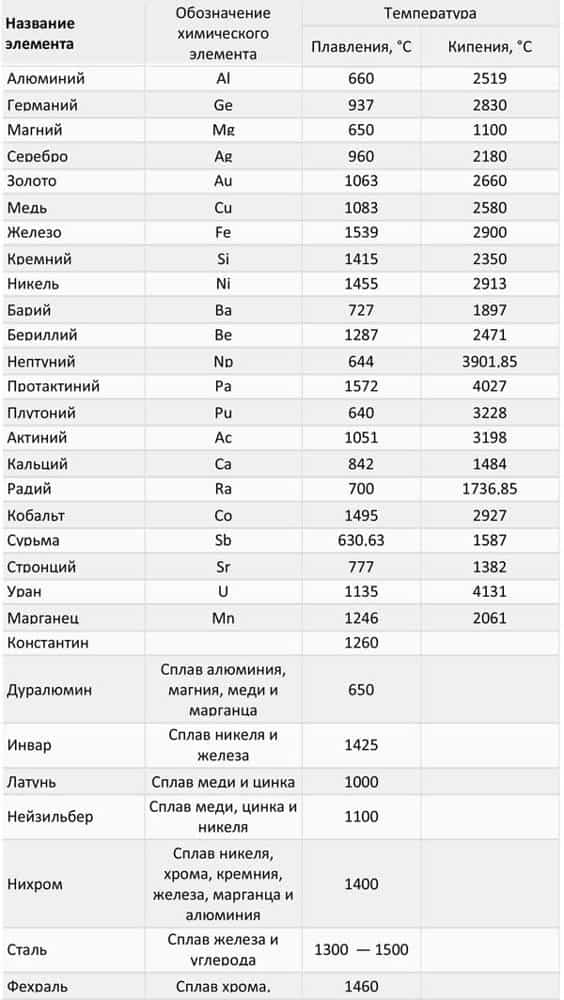
- Таблица 3, температуры плавления и кипения тугоплавких металлов:
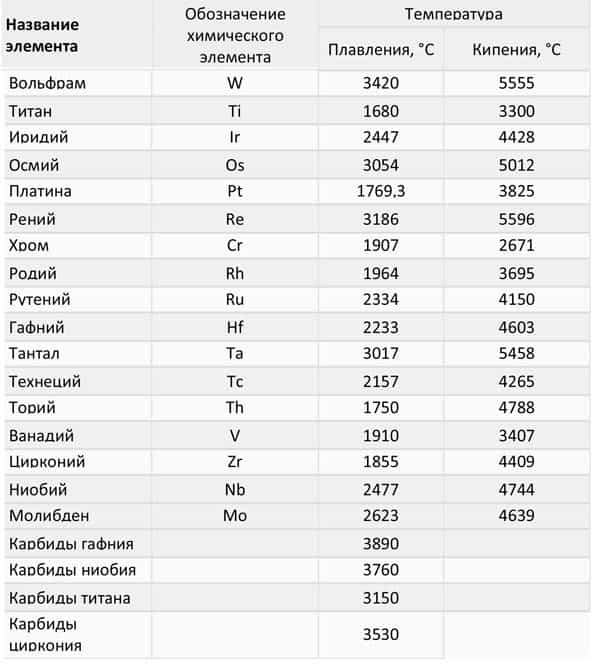
Чтобы вести процесс плавки используют разные устройства. Например, для выплавки чугуна применяют доменные печи. Для плавки цветных металлов производят внутренний нагрев с помощью токов высокой частоты.
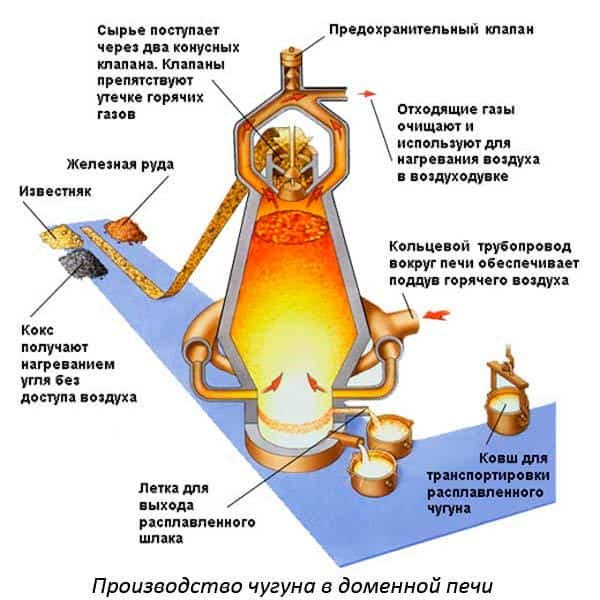
В изложницах, изготовленных из неметаллических материалов, находятся цветные металлы в твердом состоянии. Вокруг них создают переменное магнитное поле СВЧ. В результате кристаллические решетки начинают расшатываться. Молекулы вещества приходят в движение, что вызывает разогрев внутри всей массы.
При необходимости плавки небольшого количества легкоплавких металлов используют муфельные печи. В них температура поднимается до 1000…1200 ⁰С, что достаточно для плавки цветных металлов.
Черные металлы расплавляют в конвекторах, мартенах и индукционных печах. Процесс идет с добавлением легирующих компонентов, улучшающих качество металла.

Сложнее всего проводить работу с тугоплавкими металлами. Проблема в том, что нужно использовать материалы, имеющие температуру более высокую, чем температура плавления самого металла.
В настоящее время авиационная промышленность рассматривает использование в качестве конструкционного материала Титан (Ti). При высокой скорости полета в атмосфере происходит разогрев обшивки.
Поэтому нужна замена алюминию и его сплавам (AL).
Максимальная температура плавления этого довольного легкого металла привлекает конструкторов. Поэтому технологи разрабатывают технологические процессы и оборудование, чтобы производить детали из титана и его сплавов.
Чтобы проектировать изделия из сплавов, сначала изучают их свойства. Для изучения в небольших емкостях расплавляют изучаемые металлы в разном соотношении между собой. По итогам строят графики.
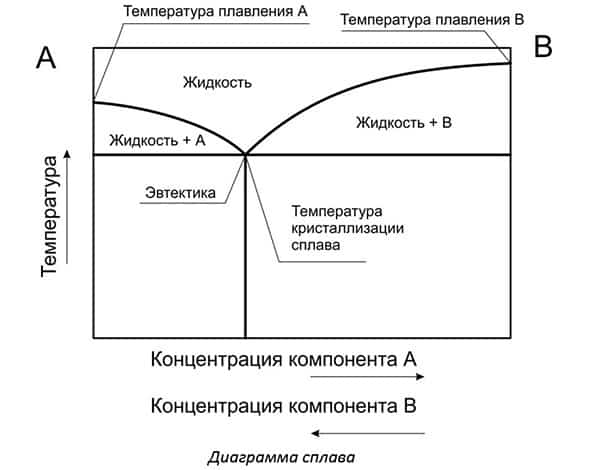
Нижняя ось представляет концентрацию компонента А с компонентом В. По вертикали рассматривают температуру. Здесь отмечают значения максимальной температуры, когда весь металл находится в расплавленном состоянии.
При охлаждении один из компонентов начинает образовывать кристаллы. В жидком состоянии находится эвтектика – идеальное соединение металлов в сплаве.
Металловеды выделяют особое соотношение компонентов, при котором температура плавления минимальная. Когда составляют сплавы, то стараются подбирать количество используемых веществ, чтобы получать именно эвтектоидный сплав. Его механические свойства наилучшие из возможных. Кристаллические решетки образуют идеальные гранецентрированные положения атомов.
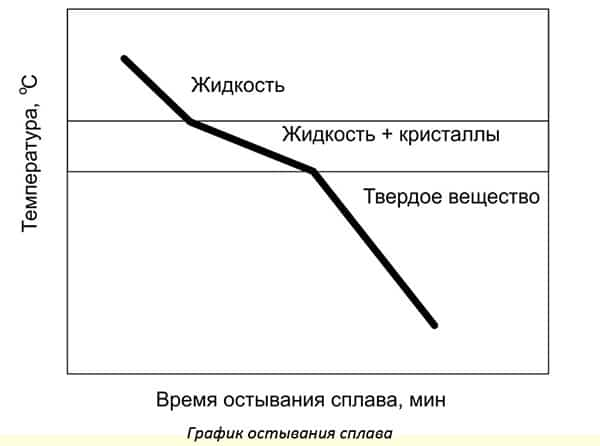
Изучают процесс кристаллизации путем исследования твердения образцов при охлаждении. Строят специальные графики, где наблюдают, как изменяется скорость охлаждения. Для разных сплавов имеются готовые диаграммы. Отмечая точки начала и конца кристаллизации, определяют состав сплава.
Сплав Вуда
В 1860 г. американский зубной техник Барнабас Вуд искал оптимальные соотношения компонентов, чтобы изготавливать зубы для клиентов при минимальных температурах плавления. Им был найден сплав, который имеет температуру плавления всего 60,2…68,5 ⁰С. Даже в горячей воде металл легко расплавляется. В него входят:
- олово — 12,5…12,7 %;
- свинец — 24,5…25,0 %;
- висмут — 49,5…50,3 %;
- кадмий — 12,5…12,7 %.
Сплав интересен своей низкой температурой, но практического применения так и не нашел. Внимание! Кадмий и свинец – это тяжелые металлы, контакт с ними не рекомендован. У многих людей могут происходить отравления при контакте с кадмием.
На практике многие сталкиваются с плавлением при пайке деталей. Если поверхности соединяемых материалов очищены от загрязнений и окислов, то их нетрудно спаять припоями. Принято делить припои на твердые и мягкие. Мягкие получили наибольшее распространение:
- ПОС-15 — 278…282 °C;
- ПОС-25 — 258…262 °C;
- ПОС-33 — 245…249 °C;
- ПОС-40 — 236…241 °C;
- ПОС-61 — 181…185 °C;
- ПОС-90 — 217…222 °C.
Их выпускают для предприятий, изготавливающих разные радиотехнические приборы.
Твердые припои на основе цинка, меди, серебра и висмута имеют более высокую температуру плавления:
- ПСр-10 — 825…835 °С;
- ПСр-12 — 780…790 °С;
- ПСр-25 — 760…770 °С;
- ПСр-45 — 715…721 °С;
- ПСр-65 — 738…743 °С;
- ПСр-70 — 778…783 °С;
- ПМЦ-36 — 823…828 °С;
- ПМЦ-42 — 830…837 °С;
- ПМЦ-51 — 867…884 °С.
Использование твердых припоев позволяет получать прочные соединения.
Внимание! Ср означает, что в составе припоя использовано серебро. Такие сплавы обладают минимальным электрическим сопротивлением.
Температура плавления неметаллов
Неметаллические материалы могут быть представлены в твердом и жидком виде. Неорганические вещества представлены в табл. 4.
Таблица 4, температура плавления неорганических неметаллов:
На практике для пользователей наибольший интерес представляют органические материалы: полиэтилен, полипропилен, воск, парафин и другие. Температура плавления некоторых веществ показана в табл. 5.
Таблица 5, температура плавления полимерных материалов:
Внимание! Под температурой стеклования понимают состояние, когда материал становится хрупким.
- Видео: температура плавления известных металлов.
Заключение
- Температура плавления зависит от природы самого вещества. Чаще всего – это постоянная величина.
- На практике используют не чистые металлы, а их сплавы. Обычно они имеют свойства гораздо лучше, чем чистый металл.
Republished by Blog Post Promoter
Пайка металлов с неметаллическими материалами
Пайкой можно соединять металлы со стеклом, кварцем, фарфором, керамикой, графитом, полупроводниками и другими неметаллическими материалами. Ввиду различия в физико-химических свойствах металлов и неметаллических материалов природа связи в зоне спая иная, чем в соединениях между металлами.
Если при пайке металлов основным условием образования прочного паяного соединения является удаление с поверхности соединяемых металлов и припоя слоя оксидов, то такие неметаллические материалы, как стекло, кварц, фарфор, керамика, состоят целиком из оксидов, и, следовательно, образование спая происходит между металлом и оксидами элементов.
- При пайке металлов с графитом и полупроводниками спай возникает между еще более различными по природе материалами.
- Ввиду резкого различия коэффициентов термического расширения и других свойств металлов и неметаллических материалов технологические процессы пайки последних разработаны в меньшей степени, чем для металлов.
- Технологические процессы получения спая между металлами (припоями) и неметаллическими материалами можно разделить на три группы:
- 1. Процессы, при которых спай образуется в результате введения расплавленного припоя непосредственно на соединяемую поверхность неметаллического материала.
- 2. Процессы, при которых на неметаллы, предварительно покрытые слоем металлов, наносится припой, и, таким образом, спай образуется в результате пайки по металлопокрытиям.
- 3. Процессы, при которых металлы соединяются с неметаллами в результате введения между ними легкоплавких стекла, глазури или эмали. В этом случае спай со стороны неметалла образуется в результате взаимодействия на границе твердый неметалл — расплав неметалла.
Соединение металлов с неметаллами с применением металлических связок производят серебряными припоями, содержащими значительное количество титана и циркония (25 — 50 %), которые обладают способностью одновременно смачивать поверхность металлов и неметаллических материалов. Примером может служить пайка титана или железоникелекобальтового сплава с высокоглиноземистой керамикой или кварцем.
Основные трудности при пайке кварца с металлами вызываются большим различием коэффициентов теплового расширения соединяемых пар: у неметаллических материалов он в 5 — 7 раз меньше, чем у металлов.
Примером соединения металлов с неметаллами в результате совместного смачивания их расплавленным припоем является также пайка металлов с графитом. Для получения паяного соединения необходимо, чтобы припой одновременно хорошо смачивал оба материала.
Для этого используют такие сильные карбидо- образователи, как титан и цирконий, хорошо смачивающие графит. Поэтому припои, содержащие эти металлы в качестве основных компонентов, оказались вполне пригодными для соединения металлов с графитом.
Недостатком припоев, содержащих титан и цирконий, является весьма низкая коррозионная стойкость в расплавах солей, в которых могут работать паяные соединения металла с графитом.
Перспективным является припой состава: 35 % Аи, 35 % Ni и 30 % Мо, который пригоден для пайки молибдена с графитом и графита с графитом и образует соединения, устойчивые в среде расплавленных солей.
Вторая группа технологических процессов соединения металлов с неметаллами, когда на неметаллический материал перед пайкой наносят пленку металла, характерна для пайки металлов со стеклом и керамикой.
В этом случае перед пайкой на поверхность стекла или керамики путем вжигания (серебра или платины), металлизацией, восстановлением оксидов или другими способами наносят слой металла.
После этого пайка принципиально ничем не отличается от обычно применяемой при соединении металлов.
Так, для соединения металлической детали со стеклянной вжи- гание металла в последнюю производится следующим образом: стеклянную деталь покрывают суспензией порошка металла или соединений металла, например хлорида платины или оксида серебра, и нагревают с целью получения прочно сцепленной со стеклом пленки металла.
После этого ее соединяют с металлической деталью путем обычной пайки оловом или оловянносвинцовым припоем. В качестве флюса применяют водный раствор хлорида цинка. Если спай предназначен для работы при высоких температурах, в качестве припоев применяют серебро, медь или сплавы на их основе.
Металлическое покрытие в этом случае должно быть особо прочно связано со стеклом.
Для получения хороших спаев стекло должно быть чистым, покрытие металлом — плотным, сочленяемый металлический элемент также должен быть тщательно очищен от загрязнений и оксидных пленок. При пайке необходимо избегать перегрева, чтобы металлическая пленка на стекле не растворилась в припое.
Третий случай соединения металлов с неметаллами путем применения переходных слоев из стекла, глазури, эмали также широко распространен. В соединениях металла со стеклом, получаемых с применением легкоплавких промежуточных стекол, опасность образования трещин уменьшается, так как напряжения в спае металл — стекло значительно ниже, чем при пайке без переходного стекла.
Этот способ позволяет предварительно покрывать металл стеклом при строго определенных режимах, а последующее соединение элементов изделия сводится к простому сплавлению стекла со стеклом.
Применение предварительного покрытия металла более легкоплавким стеклом рекомендуется также в тех случаях, когда соединяемый металл не смачивается стеклом, с которым он должен быть соединен.
Правила взаимодействия металлов с неметаллами
Рассмотрим основной ряд металлов М:
Li, Be, Na, Mg, АI, К, Са, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Си, Zn, Ga, Ge, Rb, Sr, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd, In, Sn, Sb, Cs, Ba, La, Hf Та, W, Re, Os, Ir, Pt, Au, Hg, Tl, Pb, Bi.
Он состоит из 49 элементов таблицы Д.И. Менделеева, расположенных в порядке возрастания их атомных весов. Прежде всего определим химическое отношение каждого металла ряда М ко всему ряду неметаллов L.
- Литий
- Многие химические реакции лития протекают менее энергично, чем у других щелочных металлов. С водородом при 500°С литий дает гидрид ЫН, поэтому можем записать
- Ы(Н).
Из боридов щелочных металлов описаны NaB4, КВ4. Они могут быть получены взаимодействием элементов при температуре около 1000°С (под давлением). Для лития подобные данные не найдены, поэтому пока принимаем, что
- Ы(В).
- С азотом и углеродом непосредственно соединяется только литий при 250°С. Карбид лития Ы2С2 может быть получен из элементов лишь при нагревании
- Ы(С).
- Во влажном воздухе литий образует преимущественно Li3N, при небольшом нагревании в токе сухого азота образуется Li?N
- Li(N).
- Литий окисляется кислородом воздуха при нагревании. С сухим кислородом при нагревании литий горит голубым пламенем с образованием Li iO
- Ы(О).
- Литий непосредственно соединяется с галогенами (с йодом при нагревании)
- Li(F, Cl, Br, I).
- Силициды щелочных металлов могут быть получены из элементов при 600-700°С (в замкнутой системе). Для лития известны силициды Li2Si, Li4Si, а для остальных щелочных металлов характерен тип силицида MSi
- Li(Si).
Для фосфидов щелочных металлов характерны формы М2Р (М=Ы, Na, К) и М2Р$ (M=Na, К, Rb, Cs). Известен также фосфид ЫР. Все эти вещества могут быть получены прямым взаимодействием элементов
- Li(P).
- С расплавленной серой литий дает Li2S
- Li(S).
- Для мышьяка данные не найдены, поэтому пока принимаем
- Li(As).
Аналогично сульфидам селениды и теллуриды известны для всех щелочных металлов. При обычных условиях они бесцветны (кроме желтоватого Cs2Te). Поскольку прямых указаний на реакцию лития с селеном и теллуром не найдено, то принимаем, что
Li(Se, Те).
- Она означает, что в доступной области условий литий реагирует со всеми неметаллами, кроме бора, мышьяка, селена и теллура.
- Бериллий
- С водородом до 1300°С бериллий не взаимодействует. Гидрид ВеН2 (AG°/= 115,7 кДж/моль) из простых веществ не образуется
- Ве(Н).
- Основными типами боридов бериллия являются, по-видимому, Ве4В, Ве2В, ВеВ4, ВеВб, а для магния — MgB2, MgB4, MgB6. Данные о непосредственном взаимодействии бериллия с бором не найдены, поэтому принимаем
- Ве(В).
- С углеродом при 1700-2100°С бериллий образует Ве2С
- Ве(С).
- При взаимодействии бериллия с азотом при 500-900°С получается нитрид Be3N2. Следовательно,
- Be(N).
- На воздухе при температуре выше 800°С бериллий сгорает с образованием ВеО
- Ве(О).
С галогенами бериллий легко соединяется и образует ВеГ2. Безводный ВеС12 получают при нагревании металлического бериллия в токе сухого хлора. Методы получения и свойства ВеВг2 аналогичны хлориду
- Be(F, Cl, Br, I).
- С кремнием бериллий сплавляется, но определенных соединений с ним не образует
- Be(Si).
- С фосфором при температуре выше 750°С бериллий образует Ве3Р2
- Ве(Р).
- При нагревании бериллий соединяется с серой
- Be(S).
- Спеканием бериллия с мышьяком, селеном и теллуром получены BeAs2, BeSe, ВеТе
- Be(As, Se, Те).
- Натрий
Химическая активность натрия весьма высока. При 200°С он начинает поглощать водород, образуя гидрид NaH. Реакция идет при пропускании сухого водорода над слегка нагретым натрием
- Na(H).
- Борид натрия (NaB4) может быть получен взаимодействием элементов при 1000°С (под давлением)
- Na(B).
- При 800-900°С с углеродом он образует карбид (ацетиленид) Na2C2. С графитом натрий образует соединения включения
- Na(C).
- С азотом в электрическом разряде натрий дает нитрид Na3N или азид NaN3
- Na(N).
- На воздухе выше 200°С натрий загорается. В зависимости от условий натрий окисляется до оксида Na20 или пероксида Na202
- Na(O).
- При обычной температуре натрий самовоспламеняется в атмосфере фтора и хлора. При небольшом нагревании он энергично взаимодействует с бромом и йодом
- Na(F, Cl, Br, I).
- Силицид натрия может быть получен из элементов при 600-700°С
- Na(Si).
- Для фосфида натрия характерны формы Na2P, Na2P5. Они могут
- быть
- получены прямым взаимодействием элементов
- Na(P).
- Натрий энергично взаимодействует с серой (растирание натрия с порошком серы сопровождается взрывом)
- лад.
- Данные о взаимодействии натрия с мышьяком не найдены, поэтому принимаем
- Na(As).
- С селеном и теллуром натрий образует халькогениды составов Na2X, NaX, NaX2, Na2X3. Поскольку данные о непосредственном взаимодействии натрия с селеном и теллуром не найдены, то пока можем принять
Na(Se. Те).
- Магний
- С водородом магний непосредственно не взаимодействует. А при 570°С и давлении 20 МПа в присутствии Mgl2 магний образует гидрид MgH2
- Mg(H).
- При нагревании магния с бором (900°С) образуются бориды, например MgB2. Основными типами боридов магния являются, по-видимому,
- MgB4, MgB6
- Mg(B).
- С углеродом магний при нагревании образует карбиды, например
- MgC2
- Mg(C).
- На воздухе магний сгорает, образуя MgO, Mg3N2. С азотом при 780- 800°С он образует нитрид Mg3N->
- Mg(N, О).
- С галогенами магний легко взаимодействует уже при обычной температуре, образуя галогениды Mgr?>
- Mg(F, Cl, Br, I).
- С кремнием при 500-1200°C магний образует силицид MgiSi
- Mg(Si).
- Для фосфора и мышьяка данные не найдены
- Mg(P, As).
- При нагревании магния с серой, селеном и теллуром образуются халькогениды MgS, MgSe, MgTe. Поэтому можем записать
- Mg(S, Se, Те).
- В итоге получается формула Алюминий
- При взаимодействии атомарного водорода с парами алюминия при очень низкой температуре -196°С получается гидрид А1Н, А1Н->
- А1(Н).
- При взаимодействии расплавленного алюминия с бором образуются бориды, например А1В-,
- A 1(B).
- При температуре 2000°С алюминий соединяется с углеродом
- А1(С).
- Порошкообразный алюминий выше 800°С с азотом образует нитрид A IN
- Al(N).
- На воздухе алюминий покрывается тонкой прочной беспористой пленкой А1203, защищающей металл от дальнейшего окисления и обусловливающей его высокую коррозионную стойкость
- Al(O).
- При комнатной температуре алюминий реагирует с хлором, бромом и йодом, образуя А1С13, А1Вг3, А113 , при 600°С с фтором, образуя AIF3
- Al(F, Cl, Br, I).
- Для кремния данные не найдены, поэтому пока принимаем
- Al(Si).
- С фосфором при 500°С алюминий образует фосфид А1Р
- А1(Р).
- Выше 200°С алюминий реагирует с серой, давая Al2S3
- Al(S).
- Теплота образования AlAs из элементов (28 ккал/моль) близка к теплоте образования А1Р (29 ккал/моль). Данные об условиях взаимодействия алюминия с мышьяком не найдены, поэтому принимаем
- Al(As).
- С селеном и теллуром алюминий соединяется при нагревании с взрывом
- Al(Se, Те).
- Калий
- Калий химически очень активен. При нагревании до 200-350°С калий реагирует с водородом с образованием гидрида КН
- К(Н).
- Борид калия КВ() можно получить взаимодействием элементов при ~1000°С (под давлением)
- К(В).
- С углеродом при 250-500°С калий образует слоистые соединения состава С8К-Сб0К
- К(С).
С азотом калий не взаимодействует даже под давлением при высоких температурах. Нитрид калия можно получить взаимодействием паров калия с азотом в поле тихого электрического разряда.
С азотом, возбужденным электрическим тлеющим разрядом, могут соединяться все щелочные металлы. В зависимости от условий опыта, при этом возникают нитриды MjN или азиды MN3.
Нитрид калия (а также рубидия и цезия) взрывчаты
- K(N).
- Калий легко взаимодействует с кислородом воздуха, давая оксид К20, пероксид К20? и надпероксид К02
- к(д).
- Калий воспламеняется в атмосфере фтора, слабо взаимодействует с жидким хлором, но взрывается при соприкосновении с бромом и растирании с йодом
- K(F, Cl, Br, I).
- Силициды щелочных металлов могут быть получены из элементов при 600-700°С (в замкнутой системе)
- K(Si).
- При нагревании калия с фосфором в атмосфере азота образуются фосфиды, например К3Р
- К(Р).
- С серой, селеном и теллуром при нагревании калий образует K2S, KiSe, К?Те
- K(S, Se, Те).
- Для мышьяка данные не найдены, поэтому принимается
- K(As).
- Базовая формула для калия имеет вид Кальций
- В токе сухого водорода при 250°С кальций дает гидрид СаН2.
- Реакция сопровождается воспламенением:
- Са(Н).
- Для получаемых синтезом из элементов боридов металлов для кальция характерен состав СаВ^
- Са(В).
- При накаливании кальций соединяется также с углеродом, образуя карбид СаС2:
- Са(С).
- При нагревании в азоте (450°С) кальций загорается и образует нитрид Ca^Ny.
- Ca(N).
При нагревании на воздухе и в кислороде кальций воспламеняется. На воздухе при обычной температуре кальций покрывается пленкой, содержащей окись СаО, перекись СаО?> и нитрид Ca^N2:
- Са(О).
- Кальций интенсивно реагирует с галогенами с образованием СаГу.
- Ca(F, Cl, Br, I).
- При нагревании с кремнием кальций образует силициды, например
- CaSi2:
- Ca(Si).
- Из фосфидов кальция известны Са2Р2, СаР, СаР2, которые могут быть получены из элементов:
- Са(Р).
- С халькогенами при нагревании кальций образует халькогениды
- CaS, CaSe, СаТе:
- Ca(S, Se, Те).
- Для мышьяка данные не найдены, поэтому принимаем, что
- Ca(As).
- Базовая формула для кальция имеет вид Скандий
Скандий химически высоко активен. При более или менее сильном нагревании скандий и его аналоги реагируют с большинством неметаллов. С водородом он реагирует при температуре выше 450°С с образованием гидрида ScHx, х
Спаи между металлами, между металлами и неметаллами, между неметаллами (часть 1)
В зависимости от соотношения физико-химических свойств основного материала и припоя, а также условий и режима пайки переходный слой (спай), образующийся между ними, в процессе взаимодействия может иметь различное строение.
Если рассмотреть начальный момент взаимодействия на поверхности раздела твердой и жидкой фаз при температуре пайки (рис. 2), то часть переходного слоя, примыкающего к внутреннему объему основного материала, равно как и расплава припоя, не затронутых изменениями, имеют состав, близкий к исходным.
В общем случае пайка может завершаться (путем прекращения нагрева) как на более ранней стадии взаимодействия на границе основной материал — расплав припоя, так и на последующей, более глубокой стадии развития процессов взаимодействия в зоне спая. В соответствии с этим будут меняться состав и структура спаев.
- В зависимости от природы веществ в результате взаимодействия твердой и жидкой фаз, можно получать спаи между металлами; между металлами и неметаллами; между неметаллами.
- Процесс взаимодействия основного материала и расплавленного припоя в зависимости от продолжительности может быть зафиксирован на разной стадии формирования соединения.
- Если процесс фиксируется на стадии образования химических связей, когда гетерогенной диффузией в объеме взаимодействующих металлов можно пренебречь, то такой спай называют «бездиффузионным».
- Смачивание основного металла расплавленным припоем создает условия для развития диффузионных и растворно-диффузионных процессов между ними.
Спай, образующийся в условиях протекания растворно-диффузионных процессов в зоне контакта твердого и жидкого металлов, называют растворно-диффузионным. В зависимости от природы основного металла и припоя растворно-диффузионный спай может быть образован металлами с неограниченной растворимостью, с ограниченной растворимостью и дающими эвтектические смеси.
Соединение при пайке может быть получено и без введения припоя. В этом случае используют явление контактного плавления. Спаи, образующиеся при пайке в результате контактного плавления, относят к контактно-реакционным. Этот вид спаев отличается следующим:
- 1) пайка идет без припоя и при температурах ниже точек плавления взаимодействующих, металлов;
- 2) процесс образования спая при температуре пайки начинается при отсутствии жидкой фазы;
- 3) развитие процессов взаимодействия в зоне спая происходит в направлении увеличения количества жидкой фазы в шве.
Среди применяемых в технике металлов имеется значительная группа таких, представители которых между собой не сплавляются и не вступают в химические соединения. Ранее считалось, что образование между ними спаев невозможно. Однако в этих случаях также возможно образование спаев.
Например, железо и свинец в жидком состоянии практически взаимно нерастворимы. Вольфрам не образует сплавов с медью, марганцем, серебром, оловом. При пайке указанные легкоплавкие металлы смачивают соответственно железо и вольфрам, затекают в капиллярные зазоры и обеспечивают формирование соединений.
8. Плавление металлов и строение расплавов
8. Плавление металлов и строение расплавов
Плавление – это физический процесс перехода металла из твердого состояния в жидкое расплавленное. Плавление – процесс, обратный кристаллизации, происходит при температуре выше равновесной, т. е. при перегреве.
Поскольку жидкий металл обладает большей внутренней энергией, чем твердый, при кристаллизации выделяется теплота. Между теплотой Q и температурой кристаллизации Тк существует определенная связь.
Степень перегрева при плавлении металлов не превышает нескольких градусов.
В жидком состоянии атомы вещества из-за теплового движения перемещаются беспорядочно, в жидкости имеются группировки атомов небольшого объема, в их пределах расположение атомов аналогично расположению в решетке кристалла. Эти группировки неустойчивы, они рассасываются и снова появляются в жидкости.
При переохлаждении жидкости некоторые крупные группировки становятся устойчивыми и способными к росту. Эти устойчивые группировки атомов называют центрами кристаллизации (зародышами). Для осуществления процесса плавления необходимо наличие некоторого перегрева над равновесной температурой, т. е. термодинамического потенциала.
Выше равновесной температуры более устойчив жидкий металл, он имеет меньший запас свободной энергии. Ниже этой температуры более устойчив твердый металл.
При равновесной температуре свободные энергии жидкого и твердого состояния одинаковы, поэтому при этой температуре обе фазы (жидкая и твердая) могут сосуществовать одновременно и притом бесконечно долго. Равновесная температура очень близка к температуре плавления Тпл, с которой ее часто сравнивают.
При охлаждении переход из жидкого состояния в твердое сопровождается образованием кристаллической решетки, т. е. кристаллизацией. Чтобы вызвать кристаллизацию, жидкий металл нужно переохладить до температуры ниже температуры плавления.
Жидкости, находящиеся при температуре, близкой к температуре плавления называются расплавами. Расплавы бывают металлическими, ионными, полупроводниковыми, органическими и высокополимерными. В зависимости от того, какие химические соединения образуют расплавы, выделяют солевые, оксидные, оксидно-силикатные и другие расплавы.
Большинство расплавов имеют в составе искосаэдрические частицы.
В процессе плавления химические связи в расплавах подвергаются видоизменению. В полупроводниках наблюдается образование металлической проводимости, у некоторых галогенидов вместо ионной проводимости происходит снижение электрической проводимости из-за образования расплава с молекулярным составом. Уровень температуры также влияет на тип связи в расплавах.
Среднее координационное число и межатомные расстояния также являются характеристиками расплавов. В процессе плавления металлов происходит уменьшение координационного числа примерно на 10–15 %. В тоже время межатомные расстояния остаются прежними.
При плавлении полупроводников происходит увеличение их координационного числа в 1,5 раза, расстояние между атомами также увеличивается.
Многокомпонентные расплавы характеризуются неравновесными, метастабильными состояниями, которые имеют взаимосвязь со структурой первоначальных твердых фаз.
Во многих случаях встречается отставание (гистерезис) свойств расплавов в процессе изменения температуры. На свойства и строения расплавов оказывают влияние следующие факторы: температура, время выдержки, скорость колебания температуры, тот материал, из которого создан контейнер, а также наличие примесей.
Состав расплавов отличается своей сложностью. В ионных расплавах могут содержаться простые или комплексные ионы, недиссоциированные и полимерные молекулы, а также свободные объемы. Силикатные расплавы могут содержать изолированные кремнекислородные тетраэдры и образуемые ими цепи, кольца, сетки и каркасы.
Однозначная модель структуры расплавов формируется достаточно сложно, т. к. расплавы содержат разные виды частиц и связи. Основная функция моделей: определение и интерпретация свойств расплавов, а также расчет свойств.
Расплавы в металлургической области подразделяются на промежуточные, побочные и конечные продукты. Используя расплавы в качестве электролитов, в металлургии производят и рафинируют металлы, а также осуществляют нанесение покрытий.
Многие сплавы образуются в виде расплавов. Монокристаллы и эпитаксиальные пленки выращиваются из расплавов. В качестве катализаторов принято использовать металлические, солевые и оксидные расплавы.
Солевые расплавы применяют в отжиговых и закалочных ваннах, высокотемпературных топливных элементах, в качестве теплоносителей, флюсов в процессе пайки и сварки металлов, реакционных сред в неорганическом и органическом синтезе, а также как поглотители, экстрагенты и т. д.
Некоторые расплавы используются для получения силикатных, фторидных и иных специальных стеков и аморфных металлов.
Данный текст является ознакомительным фрагментом.
Строение древесины
Сделав только поперечный срез, можно четко рассмотреть строение древесины. Каждый брусок необтесанного дерева имеет кору – это кожа дерева, которая не используется в работе, ее обязательно снимают. Под корой располагается зона роста дерева, которая
Строение древесины
Строение древесины
Сделав только поперечный срез, можно четко рассмотреть строение древесины. Каждый брусок необтесанного дерева имеет кору – это кожа дерева, которая не используется в работе, ее обязательно снимают. Под корой располагается зона роста дерева, которая
ЛЕКЦИЯ № 1. Строение древесины
ЛЕКЦИЯ № 1. Строение древесины 1. Виды древесных пород и части дерева
Растущие деревья имеют следующие составные части: корни, ствол, ветви, листья. Корневая система деревьев выполняет функции поставщика влаги и питательных веществ из почвы по стволу и ветвям к листьям.
2. Макроскопическое строение древесины
2. Макроскопическое строение древесины
При поперечном разрезе ствола дерева можно установить главные макроскопические признаки: заболонь, ядро, годичные слои, сердцевинные лучи, сосуды, смоляные ходы и сердцевинные повторения.У молодых деревьев всех пород древесина
1. Строение металлов
1. Строение металлов
Металлы и их сплавы – основной материал в машиностроении. Они обладают многими ценными свойствами, обусловленными в основном их внутренним строением. Мягкий и пластичный металл или сплав можно сделать твердым, хрупким, и наоборот. Для того чтобы
Свойства расплавов стекол
Свойства расплавов стекол
К свойствам расплавов стекломассы относятся вязкость, связанная с ней скорость твердения, поверхностное натяжение и кристаллизация, а также теплоемкость, теплопроводность, электрическая проводимость. Значение этих свойств при производстве
§ 3.3 Строение атомов и периодический закон Менделеева
§ 3.3 Строение атомов и периодический закон Менделеева Свойства простых тел, а также формы и свойства соединений элементов, находятся в периодической зависимости (или, выражаясь алгебраически, образуют периодическую функцию) от их атомных весов.
Д.И. Менделеев
Считается,
§ 3.6 Строение ядер
§ 3.6 Строение ядер Чем больше в ядре должно поместиться нуклонов, тем больше должна быть площадь поверхности ядра, где происходят присоединения то протонов, то нейтронов… Этим особенностям лучше всего отвечает форма ядра в виде двух пирамид Хеопса, соединённых
§ 4.14 Строение вещества и химическая связь
§ 4.14 Строение вещества и химическая связь Что, наконец, представляется нам затверделым и плотным,
То состоять из начал крючковатых должно несомненно,
Сцепленных между собой наподобие веток сплетённых.
В этом разряде вещей, занимая в нём первое место,
Будут алмазы
Глава 32 Строение Пространства – Времени
Глава 32 Строение Пространства – Времени «Действие есть кривизна Мира» Павел Дмитриевич Успенский, 1911 год Мы уже предполагали аналогии квантового строения микромира и макромира, при определенных условиях. Далее, будет показаны законы резонансного строения нашего
2. Зеренное строение металлов. Границы зерен и субзерен
2. Зеренное строение металлов. Границы зерен и субзерен
Металлы – это поликристаллические тела, они состоят из мелких кристаллов. Характеризуются металлическими свойствами и составляют 50 % всех химических элементов. Строение металлов и их сплавов кристаллическое.В
10. Строение слитка и аморфные сплавы
10. Строение слитка и аморфные сплавы
Строение стального слитка впервые дано в 1878 г. Д.К. Черновым. Структура литого слитка состоит из трех основных зон. Первая зона – наружная мелкозернистая корка, которая состоит из дезориентированных мелких кристаллов –






