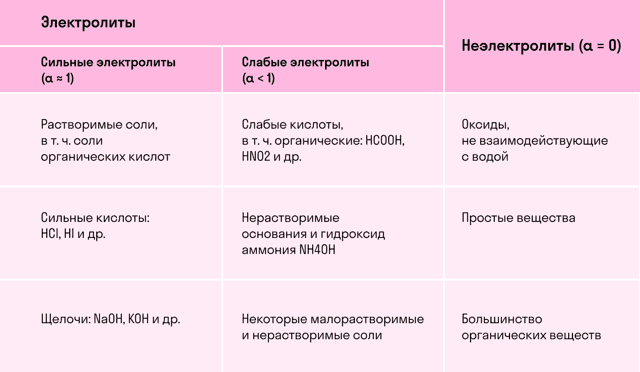
- Различают сильные и слабые электролиты
- Основные положения теории электролитической диссоциации
- Степень диссоциации
- Механизм диссоциации
- Константа диссоциации
- Правильной будет следующая форма записи:
- Электролитическая диссоциация
- Ступени диссоциации
- Электролиты и неэлектролиты
- Молекулярное, полное и сокращенное ионные уравнения
- Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних) – HIMI4KA
- Тренировочные задания
- Ответы
- Теория электролитической диссоциации (ТЭД) — что это такое? Основные положения и примеры
- Механизм электролитической диссоциации
- Электролиты и неэлектролиты
- Степень диссоциации
- Ступенчатая диссоциация
- Пример 1
- Пример 2
- Как диссоциируют разные группы веществ
- Диссоциация кислот
- Диссоциация оснований
- Диссоциация солей
- Молекулярное, полное и сокращенное ионные уравнения
- Как составить уравнение диссоциации
- Основные положения теории электролитической диссоциации
- Вопросы для самопроверки
- Электролитическая диссоциация
- Теория электролитической диссоциации
- Диссоциация кислот, оснований, солей
- Степень диссоциации
- Амфотерные электролиты
- Ионные уравнения реакций
- Водородный показатель pH
- Примеры решения задач
- 1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
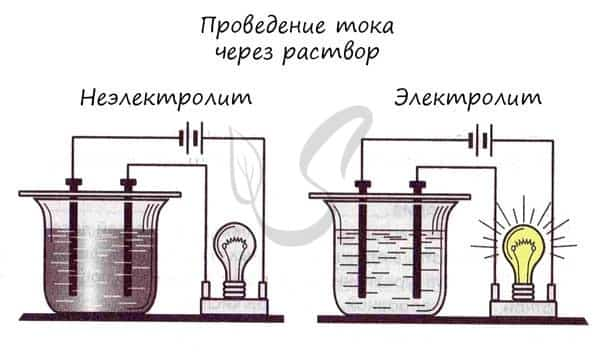
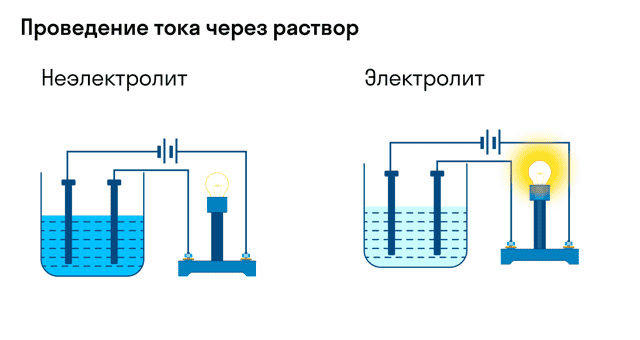
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят.
Проводимость веществами электрического тока или отсутствие проводимости можно наблюдать с помощью простого прибора.
Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара ,то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
- Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
- Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
- К электролитам относятся кислоты, основания и почти все соли.
- К неэлектролитам относятся большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи .
Электролиты — проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Различают сильные и слабые электролиты
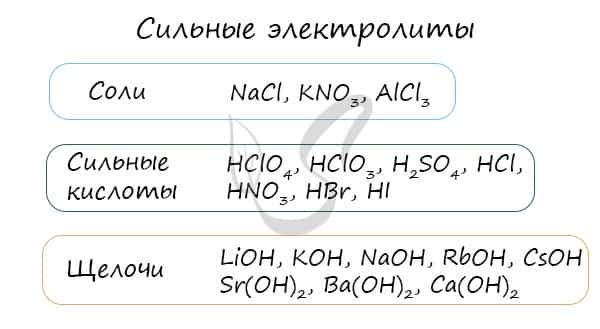
- Сильные электролиты при растворении вводе полностью диссоциируют на ионы.
- К ним относятся:
- 1) почти все соли;
- 2) многие минеральные кислоты, например Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4;
- 3) основания щелочных и щелочноземельных металлов.
- Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
- К ним относятся:
- 1) почти все органические кислоты;
- 2) некоторые минеральные кислоты, например H2СО3, Н2S, НNO2, HClO, H2SiO3;
- 3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH, который можно изображать как гидрат аммиака NH 3∙H 2O.
- К слабым электролитам относится вода.
- Слабые электролиты не могут дать большой концентрации ионов в растворе.
Основные положения теории электролитической диссоциации
- Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией.
- Так, хлорид натрия NaСl при растворении в воде полностью распадается на ионы натрия Na+ и хлорид-ионы Cl -.
- Вода образует ионы водорода Н+ и гидроксид-ионы ОН- лишь в очень незначительных количествах.
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации .
В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современное содержание этой теории можно свести к следующим трем положениям :
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома — это простые ионы ( Na +, Mg2+, Аl3+ и т.д.) — или из нескольких атомов — это сложные ионы (NО3-, SO2-4 , РОЗ-4 и т.д.).
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами , вторые — анионами .
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы ( диссоциация ) протекает процесс соединения ионов (ассоциация).
- Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К+ и анион А- в общем виде записывается так:
- КА ↔ K + + A —
- Теория электролитической диссоциации является одной из основных теорий в неорганической химии и полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Степень диссоциации
Одним из важнейших понятий теории электролитической диссоциации Аррениуса является понятие о степени диссоциации.
Степенью диссоциации (а) называется отношение числа молекул, распавшихся на ионы (n'), к общему числу растворенных молекул (n):
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые.
Рассмотрим смещение равновесия, устанавливающегося между недиссоциированными молекулами и ионами при электролитической диссоциации слабого электролита — уксусной кислоты:
СН3СООН ↔ СН3СОO-+ Н+
При разбавлении раствора уксусной кислоты водой равновесие сместится в сторону образования ионов, — степень диссоциации кислоты возрастает. Наоборот, при упаривании раствора равновесие смещается в сторону образования молекул кислоты — степень диссоциации уменьшается.
Из этого выражения очевидно, что α может изменяться от 0 (диссоциации нет) до 1 (полная диссоциация). Степень диссоциации часто выражают в процентах. Степень диссоциации электролита может быть определена только экспериментальным путем, например по измерению температуры замерзания раствора, по электропроводности раствора и т. д.
Механизм диссоциации
Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов.
Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, т.е.
ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы).
Вокруг каждой полярной молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами — к отрицательному полюсу.
В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гидратированные ионы:

Диссоциация полярных молекул может быть полной или частичной.
Таким образом , электролитами являются соединения с ионной или полярной связью — соли , кислоты и основания . И диссоциировать на ионы они могут в полярных растворителях.
Константа диссоциации
Константа диссоциации. Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
- Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
- A K → A- + K+.
- Поскольку диссоциация является обратимым равновесным процессом, то к этой реакции применим закон действующих масс, и можно определить константу равновесия как:
где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
Диапазон констант равновесия для разных реакций очень большой — от 10-16 до 1015. Например, высокое значение К для реакции
означает, что если в раствор, содержащий ионы серебра Ag+,внести металлическую медь, то в момент достижения равновесия концентрация ионов меди [Cu2+] намного больше, чем квадрат концентрации ионов серебра [Ag+]2. Напротив, низкое значение Кв реакции
говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI.
Обратите особое внимание на форму записи выражений для константы равновесия. Если концентрации некоторых реагентов существенно не изменяются в процессе реакции, то они не записываются в выражение для константы равновесия (такие константы обозначаются К1).
Так, для реакции меди с серебром неправильным будет выражение:
Правильной будет следующая форма записи:
Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.
Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI
Произведение растворимости. Константы диссоциации малорастворимых солей и гидроксидов металлов называются произведением растворимости соответствующих веществ (обозначается ПР).
Для реакции диссоциации воды
выражение константы будет:
Объясняется это тем, что концентрация воды во время реакций в водных растворах изменяется очень незначительно. Поэтому принимается, что концентрация [Н2О] остается постоянной и вводится в константу равновесия.
- Кислоты, основания и соли с позиций электролитической диссоциации.
- С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
- Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
- Например:
- НCl ↔ Н++ С l — ;
- СН3СООН ↔ Н+ + СН3СОО-
- Диссоциация многоосновной кислоты протекает главным образом по первой ступени , в меньшей степени по второй и лишь в незначительной степени — по третьей . Поэтому в водном растворе , например , фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4, НРО2-4 и РО3-4
- Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень)
- Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень)
- НРО2-4 ↔ Н+ PОЗ-4 (третья ступень)
- Основностъ кислоты определяется числом катионов водорода, которые образуются при диссоциации.
- Так , НCl, HNO3 — одноосновные кислоты — образуется один катион водорода;
- Н2S, Н2СО3, Н2SO4 — двухосновные,
- Н3 РО4, Н3 АsО4 — трехосновные , так как образуются соответственно два и три катиона водорода.
- Из четырех атомов водорода, содержащихся в молекуле уксусной кислоты СН3СООН , только один , входящий в карбоксильную группу — СООН, способен отщепляться в виде катиона Н+, — уксусная кислота одноосновная.
- Двух — и многоосновные кислоты диссоциируют ступенчато (постепенно).
- Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
- Например:
- KOH ↔ K+ + OH-;
- NH4OH ↔ NH+4 + OH-
Основания,растворимые в воде называются щелочами . Их немного . Это основания щелочных и щелочноземельных металлов : LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН . Большинство оснований в воде малорастворимо.
Кислотность основания определяется числом его гидроксильных групп ( гидроксогрупп ). Например, NН4ОН — однокислотное основание , Са(ОН)2- двухкислотное , Fе(ОН)3 — трехкислотное и т . д . Двух- и многокислотные основания диссоциируют ступенчато
Ca(ОН)2 ↔ Са(ОН)+ + OH- (первая ступень)
Ca(OH)+ ↔ Ca2++ OH- (вторая ступень)
Однако имеются электролиты , которые при диссоциации одновременно образуют катионы водорода, и гидроксид — ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н+ и ОН- (в незначительных количествах):
- Н2O ↔ Н+ + ОН-
- Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода Н+, и щелочные свойства, обусловленные наличием ионов ОН-.
- Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением
- 2ОН- + Zn2+ + 2Н 2О ↔ Zn(ОН)2 + 2Н2О ↔ [Zn(ОН)4]2-+ 2Н+
- Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH4) и анионы кислотных остатков
- Например:
- (NH4)2SO4 ↔ 2NH+4 + SO2-4;
- Na3PO4 ↔ 3Na+ + PO3-4
Так диссоциируют средние соли . Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
- KHSO4 ↔ K++ HSO-4
- И далее:
- HSO -4 ↔ H+ + SO 2-4
- У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы .
- Mg(OH)Cl ↔ Mg(OH)++ Cl-
- И далее:
- Mg(OH)+ ↔ Mg2++ OH-
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
- В общем виде процесс электролитической диссоциации можно представить так:
- KA ⇄ K+ (катион) + A- (анион)
- NaCl ⇄ Na+ + Cl-

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
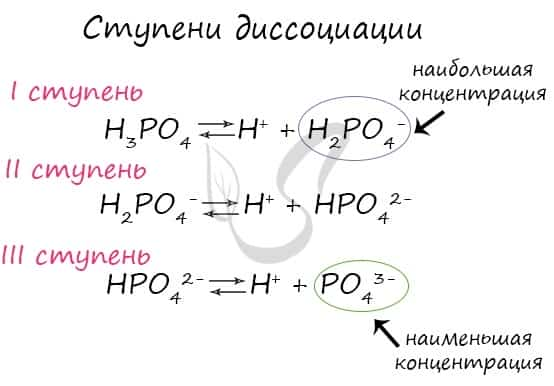
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
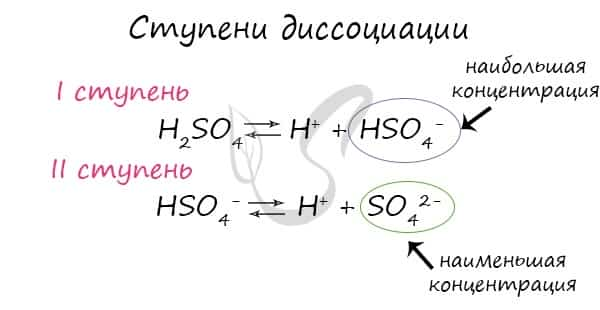
- Для средних солей диссоциация чаще всего происходит в одну ступень:
- Na3PO4 ⇄ 3Na+ + PO43-
- Из одной молекулы ортофосфата натрия образовалось 4 иона.
- K2SO4 ⇄ 2K+ + SO42-
- Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
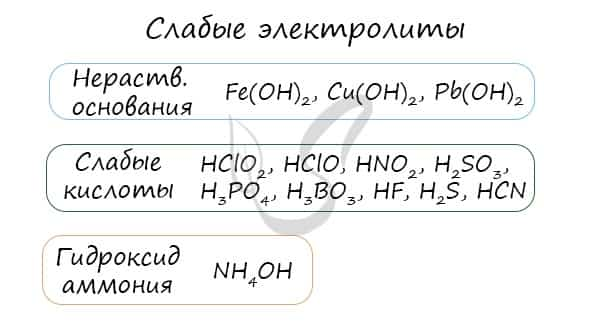
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
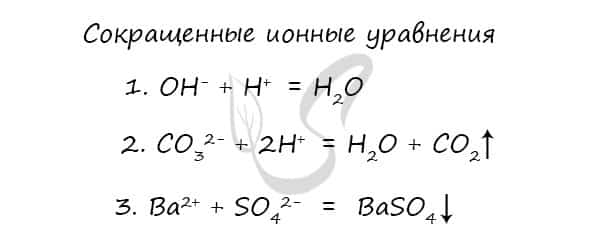
Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних) – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В процессе развития химии понятия «кислота» и «основание» претерпели серьёзные изменения.
С точки зрения теории электролитической диссоциации кислотами называют электролиты, при диссоциации которых образуются ионы водорода H+, а основаниями — электролиты, при диссоциации которых образуются гидроксид-ионы OH–. Эти определения в химической литературе известны как определения кислот и оснований по Аррениусу.
В общем виде диссоциацию кислот представляют так:
где A– — кислотный остаток.
Такие свойства кислот, как взаимодействие с металлами, основаниями, основными и амфотерными оксидами, способность изменять окраску индикаторов, кислый вкус и т. д.
, обусловлены наличием в растворах кислот ионов H+. Число катионов водорода, которые образуются при диссоциации кислоты, называют её основностью.
Так, например, HCl является одноосновной кислотой, H2SO4 — двухосновной, а H3PO4 — трёхосновной.
Многоосновные кислоты диссоциируют ступенчато, например:
От образовавшегося на первой ступени кислотного остатка H2PO4– последующий отрыв иона H+ происходит гораздо труднее из-за наличия отрицательного заряда на анионе, поэтому вторая ступень диссоциации протекает гораздо труднее, чем первая. На третьей ступени протон должен отщепляться от аниона HPO42–, поэтому третья ступень протекает лишь на 0,001%.
В общем виде диссоциацию основания можно представить так:
где M+ — некий катион.
Такие свойства оснований, как взаимодействие с кислотами, кислотными оксидами, амфотерными гидроксидами и способность изменять окраску индикаторов, обусловлены наличием в растворах OH–-ионов.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса.
Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера.
Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4+) и анионы кислотных остатков.
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
- 1. К электролитам средней силы относится
- 1) H3PO4 2) H2SO4 3) Na2SO4 4) Na3PO4
- 2. К сильным электролитам относится
- 1) KNO3 2) BaSO4 4) H3PO4 3) H2S
- 3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
- 1) BaSO4 2) PbSO4 3) SrSO4 4) K2SO4
- 4. При разбавлении раствора электролита степень диссоциации
- 1) остается неизменной 2) понижается 3) повышается
- 4) с начала повышается, потом понижается
- 5. Степень диссоциации при нагревании раствора слабого электролита
- 1) остается неизменной 2) понижается 3) повышается
- 4) с начала повышается, потом понижается
- 6. Только сильные электролиты перечислены в ряду:
- 1) H3PO4, K2SO4, KOH 2) NaOH, HNO3, Ba(NO3)2 3) K3PO4, HNO2, Ca(OH)2 4) Na2SiO3, BaSO4, KCl
- 7. Водные растворы глюкозы и сульфата калия соответственно являются:
- 1) с ильным и слабым электролитом 2) неэлектролитом и сильным электролитом 3) слабым и сильным электролитом
- 4) слабым электролитом и неэлектролитом
- 8. Степень диссоциации электролитов средней силы
- 1) больше 0,6 2) больше 0,3 3) лежит в пределах 0,03—0,3
- 4) менее 0,03
- 9. Степень диссоциации сильных электролитов
- 1) больше 0,6 2) больше 0,3 3) лежит в пределах 0,03—0,3
- 4) менее 0,03
- 10. Степень диссоциации слабых электролитов
- 1) больше 0,6 2) больше 0,3 3) лежит в пределах 0,03—0,3
- 4) менее 0,03
- 11. Электролитами являются оба вещества:
- 1) фосфорная кислота и глюкоза 2) хлорид натрия и сульфат натрия 3) фруктоза и хлорид калия
- 4) ацетон и сульфат натрия
- 12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
- 1) H3PO4 2) H2PO4– 3) HPO42– 4) PO43–
- 13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
- 1) HNO2, HNO3, H2SO3 2) H3PO4, H2SO4, HNO2 3) HCl, HBr, H2O 4) CH3COOH, H3PO4, Na2SO4
- 14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
- 1) HNO2, H3PO4, H2SO3 2) HNO3, H2SO4, HCl 3) HCl, H3PO4, H2O 4) CH3COOH, H3PO4, Na2SO4
- 15. Практически необратимо диссоциирует в водном растворе
- 1) уксусная кислота 2) бромоводородная кислота 3) фосфорная кислота
- 4) гидроксид кальция
- 16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
- 1) уксусная кислота 2) сернистая кислота 3) фосфорная кислота
- 4) гидроксид натрия
- 17. Ступенчатая диссоциация характерна для
- 1) фосфорной кислоты 2) соляной кислоты 3) гидроксида натрия
- 4) нитрата натрия
- 18. Только слабые электролиты представлены в ряду
- 1) сульфат натрия и азотная кислота 2) уксусная кислота, сероводородная кислота 3) сульфат натрия, глюкоза
- 4) хлорид натрия, ацетон
- 19. Каждое из двух веществ является сильным электролитом
- 1) нитрат кальция, фосфат натрия 2) азотная кислота, азотистая кислота 3) гидроксид бария, сернистая кислота
- 4) уксусная кислота, фосфат калия
- 20. Оба вещества являются электролитами средней силы
- 1) гидроксид натрия, хлорид калия 2) фосфорная кислота, азотистая кислота 3) хлорид натрия, уксусная кислота
- 4) глюкоза, ацетат калия
Ответы
Теория электролитической диссоциации (ТЭД) — что это такое? Основные положения и примеры
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).
Схема электролитической диссоциации: KA ⇄ K+ (катион) + A- (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na+ + Cl-.
Иногда можно встретить выражение «теория электрической диссоциации», но так говорить не стоит. В этом случае можно подумать, что распад молекул на ионы обусловлен действием электротока. На самом деле процесс диссоциации не зависит от того, проходит ток в данный момент через раствор или нет. Все, что нужно — это контакт электролита с водой (растворителем).
Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na+ и анионами хлора Cl-, которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным.
Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором.
Вещество диссоциирует на ионы.
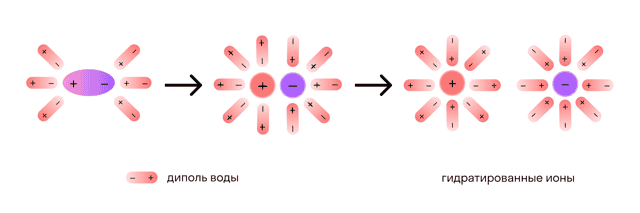
После распада хлорида натрия образовавшиеся ионы Na+ и Cl- окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
Электролиты и неэлектролиты
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
- Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
- или .
- Если в растворе на ионы распадаются все 100% электролита, .
- По силе электролиты делятся на следующие группы:
- слабые — ;
- средние — ;
- сильные — .
 Молекулы сильных электролитов необратимо распадаются на ионы, поэтому в уравнениях нужно ставить знак =. Реакции со слабыми электролитами обратимы, поэтому ставится знак ⇄.
Молекулы сильных электролитов необратимо распадаются на ионы, поэтому в уравнениях нужно ставить знак =. Реакции со слабыми электролитами обратимы, поэтому ставится знак ⇄.
Ступенчатая диссоциация
В отдельных случаях вещества расщепляются на ионы в несколько этапов или ступеней. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот. Ступенчатая диссоциация может включать два этапа и более, при этом на первой ступени концентрация ионов всегда больше, чем на последующих.
Пример 1
Ортофосфорная кислота диссоциирует в 3 ступени. На первой из них наблюдается максимальная концентрация дигидрофосфат-ионов, а на последней остается минимальное количество фосфат-ионов (диссоциация почти не идет). Данная кислота не относится к сильным электролитам, поэтому реакция обратима.
-
H3PO4 ⇄ H+ + H2PO4-
-
H2PO4- ⇄ H+ + HPO42-
-
HPO42- ⇄ H+ + PO43-
Суммарное уравнение: H3PO4 ⇄ 3H+ + PO43-.
Пример 2
Кислая соль Ca(HCO3)2 диссоциирует в 3 ступени. Поскольку это сильный электролит, на первом этапе реакция необратима. На втором этапе распадается на ионы слабый кислотный остаток HCO3- и слабый электролит, поэтому реакция обратима.
-
Ca(HCO3)2 = Ca2+ + 2HCO3-
-
HCO3- ⇄ H+ + CO32-
-
H+ + H2O = H3O+
Суммарное уравнение: Ca(HCO3)2 + 2H2O = Ca2+ + 2H3O+ + 2CO32-.
Как диссоциируют разные группы веществ
Диссоциация кислот
- Приводит к образованию катионов водорода H+ и отрицательно заряженных кислотных остатков:
- HCl = H+ + Cl-
- H2SO4 = 2H+ + SO42-
- HNO2 ⇄ H+ + NO2-
- Многоосновные кислоты диссоциируют ступенчато:
-
AlOHCl2 = AlOH2+ + 2Cl-
-
AlOH2+ ⇄ Al3+ + OH-
Диссоциация оснований
Происходит с образованием гидроксильных групп OH- и положительно заряженных ионов металла. Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
- Сильные основания:
- NaOH = Na+ + OH-
- Слабые основания:
-
Cu(ON)2 ⇄ CuOH+ + OH-
-
CuOH+ ⇄ Cu2+ + OH-
Диссоциация солей
- Ведет к образованию катионов металлов (или катиона аммония) и отрицательно заряженных кислотных остатков.
- Средние соли в растворах полностью распадаются в одну ступень.
- Na3PO4 = 3Na + PO43-
Кислые соли распадаются ступенчато. На первом этапе отделяются катионы металла, а на втором — катионы водорода.
-
KHSO4 = K+ + HSO4-
-
HSO4- ⇄ H+ + SO42-
Основные соли также диссоциируют в две ступени. На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH-.
-
MgOHBr = MgOH+ + Br-
-
MgOH+ ⇄ Mg2+ + OH-
Молекулярное, полное и сокращенное ионные уравнения
С помощью молекулярных уравнений можно показать состав вещества с разложением его на молекулы. Полные ионные уравнения отражают реакцию диссоциации, т. е. расщепление молекул на ионы. Но в таком виде расписывают только сильные электролиты.
Не раскладывают на ионы:
- слабые электролиты;
- осадки;
- газы.
- Рассмотрим это на примере взаимодействия между нитратом свинца и серной кислотой.
- Молекулярное уравнение: Pb(NO3)2 + H2SO4 → 2HNO3 + PbSO4↓
- Сульфат свинца PbSO4 мы не будем раскладывать на ионы, поскольку это слабый электролит.
- Полное ионное уравнение: Pb2+ + 2NO3- + 2H+ + SO42- → 2H+ + 2NO3- + PbSO4↓
- Сократить это выражение очень просто — нужно убрать из обеих частей одинаковые ионы, которые не изменились в ходе реакции.
- Сокращенное ионное уравнение: Pb2+ + SO42- → PbSO4↓
Как составить уравнение диссоциации
В левой части пишем молекулярную формулу вещества, а в правой — формулы образовавшихся катионов и анионов. Между ними ставим знак =, если это сильный электролит, или знак ⇄ — если средний или слабый. После этого нужно проставить коэффициенты перед ионами и проверить сумму катионов и анионов (она всегда равна 0).

Основные положения теории электролитической диссоциации
Итак, мы разобрались, что такое диссоциация в химии, а сейчас повторим ключевые моменты:
- При взаимодействии с водой или другими растворителями в электролитах разрывается химическая связь между частицами и они распадаются на ионы — происходит электролитическая диссоциация.
- Под действием электротока катионы перемещаются к положительно заряженному электроду, анионы — к отрицательно заряженному. Раствор электролита обладает проводимостью.
- Степень диссоциации зависит от типа электролита и от внешних условий. Для сильных электролитов она необратима, для слабых — это обратимая реакция.
- Химические свойства электролитов соответствуют свойствам ионов, которые образовались при диссоциации.
Вопросы для самопроверки
-
Чем электролиты отличаются от неэлектролитов? Приведите примеры тех и других веществ.
-
Согласно теории диссоциации что является причиной распада электролитов на ионы?
-
Что такое степень диссоциации и как она измеряется?
-
В каких случаях электролитическая диссоциация кислот бывает ступенчатой?
-
При каких условиях в уравнении диссоциации ставится знак =, а при каких — знак ⇄?
-
Какие компоненты ионного уравнения не раскладываются на ионы?
Электролитическая диссоциация
Водные растворы некоторых веществ являются проводниками электрического тока. Эти вещества относятся к электролитам. Электролитами являются кислоты, основания и соли, расплавы некоторых веществ.
Растворы некоторых веществ в воде не проводят электрический ток. Такие вещества называют неэлектролитами. К ним относятся многие органические соединения, например сахар и спирты.
Теория электролитической диссоциации
Теория электролитической диссоциации была сформулирована шведским ученым С. Аррениусом (1887 г.). Основные положения теории С. Аррениуса:
- — электролиты при растворении в воде распадаются (диссоциируют) на положительно и отрицательно заряженные ионы;
- — под действием электрического тока положительно заряженные ионы движутся к катоду (катионы), а отрицательно заряженные – к аноду (анионы);
- — диссоциация – обратимый процесс
- КА ↔ К+ + А−
Механизм электролитической диссоциации заключается в ион-дипольном взаимодействии между ионами и диполями воды (рис. 1).
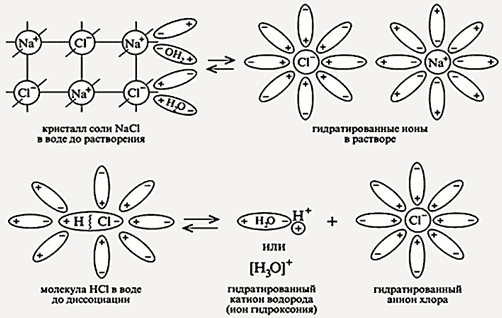
Рис. 1. Электролитическая диссоциация раствора хлорида натрия
Легче всего диссоциируют вещества с ионной связью. Аналогично диссоциация протекает у молекул, образованных по типу полярной ковалентной связи (характер взаимодействия – диполь-дипольный).
Диссоциация кислот, оснований, солей
При диссоциации кислот всегда образуются ионы водорода (H+), а точнее – гидроксония (H3O+), которые отвечают за свойства кислот (кислый вкус, действие индикаторов, взаимодействие с основаниями и т.д.).
HNO3 ↔ H+ + NO3−
При диссоциации оснований всегда образуются гидроксид-ионы водорода (OH−), ответственные за свойства оснований (изменение окраски индикаторов, взаимодействие с кислотами и т.д.).
- NaOH ↔ Na+ + OH−
- Соли – это электролиты, при диссоциации которых образуются катионы металлов (или катион аммония NH4+) и анионы кислотных остатков.
- CaCl2 ↔ Ca2+ + 2Cl−
- Многоосновные кислоты и основания диссоциируют ступенчато.
- H2SO4 ↔ H+ + HSO4− (I ступень)
- HSO4− ↔ H+ + SO42- (II ступень)
- Ca(OH)2 ↔ [CaOH]+ + OH− (I ступень)
- [CaOH]+ ↔ Ca2+ + OH−
Степень диссоциации
Среди электролитов различают слабые и сильные растворы. Чтобы охарактеризовать эту меру существует понятие и величина степени диссоциации (). Степень диссоциации – отношение числа молекул, продиссоциировавших на ионы к общему числу молекул. часто выражают в %.
= N’ / N
К слабым электролитам относятся вещества, у которых в децимолярном растворе (0,1 моль/л) степень диссоциации меньше 3%.
К сильным электролитам относятся вещества, у которых в децимолярном растворе (0,1 моль/л) степень диссоциации больше 3%.
Растворы сильных электролитов не содержат непродиссоциировавших молекул, а процесс ассоциации (объединения) приводит к образованию гидратированных ионов и ионных пар.
На степень диссоциации оказывают особое влияние природа растворителя, природа растворенного вещества, температура (у сильных электролитов с повышением температуры степень диссоциации снижается, а у слабых – проходит через максимум в области температур 60oС), концентрация растворов, введение в раствор одноименных ионов.
Амфотерные электролиты
Существуют электролиты, которые при диссоциации образуют и H+, и OH− ионы. Такие электролиты называют амфотерными, например: Be(OH)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и т.д.
H++RO− ↔ ROH ↔ R+ + OH−
Ионные уравнения реакций
- Реакции в водных растворах электролитов – это реакции между ионами – ионные реакции, которые записывают с помощью ионных уравнений в молекулярной, полной ионной и сокращенной ионной формах. Например:
- BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl (молекулярная форма)
- Ba2+ + 2Cl− + 2Na+ + SO42- = BaSO4 ↓ + 2Na+ + 2Cl− (полная ионная форма)
- Ba2+ + SO42- = BaSO4 ↓ (сокращенная ионная форма)
Водородный показатель pH
- Вода – слабый электролит, поэтому процесс диссоциации протекает в незначительной степени.
- H2O ↔ H+ + OH−
- К любому равновесию можно применить закон действующих масс и записать выражение для константы равновесия:
- K = [H+][OH−]/[H2O]
- Равновесная концентрация воды – величина постоянная, слеовательно.
- K[H2O] = [H+][OH−] = KW
- Кислотность (основность) водного раствора удобно выражать через десятичный логарифм молярной концентрации ионов водорода, взятый с обратным знаком.
Эта величина называется водородным показателем (рН):
- рН = — lg[H+]
- Если раствор нейтральный, то [H+]=[OH−] =10-7, рН =7.
- Если среда кислая [H+] > 10-7, рН < 7.
- Если среда щелочная [H+] < 10-7, рН > 7
Примеры решения задач
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
Как известно из курса физики, электрическим током называют упорядоченное движение заряженных частиц. В случае металлов, электропроводность обеспечивается подвижными электронами в кристалле, слабо связанными c ядрами атомов, что позволяет им направленно двигаться под действием разности потенциалов.
Кроме металлов, существуют также вещества растворы или расплавы которых проводят электрический ток. Такие вещества называют электролитами.
Электролиты — вещества, расплавы или водные растворы которых проводят электрический ток.
Но за счет чего обеспечивается электрическая проводимость расплавов и растворов электролитов?
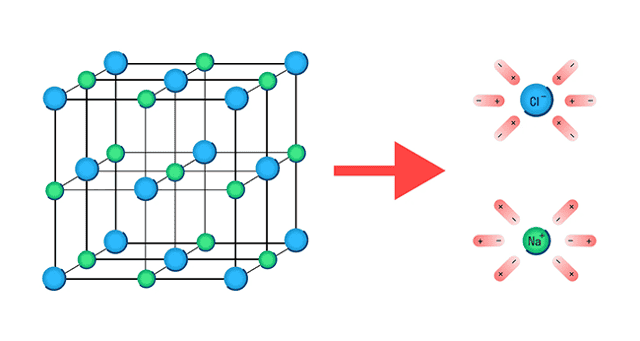
Рассмотрим такое соединение как хлорида натрия. Это вещество характеризуется ионным строением. В узлах его структурной решетки находятся попеременно в шахматном порядке катионы натрия и анионы хлора:
Как можно видеть, заряженные частицы, которые могли бы быть обеспечивать электрическую проводимость присутствуют, но статичны, т.е. неподвижны в узлах решетки. Поэтому, чтобы электрический ток смог протекать через хлорид натрия, нужно еще и обеспечить «подвижность» ионов, из которых он состоит.
Как известно, для одного и того же вещества наиболее подвижны составляющие его частицы в том случае, когда он находится в жидком, а не в твердом агрегатном состоянии.
Поэтому для того, чтобы хлорид натрия смог проводить электрический ток, его необходимо расплавить, т.е. превратить в жидкость.
В результате сообщения энергии кристаллу хлорида натрия в виде большого количества теплоты частично разрушаются ионные связи Na+Cl− , т.е. происходит диссоциация на свободные подвижные ионы:
Na+Cl− ↔ Na+ + Cl−
Однако, добиться диссоциации хлорида натрия можно не только его плавлением, но также и его растворением в воде. Но каким образом, это становится возможным? Ведь для того чтобы произошло разрушение кристаллической решетки требуется сообщить ей энергию, что и происходило при расплавлении. Откуда же берется энергия на разрушение решетки в случае растворения?
При помещении кристалла NaCl в воду его поверхность подвергается «облепливанию» молекулами воды или гидратации, в результате которой, ионам в структурной решетке сообщается энергия, достаточная для выделения из структурной решетки и «отправления в свободное плавание» в «оболочке» из молекул воды:
или более упрощенно:
NaCl ↔ Na+ + Cl−(участвующие в гидратации кристалла NaCl и ионов молекулы воды не записываются)
Если энергия, выделяющаяся при гидратации кристалла, меньше энергии кристаллической решетки, то его растворение и диссоциация становятся невозможными.
Например, поверхность кристалла сульфата бария, помещенного в водную среду, также покрывается молекулами воды, но выделяющаяся в результате этого энергия недостаточна отрыва ионов Ba2+ и SO42- из кристаллической решетки и, как следствие, становится невозможно его растворение (на самом деле возможно, но в крайне малой степени, т.к. абсолютно нерастворимых веществ не бывает).
Аналогичным образом диссоциация осуществляется также гидроксидами металлов. Например:
NaOH = Na+ + OH−
Помимо веществ ионного строения, электролитически диссоциировать способны также и некоторые вещества молекулярного строения с ковалентным полярным типом связи, а именно кислоты.
Как и в случае ионных соединений, причина образования ионов из электронейтральных молекул кроется в их гидратации. Существование гидратированных ионов энергетически более выгодно, чем существование гидратированных молекул.
Например, диссоциация молекулы соляной кислоты выглядит примерно следующим образом:
- Гидратация катионов водорода настолько сильна, что можно говорить не просто о катионе водорода, окружённом молекулами воды (как это было с катионами натрия), а о полноценной частице – ионе гидроксония H3O+, содержащей три полноценные ковалентные связи H-О, одна из которых образована по донорно-акцепторному механизму. Таким образом, уравнение диссоциации соляной кислоты правильнее записывать так:
- H2O + HCl = H3O+ + Cl−
- Тем не менее, даже в этом случае, чаще всего, уравнение диссоциации соляной кислоты, впрочем, как и любой другой, записывают, игнорируя явное участие в диссоциации кислот молекул воды.
- HCl = H+ + Cl−
- Диссоциация многоосновных кислот протекает ступенчато, например:
- H3PO4 ↔ H+ + H2PO4−
- H2PO4− ↔ HPO42- + H+
- HPO42- ↔ PO43- + H+
- Таким образом, как мы уже выяснили, к электролитам относят: соли, кислоты и основания.
- Для описания способности электролитов к электролитической диссоциации используют величину, которая называется степенью диссоциации (α).
- Степень диссоциации – отношение числа продиссоциировавших частиц, к общему числу растворенных частиц.
- По степени диссоциации электролиты делят на сильные (α>30%), средней силы (30%> α>3%) и слабые (α30%)
средней силы (30%> α>3%) слабые (α






