- Реакции с металлами
- Реакции с кислотами
- Реакции с другими солями
- Термическое разложение
- Урок 11: Протекание реакций в растворе
- Особенности протекания реакций в растворе
- Кислоты и их свойства
- Основания и их свойства
- Соли и их свойства
- Конспект урока по химии на тему: "Взаимодействие металлов с растворами солей"
- Химические свойства солей — урок. Химия, 8 класс
- «Проблемный эксперимент при изучении взаимодействия растворов солей с металлами» выступление на научно-практическом семинаре учителей химии «Техника химического. — презентация
- Практическая работа по химии "Металлы"
Архив уроков › Химия 8 класс
В уроке 40 «Химические свойства солей» из курса «Химия для чайников» рассмотрим реакции солей с металлами, кислотами, со щелочами и другими солями.

Для большинства солей характерны реакции замещения и обмена, а для некоторых — еще и реакции разложения.
Реакции с металлами
Соли реагируют с металлами по общей схеме:

Образующиеся в этих реакциях менее активные металлы осаждаются на поверхности более активных металлов в виде рыхлой корочки. Если менее активным металлом является жидкая ртуть, она выделяется в виде сплошной блестящей пленки.
На этом ее свойстве основан очень интересный опыт «Серебрение монеты». В раствор соли ртути Hg(NO3)2опускают медную монету и практически сразу же ее поверхность становится блестящей, как серебро.
Этот блеск никак не связан с серебром, он обусловлен выделением блестящей ртути:
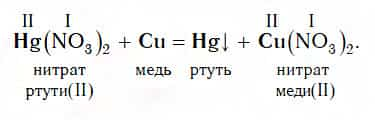
Следует помнить, что ртуть и ее соли сильно ядовиты! Поэтому данный опыт ни в коем случае нельзя пытаться выполнить самостоятельно.
Реакции с кислотами
Вы изучили химические свойства кислот и уже знаете, что в водных растворах они реагируют с солями, образуя новые кислоты и новые соли.
А можно ли сказать, что соли реагируют с кислотами с образованием тех же продуктов? Конечно, можно! Вы ведь уже хорошо знаете, как можно применить в химии математическое правило «от перемены мест слагаемых сумма не меняется».
Действительно, если кислоты реагируют с солями, то почему бы солям не реагировать с кислотами.
Итак, в водных растворах соли реагируют с кислотами по общей схеме:

Реакции этого типа относятся к реакциям обмена, поскольку участвующие в них исходные вещества обмениваются своими составными частями.
Изучив химические свойства оснований, вы узнали, что щелочи (растворимые основания) реагируют с солями, образуя новые основания и новые соли.
Будет совершенно правильным, если вы теперь скажете: «Эти же продукты образуются и при взаимодействии солей с основаниями».
Уже в который раз мы с вами убеждаемся в том, что из одних и тех же исходных веществ, независимо от порядка их смешивания, образуются одни и те же продукты.
Итак, соли реагируют с щелочами по общей схеме:

Реакции с другими солями
Соли в водных растворах вступают в реакции обмена с другими солями по общей схеме:

Термическое разложение
Соли некоторых кислородсодержащих кислот разлагаются с образованием основного и кислотного оксидов по общей схеме:
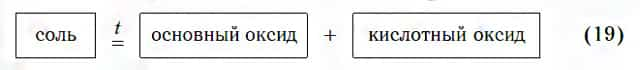
В ходе таких реакций всегда образуется газообразный кислотный оксид. Он соответствует той кислоте, остаток которой содержится в исходной соли. Вы помните, что угольной кислоте H2CO3 соответствует кислотный оксид CO2. Поэтому при разложении соли, содержащей остаток угольной кислоты, образуется указанный кислотный оксид:
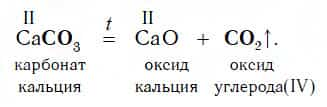
По приведенной схеме разлагаются и некоторые соли сернистой кислоты H2SO3, которой соответствует кислотный оксид SO2:
Краткие выводы урока:
- Соли реагируют с металлами, кислотами, основаниями и другими солями.
Надеюсь Урок 40 «Химические свойства солей» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 11: Протекание реакций в растворе
- План урока:
- Особенности протекания реакций в растворе
- Кислоты и их свойства
- Основания и их свойства
- Соли и их свойства
Особенности протекания реакций в растворе
Химические реакции, в отличие от физических, характеризуются образованием новых веществ. Судить об их получении, мы можем, наблюдая изменение окраски, либо выделение газа или осадка.
Вспомним, что происходит с веществом, когда оно попадает в воду. Оно распадается на ионы. Тем не менее, этот процесс характерен не для всех веществ, а только для сильных электролитов, к которым относятся растворимые соли и кислоты, а также щёлочи.
Также необходимо вспомнить, какие реакции относятся к типу обмена.
Судить произошла реакция или нет, мы можем, если будет выполняться хотя бы одно из условий.
Условия протекания реакций между ионами сложных веществ.
Рассмотрим подробно каждое условие и составим алгоритм написания уравнений.
Выпадение осадка является подтверждением того, мы визуально видим, что реакция произошла. Составим уравнение между щёлочью – гидроксидом калия и солью – сульфатом меди (II). Запишем молекулярное уравнение.
Выполняя данный опыт, Вы могли бы наблюдать образование осадка голубого цвета.
Чтобы понять, какое вещество выпало в осадок, воспользуемся таблицей растворимости, а также составим полное ионно-молекулярное уравнение, которое отображает все частицы, находящиеся в растворе, с учётом коэффициентов.
Таким образом, KOH, K2SO4 и CuSO4 – это сильные электролиты, которые запишем в ионном виде. Cu(OH)2 – нерастворимое вещество, будет в молекулярном виде со стрелкой ↓. Также обращаем внимание, что перед щёлочью КОН находится коэффициент 2. Значит, образуется по два моля ионов К+ и ОН−.
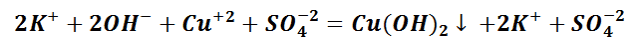
При написании уравнений реакций, не забываем о законе сохранения вещества. Поэтому количество атомов, а также ионов, до реакции и после должны быть равны.
Следует отметить, что в полном ионно-молекулярном уравнении, слева и справа, имеются одинаковые частицы, их можно сократить.
Эти ионы при взаимодействии не образуют вещества, поэтому находятся в растворе в свободном виде как K+и SO4−2.
Сокращённая реакция ионного обмена отображает суть химического процесса, а именно, между какими частицами происходит реакция.
Следственно, Cu(OH)2 будет осадком в растворе состоящем из ионов SO42−и К+.
Вторым из условий является выделение газа. Эту реакцию Вы наблюдаете, когда гасите соду кислотой, не важно, какой уксусной, лимонной, яблочной, или же при добавлении к ней кефира, результат будет один и тот же, образование пузырьков углекислого газа. Для примера возьмём взаимодействие соды и соляной кислоты. Составим молекулярное уравнение.
Возникает закономерный вопрос, в уравнении отсутствует газ, однако раствор «шипит». Чтобы разобраться в этой проблеме, следует вспомнить, что угольная кислота относится к слабым электролитам и происходит выделение углекислого газа, а также образование молекулы воды. Поэтому полное молекулярно-ионное уравнение приобретает вид.
- После сокращение одинаковых частиц левой и правой части, получаем сокращённое ионное уравнение.
- Именно по причине наличия ионов водорода, сода «шипит» во всех кислотах.
И к третьему условию относится образование слабого электролита, зачастую это молекула воды, однако могут получаться и другие вещества. Ярким примером является реакция нейтрализации.
Почему этот тип реакции носит такое название? Рассмотрим на примере взаимодействия оснований КОН и Cu(OH)2 с раствором соляной кислоты.
В каждом случае происходит образование воды. В случае нерастворимых оснований, реакция идёт с образованием растворимой соли.
Уравнение реакции нейтрализации показывает, как два противоположных по свойствам класса неорганических соединений, отдавая по своей частице (Н+ и ОН-), образуют нейтральное вещество Н2О.
Кислоты и их свойства
Если посмотреть на состав этого класса соединений, то абсолютно во всех содержаться ионы водорода.
Следует заметить, что уравнение диссоциации кислот похожи, но отличие будет по кислотному остатку.Рассмотрим на примерах следующих многоосновных кислот –сернойН2SО4 и фосфорной Н3РО4.Характерной особенностью диссоциации многоосновных кислот – это ступенчатая диссоциация. Это означает, что ионы водорода будут отрываться не сразу все (2 или 3), а по одному.
- Следствием этого является способность многоосновных кислот образовывать кислые соли.
- Рассмотрим химические свойства кислот, за которые отвечают ионы Н+.
Каким образом можно доказать, что неизвестное вещество относится к кислотам. Для этих целей создали индикаторы, которые как настоящие сыщики, ищут ионы Н+ или ОН- (в основаниях). Найдя их, они моментально меняют свою окраску. Кислая среда обусловлена наличием Н+.
- В реакциях обмена на их место могут стать только ионы металла, поэтому кислоты реагируют со следующими веществами.
- Следственно, при реакции кислот с основными оксидами образуется соль и вода.
- Атомы металла входят в состав оснований, в результате реакции нейтрализации, аналогично, как и основными оксидами, продуктом реакции является соль (может быть и кислая, и средняя) и вода.
- Исходя из этого, кислая соль образуется, если «не хватает» атомов металла, чтобы обменять их на атомы водорода.
- Взаимодействие кислот с солями возможно только в случае, когда соль образована слабой или летучей кислотой, а также в продукте будет газ или осадок.
- Источник
Особенно хочется отметить взаимодействие металлов с кислотами, поскольку это будет реакция замещения со сменой степени окисления. Не все металлы способны реагировать с кислотами, а только те, что стоят в ряду напряжения до водорода и способны его вытеснить.
Действие концентрированных серной и азотной кислот на металлы отличается от их растворов, при этом происходит образование не водорода, а воды и других продуктов. Детально со свойствами азотной кислоты Вы познакомитесь чуть позже, однако сейчас необходимо запомнить, что при реакции с раствором этой кислоты водород не выделяется.
Основания и их свойства
Данный класс веществ характеризуется наличием функциональной группы, которая отвечает за химические свойства, а именно группы ОН-. По растворимости основания делятся на щёлочи (растворимые) и нерастворимые основания. Соответственно они будут отличаться по химическим свойствам. Щелочная среда образуется, если есть свободные ОН-, которые образуются при диссоциации щелочей.
- Для щелочей, подобно многоосновным кислотам, характерна ступенчатая диссоциация.
Тем не менее, будет происходить не только взаимодействие щелочей с кислотами, но и нерастворимых оснований. Объяснением этому служит, то, что кислоты практически все растворимы, за исключением силикатной H2SiO3, которая реагирует только со щелочами. Продуктом будет соль (в зависимости от соотношения реагентов средняя, основная или кислая) и вода.
- Кислотные оксиды со щелочами образуют соль и воду.
- Для нерастворимых оснований эта реакция не характерна, поскольку именно гидроксильная группа реагирует с оксидами.
Амфотерные основания реагируют также с щелочами. Результатом данного взаимодействия будет соль, зачастую комплексная, и вода.
Взаимодействие солей с щелочами приводит к образованию соли либо основания. Также не забываем об условии, что в продукте должен быть либо газ, либо осадок.
Отличительной способностью обладают нерастворимые, а также амфотерные основания. Они при нагревании распадаются на оксиды.
Соли и их свойства
Этот класс веществ состоит из частичек кислоты – кислотного остатка и основания – катионов металла (либо иона аммония NH4+). Диссоциация солей всегда идёт в одну стадию.
Если посмотреть на состав соли, то смело можно предположить, что их растворы будут нейтральными. Поскольку нет ионов, которые отвечают за реакцию среды. Однако на деле совсем не так.
Лакмус в водном растворе солей может иметь как красную, так и синюю окраску, а также не изменять её. Объяснением этого явления служит их взаимодействие с водой, которое имеет название гидролиз солей.
Возьмём, к примеру, три пробирки, в которых содержатся растворы NaCl, ZnCl2 и Na2CO3. И в каждую добавим лакмус. Результаты эксперимента отображены на рисунке.
- Запишем суть реакции соли с водой (молекулу Н2О распишем как НОН), с помощью ионно-молекулярных уравнений.
Сокращённое уравнение хорошо иллюстрирует, почему происходит изменение окраски индикатора. Теперь давайте разберёмся, какие соли подвергаются гидролизу.
- Именно наличием ионов Н+ в растворе соли ZnCl2, а также группы ОН- в солевом растворе карбоната натрия, объясняется изменение окраски индикатора.
- Источник
Рассмотрим взаимодействие металлов с солями. Чтобы понять принцип их взаимодействия, вспомним ряд активностей металлов.
Данный вид взаимодействия Вы можете наблюдать, выполнив дома опыт (не забываем о разрешении родителей). Вам понадобится раствор медного купороса и скрепка, либо гвоздь.
На поверхности гвоздя выделилась медь в чистом виде. Это окислительно-восстановительная реакция.
Более сильный металл, вытесняет слабый с раствора его соли. Если промоделировать обратную реакцию, а именно положить медную проволоку в раствор соли железа, то не будет никакого взаимодействия. «Силы» у меди не хватит, потеснить железо.
- Взаимодействие солей между собой возможно только, если реагенты растворимы, а в продукте будет осадок.
- Свойства солей, кислот и оснований, рассмотренных выше, можно объединить в схематическом виде.
- Источник
Конспект урока по химии на тему: "Взаимодействие металлов с растворами солей"
| Раздел долгосрочного плана: 8.2 Ряд активности металлов | Школа: №9 | |||||||||||||||||||||
| Дата:_____________ | ФИО учителя: Ишина О.Н. | |||||||||||||||||||||
| Класс: 8 | количество присутствующих:__ | количество отсутствующих:__ | ||||||||||||||||||||
| Тема урока | Взаимодействиеметалловсрастворамисолей Interaction of metals from solutions of salts. | |||||||||||||||||||||
| Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу) | 8.2.4.6 планировать и исследовать реакции замещения металлов в растворах солей | |||||||||||||||||||||
| Цели урока |
|
|||||||||||||||||||||
| Критерии оценивания |
|
|||||||||||||||||||||
| Языковые цели |
|
|||||||||||||||||||||
| Привитие ценностей |
|
|||||||||||||||||||||
| Применение ИКТ на уроке | Интернет-ресурсы, слайд-презентация | |||||||||||||||||||||
| Межпредметные связи | Физика-при объяснении активности металлов; Математика- при уравнении реакции; | |||||||||||||||||||||
| Предварительныезнания | 8.1B Химическая активность металлов | |||||||||||||||||||||
| Ход урока | ||||||||||||||||||||||
| Запланированные этапы урока | Запланированная деятельность на уроке | Ресурсы | ||||||||||||||||||||
|
Организационный момент. Good afternoon, children and collegues. I am glad to see you in our lesson. I wish you a good mood, fruitful work and new knowledge.
Well done( молодец!) All right. there are mistakes. (есть ошибки). Repeat paragraph twelve.
Работайте в группах. Work in groups. Выполняется задание для повторения предыдущего урока и повышения интереса к данному уроку. Для этого учащимся раздаются нарезки частей реакций металлов и кислот. Учащиеся должны выполнить данное задание в группах.Затем должны правильно расположить в соответствии с активностью металлов. Например: Прочитайте данные реакции. Read these reactions.
|
|||||||||||||||||||||
|
Название задания: объяснение нового материала. Listen to me. Open the notebook and write down the topic of the lesson.
· Нитрат алюминия+ медь.=нет реакции.
· Учащиеся уравнивают хим. Реакции.
Прверка работ по принципу «Карусель» |
|||||||||||||||||||||
| Конец урока | Домашние задания. 1. Ответить на вопрос: Какие условия необходимы для взаимодействия металлов с растворами солей?
Цель: Способствует развитию критического мышления На доску прикрепить картину «Рюкзака» затем каждый ученик подходит не просто фиксирует успех, но и приводит конкретный пример. Если нужно ученику собраться с мыслями, можно сказать «пропускаю ход». Спасибо за вашу активную работу. Thank you for your active work. |
| K | + | H2O | → | KOH | + | H2 |
| Ca | + | H2SO4 | → | Ca SO4 | + | H2 |
| Fe | + | HNO3 | → | Fe(NO3 ) 2 | + | H2 |
| Zn | + | HCl | → | ZnCl2 | + | H2 |
| Al | + | H2SO4 | → | Al 2 ( SO4 )3 | + | H2 |
| Na | + | O2 | → | Na2O | + | |
| Mg | + | HNO3 | → | Mg(NO3 )2 | + | H2 |
| Li | + | H2O | → | LiOH | + | H2 |
| Cu | + | O2 | → | CuO | + | — |
| Zn | + | H2SO4 | → | Zn SO4 | + | H2 |
- sulphuric acid
– серная кислота Nitric acid-
азотная кислота - hydrochloric acid
-соляная кислота - ………sulfate-
…… сульфат - ………nitrate — ………нитрат
………hydroxid — ……..гидроксид.
magnesium plus sulfuric
acid to give magnesium sulfate plus hydrogen.
Химические свойства солей — урок. Химия, 8 класс
1. Соли являются электролитами.
В водных растворах соли диссоциируют на положительно заряженные ионы (катионы) металлов и отрицательно заряженные ионы (анионы) кислотных остатков.
Например, при растворении кристаллов хлорида натрия в воде положительно заряженные ионы натрия и отрицательно заряженные ионы хлора, из которых образована кристаллическая решётка этого вещества, переходят в раствор:
NaCl→Na++Cl−.
При электролитической диссоциации сульфата алюминия образуются положительно заряженные ионы алюминия и отрицательно заряженные сульфат-ионы:
Al2SO43→2Al3++3SO42−.
2. Соли могут взаимодействовать с металлами.
В ходе реакции замещения, протекающей в водном растворе, химически более активный металл вытесняет менее активный.
Например, если кусочек железа поместить в раствор сульфата меди, он покрывается красно-бурым осадком меди. Раствор постепенно меняет цвет с синего на бледно-зелёный, поскольку образуется соль железа((II)):
Fe+CuSO4→FeSO4+Cu↓.
Видеофрагмент:
| взаимодействие сульфата меди((II)) с железом |
При взаимодействии хлорида меди((II)) с алюминием образуются хлорид алюминия и медь:
2Al+3CuCl2→2AlCl3+3Cu↓.
3. Соли могут взаимодействовать с кислотами.
Протекает реакция обмена, в ходе которой химически более активная кислота вытесняет менее активную.
Например, при взаимодействии раствора хлорида бария с серной кислотой образуется осадок сульфата бария, а в растворе остаётся соляная кислота:
BaCl2+H2SO4→BaSO4↓+2HCl.
- При взаимодействии карбоната кальция с соляной кислотой образуются хлорид кальция и угольная кислота, которая тут же разлагается на углекислый газ и воду:
- CaCO3+2HCl→CaCl2+H2O+CO2↑⏟H2CO3.
- Видеофрагмент:
| Взаимодействие кислот с солями |
4. Растворимые в воде соли могут взаимодействовать со щелочами.Реакция обмена возможна в том случае, если в результате хотя бы один из продуктов является практически нерастворимым (выпадает в осадок).
Например, при взаимодействии нитрата никеля((II)) с гидроксидом натрия образуются нитрат натрия и практически нерастворимый гидроксид никеля((II)):
NiNO32+2NaOH→NiOH2↓+2NaNO3.
Видеофрагмент:
| Взаимодействие нитрата никеля((II)) с гидроксидом натрия |
При взаимодействии карбоната натрия (соды) с гидроксидом кальция (гашёной известью) образуются гидроксид натрия и практически нерастворимый карбонат кальция:
Na2CO3+CaOH2→2NaOH+CaCO3↓.
5. Растворимые в воде соли могут вступать в реакцию обмена с другими растворимыми в воде солями, если в результате образуется хотя бы одно практически нерастворимое вещество.
Например, при взаимодействии сульфида натрия с нитратом серебра образуются нитрат натрия и практически нерастворимый сульфид серебра:Na2S+2AgNO3→2NaNO3+Ag2S↓.
Видеофрагмент:
| Взаимодействие сульфида натрия с нитратом серебра |
При взаимодействии нитрата бария с сульфатом калия образуются нитрат калия и практически нерастворимый сульфат бария:
BaNO32+K2SO4→2KNO3+BaSO4↓.
6. Некоторые соли при нагревании разлагаются.
Разложение солей может происходить:
- без изменения степени окисления элементов;
- с изменением степени окисления элементов (то есть, протекают окислительно-восстановительные реакции).
A. Реакции разложения солей, в которых степени окисления элементов не изменяются.
При сильном нагревании карбонат кальция (мел, известняк, мрамор) разлагается, образуя оксид кальция (жжёную известь) и углекислый газ:CaCO3⇄t°CaO+CO2↑.
Видеофрагмент:
| Разложение мела при нагревании |
Гидрокарбонат натрия (пищевая сода) при небольшом нагревании разлагается на карбонат натрия (соду), воду и углекислый газ:2NaHCO3⇄t°Na2CO3+H2O+CO2↑.
Видеофрагмент:
| Разложение гидрокарбоната натрия |
Кристаллогидраты солей при нагревании теряют воду. Например, пентагидрат сульфата меди((II)) (медный купорос), постепенно теряя воду, превращается в безводный сульфат меди((II)):
CuSO4⋅5H2O→t°CuSO4+5H2O.
При обычных условиях образовавшийся безводный сульфат меди можно превратить в кристаллогидрат:
CuSO4+5H2O→CuSO4⋅5H2O
Видеофрагмент:
| Разрушение и образование медного купороса |
Аналогичная химическая реакция протекает, когда к гемигидрату сульфата кальция (жжёному гипсу) при помешивании добавляют воду. Получившаяся кашица быстро застывает в результате образования дигидрата сульфата кальция (гипса):
CaSO4⋅0,5H2O+1,5H2O→CaSO4⋅2H2O
Видеофрагмент:
| Застывание гипса |
Б. Окислительно-восстановительные реакции разложения солей.
Окислительно-восстановительные процессы протекают при разложении нитратов.Например, при термическом разложении нитрата калия образуются нитрит этого металла и кислород:2KN+5O−23⟶t°2KN+3O2+O2↑0
Видеофрагмент:
| Разложение нитрата калия |
Разложение перманганата калия в лабораторных условиях можно использовать для получения кислорода. При разложении этой соли, кроме кислорода, образуются манганат калия и оксид марганца((IV)):
2KMn+7O−24⟶t°K2Mn+6O4+Mn+4O2+O2↑0
«Проблемный эксперимент при изучении взаимодействия растворов солей с металлами» выступление на научно-практическом семинаре учителей химии «Техника химического. — презентация
1 «Проблемный эксперимент при изучении взаимодействия растворов солей с металлами» выступление на научно-практическом семинаре учителей химии «Техника химического эксперимента», Автор – Пешкина Е. В. 29 февраля 2008 г.
2 План доклада Значение проблемного эксперимента в процессе обучения химии как элемента инновационной технологии. Этапы применения проблемного эксперимента. Использование проблемного эксперимента при изучении темы «Взаимодействие металлов с растворами солей»: 1.
Лабораторный опыт «Взаимодействие раствора сульфата меди (II) с железом»; 2. Демонстрационный эксперимент «Взаимодействие раствора сульфата меди (II) с литием»; 3. Демонстрационный эксперимент «Взаимодействие магния с раствором сульфата цинка»; 4.
Лабораторный опыт «Взаимодействие меди и растворов хлоридов железа (II) и (III). Выводы. Использованная литература.
3 Этапы применения проблемного эксперимента эксперимент, создающий проблемную ситуацию проблемагипотеза Исследова- тельский эксперимент теория вывод проверочный эксперимент
4 1.
Лабораторный опыт «Взаимодействие раствора сульфата меди (II) с железом»: CuSO 4 + Fe = FeSO 4 + Cu признак реакции – выделение красной меди, изменение цвета раствора (с течением времени) с голубого на желтоватый вывод – более активный металл вытесняет менее активный из растворов его солей (см. ряд активности металлов). Данная реакция является окислительно- восстановительной; окислители – ионы менее активного металла.
- 5 Закрепление полученных знаний: Pb(NO 3 ) 2 + Ni CuCl 2 + Zn CuSO 4 + Li
- 6 2. «Взаимодействие раствора сульфата меди (II) с литием»: Признак реакции – выделение газа, образование черного осадка Схема: CuSO 4 (раствор) + Li H 2 + CuO Взаимодействие лития с водой раствора: 2Li + 2H 2 O = 2LiOH + H 2 + Q (экзотермическая реакция) Взаимодействие образующейся щелочи с раствором соли меди: 2LiOH + CuSO 4 = Cu(OH) 2 + Li 2 SO 4 Разложение полученного гидроксида меди (температура выше 50°С): Cu(OH) 2 =t CuO + H 2 O или в обобщенном виде: 2Li + H 2 O + CuSO 4 = Li 2 SO 4 + H 2 + CuO
- 7 Взаимодействие лития с растворами солей магния, железа (III), никеля Признаки реакций: выделение газа, образование осадков 2Li + 2H 2 O + MgCl 2 = Mg(OH) 2 + H 2 + 2LiCl 6Li + 6H 2 O + 2FeCl 3 = 2Fe(OH) 3 + 3H 2 + 6LiCl 2Li + 2H 2 O + NiCl 2 = Ni(OH) 2 + H 2 + 2LiCl Гидроксиды не разлагаются – выделившегося тепла недостаточно на данные процессы.
8 3. Демонстрационный эксперимент «Взаимодействие магния с раствором сульфата цинка». Признак реакции – выделение водорода.
Ионы водорода образовались в результате гидролиза соли, образованной слабым основанием и сильной кислотой: Zn2+ + HOH ZnOH+ + H+ Магний, как довольно активный металл, восстанавливает образующиеся ионы водорода: Mg + 2H+ = Mg2+ + H 2 Mg + ZnSO 4 + 2H 2 O = MgSO 4 + H 2 + Zn(OH) 2 Вывод – необходимо учитывать возможность гидролиза данных солей.
9 Опыт по взаимодействию магния и раствора хлорида алюминия 3Mg + 2AlCl 3 + 6H 2 O = 3MgCl 2 + 3H 2 + 2Al(OH) 3 (на первых стадиях реакций образуются не гидроксиды, а основные соли цинка и алюминия) Образование гидроксидов возможно благодаря усилению гидролиза солей вследствие удаления водорода из сферы реакции, т.е. уменьшения концентрации ионов Н+ (принцип Ле Шателье).
10 4. Лабораторный опыт «Взаимодействие меди и растворов хлоридов железа (II) и (III). хлорид (или сульфат) железа (II) действительно не реагирует с медью реакция с хлоридом железа (III) идет.
Ее признак – желто-коричневая окраска постепенно меняется на зеленую справочные данные — стандартные электродные потенциалы: E° Fe3+/ Fe2+ = 0,76 В, E° Cu2+/ Cu0 = 0,34 В Cu + 2FeCl 3 = CuCl 2 + 2FeCl 2
11 Проверочный эксперимент реакция взаимодействия раствора хлорида железа (III) с железными опилками: Fe + 2FeCl 3 = 3FeCl 2 Окислительные свойства ионов Fe3+ используются и для демеркуризации, т.е. обезвреживания, разлитой ртути (опыт не проводится!): Hg + 2FeCl 3 = HgCl 2 + 2FeCl 2 Вывод – необходимо учитывать сильные окислительные свойства некоторых ионов металлов.
12 Использованная литература: Сурин Ю. В. Проблемный эксперимент как одна из форм химического эксперимента // Химия в школе. – – с.57-61
Практическая работа по химии "Металлы"
- Практическая работа №2
- По теме: «Общие свойства металлов и их соединений».
- Цель работы: изучение химических свойств металлов и их соединений.
- Задачи работы:
-
Закрепить знания о химических свойствах металлов: взаимодействие металлов с растворами кислот и солей.
-
Экспериментальным путем убедиться в различной химической активности металлов, доказать, что более активные металлы восстанавливают менее химически активные из водных растворов их солей.
-
Изучить общие свойства амфотерных гидроксидов.
-
Изучить общие свойства нерастворимых оснований.
-
Отработать навыки экспериментальной работы согласно правилам техники безопасности.
Краткие теоретические сведения.
Металлы в периодической системе находятся в I, II, III группах, в побочных подгруппах всех групп. Кроме того, металлами являются наиболее тяжелые элементы IV, V, VI и VII групп.
Особенностью строения атомов металлов является небольшое число электронов во внешнем электронном уровне, как правило, не превышающее трёх. Атомы металлов легко отдают электроны и являются хорошими восстановителями.
- Металлы по их активности расположены в ряд, называемый электрохимическим рядом напряжений металлов.
- Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Au
- Металлы, стоящие в электрохимическом ряду напряжений металлов до водорода, могут вытеснять его из растворов кислот, а всякий металл, стоящий ближе к началу ряда, может вытеснять (восстанавливать) последующие из растворов их солей.
- 1.Металлы, расположенные в начале ряда — от лития до магния –восстанавливают водород из воды с образованием щелочи:
- 2Na + 2HOH 2NaOH + H2↑.
- 2. Металлы менее активные (от марганца до железа), восстанавливая из воды водород, образуют оксиды:
- 3Fe + 4H2O Fe3O4 + 4H2↑.
3.Металлы реагируют с кислотами. Взаимодействие металлов зависит от их активности (см. электрохимическим рядом напряжений металлов) и от концентрации кислоты:
- а) кислоты HCl, H3PO4, H2SO4(разб.) реагируют со всеми металлами (кроме Pb), которые стоят в ряду напряжений до водорода, при этом выделяется водород;
- Zn + 2HCl ZnCl2 + H2↑.
- б) концентрированная H2SO4 при нагревании реагирует со всеми металлами (кроме Pt и Au), при этом водород не выделяется; с тяжелыми (плотность 5 г/ см3) металлами образует газ SO2 (оксид серы (IV)); с более активными легкими (плотность 3) металлами выделяется H2S (сероводород):
- Cu +2H2SO4 (конц) CuSO4 + 2H2O + SO2↑.
- в) концентрированная НNO3 c щелочными и щелочноземельными металлами образует газ N2O – оксид азота (IV), с другими тяжелыми металлами – оксид азота (IV) NO2:
- Ca + 10HNO3(конц.) → Ca(NO3)2 + N2O + 5 H2O
- Cu + 4HNO3(конц.) → Cu(NO3)2 + NO2 + 2 H2O
- г) разбавленная НNO3 взаимодействует c щелочными и щелоч-ноземельными металлами, а также с Zn, Fe, Sn, при этом выделяется газ NH3 (аммиак) или образуется соль аммония (NH3 + НNO3 =NH4NO3), при реакции с остальными металлами (плотность 5 г/ см3) образуется оксид азота (II)NO:
- Ca + 10HNO3(разб.) → 4Ca(NO3)2 + NH4NO3 + 3 H2O
- Cu + 4HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
- д) кислоты H2CO3,H2SO3, CH3COOH – слабые, взаимодействуют с активными металлами:
- 2CH3COOH + 2Na → 2CH3COONa + H2
4. Каждый последующий металл может быть восстановлен из раствора соли предыдущим металлом: Fe + CuSO4 FeSO4 + Cu.
Переходные металлы расположены в Периодической системе с 4 по 7 период. Переходные металлы, символы которых расположены в самой таблице, называют d-элементами, а те элементы, символы которых расположены в нижней части Периодической системы, называют лантаноидами и актиноидами или f-элементами.
Амфотерные оксиды — оксиды переходных металлов.
Свойства.
1. Амфотерные оксиды не растворяются в воде.
- 2. Амфотерные оксиды, реагируя с основными и с кислотными оксидами, дают соли:
- Al2O3 + K2O 2KAlO2,
- Al2O3 + 3SO3 Al2(SO4)3.
- 3. Амфотерные оксиды, реагируя с основными или кислотными гидроксидами, дают соли:
- ZnO + 2KOH K2ZnO2 + H2O,
- ZnO + H2SO4 ZnSO4 + H2O
- 4. Соответствующие амфотерным оксидам гидроксиды обладают амфотерными свойствами:
- Zn(OH)2Zn2+ + 2OH— — как основание
- H2ZnO2 2H+ + ZnO22- — как кислота
- Амфотерные гидроксиды — это такие гидроксиды, где растворенная в воде часть, диссоциирует на катионы водорода, металла и анионы гидроксида и кислотного остатка.
- Zn(OH)2⇆ Zn2+ + 2OH—, H2ZnO2⇆ 2H+ + ZnO22-
- Получение:
- 1.Взаимодействием переходных металлов (после удаления оксидной пленки) с водой:
- 2Al + 6H2O = 2Al(OH)3+ 3H2↑
- 2.Взаимодействие солей со щелочами:
- ZnCl2 + 2KOHZn(OH)2 + 2KCl
- 3. Взаимодействием солей с кислотами:
- Na[Al(OH)4] + HCl Al(OH)3+ NaCl + H2O
- Свойства:
- 1. Диссоциирует на ионы растворенная в воде часть амфотерного гидроксида: Zn(OH)2⇆Zn(OH)+ + OH—⇆Zn2+ + 2OH—
- H2ZnO2⇆ HZnO2- + H+⇆ZnO22- + 2H+
- 2. Взаимодействие с кислотными оксидами, кислотами и кислыми солями:
- 2Cr(OH)3 + 3SO3 Cr2(SO4)3 + 3H2O
- Al(OH)3 + 3HBr AlBr3 + 3H2O
- Zn(OH)2+ 2NaHSO4 ZnSO4 + Na2SO4 + 2H2O
- 3. Взаимодействуют с основными оксидами, основаниями и основными солями:
- Zn(OH)2 + Li2OLi2ZnO2 + H2O
- Zn(OH)2 + Ba(OH)2BaZnO2 + 2H2O
- 4. Подвергаются разложению при нагревании:
- 2Al(OH)3 Al2O3 + 3H2O
- Приборы и реактивы:
- — штатив с пробирками, пипетка, держатель для пробирок, спиртовки, спички, стеклянная палочка.
- — растворы: серной кислоты, гидроксида натрия; растворы солей:сульфат меди (II),хлорид цинка, сульфат алюминия, сульфат натрия; кусочки: цинка, меди.
- Порядок выполнения работы.
Опыт № 1. Взаимодействие металлов с растворами кислот.
Ход работы: В три пробирки положить: в первую кусочек магния, во вторую – гранулу цинка, в третью – медь (кусочек проволоки). Прилить во все пробирки 1 мл раствора серной кислоты.
Записать наблюдения в таблицу «Оформление отчета». Сравнить скорость происходящих реакций. Почему в одной из пробирок реакция не идёт? Дать объяснение. Записать уравнения реакций в молекулярном и ионном видах.
Опыт № 2. Взаимодействие металлов с солями.
Ход работы: В одну пробирку положить одну гранулу цинка и прилить раствор медного купороса, во вторую – кусочек медной проволоки и прилить раствор сульфата натрия.
Записать наблюдения в таблицу «Оформление отчета». Составить схему электронного баланса в окислительно–восстановительных реакциях.
Опыт № 3. Получение гидроксида цинка и испытание его амфотерных свойств.
- Ход работы: В две пробирки налить по 5-6 капель раствора соли цинка и очень аккуратно по каплям добавить в них раствор щелочи до появления осадка.
- Затем в одну пробирку добавить 2-3 капли раствора серной кислоты.
- В другую пробирку добавить избыточное количество щелочи (до растворения осадка).
Записать наблюдения в таблицу «Оформление отчета». Составить уравнения реакций в молекулярном и ионном виде.
Опыт № 4. Получение гидроксида меди и изучение его свойств
Ход работы: Из имеющихся реактивов получить гидроксид меди (II). Указать цвет осадка. Нагреть полученное вещество.
Записать наблюдения в таблицу «Оформление отчета». Что произойдет с осадком при нагревании?
Составьте уравнения реакций в молекулярно и ионном виде.
Оформление отчета
| Название работы. Условия проведения. | Наблюдения. | Уравнения реакции. Вывод. |
Выводы по работе (ответить на вопросы).
Какими химическими свойствами обладают металлы. Указать, металлы, которые могут вытеснять водород из растворов кислот и металлы которые могут вытеснять другие металлы из растворов их солей.
Список литературы:
Ерохин Ю.М. Химия: учеб. для студ. учреждений сред. проф. образования / Ю.М. Ерохин.- М.: Академия,2011. с. 170-360. — ISBN 978-5-7695 -8350-6






