- 2. Запишите уравнение химической реакции сероводорода с раствором нитрата свинца(II) в молекулярном, полном и сокращённом ионном виде. Отметьте признаки этой реакции
- 3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CuS→H2S→SO2→SO3
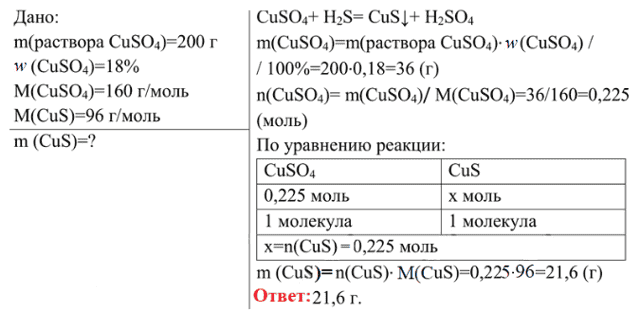
- 4. Сероводород пропустили через 200 г раствора сульфата меди(II) (массовая доля CuSO4 равна 18%). Вычислите массу осадка, выпавшего в результате этой реакции
- Тестовые задания
- 1. Летучие водородные соединения элементов VIA-группы имеют кристаллическую решётку
- 1) ионную
- 2) атомную
- 3) молекулярную
- 4) металлическую
- 2. Сероводород проявляет свойства восстановителя в химических реакциях
- 1) H2S + О2→S + H2O
- 2) H2S + NaOH→Na2S + Н2O
- 3) H2S + SO2→S + H2O
- 4) H2S + Pb(NO3)2→PbS + HNO3
- 5) H2S + O2→SO2 + H2O
- Окислительные свойства серной кислоты | Дистанционные уроки
- Обсуждение: «Окислительные свойства серной кислоты»
- Сероводород. Что это такое? Формула, соединения и примеры
- Строение и физические свойства сероводорода
- Способы получения сероводорода
- Химические свойства сероводорода
- Горение
- Растворимость в воде
- Свойства кислот
- Взаимодействие с аммиаком
- Окисление металлов
- Реакции с галогенами
- Качественные реакции
- Восстановительные свойства
- Вопросы для самопроверки
- Соединения серы (II). Сероводород и сульфиды
- Физические свойства
- Сероводород в природе
- Способы получения
- Химические свойства H2S
- H2S — сильный восстановитель
- Реакции с простыми веществами окислителями
- Реакции с окисляющими кислотами (HNО3, H2SO4(конц.)
- Реакции с солями — окислителями
- Водный раствор H2S проявляет свойства слабой кислоты
- Особенности реакций H2S с солями сильных кислот
- Качественная реакция на сульфид-анион
- Сульфиды
- Обратимый гидролиз растворимых сульфидов
- Необратимый гидролиз сульфидов
- Нерастворимые сульфиды
- Окислительный обжиг сульфидов
- Способы получения сульфидов
- Сероводород — формула, свойства и применение вещества » ГДЗ онлайн
- Общее описание
- Физические характеристики
- Химические свойства
- Соли кислоты
- Получение вещества
- Вред сероводорода
- Применение дигидросульфида
- В нормальном состоянии
- При патологических изменениях
- Использование при анабиозе

Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
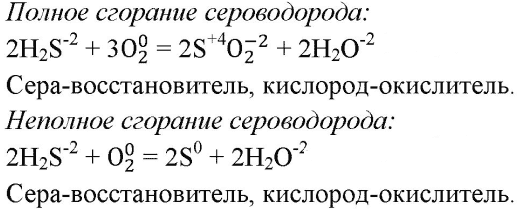
2. Запишите уравнение химической реакции сероводорода с раствором нитрата свинца(II) в молекулярном, полном и сокращённом ионном виде. Отметьте признаки этой реакции
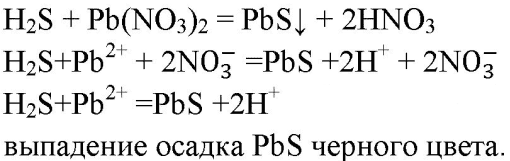
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CuS→H2S→SO2→SO3
4. Сероводород пропустили через 200 г раствора сульфата меди(II) (массовая доля CuSO4 равна 18%). Вычислите массу осадка, выпавшего в результате этой реакции
Тестовые задания
1. Летучие водородные соединения элементов VIA-группы имеют кристаллическую решётку
1) ионную
2) атомную
3) молекулярную
4) металлическую
3) молекулярную
2. Сероводород проявляет свойства восстановителя в химических реакциях
1) H2S + О2→S + H2O
2) H2S + NaOH→Na2S + Н2O
3) H2S + SO2→S + H2O
4) H2S + Pb(NO3)2→PbS + HNO3
5) H2S + O2→SO2 + H2O
Вам также может понравиться
Окислительные свойства серной кислоты | Дистанционные уроки
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
- Разбавленная серная ведет себя, как и остальные кислоты, окислительные свои возможности прячет:
- Zn + H2SO4 → ZnSO4 + H2↑
- Автор статьи — Саид Лутфуллин
И еще, что надо помнить про разбавленную серную кислоту: она не реагирует со свинцом. Кусок свинца, брошенный в разбавленную H2SO4 покрывается слоем нерастворимого (см. таблицу растворимости) сульфата свинца и реакция моментально прекращается.
Pb + H2SO4 ≠
Концентрированная серная кислота – тяжелая маслянистая жидкость, не летучая, не имеет вкуса и запаха
За счет серы в степени окисления +6(высшей) серная кислота приобретает сильные окислительные свойства.
Правило для задания 24 (по-старому А24) при приготовлении растворов серной кислоты никогда нельзя в нее лить воду. Концентрированую серную кислоту нужно тонкой струйкой вливать в воду, постоянно помешивая.
Взаимодействие концентрированной серной кислоты с металлами
Эти реакции строго стандартизированны и идут по схеме:
H2SO4(конц.) + металл → сульфат металла + H2O + продукт восстановленной серы.
Есть два нюанса:
1) Алюминий, железо и хром с H2SO4 (конц) в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2) С платиной и золотом H2SO4 (конц) не реагирует вообще.
Сера в концентрированной серной кислоте – окислитель
- значит, сама будет восстанавливаться;
- то, до какой степени окисления будет восстанавливаться сера, зависит от металла.
Рассмотрим диаграмму степеней окисления серы:
- До -2 серу могут восстановить только очень активные металлы — в ряду напряжений до алюминия включительно.
- Реакции будут идти вот так:
- 8Li + 5H2SO4(конц.) → 4Li2SO4 + 4H2O + H2S↑
- 4Mg + 5H2SO4(конц.) → 4MgSO4 + 4H2O + H2S↑
- 8Al + 15H2SO4(конц.) (t)→ 4Al2(SO4)3 + 12H2O + 3H2S↑
- при взаимодействии H2SO4 (конц) с металлами в ряду напряжений после алюминия, но до железа, то есть с металлами со средней активностью сера восстанавливается до :
- 3Mn + 4H2SO4(конц.) → 3MnSO4 + 4H2O + S↓
- 2Cr + 4H2SO4(конц.) (t)→ Cr2(SO4)3 + 4H2O + S↓
- 3Zn + 4H2SO4(конц.) → 3ZnSO4 + 4H2O + S↓
- все остальные металлы, начиная с железа в ряду напряжений (включая те, что после водорода, кроме золота и платины, конечно), могут восстановить серу только до +4. Так как это малоактивные металлы:
- 2Fe + 6H2SO4(конц.) (t)→ Fe2(SO4)3 + 6H2O + 3SO2↑
- (обратите внимание, что железо окисляется до +3, до максимально возможной, высшей степени окисления, так как оно имеет дело с сильным окислителем)
- Cu + 2H2SO4(конц.) → CuSO4 + 2H2O + SO2↑
- 2Ag + 2H2SO4(конц.) → Ag2SO4 + 2H2O + SO2↑

Конечно, все относительно. Глубина восстановления будет зависеть от многих факторов: концентрации кислоты (90%, 80%, 60%), температуры и т.д. Поэтому совсем уж точно предсказать продукты нельзя.
Приведенная выше таблица тоже имеет свой процент приблизительности, но пользоваться ей можно.
Еще необходимо помнить, что в ЕГЭ, когда продукт восстановленной серы не указан, и металл не отличается особой активностью, то, скорее всего, составители имеют в виду SO2. Нужно смотреть по ситуации и искать зацепки в условиях.
SO2 – это вообще частый продукт ОВР с участием конц. серной кислоты.
- H2SO4 (конц) окисляет некоторые неметаллы (которые проявляют восстановительные свойства), как правило, до максимальной — высшей степени окисления (образуется оксид этого неметалла). Сера при этом тоже восстанавливается до SO2:
- C + 2H2SO4(конц.) → CO2↑ + 2H2O + 2SO2↑
- 2P + 5H2SO4(конц.) → P2O5 + 5H2O + 5SO2↑
- Свежеобразованный оксид фосфора (V) реагирует с водой, получается ортофосфорная кислота. Поэтому реакцию записывают сразу:
- 2P + 5H2SO4(конц) → 2H3PO4 + 2H2O + 5SO2↑
- То же самое с бором, он превращается в ортоборную кислоту:
- 2B + 3H2SO4(конц) → 2H3BO3 + 3SO2↑
Очень интересны взаимодействие серы со степенью окисления +6 (в серной кислоте) с «другой» серой (находящейся в другом соединении). В рамках ЕГЭ рассматривается взаимодействиеH2SO4 (конц) с серой (простым веществом) и сероводородом.
Начнем с взаимодействия серы (простого вещества) с концентрированной серной кислотой. В простом веществе степень окисления 0, в кислоте +6. В этой ОВР сера +6 будет окислять серу 0. Посмотрим на диаграмму степеней окисления серы:
- Сера 0 будет окисляться, а сера +6 будет восстанавливаться, то есть понижать степень окисления. Будет выделяться сернистый газ:
- 2H2SO4(конц.) + S → 3SO2↑ + 2H2O
- Но в случае с сероводородом:
- Образуется и сера (простое вещество), и сернистый газ:
- H2SO4(конц.) + H2S → S↓ + SO2↑ + 2H2O
Этот принцип часто может помочь в определении продукта ОВР, где окислитель и восстановитель – один и тот же элемент, в разных степенях окисления. Окислитель и восстановитель «идут навстречу друг другу» по диаграмме степеней окисления.
- H2SO4 (конц) , так или иначе, взаимодействует с галогенидами. Только вот тут надо понимать, что фтор и хлор – «сами с усами» и с фторидами и хлоридами ОВР не протекает, проходит обычный ионно-обменный процесс, в ходе которого образуется газообразный галогеноводород:
- CaCl2 + H2SO4(конц.) → CaSO4 + 2HCl↑
- CaF2 + H2SO4(конц.) → CaSO4 + 2HF↑
А вот галогены в составе бромидов и иодидов (как и в составе соответствующих галогеноводородов) окисляются ей до свободных галогенов. Только вот сера восстанавливается по-разному: иодид является более cильным восстановителем, чем бромид. Поэтому иодид восстанавливает серу до сероводорода, а бромид до сернистого газа:
- 2H2SO4(конц.) + 2NaBr → Na2SO4 + 2H2O + SO2↑ + Br2
- H2SO4(конц.) + 2HBr → 2H2O + SO2↑ + Br2
- 5H2SO4(конц.) + 8NaI → 4Na2SO4 + 4H2O + H2S↑ + 4I2↓
- H2SO4(конц.) + 8HI → 4H2O + H2S↑ + 4I2↓
- Хлороводород и фтороводород (как и их соли) устойчивы к окисляющему действию H2SO4 (конц).
И наконец, последнее: для концентрированной серной кислоты это уникально, больше никто так не может. Она обладает водоотнимающим свойством.
Это позволяет использовать концентрированную серную кислоту самым разным образом:
Во-первых, осушение веществ. Концентрированная серная кислота забирает воду от вещества и оно «становится сухим».
- Во-вторых, катализатор в реакциях, в которых отщепляется вода (например, дегидратация и этерификация):
- H3C–COOH + HO–CH3 (H2SO4(конц.))→ H3C–C(O)–O–CH3 + H2O
- H3C–CH2–OH (H2SO4(конц.))→ H2C=CH2 + H2O
Обсуждение: «Окислительные свойства серной кислоты»
(Правила комментирования)
Сероводород. Что это такое? Формула, соединения и примеры
Сероводород — это молекулярное соединение с ковалентной полярной связью. По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S.
Строение и физические свойства сероводорода
Сероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит.
Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению. Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода. В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора.
Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
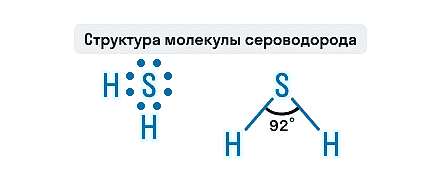
Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни.
Способы получения сероводорода
Сероводород встречается в природе в вулканических газах и водах минеральных источников. Также он образуется в результате разложения белков погибших животных и растений, при гниении пищевых отбросов.
-
При высокой температуре сера взаимодействует с водородом, в результате образуется газ — сероводород:
H2 + S → H2S.
-
Практический способ получения сероводорода — действие разбавленных кислот на сульфиды:
FeS (тв) + 2HCl (разб) → H2S + FeCl2.
-
Полный гидролиз, в результате которого выделяется газ и выпадает осадок:
Al2S3 + 6H2O → 3H2S + 2Al(OH)3.
-
Сероводород можно получить путем нагревания смеси парафина и серы:
С20H42 + 21S → 21H2S + 20C.
-
Действие концентрированной серной кислоты на щелочные и щелочноземельные металлы:
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S + 4H2O.
Химические свойства сероводорода
Горение
На воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях:
-
Полное горение. Продукты реакции — диоксид серы и вода:
2H2S + 3O2 → 2SO2 + 2H2O.
-
Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета:
2H2S + O2 → 2S + 2H2O.
Растворимость в воде
Сероводород растворим в воде. Его раствор называют сероводородной водой или сероводородной кислотой. Формула сероводородной кислоты — H2S. Если кислота долго находится на воздухе и особенно на свету, она мутнеет, т. к. сера окисляется.
Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени:
-
H2S ⇄ H+ + HS−.
-
HS− ⇄ H+ + S2−.
Свойства кислот
Так как раствор сероводорода является кислотой, то для него характерны свойства кислот:
- изменение цвета индикатора — лакмус становится розовым в растворе сероводорода;
- взаимодействие с активными металлами:
H2S + Mg → MgS + H2; - раствор сероводорода реагирует с основными оксидами:
H2S + BaO → BaS + H2O; -
- взаимодействие со щелочами:
- H2S + NaOH → NaHS + H2O;
- H2S + 2NaOH → Na2S + 2H2O;
-
сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид:
H2S + CuCl2 → CuS↓ + 2HCl.
Взаимодействие с аммиаком
Раствор сероводородной кислоты взаимодействует с аммиаком:
H2S + 2NH3 → (NH4)2S.
Окисление металлов
Сероводород может окислять малоактивные металлы в присутствии кислорода:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O.
Реакции с галогенами
Сероводород вступает в реакции с галогенами:
H2S + Cl2 → S + 2HCl.
Качественные реакции
Качественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
Восстановительные свойства
В молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя. При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
- в реакции с бромной водой наблюдается обесцвечивание раствора:
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr; - окисление сероводорода подкисленным раствором перманганата калия:
5H2S + 2KMnO4 + 3H2SO4 → 5S + K2SO4 + 2MnSO4 + 8H2O; - сероводород в кислой среде реагирует с дихроматом калия:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O; -
- взаимодействие с кислотами-окислителями (HNO3, H2SO4):
- 3H2S + 8HNO3 (разб) → 3H2SO4 + 8NO + 4H2O;
- H2S + 8HNO3 (конц) → H2SO4 + 8NO2 + 4H2O;
- H2S + H2SO4 (конц) → S + SO2 + 2H2O.
Вопросы для самопроверки
-
Охарактеризуйте физические свойства сульфида водорода.
-
Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов?
-
Схеме превращений S−2 → S+4 соответствует уравнение:
- 2H2S + O2 → S + 2H2O
- H2SO3 + H2O2 → H2SO4 + H2O
- PbS + 4H2O2 → PbSO4 + 4H2O
- 2H2S + 3O2 → 2SO2 + 2H2O
-
Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2.
-
Верны ли следующие суждения?
А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые.
Б. Сероводород — восстановитель.
-
Верно только А
-
Верно только Б
-
Оба верны
-
Оба неверны
-
Соединения серы (II). Сероводород и сульфиды
Все водородные соединения подгруппы серы имеют молекулярную структуру и ковалентную полярную связь.
Химическое строение молекул H2S аналогично строению молекул Н2O: (угловая форма)
Но, в отличие от воды, молекулы H2S малополярны; водородные связи между ними не образуются; прочность молекул значительно ниже.
Физические свойства
При обычной температуре H2S — бесцветный газ с чрезвычайно неприятным удушливым запахом тухлых яиц, очень ядовитый (при концентрации > 3 г/м3 вызывает смертельное отравление). Сероводород тяжелее воздуха, легко конденсируется в бесцветную жидкость.H2S растворим в воде (при обычной температуре в 1 л H2O растворяется — 2,5 л газа).
Сероводород в природе
H2S присутствует в вулканических и подземных газах, в воде серных источников. Он образуется при гниении белков, содержащих серу, а также выделяется в процессе жизнедеятельности многочисленных микроорганизмов.
Способы получения
- 1. Синтез из простых веществ:
- S + Н2 = H2S
- 2. Действие неокисляющих кислот на сульфиды металлов:
- FeS + 2HCI = H2S↑ + FeCl2
3.Действие конц. H2SO4 (без избытка) на щелочные и щелочно-земельные Me:
- 5H2SO4(конц.) + 8Na = H2S↑ + 4Na2SO4 + 4H2О
- 4. Образуется при необратимом гидролизе некоторых сульфидов:
- AI2S3 + 6Н2О = 3H2S↑ + 2Аl(ОН)3↓
Химические свойства H2S
H2S — сильный восстановитель
Взаимодействие H2S с окислителями приводит к образованию различных веществ (S, SО2, H2SO4),
Реакции с простыми веществами окислителями
- Окисление кислородом воздуха
- 2H2S + 3О2(избыток) = 2SО2↑ + 2Н2О
- 2H2S + О2(недостаток) = 2S↓ + 2Н2О
- Окисление галогенами:
- H2S + Br2 = S↓ + 2НВr
Реакции с окисляющими кислотами (HNО3, H2SO4(конц.)
- 3H2S + 8HNО3(разб.) = 3H2SO4 + 8NO + 4Н2О
- H2S + 8HNО3(конц.) = H2SO4 + 8NО2↑ + 4Н2О
- H2S + H2SO4(конц.) = S↓ + SО2↑ + 2Н2О
Реакции с солями — окислителями
- 5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8Н2О
- 5H2S + 6KMnO4 + 9H2SO4 = 5SО2 + 6MnSO4 + 3K2SO4 + 14Н2О
- H2S + 2FeCl3 = S↓ + 2FeCl2 + 2HCl
Водный раствор H2S проявляет свойства слабой кислоты
- Сероводородная кислота H2S 2-основная кислота диссоциирует ступенчато
- 1-я ступень: H2S → Н+ + HS-
- 2-я ступень: HS- → Н+ + S2-
- Для H2S в водном растворе характерны реакции, общие для класса кислот, в которых она ведет себя как слабая кислота.
Взаимодействует:
- а) с активными металлами
- H2S + Mg = Н2↑ + MgS
- б) с малоактивными металлами (Аg, Си, Нg) в присутствии окислителей
- 2H2S + 4Аg + O2 = 2Ag2S↓ + 2Н2O
- в) с основными оксидами
- H2S + ВаО = BaS + Н2O
- г) со щелочами
- H2S + NaOH(недостаток) = NaHS + Н2O
- д) с аммиаком
- H2S + 2NH3(избыток) = (NH4)2S
Особенности реакций H2S с солями сильных кислот
- Несмотря на то, что сероводородная кислота — очень слабая, она реагирует с некоторыми солями сильных кислот, например:
- CuSO4 + H2S = CuS↓ + H2SO4
- Реакции протекают в тех случаях, если образующийся сульфид Me нерастворим не только в воде, но и в сильных кислотах.
Качественная реакция на сульфид-анион
- Одна из таких реакций используется для обнаружения анионов S2- и сероводорода:
- H2S + Pb(NO3)2 = 2HNO3 + PbS↓ черный осадок.
- Газообразный H2S обнаруживают с помощью влажной бумаги, смоченной раствором Pb(NO3)2, которая чернеет в присутствии H2S.
Сульфиды
Сульфидами называют бинарные соединения серы с менее ЭО элементами, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
Наибольшее значение имеют сульфиды металлов, поскольку многие из них представляют собой природные соединения и используются как сырье для получения свободных металлов, серы, диоксида серы.
Обратимый гидролиз растворимых сульфидов
- Сульфиды щелочных Me и аммония хорошо растворимы в воде, но в водном растворе они подвергаются гидролизу в очень значительной степени:
- S2- + H2O → HS- + ОН-
- Поэтому растворы сульфидов имеют сильнощелочную реакцию
- Сульфиды щелочно-земельных Me и Mg, взаимодействуя с водой, подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
- 2CaS + 2НОН = Ca(HS)2 + Са(ОН)2
- При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
- HS- + H2O → H2S↑ + ОН-
Необратимый гидролиз сульфидов
- Сульфиды некоторых металлов подвергаются необратимому гидролизу и полностью разлагаются в водных растворах, например:
- Al2S3 + 6H2O = 3H2S↑ + 2AI(OH)3↓
- Аналогичным образом разлагаются Cr2S3, Fe2S3
Нерастворимые сульфиды
- Большинство сульфидов тяжелых металлов в воде практически не растворяются и поэтому гид
ролизу не подвергаются. Некоторые из них растворяются под действием сильных кислот, например: - FeS + 2HCI = FeCl2 + H2S↑
- ZnS + 2HCI = ZnCl2 + H2S↑
- Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
Окислительный обжиг сульфидов
- Окисление сульфидов кислородом воздуха при высокой температуре является важной стадией переработки
сульфидного сырья. Примеры: - 2ZnS + 3O2 = 2ZnO + 2SO2
- 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
Способы получения сульфидов
- 1. Непосредственное соединение простых веществ:
- Fe + S = FeS
- 2.Взаимодействие H2S с растворами щелочей:
- H2S + 2NaOH = 2H2O + Na2S сульфид натрия
- H2S + NaOH = H2O + NaHS гидросульфид натрия
- 3.Взаимодействие H2S или (NH4)2S с растворами солей:
- H2S + CuSO4 = CuS↓ + H2SO4
- H2S + 2AgNO3 = Ag2S↓ + 2HNO3
- 4. Восстановление сульфатов прокаливанием с углем:
- Na2SO4 + 4С = Na2S + 4СО
- Этот процесс используют для получения сульфидов щелочных и щелочно-земельных металлов.
Сероводород — формула, свойства и применение вещества » ГДЗ онлайн
Сернистый водород, или гидросульфит, представляет собой сладковатый газ без цвета с запахом тухлых яиц. Он является двоичным соединением серы и водорода, для обозначения применяется формула H2S. Ядовитый и огнеопасный газ используется в производстве серы, сульфидов и серной кислоты, применяется для лечебных ванн.
Общее описание
Вещество в природных условиях встречается в смеси нефтяных газообразных углеводородов, содержится в составе вулканических выделений.
В водной среде находится в форме раствора, например, в Черном море содержится в толще воды на глубине более 200 м.
Гидросульфит выделяется в процессе разложения белков, которые имеют в составе цистеин или метионин (аминокислоты с содержанием серы). Малое количество сернистого водорода выделяется из кишечных газов животных и человеческих организмов.
Физические характеристики
Вещество относится к термически устойчивым соединениям в агрегатном состоянии, при повышении температуры свыше +400ºС разделяется на простые компоненты — Н2 и S. Молекула вещества представляется в изогнутой форме и отличается полярностью (μ = 0,34. 10-29 Кл.м). Водороды не обнаруживаются в дигидросульфидах, в отличие от воды, поэтому в нормальных условиях вещество в жидкое состояние не преобразуется.
Физические свойства сероводорода:
- При растворении дигидросульфида в водной среде получается малая по силе сероводородная кислота, которая становится сверхпроводником при понижении температуры до -70ºС и показателе давления 150 ГПа.
- В жидком состоянии H2S обладает сниженной электропроводимостью, по сравнению с водной средой, так как сернистый водород отличается слабой диэлектрической проницаемостью. В таком виде соединение получает свойства органического раствора, который почти не растворяет лед.
- Твердый дигидросульфид отличается плотностью молекулярного строения, при этом у всех частиц есть 12 расположенных рядом соседей (связи явно различаются со структурным сцеплением льда).
- Плавится серный водород при показателе 2,5 кДж/моль, а испаряется в случае достижения условий 18,7 кДж/моль.
- Вещество весит больше воздуха и подвергается сжатию при достижении температуры -60,2ºС. Полное сжатие проходит при -85,7ºС.
В воздушной среде происходит горение вещества с образованием воды и серного диоксида, реакция выражается уравнением: 2H2S + 3O2 = 2SO2 + 2H2O.
Если в огонь поместить холодный твердый предмет, то окисление идет до свободной серы, которая образует остаток желтого цвета: O2 + 2H2S = 2S + 2H2O.
Чтобы растворить 2,5 объема сернистого водорода, потребуется всего 1 объем жидкости, при этом раствор будет называться сероводородной водой. Смесь становится мутной при содержании на воздухе и на свету, так как происходит кислотная реакция между гидросульфидом и воздухом.
Химические свойства
В результате охлаждения насыщенного раствора можно получить кристаллогидрат H2S . 6H2O. Растворимость сероводородного компонента в органике происходит более активно, чем в воде. В одной порции спирта растворяется 7 частей сероводорода. Интенсивность растворимости достигает максимума при температуре 350ºС, что объясняется получением полисульфидов.
В воде вещество окисляется йодом с выделением свободной серы, а в газовой среде сера окисляет йодистый водород до появления свободного йода по схеме:
- I2 + H2S = S + 2HI.
- S + 2HI = I2 + H2S + 6 кДж.
В газово-воздушной среде при температуре ниже -50ºС образуется молярное соединение H2S . I2. Константа диссоциации сероводородной кислоты слабее угольной, децинормальная смесь имеет кислотность pH = 4.1. Сера с водородом не вступает во взаимодействие в обычных обстоятельствах, только при увеличении температуры идет реакция: S + H2 = H2S + 21 кДж.
Химические свойства сероводорода позволяют выступать ему в качестве восстановителя, примером служит список реакций:
- Br 2 + H 2 S-2 = 2HBr + S0.
- 4Cl 2 + 4H 2 O +H 2 S-2 = H 2 S + 6SO 4 + 8HCl.
- 2FeCl 3 + H2S-2 = S0 + 2FeCl 2 + 2HCl.
Серебро получает черный оттенок, если реагирует с сероводородом, что является результатом взаимного влияния растворимых сульфидов и дигидросульфидов в химии.
Средние соли с содержанием аниона S2- носят название сульфидов, а кислые массы с анионом HS относятся к классу гидросульфидов. Соли имеют различную цветность, несмотря на то, что ионы являются бесцветными.
Сульфиды в воде почти не растворяются, а гидросульфиды реагируют и образуют водные растворы.
Соли кислоты
Вещества растворяются в воде, если находятся в таблице щелочных металлов. Остальные соединения подобного типа не взаимодействуют с водой. Сульфиды выпадают в осадок в результате реакции гибридизации, когда вводятся металлические соли или соль сероводородной кислоты.
У щелочноземельных и щелочных металлов есть гидросульфиды М2+(Н S)2 и M+ HS. Нестойкими являются гидросульфиды Ca2+ Sr2+ . Растворимые сульфиды героизируются в воде, так как относятся к слабым солям кислоты. Часто такая реакция является необратимой с появлением осадка в виде нерастворимого гидроксида.
Получение вещества
Практическое получение сероводорода проходит в реакции сульфида железа и разбавленных кислот.
Другим удобным методом является нагревание сплавленной серы в виде порошка до 170ºС в сочетании с частицами асбеста и парафином. Концентрация смеси составляет 3:2:5, соответственно.
В охлажденном состоянии взаимодействие прекращается, а активизируется реакция с повышением температуры.
Начальный сплав заготавливается заранее и расходуется в случае необходимости, при этом 1 г дает 150 г сероводорода. Для получения чистого вещества смесь пропускается вместе с серными парами над разогретыми глыбами пемзы, при этом температура равняется 100ºС, а давление составляет 90 атм. Температурная диссоциация сероводорода наступает при 400ºС и достигает апогея при достижении 1700ºС.
Вред сероводорода
Взрывоопасной является смесь вещества с воздухом, при этом температура 300ºС ведет к воспламенению и дальнейшему взрыву в случае содержания 5−46% H2S. Ядовитость вещества часто недооценивается и деятельность с ним без защитных средств ведет к отравлению. Всего 0,1% концентрация сероводорода в атмосфере помещения вызывает неприятные последствия для организма.
После вдыхания сероводородных паров наступает потеря обоняния, затем обморок или паралич дыхания, что ведет к смерти человека. Помогает быстрое удаление пострадавшего из проблемного помещения.
Симптомами отравления является головная боль, нарушение сознания и тошнота. Иногда обмороки наступают позднее, когда человек уже не работает с газом.
Средства защиты необходимы, при этом требуется тщательно запахнуть респираторы и другие предметы предохранения.
Применение дигидросульфида
Сероводород в качестве сульфидов используется в технике, например, с его применением изготавливаются люминофоры, полупроводники. В этом производстве задействуются сульфиды кадмия и цинка. В качестве основы смазок берется дисульфид молибдена.
Польза от применения сероводорода:
- в области неорганической химии вещество применяется в качестве реагента для выделения осадка тяжелых металлов, если их сульфиды относятся к категории слаборастворимых;
- в медицине используется в виде искусственных и природных ванн и вводится в состав минеральных вод;
- серный водород участвует в производстве сульфидов, элементарной серы и серной кислоты;
- используется в синтезе меркаптанов и тиофена.
В последние годы рассматривается возможность применения вещества из глубин моря. Его планируется использовать в области сероводородной энергетики в виде химического и электронного сырья.
В нормальном состоянии
Эндогенный дигидросульфид в небольшой массе производится клетками живых организмов и является важным компонентом многих биологических действий.
Вещество является третьим из найденных ранее трансмиттеров после угарного газа и азотной окиси. Этот тип соединения выделяется в организме с помощью цистеина и относится к группе спазмолитиков и вазодилататоров.
Он активно действует на ЦНС, повышает трансмиссию нейронов и способствует функционированию памяти.
Впоследствии вещество окисляется до ионов сульфитов в митохондриях с помощью тиосульфат-редуктазы, затем превращается в ионы сульфатов при воздействии специального фермента. Из организма в конечном виде выводится мочевыми протоками.
В организме человека эндогенный сероводород считается важным фактором для защиты от заболеваний сердца и сосудов, благодаря аналогичности со свойствами азотной окиси.
Несмотря на схожесть, действие сероводорода и оксида азота различаются, хотя они оба оказывают кардиопротективное действие.
Азот активирует гуанилатциклазу, а дисульфид приводит в тонус чувствительные каналы поставки калия в гладких мышцах.
Исследования показывают, что для поддержания сосудистого тонуса важно сочетание азота, сероводорода и угарного газа.
Окись азота в условиях физиологической нормы расширяет крупные артерии и вены, а серный водород отвечает за расслабление периферических сосудов крови.
В организме выявляется взаимодействие сигнальных путей азота и сероводорода, что говорит о зависимости спазмолитического, цитопротекторного и противовоспалительного действия газов друг от друга.
В теле человека серный водород реагирует с внутриклеточными ферментами, при этом образуется HSNO (нитрозотиол). Веществу отводится ведущая роль контроля внутриклеточной концентрации энзимов.
При патологических изменениях
В случае инфаркта выявляется дефицит эндогенного сероводородного газа, что негативно сказывается на состоянии сосудов. Сниженная биологическая доступность серного водорода и окиси азота ведет к некрозу мышцы сердца. Дефицит сероводорода способствует высвобождению большого числа радикалов и наступает экссудативный внутриклеточный стресс.
При недостатке серного водорода активность ферментов изменяется и угнетается биологическое воспроизводство азота. В это время применяется сероводородная терапия прекурсорами вещества или донорами, например, диалил-трисульфидами для увеличения содержания газа в крови и мышцах больного. В результате опасность патологии и повреждений сердечной мышцы становится минимальной.
В организме серный водород может запасаться в виде сульфат-серы. Это промежуточный компонент, который образуется при взаимодействии избыточного вещества с кислородом и используется при необходимости. Порции запасного сероводорода вступают в реакцию с кислородом и активизируют выработку азота, что уменьшает число свободных радикалов.
При заболевании Альцгеймера снижается уровень сероводородного компонента в сосудах мозга, как и у пациентов с недугом Паркинсона. Введение прекурсоров вещества дает улучшение самочувствия вплоть до полного избавления от характерных симптомов. При синдроме Дауна, наоборот, содержание сероводорода обнаруживается в очень завышенной концентрации.
Использование при анабиозе
Теоретически и практически доказано, что продукция сернистого водорода у особей, которые впадают в зимнюю спячку, повышается в несколько раз. Дыхание замедляется и составляет около 10 движений в минуту, а температура тела снижается на 2º. На опытах с мышами было установлено, что гипотермия мозга при этом уменьшает повреждение в органе при инсульте или травматическом воздействии.
Если бы удалось воспроизвести такое действие в организме человека, то сероводородная гибернация стала бы полезным открытием в клинике спасения жизней после травм, инсультов и инфарктов, а также для хранения органов от донора.
Исследования показывают, что эндогенный серный водород влияет на скорость метаболизма, регулирует естественным способом уровень обменных процессов. Последние опыты показали, что эффект гибернации не возникает у крупных животных, а развивается исключительно у мышей.
Анабиозу с помощью сероводородного компонента нельзя подвергнуть свиней или овец, что было практически доказано. Клинические испытания действия сероводорода на человека в части анабиоза были начаты, но неожиданно прекратились медицинской компанией без объяснения причин.