- ПОИСК
- Большая Рнциклопедия Нефти Рё Газа
- Нитриты: свойства, строение, номенклатура, образование
- Содержание:
- Нитритные свойства
- Основность
- Реакции
- Физические проявления
- Состав
- Нитрит-анион
- Твердый
- Органические нитриты
- Сложный
- Номенклатура
- Обучение
- Нитрификация
- Оксиды азота в основных средах
- Реакция с оксидом азота
- Применение нитритов
- Колбасы
- Азокрасители
- Пигменты
- Вазодилататор
- Примеры нитритов
- Ссылки
- Способ производства нитрита натрия
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
- В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
- NH3 + O2 → (кат. Pt) NO + H2O
- KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
- Кислотные свойства
- CaO + HNO3 → Ca(NO3)2 + H2O
- HNO3 + NaOH → NaNO3 + H2O
- Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑
- Термическое разложение
- Реакции с неметаллами
- Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.
- HNO3(конц.) + C → CO2 + H2O + NO2
- HNO3(конц.) + S → H2SO4 + NO2 + H2O
- HNO3(разб.) + S → H2SO4 + NO + H2O
- HNO3(конц.) + P → H3PO4 + NO2 + H2O
- Реакции с металлами
- Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
- Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
- С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
- Al + HNO3(конц.) ⇸ (реакция не идет)
- При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
- Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте. HNO3 → (hv) NO2 + H2O + O2
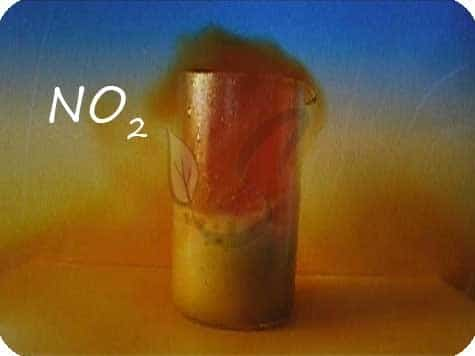
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
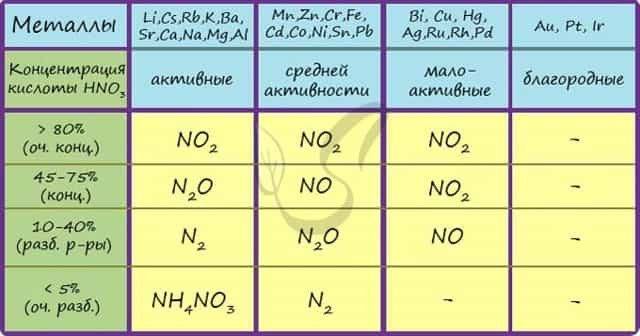
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
- Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
- Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
- В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
- MgO + HNO3 → Mg(NO3)2 + H2O
- Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O
- Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
- Реакции с металлами, основаниями и кислотами
- Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
- Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
- AgNO3 + KCl → AgCl↓ + KNO3
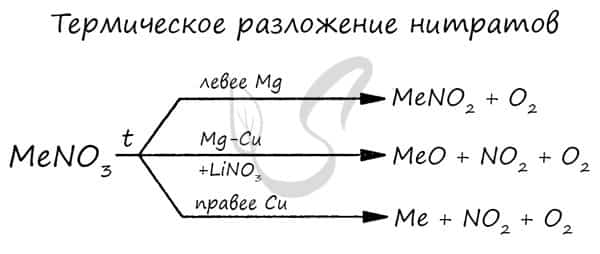
- Разложение нитратов
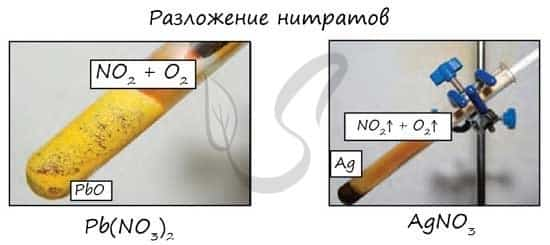
- Pb(NO3)2 → (t) PbO + NO2 + O2
- NaNO3 → (t) NaNO2 + O2
- Cu(NO3)2 → (t) CuO + NO2 + O2
- PtNO3 → (t) Pt + NO2 + O2
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.
ПОИСК
Процессы деструктивного нитрования и окисления обусловлены образованием азотистой кислоты по ранее приведенному уравнению, а также образованием нитритов [c.347]
Карбонат этаноламина и различные другие соединения рассматриваются в качестве летучих ингибиторов в [35, 45].
Смесь мочевины и нитрита натрия также нашла практическое применение, в частности в виде пропитки для бумаги. В присутствии» влаги компоненты смеси, вероятно, взаимодействуют друг с другом с образованием нитрита аммония, который летуч, хотя мало устойчив, и обеспечивает подвод ингибирующих ионов N0 к поверхности металла.
[c.274]
Таблица 20 аммиака, так как образование нитритов и нитратов ие входит в величину ХПК. [c.224]
- Разложение солей может происходить по различным направ лениям в зависимости от того, какая соль берется для разложения, и от условий процесса так, нитрат кальция в зависимости от температуры разлагается с образованием нитрита или окиси кальция [c.221]
- Эта же реакция в отсутствие влаги идет только до образования нитрита калия [c.244]
- КгОз — кислотный оксид, поэтому легко взаимодействует со щелочами с образованием нитритов — солей азотистой кислоты [c.224]
- Разложение нитрата металла с образованием нитрита происходит по схеме [c.101]
Нитрование п-крезола — также автокаталитическая реакция, протекающая с образованием нитрита. [c.162]
Одновременно в большей или меньшей степени протекает побочная реакция, также приводящая к окислению солей аммония, ио с образованием нитрита [552] [c.132]
Для выяснения возможности применения биологического метода при очистке новых сточных вод активным илом предварительно ставят опыты для выяснения отсутствия токсического действия загрязнений на микроорганизмы. Для этого сточные воды разбавляют бытовыми водами в различных соотношениях.
Затем в течение 10—20 дней контролируют следующие показатели исслед(уемой сточной жидкости данные микроскопических исследований, количество бактерий в 1 мл жидкости, ХПК, БПКполн, pH, а также определяют органические загрязнители при помощи специфических реакций (если последние имеются).
Если этими показателями подтверждается биохимический распад органических загрязнений (снижение БПК, ХПК, образование нитритов и нитратов и т. д.), то вопрос о возможности применения к изучаемым сточным водам биологического метода очистки можно считать решанным [77]. [c.
196]
Концентрация Н в отвалах превыщает природный фон в регионе в 40—60 раз, а содержание Аз превышает ПДК в 40—65 раз и достигает 80—130 мг/кг. Различные химические реакции, происходящие в горящих терриконах, способствуют образованию нитритов, нитратов и целого ряда сульфатов тяжелых металлов, постепенно загрязняющих грунтовые воды и почвы. [c.116]
Газы из реакторов 6 перед выбросом в атмосферу промывают водой, а газы из реакторов 7 — азотной кислотой. Совместное улавливание газов производить не рекомендуется во избежание образования нитрита аммония В последний реактор-аммонизатор вводят третий питательный элемент калий, обычно в виде КС1. При этом протекает обменная реакция [c.579]
Окись и двуокись азота реагируют с органическими радикалами в растворе с образованием нитрозо- и нитросоединений [2, 30] иногда наблюдается образование нитритов и нитратов [21. Разложение перекиси этила в присутствии окиси азота дает этилнитрит [31] [c.130]
Термическое разложение нитрата калия с образованием нитрита происходит согласно уравнению [c.39]
В противоположность аминным, нитратные и нитритные комплексы отличаются стабильностью.
Особой прочностью обладает нитритный комплекс, для которого характерно вхождение валентной группы МОг во внутреннюю сферу К2[Н1(М02)4] или K4[N (N02)6] и др.
Вместе с тем при нагревании плава выше 770 К нитратные соединения никеля способны отщеплять часть кислорода с образованием нитритов [c.470]
Хорошо известно, что при контактировании азотсодержащих газов, т. е. таких, в состав которых входят оксид и диоксид азота, с водными растворами щелочи оксиды азота абсорбируются с образованием нитритов и нитратов.
Подобные газы образуются в большом количестве различных процессов, например при фиксации азота в электрической дуге, при окислении воздухом аммиака или при абсорбции реакционных смесей, в которых первичным продуктом является азотная кислота.
Регулируя соотношение между оксидом и диоксидом азота таким образом, чтобы основным компонентом подаваемого газа был оксид азота, образование нитратов можно свести к минимуму и достичь максимального превращения оксида азота в нитриты. [c.337]
Нитрификация — это цепь реакций, осуществляемая нитрифицирующими бактериями, где происходит образование нитритов и нитратов, а главное ионы аммония (КН ) окисляются до нитритов (N02) или происходит превращение нитритов в нитраты (N0 — NOi). [c.140]
Таким образом, данная реакция в стандартных условиях хорошо протекает в прямом направлении с образованием нитрита аммония и воды. [c.76]
Выполнение работы. В цилиндрическую пробирку поместить 3—4 кристаллика нитрата калия. Пробирку укрепить в штативе вертикально и нагревать на пламени горелки до расплавления соли и начала выделения пузырьков газа. Внести в пробирку тлеющую лучинку.
Какой газ выделяется Продолжать нагревание до полного -прекращения выделения пузырьков газа. Доказать образование нитрита калия при разложении нитрата. Для этого по охлаждении пробирки внести в нее 4—6 капель воды и, помешивая стеклянной палочкой, растворить твердый остаток.
По 2—3 капли полученного раствора внести в две пробирки, в одной из которых содержится 3—4 капли раствора иодида калия, подкисленного 2 каплями 2 н. серной кислоты, а в другой — 3—4 капли подкисленного раствора перманганата калия.
Отметить, как изменилась окраска растворов в первом и во втором случае. Проверить, взаимодействует ли КЫОд с К1. [c.153]
При сушке раствора нитрата кальция, в зависимости от температуры гранул в кипящем слое, можно получать продукт с различным содержанием кристаллизанионной воды. В системе Са(НОз)2 — Н2О при низких температурах стабилен тетрагидрат Са(М0з)г-4Н20, который плавится при 43 °С.
В пределах 43—51 °С стабилен тригидрат Са(ЫОз)г ЗНаО. Выше этой температуры существует безводная соль, которая плавится при 561 С, но уже прп 500 °С начинается ее разложение с потерей кислорода и образованием нитрита кальция Са(Ы0г)2, распадающегося затем на СаО и оксиды азота. [c.
366]
Солц азотной кислоты — нитраты — известны почти для всех металлов. Большинство из них бесцветны и хорошо растворяются в воде.
В кислых водных растворах нитраты являются более слабыми окислителями, чем азотная кислота, а в нейтральной среде вообще не обладают окислительными свойствами. Сильными окислителями они становятся в расплавах, а также при температуре разложения с выделением кислорода.
Термическое разложение нитратов щелочных и щелочно-земельных металлов протекает с образованием нитритов, например [c.265]
По условиям техники безопасности при пуске контактных аппаратов н во время нормальной эксплуатации на тарелках газовых холоднльников-промы-вателей поддерживают кислую среду для предотвращения образования нитрита аммония. [c.63]
Термическое разложение нитрата калия начинается при 533—561 °С и роисходит с образованием нитрита калия, кислорода и следов оксидов азота, увеличением температуры от 660 до 700 и 800 °С резко увеличивается [c.205]
Действием сильно разб. HNO3 на карбоновые к-ты получают их нитропроизводные, действием более концентрированной-динитроалканы.
Как и в случае углеводородов, в карбоновых к-тах легче всего замещение происходит при третичном атоме С. Основная побочная р-ция процесса-окисление исходных соед. др.
побочные р-ции-образование нитритов, нитрозосоединений и полинитросоедииений. [c.454]
Реакция заканчивается образованием нитрита калия KNOg и выделением диоксида углерода Og [c.328]
Нитрат кальция при комнатной температуре выделяется из водных растворов Са(Н0з)2-4Н20 в виде бесцветных кристаллов с температурой плавления 42,7° С. Выше 51,6° С кристаллизуется безводная соль (кристаллы кубической сингонии, а = 7,62 А, плотность равна 2,36).
Плавится безводная соль при 561° С при 500° С начинается ее разложение с выделением кислорода и образованием нитрита кальция. Последний распадается на окись кальция и двуокись азота. Растворимость безводного нитрата кальция в воде равна 127 (20° С), 355 (51,6° С) г/100 г Н2О.
Кристаллогидраты и безводная соль гигроскопичны, поэтому нитрат кальция хранят без доступа влаги. [c.12]
Одновременно нужно учитывать, что подобное течение реакции может носить лищь локальный характер, так как в области температур 720—770 К исходный KNO3 претерпевает значительные изменения, связанные с его разложением (сопровождающиеся образованием нитрита калия и кислорода) при более низких температурах. [c.483]
Кадмий легко растворяется в насыщенном растворе нитрата аммония с образованием нитритов (без выделения газа).
При действии на кадмий раствора сернистого газа получается желтая жидкость, из которой постепенно выделяются сера и сульфид кадмия (последний выделяется и при кипячении с соляной кислотой). Растворяется кадмий и в растворах щелочных иодидов,. СиС12 и солей Ре (П1).
При действии растворов персульфата калия и аммония кадмий покрывается порошкообразным налетом основного сульфата [456, стр. 14]. [c.21]
Наличие нитрифицирующих бактерий первой фазы определяют по образованию нитритов (реакция с цинк-йод Кралмалом в кислой среде). Пробы берут через 7, 14 и 21 день инкубации. [c.156]
Азотистая кислота является положительным катализатором реакции нитрования фенола Применением колориметрического метода Мартинсену удалось доказать образование азотистой кислоты во время нитрования фенола, чем и объясняется, по его мнению, автокаталитический характер этой реакции Нитрование п-крезола — также автокаталитическая реакция, протекающая с образованием нитрита [c.162]
И только при нагревании выше 500 °С образующийся ортонитрат калия K3NO4 разлагается с образованием нитрита, суммарно давая продукты реакции. [c.504]
Разложение гексогена щелочью в ацетоновом растворе с образованием нитрита, определяемого колориметрически с реактивом Грисса — Илосвая. [c.60]
Нитрат натрия NaNOj —белые, гигроскопичные, хорошо растворимые в воде кристаллы. Т. пл. 311 °С. Прн 380 °С нитрат разлагается с образованием нитрита натрия и газообразного кислорода [c.280]
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Образование нитрита угнетается также под влиянием больших количеств нитрата. [1]
Р�нтересной реакцией образования нитритов щелочных ( Рё щелочноземельных) металлов является взаимодействие РёС… твердых гидроокисей СЃ РѕРєРёСЃСЊСЋ азота РїРѕ схеме: 2РРћРќ 4NO 2РРњРћР° NjO HoO. Процесс медленно идет РІ обычных условиях, причем скорость его РїРѕ СЂСЏРґСѓ Li — Cs резко возрастает. Термический распад нитрита натрия протекает около 900 РЎ РїРѕ суммарному уравнению: 4NaNO2 2NajO 2Na Р—РћРі. РџРѕРґ вакуумом РїСЂРё 350 — 500 РЎ нитриты натрия Рё калия РјРѕРіСѓС‚ быть отогнаны РёР· РёС… расплавов без существенного разложения. [2]
- Р’ этом случае образование нитрита РІ продуктах реакции РЎРќ3 СЃ N02 связано СЃ вторичным процессом РЎРќ30 N0 — CH3ONO, РІ котором выделяющаяся энергия РЅРµ превышает энергии РЅРё РѕРґРЅРѕР№ РёР· связей РІ этой молекуле. [3]
- Р’ этом случае образование нитрита РІ продуктах реакции РЎРќ3 СЃ NO Рѕ связано СЃ вторичным процессом РЎРќ30 N0 — CH3ONO, Рї котором выделяющаяся энергия РЅРµ превышает энергии РЅРё РѕРґРЅРѕР№ РёР· связей РІ этой молекуле. [4]
- Окислов азота СЃ образованием нитрита натрия поглощается 78 75 0 708 55 75 РєРіРјРѕР», остается окислов азота 78 75 — — 55 75 23 РєРіРјРѕР». [5]
В почве под влиянием микроорганизмов обнаружено образование нитритов, что указывает на протекание не только процессов, приведенных на схеме, но и отщепления нитрогруппы с последующей деструкцией молекулы. Метаболизм в организме позвоночных и насекомых близок. [6]
Предположение о протекании реакции окисления через стадию образования нитритов целлюлозы подтверждается указанными исследователями некоторыми экспериментальными данными. Так, например, добавление NaNO2, который при взаимодействии с HNO3 выделяет HNO2, значительно ускоряет окисление целлюлозы. [7]
Разложение гексогена щелочью РІ ацетоновом растворе СЃ образованием нитрита, определяемого колориметрически СЃ реактивом Грисса — Р�лосвая. [8]
При наличии в исходной воде бактерий, обусловливающих образование нитритов, должна проводиться периодическая обработка трубопроводов исходной воды и фильтрующих материалов осветлительных фильтров раствором хлорной извести. [9]
Последний поглощается аммиачной водой в скруббере 3 с образованием нитрита и нитрата аммония. Очищенный от NO и SO2 дымовой газ после водной промывки и подогрева выбрасывается в дымовую трубу. [11]
- При нагревании в сухом состоянии нитраты разлагаются с образованием нитритов ( стр. [12]
- Нитрование Рї-крезола — также автокаталитическая реакция, протекающая СЃ образованием нитрита. [13]
- Нитрование и-крезола также является автокаталитической реакцией, протекающей с образованием нитрита. [14]
- Метод основан на разложении гексогена щелочью в ацетоновом растворе с образованием нитритов и их последующем колориметрическом определении с реактивом Грисса. [15]
- Страницы: 1 2 3 4
Нитриты: свойства, строение, номенклатура, образование
Нитриты: свойства, строение, номенклатура, образование. — Наука
Содержание:
В нитриты все те соединения, которые содержат анион NO2–, если они неорганические, или группа -ONO, если они являются органическими. Подавляющее большинство составляют нитриты металлов, которые представляют собой неорганические соли, в которых NO2– электростатически взаимодействует с катионами Mп +; например, катион натрия Na+.
Таким образом, нитрит натрия, NaNO2, представляет собой пример нитритного соединения или соли. Эти соли встречаются в природе, будь то почвы, моря, млекопитающие и ткани растений, поскольку они являются частью биологического цикла азота. Следовательно, NO2– Это вещество, присутствующее в нашем организме, и оно связано с сосудорасширяющими процессами.
Нитрит — это форма азота, которая более восстановлена или менее окислена, чем нитрат, NO3–. Оксид азота, NO, вырабатывается из него в тех частях тела, где наблюдается дефицит кислорода. NO представляет собой сигнальную молекулу, которая оказывает сосудорасширяющее действие, расслабляя мышцы и артерии.
Вне биохимии и медицины нитриты используются как бактерициды, и их добавление в мясо довольно распространено. Это сделано с целью их лечения и продления их качества и свежести на более длительное время.
У нитрита две стороны: одно полезно для здоровья, а другое угрожает ему. Хорошее лицо обусловлено именно реакциями, которые сводят его к НЕТ. Между тем, плохое лицо связано с его преобразованием в нитрозамин: семейство органических соединений, в котором есть несколько членов, признанных канцерогенными.
Нитритные свойства
Основность
- Нитриты являются основными солями, поскольку анион NO2– представляет собой сопряженное основание азотистой кислоты, HNO2:
- HNO2 + H2ИЛИ ⇌ НЕТ2– + H3ИЛИ+
- В воде и в небольших количествах он гидролизуется с образованием ионов ОН.–:
- Нет2– + H2O ⇌ HNO2 + ОН–
Эта основность присуща всем нитритным солям, поскольку зависит от NO.2– а не катионов, которые его сопровождают.
Однако эти катионы и их взаимодействие с NO2– они действительно влияют на растворимость солей нитрита в воде и других полярных растворителях.
Реакции
Нитритные реакции различаются в зависимости от катионов NO2–, или, если это органический нитрит, RONO. В общем, нитриты могут разлагаться, окисляться или восстанавливаться до оксидов металлов, NO3–, НЕТ2, NO и даже газообразный азот, N2.
Например, нитрит аммония, NH4Нет2 разлагается на N2 и H2ИЛИ.
Физические проявления
Почти все нитриты представляют собой твердые вещества с кристаллическим внешним видом. Многие из них имеют беловатый или желтоватый цвет, хотя некоторые из них окрашены, если содержат катионы переходных металлов.
С другой стороны, органические нитриты — это в основном летучие жидкости, которые очень нестабильны и взрывоопасны.
Состав
Нитрит-анион
На первом изображении нитрит-анион показан в полномасштабной модели. Недостатком этой модели является то, что она точно такая же, как у диоксида азота NO.2. Вместо этого верхнее изображение лучше описывает нитрит-анион и поведение его отрицательного заряда.
Этот заряд делокализован между двумя атомами кислорода, поэтому каждый из них имеет половину отрицательного заряда (-1/2). И именно этот отрицательный заряд отвечает за привлечение катионов из окружающей среды простым электростатическим притяжением.
Твердый
Все неорганические нитриты представляют собой твердые кристаллические соединения. Их взаимодействие чисто электростатическое, с притяжением между NO2– а катионы Mп +. Так например, NaNO2 имеет ромбическую кристаллическую структуру и образован ионами Na+ и нет2–.
Тип кристаллической структуры будет зависеть от идентичности M+ п, поэтому не все нитриты имеют орторомбическую структуру.
Органические нитриты
Органические нитриты, в отличие от неорганических, представляют собой не ионные, а ковалентные соединения. Следовательно, они состоят из молекул, которые характеризуются наличием связи R-ONO, где R может быть алкильной или ароматической группой.
Они считаются сложными эфирами азотистой кислоты, поскольку их водород, H-ONO, заменен группой R:
Согласно изображению выше, этот эфир можно записать как RON = O, что очень похоже на формулу для сложных эфиров углерода, ROC = O. Обратите внимание на большое сходство этой структуры со структурой нитросоединений RNO2, где теперь главная ссылка R-NO2 а не Р-ОНО. Таким образом, единственная разница заключается в атоме, с которым связан NO.2 в группу R.
По этой причине сложные эфиры нитрита и нитросоединения считаются связывающими изомерами, имеющими одинаковые атомы, но по-разному связанные.
Сложный
Комплексы нитритов могут иметь как неорганические, так и органические компоненты. В них между металлическим центром и одним из атомов кислорода NO образуется координационная связь.2–. То есть мы не говорим о чисто электростатическом взаимодействии, Mп +Нет2–, но координация Mп +-ИЛИ НЕ–.
Органические нитриты и их комплексы будут устанавливать кристаллические структуры или нет, в зависимости от того, удастся ли их взаимодействиям упорядочить их частицы в космосе.
Номенклатура
Неорганические и органические нитриты имеют довольно простую номенклатуру. Чтобы назвать их, сначала помещаются слова «нитрит», за которыми в скобках указывается название металла и его валентность. Аналогично, окончания –ico и –oso могут использоваться, если имеется более одной валентности.
Например, CuNO2 Его можно назвать двумя способами: нитрит меди (I) или нитрит меди.
https://www.youtube.com/watch?v=dk3otKuJr6wu0026t=31s
Это правило наименования применимо также к органическим нитритам. Например, CH3ONO называют метилнитритом, так как CH3 соответствует группе R, связанной с кислородом NO2.
Номенклатура может усложниться, если существуют другие группы, имеющие такое же или большее химическое значение, чем NO.2, или если они комплексы металлов.
Обучение
Нитрификация
Многие неорганические нитриты образуются в природе на одной из стадий азотного цикла: нитрификации. Этот процесс состоит из окисления аммиака, осуществляемого микроорганизмами, в частности, нитрозомонадными бактериями.
- Нитрификация также включает последующее окисление нитрита до нитрата; однако образование нитрита — медленная стадия этих реакций, так как она требует больше энергии и должна преодолевать больший кинетический барьер.
- Следующее уравнение иллюстрирует вышеизложенное:
- 2NH4+ + 3O2 → 2НО2– + 4H+ + 2H2ИЛИ
- В этой реакции участвуют несколько ферментов, и гидроксиламин NH2ОН, который является продуктом, из которого в конечном итоге будут происходить нитрит-анионы.
Именно благодаря нитрификации растения содержат нитриты, а животные, в свою очередь, их потребляют. Нитриты присутствуют не только в почве, но и в морях, и почти вся их естественная выработка обусловлена окислительным и анаэробным действием различных микроорганизмов.
Оксиды азота в основных средах
- Нитриты щелочных металлов могут быть получены промышленным способом путем барботирования азотсодержащих оксидов в растворах или основных средах либо их соответствующих гидроксидов, либо карбонатов. Например, нитрит натрия производится по следующей реакции:
- НЕТ + НЕТ2 + NaOH → 2NaNO2 + H2ИЛИ
- В случае нитрита аммония триоксид диазота барботируется в аммиак:
- 2NH3 + H2O + N2ИЛИ3 → 2NH4Нет2
Реакция с оксидом азота
Алкилнитриты, RONO, могут быть синтезированы путем взаимодействия алкиловых спиртов с оксидом азота, в контакте с воздухом и с использованием органических растворителей в качестве реакционной среды. Общая реакция была бы следующей:
Р-ОН → Р-ОНО
Применение нитритов
Колбасы
Нитриты обладают антибактериальным действием, поэтому их добавляют в мясо в умеренных количествах, чтобы замедлить гниение. Помимо выполнения этой функции, они вступают в реакцию с белками мяса, придавая им более красноватый и привлекательный цвет.
Обратной стороной этой практики является то, что в некоторых видах мяса может содержаться слишком много солей нитрита, и при приготовлении при высоких температурах они превращаются в нитрозоамины. Следовательно, существует риск увеличения шансов заболеть каким-либо видом рака, если потребление этих колбасных изделий чрезмерно.
Азокрасители
Нитриты используются в органической химии для проведения реакции диазотирования, с помощью которой синтезируются красители или азокрасители.
Пигменты
Некоторые нитритные комплексы, такие как комплексы кобальта, могут использоваться в качестве пигментов для красок или фарфора из-за их яркого цвета.
Вазодилататор
Нитриты отвечают за образование оксида азота в организме в регионах с дефицитом кислорода. NO — сигнальная молекула, на которую кровеносные сосуды реагируют расслаблением и расширением. Это расширение или расширение приводит к снижению артериального давления.
Примеры нитритов
- Наконец, будут перечислены некоторые примеры нитритов с их соответствующими формулами и названиями:
- -Старший брат2: нитрат натрия
- -КНО2: нитрит калия
- -Mg (НЕТ2)2: нитрит магния
- -Носик2)2: нитрит кальция
- -CH3CH2ONO: этилнитрит
- -NH4Нет2: нитрит аммония
- -Zn (НЕТ2)2: нитрит цинка
- -Pb (НЕТ2)2: нитрит свинца (II) или нитрит плюмбозы
- -Fe (НЕТ2)3: нитрит железа (III) или нитрит железа
- — (CH3)2CHCH2CH2ONO: изоамилнитрит
Ссылки
- Шивер и Аткинс. (2008). Неорганическая химия. (Четвертый выпуск). Мак Гроу Хилл.
- Кэри Ф. (2008). Органическая химия. (Издание шестое). Мак Гроу Хилл.
- Грэм Соломонс Т.В., Крейг Б. Фрайл. (2011). Органическая химия. (10-е изд.). Wiley Plus.
- Википедия. (2020). Нитрит. Получено с: en.wikipedia.org
- Elsevier B.V. (2020). Нитрит. ScienceDirect. Получено с: sciencedirect.com
- Альфа Эсар. (2020). Нитритные соли. Thermo Fisher Scientific. Получено с: alfa.com
- Редакторы Энциклопедии Британника. (23 февраля 2018 г.). Нитриты. Encyclopdia Britannica. Получено с: britannica.com
- Энтони Р. Батлер и Мартин Филиш. (22 апреля 2018 г.). Терапевтическое использование неорганических нитритов и нитратов. doi.org/10.1161/CIRCULATIONAHA.107.753814
- Крис Гуннарс. (10 февраля 2020 г.). Вредны ли нитраты и нитриты в пищевых продуктах? Получено с: healthline.com
Способ производства нитрита натрия
Заявляемое техническое решение относится к области производства нитрита натрия из концентрированных нитрозных газов и может быть использовано при получении нитритов других щелочных металлов.
https://www.youtube.com/watch?v=dk3otKuJr6wu0026t=217s
Нитрит натрия широко используется в пищевой и машиностроительной промышленности, в строительстве и т.д.
- Его производство в промышленном масштабе основано на поглощении оксидов азота щелочными растворами карбоната натрия (соды) или гидроксида натрия (едкого натра) с образованием нитрита натрия по реакциям: Na2CO3 + N2O3 2NaNO2 + CO2 (1); 2NaOH + N2O3 2NaNO2 + H2O (1a); Na2CO3 + 2NO2 NaNO2 + NaNO3 + CO2 (2); 2NaOH + 2NO2 NaNO2 + NaNO3 + H2 (2a).
- Стремятся обычно к тому, чтобы параллельно с NaNO2 образовывалось как можно меньше NaNO3, особенно это важно в отдельных случаях, например, если растворы нитрита натрия используются в производстве капролактама или при получении нитрита натрия высшего качества.
- Установлено, что для достижения этой цели необходимо поддерживать соотношение NO:NO2 в газе на всем протяжении процесса абсорбции оксидов щелочным раствором не выше 1:1 [1] Когда производство нитрита натрия базировалось на щелочном поглощении оксидов азота из низкоконцентрированных нитрозных газов под атмосферным давлением после кислотного поглощения в производстве азотной кислоты, поддержание такой степени окисленности нитрозных газов не представляло особого труда.
- Однако в современных производствах азотной кислоты щелочная очистка выхлопных газов от оксидов азота не практикуется.
Поэтому целевые установки по производству нитрита натрия базируются на переработке концентрированных нитрозных газов, причем с целью достижения глубокой очистки выхлопных газов от оксидов азота, по крайней мере на последней стадии абсорбции, используют повышенное давление [2] В наиболее совершенном производстве нитрита натрия окисление аммиака осуществляют под атмосферным давлением, поглощают раствором соды из горячих нитрозных газов 90% всех оксидов азота, затем охлажденный газ компримируют до 4 ата и оставшиеся оксиды азота (10% от общего количества полученных конверсией аммиака оксидов азота) поглощают раствором соды под этим давлением в санитарной абсорбционной колонне, на выходе из которой газ содержит до 0,3 об. оксидов азота, поэтому дальнейшая очистка осуществляется при помощи аммиака на специальном катализаторе.
Это производство, описанное в [3] принято в качестве прототипа заявляемого способа.
Существенным недостатком этого способа производства является то, что затруднено регулирование соотношения NO:NO2 в оптимальном соотношении с точки зрения минимального образования NaNO3, особенно на стадии абсорбции оксидов азота под повышенным давлением.
Опыт эксплуатации производства нитрита натрия показал, что по прототипу на 2-ой ступени щелочной абсорбции под давлением перерабатывается всего 10% от общего количества оксидов азота. При этом количество образующегося нитрата натрия на этой ступени по абсолютному количеству близкой к количеству нитрата натрия, образующегося на 1-ой ступени абсорбции.
Образование значительных количеств нитрата натрия обусловлено высокой окисленностью газа; переокисление газа на этой стадии усугубляется тем, что на всас нитрозного компрессора подается дополнительный воздух.
Таким образом, на 2-й ступени в нитрат натрия перерабатывается 3,4% всех оксидов азота (или 34% от поступающих на вторую ступень абсорбции), а на 1-ой ступени 5% По прототипу инверсия нитрит-нитратных растворов осуществляется при атмосферном давлении и отдувка оксида азота осуществляется воздухом, а нитрозный газ со стадии инверсии поступает на 1-ую ступень абсорбции.
Процесс инверсии нитрит-нитратных растворов заключается в переводе остатка нитрата натрия в нитрат натрия по реакции: 2NaNO2 + 2HNO3 3NaNO3 + 2NO + H2O (3) Процесс ведут при температуре 90 110oC и в кислой среде.
В процессе инверсии в газовую фазу выделяется оксид азота. Так как оксид азота перенасыщает раствор, необходима отдувка NO из раствора.
Обычно для этого используется воздух, а процесс инверсии ведут при атмосферном давлении, чтобы осуществить отдувку NO небольшим количеством воздуха.
- По прототипу содержание NO в инверсионном газе составляет 50 70% Повышение давления на стадии инверсии не влияет на протекание реакции (3), так как она идет в жидкой фазе, но затрудняет отдувку оксида азота.
- Задача заявляемого технического решения заключается в снижении степени переработки оксидов азота, поступающих на 2-ую ступень абсорбции, в нитрат натрия с 34 до 5% Это возможно если обеспечить окисленность нитрозных газов на входе в зону щелочной абсорбции 2-ой ступени близкую к 50% (мольное соотношение NO:NO2 1:1).
- По заявляемому способу это достигается путем проведения инверсии нитрит-нитратного раствора (после высаждения из него основной массы нитрита натрия) под давлением, равным давлению на 2-ой ступени абсорбции (в данном случае, при 4 ата), с отдувкой оксида азота из раствора нитрозным газом, поступающим на 2-ую ступень абсорбции.
- Подача малоокисленных газов инверсии (окисленность 25%) в нитрозный газ непосредственно перед щелочной колонной 2-ой ступени абсорбции позволяет обеспечить окисленность NO 45% при которой достигаются оптимальные условия для перевода оксидов азота в нитрит натрия.
По предлагаемому способу для отдувки NO используется нитрозный газ, что позволяет не ограничивать его количество и обеспечить отдувку NO под повышенным давлением. Нитрозный газ перед 2-ой ступенью абсорбции содержит N2 80,6 об. О2 2,6 об. NO2 0,01 об. NO 1,22 об. CO2 6,1 об. остальное пары H2O.
Чтобы обеспечить парциальное давление оксидов азота в инверсионном газе не выше, чем в обычном процессе при атмосферном давлении (0,5 0,7 ата), при 4 ата содержание оксидов азота в инверсионном газе достаточно снизить до 14 об. нитрозного газа указанного выше состава требуется примерно в 6,7 раза больше, чем воздуха при атмосферном давлении, в абсолютном исчислении 300 нм3 в расчете на 1 т NaNO2 или 7,5% от общего количества нитрозного газа.
https://www.youtube.com/watch?v=dk3otKuJr6wu0026t=300s
По настоящему решению нет принципиальных ограничений по количеству нитрозного газа, отбираемого из общего потока на отдувку NO из инверсионного раствора, так как при отказе от использования воздуха дополнительный кислород в систему не вводится. Поэтому оно может быть значительно выше минимально необходимого, т.е. отдувка NO из инверсионного раствора при повышенном давлении надежно обеспечивается.
- Давление в системе 4 ата принято как преимущественное, но оно не ограничивается.
- Предлагаемый способ производства предусматривает в отдельных случаях подачу инверсионных газов, богатых NO, в основной поток нитрозных газов дробными порциями по высоте щелочного абсорбера, например, когда нитрозный газ богат оксидами азота и кислородом, и окисление NO в NO2 в самом щелочном абсорбере идет быстро (преимущественно для систем под единым давлением).
- В этом случае обеспечение окисленности газа 50% не гарантирует оптимального соотношения NO и NO2 далее по высоте колонны, так как из-за высокого содержания в газе кислорода и оксидов азота может происходить переокисление NO в NO2.
- Подача части инверсионных газов с низкой окисленностью NO в переокисленный газ по высоте колонны оптимизирует окисленность.
- Этот прием является дополнительным признаком настоящего технического решения.
Когда давление в системе выше, т.е. и на стадии инверсии, (например 6 8 ата) или нитрозный газ, которым ведут отдувку NO, содержит оксидов азота более 2 об. инверсионные растворы перед выдачей на стадию выделения NaNO3 можно отдуть от остатков растворенных окислов азота небольшим количеством выхлопных газов, очищенных от оксидов азота, и вернуть их в систему.
По заявляемому способу, такая отдувку производится не воздухом, а выхлопными газами, содержащими мало кислорода (0,3 об.).
Выхлопные газы отбираются до промывной колонны и возвращаются в систему перед реактором каталитической очистки (в системе с единым давлением) или на всас нитрозного нагнетателя (в системе с двумя давлениями, как показано на рисунке).
Этот прием является также дополнительным признаком изобретения.
Предлагаемый способ преимущественно предназначен для системы, подобной прототипу, т.е.
с двумя ступенями щелочной абсорбции под разными давлениями, но может быть использован и в системах щелочной абсорбции под одним давлением, даже с большей эффективностью, поскольку позволяет не вводить в систему дополнительный кислород, что предотвращает переокисление NO в NO2, дает возможность дробной подачей малоокисленных инверсионных газов регулировать соотношение NO:NO2 на уровне оптимального 1:1 по высоте абсорбера.
Предлагаемый способ позволяет уменьшить долю оксидов азота, перерабатываемых в NaNO3, и соответственно увеличить выход целевого продукта нитрита натрия (NaNO2).
Так, по сравнению с прототипом, на стадии щелочной абсорбции количество оксидов азота, перерабатываемых в NaNO3, можно уменьшить с 8,4 до 5,5% Снижение содержания NaNO3 в исходных растворах нитрит-нитратных солей позволяет более глубоко высадить чистый нитрит натрия, уменьшить инверсию NaNO2 в NaNO3, а в результате увеличить соотношение вырабатываемого нитрита натрия и нитрата натрия с 2:1 до 2,7:1.
Новизна заявляемого способа заключается в проведении инверсии под давлением с отдувкой оксида азота тем же нитрозным газом, который идет на щелочную абсорбцию, вместо воздуха; в проведении отдувки оксида азота частью нитрозного газа, который смешивается с основным потоком нитрозного газа дробными порциями; в проведении отдувки остатков оксидов азота выхлопными газами, возвращаемыми в систему.
Осуществление способа представлено схемой на чертеже, в котором: 1 — линия газообразного аммиака; 2 линия воздуха; I смеситель; 3 линия аммиачно-воздушной смеси; II реактор окисления аммиака; 4, 5, 6, 7, 8 — линии нитрозных газов; III котел-утилизатор; IV колонна 1-ой ступени щелочной абсорбции; V компрессор нитрозных газов; Va турбодетандер; VI — подогреватель выхлопных газов; VII колонна 2-ой ступени щелочной абсорбции; VIII промыватель выхлопных газов; 9, 10, 11 линии выхлопных газов; IX — реактор каталитической очистки выхлопных газов; X инверсионная колонна; XI — продувочная колонна; 12, 13, 14, 15 линии очищенных выхлопных газов; 16, 17 линии инверсионных растворов на выделение NaNO3; 18, 19 линии раствора нитрит-нитратных солей на выделение NaNO2; 20 линия циркулирующего щелочного раствора нитрит-нитратных солей; 21 линия раствора нитрит-нитратных солей на инверсию; 22 линия азотной кислоты на инверсию; 23 линия питательной воды; 24 линия пара; 25, 26 линии конденсата сокового пара; 27, 28 линии охлаждающей воды; 29 линия газов инверсии; 30 линия раствора соды.
Газообразный аммиак в количестве 1730 кг/ч по линии 1 поступает в смеситель 1, где смешивается с воздухом, поступающим по линии 2. Полученная аммиачно-воздушная смесь с концентрацией аммиака 11,2 об. направляется в реактор окисления аммиака 11.
Окисление аммиака осуществляется при температуре 800 820oC с образованием 24600 кг/ч нитрозных газов, содержащих 10,6 об. оксида азота (2200 кг/ч). Нитрозный газ, охлажденный в котле-утилизаторе III до 200 230oC, поступает на щелочную абсорбцию в абсорбционную колонну 1-ой ступени IV.
Поглощение оксида азота осуществляется раствором соды при температуре 40 45oC.
Тепло реакций образования нитрита и нитрата натрия отводится циркулирующим раствором нитрит-нитратных солей. Степень поглощения оксидов азота в колонне IV составляет 90% при этом 85% оксидов азота переходит в нитрит натрия, 5% в нитрат натрия.
Количество оксидов азота в нитрозных газах на выходе из абсорбционной колонны 1-ой ступени составляет 285 кг/ч (1,3 об.).
Отводимый по линии 18 продукт, содержащий 5780 кг/ч NaNO2 и 420 кг/ч NaNO3, направляется на переработку в кристаллический продукт.
По линии 6 нитрозные газы поступают в турбокомпрессор V, где сжимаются до давления 4,2 ата, температура при этом повышается до 200oC. Перед сжатием в нитрозный газ добавляется продувочный газ из колонны XI.
Тепло нитрозных газов используется в подогревателе выхлопного газа VI для нагрева выхлопных газов до 260oC перед реактором каталитической очистки IX. Нитрозные газы охлаждаются при этом до 100oC и направляются в абсорбционную колонну 2-ой ступени VII.
На входе в абсорбционную колонну VII в нитрозные газы добавляются из линии 29 газы инверсии, содержащие 370 кг/ч оксидов азота (NO 246 кг/ч, NO2 126 кг/ч).
Абсорбция оксидов азота осуществляется раствором соды в колонне VII тарельчатого типа. Количество оксидов азота перед абсорбцией с учетом газов инверсии составляет 780 кг/ч, в том числе NO 340 кг/ч, NO2 440 кг/ч (мольное соотношение NO:NO2 1,18:1.
Тепло реакций отводится циркулирующим раствором нитрит-нитратных солей.
Содержание оксидов азота после 2-ой ступени абсорбции 0,2 об. (67 кг/ч). По линии 19 из колонны VII отводятся нитрит-нитратные соли на переработку в кристаллический продукт в количестве: NaNO2 1230 кг/ч, NaNO3 — 80 кг/ч.
Выхлопные газы после колонны VII проходят промыватель выхлопных газов VIII, подогреватель VI, реактор каталитической очистки IX, турбодетандер Va. В турбодетандере выхлопные газы расширяются до атмосферного давления и с температурой 150oC выбрасываются в атмосферу.
- Инверсия растворов нитрита натрия осуществляется под давлением 4 ата в инверсионной колонне Х, в которую подают нитрит-нитратный раствор, содержащий 1130 кг/ч NaNO2 и 565 кг/ч NaNO3.
- Азотную кислоту подают по линии 22 в количестве 920 кг/ч.
- Инверсия осуществляется по реакции: 2NaNO2 + 2HNO3 3NaNO3 + 2NO + H2O Полученный нитрат натрия в количестве 1700 кг/ч (включая нитрат натрия, полученный в результате до нейтрализации свободной азотной кислоты) выводится по линиям 16, 17 на кристаллизацию.
Отдувка оксидов азота из растворов осуществляется нитрозным газом; 10% нитрозных газов отбирается из линии 8 и подается в колонну Х. Газы инверсии, содержащие 330 кг/ч оксида азота (NO), возвращаются в нитрозные газы перед щелочной абсорбцией 2-ой ступени. При этом обеспечивается окисленность газов 46% перед щелочной абсорбцией 2-ой ступени.
Содержание кислорода в нитрозных газах невелико (2 об.), поэтому окисление NO в NO2 в колонне идет медленно и обеспечивается соотношение NO:NO2 1:1.
- В результате обеспечения окисленности газов на уровне 50% доля оксидов азота, поглощаемая с образованием нитрита натрия на 2-ой стадии абсорбции составляет 95% а в целом по установке до 94,5% Суммарно по примеру в установке производится 5620 кг/ч NaNO2 и 1520 кг/ч NaNO3, а соотношение NaNO2: NaNO3 составляет 2,7:1 вместо 2:1 по прототипу.
- Как показано в примере, по сравнению с прототипом обеспечивается более глубокая переработка оксидов азота в нитрит натрия, повышается степень абсорбции оксидов азота.
- В результате использования предлагаемого способа достигается экономия аммиака и энергоресурсов: пара, электроэнергии; уменьшается потребление дефицитной соды на тот же объем выработки нитрита натрия.
1.
Способ производства нитрита натрия из концентрированных нитрозных газов, включающий поглощение оксидов азота содовым раствором в абсорберах в две ступени при повышенном давлении на второй ступени, выделение кристаллического нитрита натрия из полученного раствора нитрит-нитратных солей, инверсию маточного раствора после выделения нитрита натрия, отвод выхлопных газов, отличающийся тем, что инверсию маточного раствора ведут под давлением с отдувкой из инверсного раствора оксидов азота с помощью нитрозных газов и возвратом последних на вторую ступень абсорбции. 2. Способ по п. 1, отличающийся тем, что отдувку оксидов азота из инверсионных растворов ведут частью нитрозных газов, которые затем дробными порциями смешивают с основным потоком нитрозных газов, поступающих на вторую ступень абсорбции, обеспечивая при этом соотношение NO NO2 в нитрозных газах по высоте абсорбера на уровне 1 1. 3. Способ по п. 1, отличающийся тем, что из инверсионных растворов отдувают остатки оксидов азота выхлопными газами и последние возвращают на сжатие в смеси с нитрозными газами.






