- Сероводород
- Сернистый газ и сернистая кислота
- Серный ангидрид и серная кислота
- Выводы
- Сера в химии — классификация, получение, свойства, формулы и определения с примерами
- Сера в природе
- Строение атома серы
- Строение и физические свойства простых веществ
- Химические свойства серы
- Применение серы
- Оксид серы(IV) и оксид серы(VI)
- Оксид серы(VI)
- Серная кислота
- Строение молекулы серной кислоты
- Химические свойства серной кислоты
- Сульфаты — соли серной кислоты
- Соли серной кислоты
- Применение серной кислоты и сульфатов
- Сера — химические свойства, получение, соединения. ВИа группа » HimEge.ru
- Нахождение серы в природе
- Аллотропные модификации серы
- Получение серы
- Химические свойства серы
- Сероводород H2S и сульфиды- химические свойства
- Соединения серы +4: сернистый газ, сернистая кислота и её соли сульфиты.
- Серная кислота – химические свойства и промышленное производство
- Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
- Сера (S)
- Сера, как простое вещество
- Химические свойства серы
- Аллотропные модификации серы
- α-сера
- β-сера
- Пластическая сера
- Получение и применение серы
- 2.3.2. Химические свойства кислорода и серы
- Химические свойства серы
Самоучитель по химии › Неорганическая химия
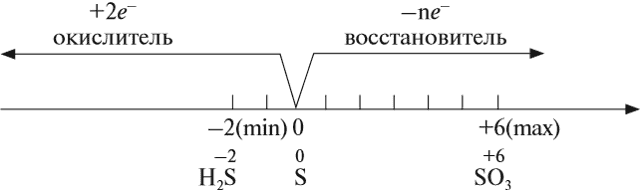
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:
Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:
Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:
Иногда эти свойства проявляются в одной реакции:
Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.

Сероводород
H2S — сероводород, сильно ядовитый газ с противным запахом тухлых яиц. Правильнее сказать, белки яиц при гниении разлагаются, выделяя сероводород.
Задание 15.4. Исходя из степени окисления атома серы в сероводороде, предcкажите, какие свойства будет проявлять этот атом в окислительно-восстановительных реакциях.
Поскольку сероводород — восстановитель (атом серы имеет низшую степень окисления), он легко окисляется. Кислород воздуха окисляет сероводород даже при комнатной температуре:
Сероводород горит:
Сероводород немного растворим в воде, причём его раствор проявляет свойства очень слабой кислоты (сероводородной H2S). Она образует соли сульфиды:
Вопрос. Как, имея сульфид, получить сероводород?
Сероводород в лабораториях получают, действуя на сульфиды более сильными (чем H2S) кислотами, например:
Сернистый газ и сернистая кислота
SO2 — сернистый газ с резким удушливым запахом. Ядовит. Растворяется в воде, образуя сернистую кислоту:
- Эта кислота средней силы, но очень неустойчива, существует только в растворах. Поэтому при действии на её соли — сульфиты — другими кислотами можно получить сернистый газ:
- При кипячении полученного раствора эта кислота разлагается полностью.
Задание 15.5. Определите степень окисления серы в сернистом газе, сернистой кислоте, сульфите натрия.
- Поскольку степень окисления +4 для серы является промежуточной, все перечисленные соединения могут быть и окислителями и восстановителями:
- Например:
Задание 15.6. Расставьте коэффициенты в этих схемах методом электронного баланса. Укажите, какие свойства проявляет атом серы со степенью окисления +4 в каждой из реакций.
Восстановительные свойства сернистого газа применяются на практике. Так, при восстановлении теряют цвет некоторые органические соединения, поэтому оксид серы IV и сульфиты применяют при отбеливании. Сульфит натрия, растворённый в воде, замедляет коррозию труб, так как легко поглощает кислород из воды, а именно кислород является «виновником» коррозии:
- Окисляясь в присутствии катализатора, сернистый газ превращается в серный ангидрид SO3:
Серный ангидрид и серная кислота
- Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
- Серная кислота H2SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:
- Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:
- Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
- Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:
Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:
Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
- Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
- Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.
Выводы
Изложенное выше можно отразить в шутливом стишке: «Сера, сера, буква S, 32 атомный вес, сера в воздухе горит, образует ангидрид (какой кислоты?), ангидрид плюс вода — получилась кислота (какая?)».
Сера в химии — классификация, получение, свойства, формулы и определения с примерами
Содержание:
Сера — химический элемент и простое вещество:
Сера, так же как и кислород, является элементом VIA-группы периодической системы, она находится в третьем периоде. Рассмотрим свойства этого химического элемента и образуемых им простых веществ.
Сера в природе
Массовая доля серы в земной коре составляет около 0,05 %, она является распространенным элементом. В природе сера встречается как в виде самородной серы (рис. 49), так и в составе различных минералов и горных пород (рис. 50): сульфидов

Строение атома серы
В атоме серы 16 электронов (рис. 51), из них 6 электронов — на внешнем электронном слое:
В соединениях с металлами и водородом сера обычно проявляет степень окисления, равную –2, например — сульфид алюминия. В соединениях с более электроотрицательными элементами (F, O, N, Cl, Br) атомы серы проявляют положительные степени окисления, чаще +4 и +6, например — оксид серы(IV), — фторид серы(VI).
Строение и физические свойства простых веществ
Простое вещество сера существует в виде нескольких аллотропных модификаций, отличающихся составом и строением. Кристаллическая сера — твердое, легкоплавкое вещество желтого цвета. Кристаллическая сера имеет молекулярное строение — состоит из циклических молекул (рис. 52). Если расплавленную серу вылить в холодную воду, то она застынет в виде светложелтой, прозрачной массы, похожей на резину (рис. 53). Это аморфная модификация — пластическая сера, состоящая из длинных цепей атомов серы S.
Сера в воде не растворяется и даже не смачивается ею. Если бросить в воду немного порошка серы, то частички серы не осядут на дно, а будут плавать на поверхности воды, образуя желтую пленку (рис. 54).
Химические свойства серы
- Сера взаимодействует со многими простыми и сложными веществами, хотя ее реакционная способность ниже, чем у кислорода.
- Сера реагирует со многими металлами, кроме золота и платины, проявляя при этом окислительные свойства, например (рис.
55):
- Продуктами такого взаимодействия являются сульфиды металлов.
Реакция с серой является основой способа удаления и обезвреживания разлитой ртути, например, из разбитого термометра. Ртуть, которая попала в щели и другие труднодоступные места, засыпают порошком серы.
Такой процесс называют демеркуризацией.
- Окислительные свойства серы проявляются и в реакциях с некоторыми неметаллами. Сера взаимодействует с водородом при нагревании, образуя летучее соединение — сероводород
Сероводород — бесцветный газ с резким запахом тухлых яиц. Правильнее сказать, что это тухлые яйца пахнут сероводородом, так как этот газ образуется при гниении растительных и животных остатков.
Сероводород ядовит. Поэтому его вдыхание может привести к тяжелому отравлению. Однако в небольших количествах сероводород оказывает целебное действие.
Он содержится в водах некоторых минеральных источников.
Сера окисляется кислородом, проявляя при этом восстановительные свойства (рис. 56):
Применение серы
Больше половины добытой серы расходуется для получения серной кислоты, одного из самых важных химических продуктов. Нагреванием серы с каучуком получают резину. Как горючее вещество сера входит в состав черного пороха, спичечных головок. Широко применяется сера в сельском хозяйстве для борьбы с вредителями растений. В медицине серу используют для лечения кожных заболеваний.
- Сера в соединениях с металлами и менее электроотрицательными элементами проявляет степень окисления –2, а в соединениях с более электроотрицательными элементами — +4 и +6.
- Простое вещество сера существует в виде нескольких аллотропных модификаций.
- Сера при взаимодействии с металлами, водородом и некоторыми неметаллами ведет себя как окислитель.
- В реакции с кислородом сера является восстановителем.
Оксид серы(IV) и оксид серы(VI)
- Сера образует с кислородом два оксида: оксид серы(IV), или сернистый газ, и оксид серы(VI)
- Оксид серы(IV)
- Оксид серы(IV) — это бесцветный газ с характерным запахом. Графическая формула его молекулы:
- Оксид серы(IV) является кислотным оксидом, проявляя все соответствующие химические свойства: взаимодействует с водой, щелочами и осно Ђвными оксидами.
- При растворении оксида серы(IV) в воде образуется слабая двухосновная сернистая кислота:
В этом легко убедиться по изменению окраски лакмуса с фиолетовой на красную в водном растворе оксида серы(IV). Сернистая кислота неустойчива и существует только в растворе. Соли этой кислоты называются сульфитами.
Сернистый газ обладает бактерицидным действием. Поэтому его широко используют для обработки овощехранилищ, плодов и фруктов, чтобы предотвратить их загнивание. Сернистый газ, как и соли сернистой кислоты, применяют для отбеливания соломы, шерсти, бумаги, тканей.
- В оксиде серы(IV) сера находится в промежуточной степени окисления +4. Поэтому сернистый газ может проявлять как окислительные свойства, реагируя с восстановителями:
- так и восстановительные свойства, взаимодействуя с сильными окислителями:
Реакция взаимодействия сернистого газа с сероводородом — один из важных процессов, протекающих в природе. При извержении вулканов выделяются SO2 и H2S, а при их взаимодействии образуется сера в виде кристаллов. На рисунке вы видите извержение вулкана Килауэа.
Оксид серы(VI)
Оксид серы(VI) SO3 представляет собой бесцветную жидкость, которая при температуре ниже 17 °С превращается в белое твердое вещество. Графическая формула его молекулы представлена на рисунке 58.
- Это типичный кислотный оксид. Он реагирует с водой с выделением теплоты, образуя серную кислоту:
- Оксид серы(VI) реагирует с основными оксидами:
- и щелочами:
- Оксид серы(VI) применяется для промышленного получения серной кислоты.
Попадание оксидов серы в атмосферу при сжигании топлива приводит к образованию в облаках кислот и выпадению кислотных дождей. Они губительно действуют на все живое: разрушается почва, изменяется состав почвенных организмов, гибнут ценные виды рыб, исчезает растительность (см. рис.).
- Оксид серы(IV) и оксид серы(VI) представляют собой типичные кислотные оксиды.
- При взаимодействии с водой оксид серы(IV) и оксид серы(VI) образуют соответственно сернистую и серную кислоты.
Серная кислота
Серная кислота является важнейшим кислородсодержащим соединением серы. Она была получена алхимиками еще в XIII в. и называлась тогда «купоросное масло». С помощью серной кислоты удалось получить и другие минеральные (неорганические) кислоты — соляную, азотную.
Строение молекулы серной кислоты
Модель молекулы серной кислоты представлена на рисунке 59. В молекуле атом серы соединен с четырьмя атомами кислорода за счет образования двух двойных связей S=O и двух одинарных S=OH.
- Связи в молекуле серной кислоты являются сильно полярными, поэтому у ярко выражены кислотные свойства. Серная кислота — сильный электролит, в разбавленных водных растворах диссоциирует на ионы полностью:
- Физические свойства серной кислоты
Чистая серная кислота — бесцветная маслянистая нелетучая жидкость без запаха, примерно в 2 раза тяжелее воды. Она смешивается с водой в любых соотношениях. При приготовлении водных растворов серной кислоты выделяется большое количество теплоты, происходит разогревание смеси, которое может сопровождаться ее разбрызгиванием.
- Помните!
- Кислоту осторожно тонкой струйкой вливают в воду при непрерывном перемешивании раствора.
- Обычно водный раствор серной кислоты с массовой долей более 70 % называют концентрированной серной кислотой, а менее 70 % — разбавленной серной кислотой.
Концентрированная серная кислота используется как водоотнимающий агент, например для осушения газов (см. рис. слева).
Она способна отнимать воду и у сложных веществ, в состав которых входят водород и кислород. Так, под действием концентрированной серной кислоты сахар обугливается и реакционная масса чернеет и вспучивается (см. рис. справа):
Химические свойства серной кислоты
Разбавленная серная кислота, как и соляная, проявляет все характерные для кислот свойства. Она изменяет окраску индикаторов: лакмус и метилоранж в растворе становятся красными. Разбавленная взаимодействует с металлами, стоящими в ряду активности до водорода, с выделением водорода:
- являясь окислителем за счет ионов водорода Н+ .
- Разбавленная серная кислота реагирует также с оксидами металлов:
- с основаниями:
- с солями:
Концентрированная серная кислота по своим свойствам отличается от разбавленной. Она является более сильным окислителем за счет атомов серы, имеющих степень окисления +6. Концентрированная способна взаимодействовать с металлами, стоящими в ряду активности не только до, но и после водорода (кроме золота и платины).
Продемонстрируем действие концентрированной серной кислоты на медь. При приливании концентрированной серной кислоты в пробирку с медью и нагревании смеси раствор окрашивается в серовато-синий цвет и наблюдается выделение газа (рис. 60):
Железо, алюминий и некоторые другие металлы при обычных условиях не реагируют с концентрированной серной кислотой из-за образования защитной пленки на поверхности металла. Поэтому концентрированную серную кислоту можно хранить и перевозить в стальных цистернах (рис. 61).
Концентрированная серная кислота способна взаимодействовать с простыми веществами — неметаллами, а также со многими сложными, в том числе органическими соединениями. Серная кислота обугливает бумагу и древесину, разрушает одежду и кожу — это очень опасное вещество, способное вызывать труднозаживающие химические ожоги.
- Серная кислота — бесцветная, маслянистая жидкость. В водных растворах является сильным электролитом.
- Разбавленная серная кислота проявляет все характерные для кислот свойства: взаимодействует с металлами, стоящими в ряду активности до водорода, с выделением водорода; с оксидами металлов; с основаниями; с солями.
- При взаимодействии концентрированной серной кислоты с медью выделяется оксид серы(IV).
Сульфаты — соли серной кислоты
Серная кислота — один из главных продуктов химической промышленности. Об этом говорят и масштабы мирового производства, достигающие 200 млн т в год.
Соли серной кислоты
Как вы уже знаете из предыдущего параграфа, соли серной кислоты — сульфаты могут образовываться при ее взаимодействии с металлами, оксидами металлов, основаниями и солями.
Большинство сульфатов хорошо растворимы в воде. Растворимые сульфаты, главным образом сульфат магния, содержатся в морской воде и обуславливают ее горький вкус.
Многие сульфаты способны связывать воду, образуя кристаллогидраты. Кристаллогидраты солей серной кислоты часто называют купоросами, например: — медный купорос, — железный купорос, — цинковый купорос (рис. 63). При нагревании они легко выделяют содержащуюся в них воду.
- Плохо растворимы сульфаты металлов IIА-группы (кроме сульфатов бериллия и магния), меньше других растворим сульфат бария. При добавлении раствора соли бария, например хлорида бария к водным растворам серной кислоты или сульфатов образуется осадок сульфата бария белого цвета:
- Поэтому для обнаружения серной кислоты и ее солей в водных растворах используют растворимые соли бария.
Применение серной кислоты и сульфатов
Серная кислота — один из важнейших продуктов, широко используемых в различных областях промышленности (рис. 64).
Основными ее потребителями являются производства минеральных удобрений, соляной, уксусной и других кислот, моющих средств, взрывчатых веществ, красителей, лекарств.
Серная кислота применяется также в металлургии, для очистки нефтепродуктов, в качестве электролита в кислотных аккумуляторах и т. д.
Соли серной кислоты используются в качестве минеральных удобрений, в строительстве, в медицине, для борьбы с вредителями растений, в производстве соды и стекла.
Например, кристаллогидраты сульфата меди(II) (медный купорос) и сульфата железа(II) (железный купорос) используются в сельском хозяйстве для борьбы с вредителями растений, как антисептическое средство для обработки древесины, в производстве красителей.
Гидратированный сульфат магния (горькая, или английская, соль) широко применяется в медицине, в том числе как сильное слабительное средство.
Природный гипс служит для улучшения почвы, алебастр нашел широкое применение в строительном деле, для формовки всевозможных изделий, при изготовлении гипсовых скульптур и т. п.
- Серная кислота — один из главных продуктов химической промышленности.
- Большинство сульфатов хорошо растворимы в воде.
- Для обнаружения серной кислоты и ее солей в водных растворах используют растворимые соли бария.
Сера — химические свойства, получение, соединения. ВИа группа » HimEge.ru
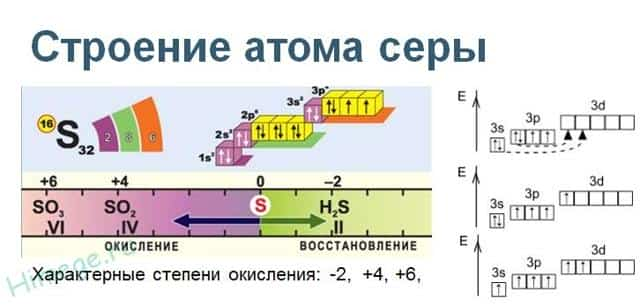
Сера расположена в ВИа группе Периодической системы химических элементов Д.И. Менделеева. На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s 2 3p 4 .
В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
 Нахождение серы в природе
Нахождение серы в природе
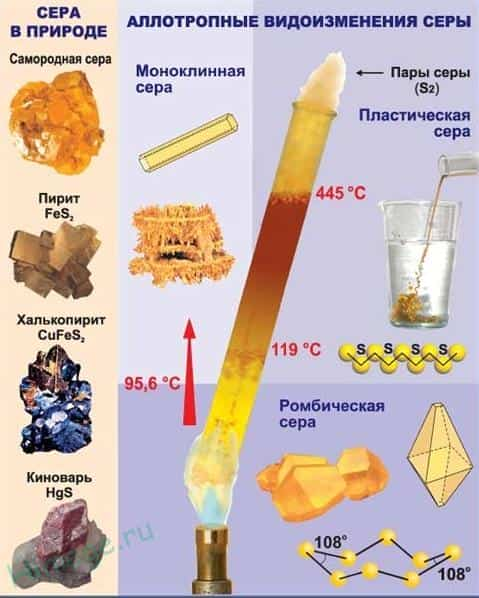
- Сера встречается в свободном (самородном) состоянии и связанном виде.
- Важнейшие природные соединения серы:
- FeS 2 — железный колчедан или пирит,
- ZnS — цинковая обманка или сфалерит (вюрцит),
- PbS — свинцовый блеск или галенит,
- HgS — киноварь,
- Sb 2 S 3 — антимонит.
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропные модификации серы
Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О 2 и О 3 , S 2 и S 8 , Р 2 и Р 4 и т.д).
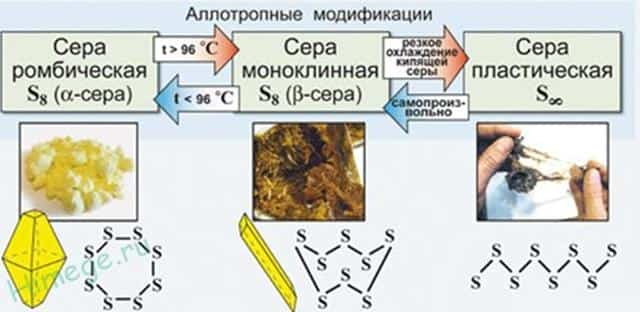
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S 8 , образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.
- Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
- 1) ромбическая — S 8
- t°пл. = 113°C; r = 2,07 г/см 3
- Наиболее устойчивая модификация.
- 2) моноклинная — темно-желтые иглы
- t°пл. = 119°C; r = 1,96 г/см 3
- Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
- 3) пластическая — коричневая резиноподобная (аморфная) масса
- Неустойчива, при затвердевании превращается в ромбическую
Получение серы
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
2H 2 S + O 2 → 2S + 2H 2 O
2H 2 S + SO 2 → 3S + 2H 2 O
Химические свойства серы
- Окислительные свойства серы ( S 0 + 2ē → S -2 )
- 1) Сера реагирует со щелочными металлами без нагревания:
- 2Na + S → Na 2 S
- c остальными металлами (кроме Au, Pt) — при повышенной t°:
- 2Al + 3S –→ Al 2 S 3
- Zn + S –→ ZnS
- 2) С некоторыми неметаллами сера образует бинарные соединения:
- H 2 + S → H 2 S
- 2P + 3S → P 2 S 3
- C + 2S → CS 2
- Восстановительные свойства сера проявляет в реакциях с сильными окислителями: ( S — 2ē → S +2 ; S — 4ē → S +4 ; S — 6ē → S +6 )
- 3) c кислородом:
- S + O 2 – t° → S +4 O 2
- 2S + 3O 2 – t °; pt → 2S +6 O 3
- 4) c галогенами (кроме йода):
- S + Cl 2 → S +2 Cl 2
- S + 3F 2 → SF 6
- Со сложными веществами:
- 5) c кислотами — окислителями:
- S + 2H 2 SO 4 (конц) → 3S +4 O 2 + 2H 2 O
- S + 6HNO 3 (конц) → H 2 S +6 O 4 + 6NO 2 + 2H 2 O
- Реакции диспропорционирования:
- 6) 3S 0 + 6KOH → K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O
- 7) сера растворяется в концентрированном растворе сульфита натрия:
- S 0 + Na 2 S +4 O 3 → Na 2 S 2 O 3 тиосульфат натрия
-
-

Сероводород H2S и сульфиды- химические свойства
Соединения серы +4: сернистый газ, сернистая кислота и её соли сульфиты.
Серная кислота – химические свойства и промышленное производство
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
Сера (S)
- Обозначение — S (Sulphur);
- Период — III;
- Группа — 16 (VIa);
- Атомная масса — 32,066;
- Атомный номер — 16;
- Радиус атома = 127 пм;
- Ковалентный радиус = 102 пм;
- Распределение электронов — 1s22s22p63s23p4;
- t плавления = 112,8°C;
- t кипения = 444,674°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,58/2,44;
- Степень окисления: +6; +4; +2; +1; 0; -1; -2;
- Плотность (н. у.) = 2,070 г/см3;
- Молярный объем = 15,5 см3/моль.
Соединения серы:
Точное время открытия человеком серы неизвестно — данное вещество было известно человеку еще с доисторических времен. Природная сера является светло-желтым порошкообразным веществом, массовая доля серы в земной коре составляет 0,03%.
В природе сера встречается, как в виде самородков, так и в виде разнообразных соединений: сульфидов (FeS2; FeCuS2) и сульфатов (BaSO4), входящих в состав разнообразных минералов (пирит, медный колчедан, гипс, барит). Также сера в виде соединений присутствует в природных углеводородах: нефте, газе, угле.
Сера является биогенным элементом — в организме человека массовая доля серы составляет 0,16%, сера входит в состав белков, аминокислот, гормонов.
Сера в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером «16», относится к 16(VIa) группе (см. Атомы 16(VIa) группы).
Атом серы содержит 16 электронов, при этом у серы, как и у атома кислорода, на внешнем энергетическом уровне находится 6 валентных электронов (см. Электронная структура атомов).
В отличие от кислорода, атом серы способен образовывать не только 2 (H2S) ковалентные связи, но и 4 (H2SO3) или 6 (H2SO4) (см. Ковалентная связь). Данное свойство объясняется наличием у атома серы свободного d-подуровня, на который могут переходить 1 или 2 электрона с s- или р-подуровня (см. Атомы 16(VIa) группы).
Сера, как простое вещество
Молекула S2 имеет строение, аналогичное O2.
В отличие от кислорода, сера может образовывать зигзазообразные цепи, но наиболее устойчивыми являются циклические молекулы серы, имеющие форму короны, в которую входят 8 атомов (S8) — α-сера. «Короны» с меньшим числом атомов менее устойчивы. Кроме этого, молекулы серы могут образовывать открытые цепи (S∞).
В ромбической модификации S8 — 8 атомов серы соединены между собой одинарными ковалентными связями — это твердые кристаллы желтого цвета, нерастворимые в воде, но хорошо растворяющиеся в органических растворителях, например, в сероуглероде.
Сера при высоких температурах может существовать в газообразном состоянии:
- S8
- S6 — 450°C
- S4 — 650°C
- S2 — 900°C
- S — 1500°C
Химические свойства серы
- Сера является типичным активным неметаллом.
- В воде сера практически не растворяется (даже не смачивается водой), а в органических растворителях сера растворяется хорошо.
- При взаимодействии с другими веществами сера может выступать, как в роли окислителя, так и в роли восстановителя, в зависимости от окислительно-восстановительных свойств веществ, с которыми сера вступает в реакцию:
- окислителем сера является в реакциях с простыми веществами-восстановителями, имеющими меньшую электроотрицательность, чем сера — это водород, металлы, некоторые неметаллы: S0+2e- → S-2
- восстановителем сера является в реакциях с кислородом, галогенами, кислотами-окислителями S0-2e- → S+2 S0-4e- → S+4 S0-6e- → S+6
Реакции, в которых сера является окислителем:
- с металлами сера реагирует при нагревании с образованием сульфидов: Fe0+S0 = Fe+2S-2 2Na0+S0 = Na2+1S-2
- с водородом: S0+H20 = H2+1S-2;
- с фосфором: 3S0+2P0 = P2+3S3-2
- с углеродом: C0+2S0 = C+4S2-2
Реакции, в которых сера является восстановителем:
- с кислородом: S0 + O20 = S+4O2-2
- с хлором: S0 + Cl20 = S+2Cl2-1
- с фтором: S0 + 3F20 = S+6F6-1
Взаимодействие серы со сложными веществами:
- реагирует, как восстановитель с кислотами-окислителями при нагревании: S0 + 2H2S+6O4 = 3S+4O2↑ + 2H2O S0 + 2HN+5O3 = H2S+6O4 + 2N+3O↑ S0 + 6HN+5O3 = H2S+6O4 + 6N+4O2↑ + 2H2O
- в реакциях диспропорционирования с растворами щелочей при нагревании сера выступает и окислителем, и восстановителем: 3S0 + 6NaOH = 2Na2S-2 + Na2S+4O3 + 3H2O
Аллотропные модификации серы
α-сера
Рис. Ромбическая α-сера.
α-сера:
- кристаллическое вещество желтого цвета;
- устойчиво при комнатной температуре;
- состоит из циклических молекул S8.
- температура плавления = 112,8°C;
- плотность = 2,06 г/см3.
β-сера
Рис. Моноклинная β-сера.
β-сера:
- темно-желтые кристаллы;
- устойчиво при температуре 95°C и выше;
- от альфа-серы отличается ориентацией кольцевых молекул в узлах кристаллической решетки;
- температура плавления = 119,3°C;
- плотность = 1,957 г/см3.
Пластическая сера
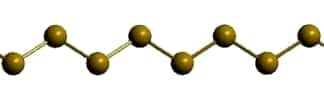 Рис. Пластическая сера.
Рис. Пластическая сера.
Пластическая сера:
- резиноподобное вещество темно-коричневого цвета;
- образуется при резком охлаждении расплавленной серы;
- состоит из открытых цепных полимерных молекул (S∞);
- плотность = 2,046 г/см3.
Получение и применение серы
Способы получения серы:
- промышленным способом получения серы является очищение самородной серы от примесей расплавлением перегретым водяным паром;
- окислением сероводорода кислородом: 2H2S + O2 = 2S + 2H2O;
- восстановлением оксида серы (IV) углеродом: SO2 + C = S + CO2;
- разложением пирита (FeS2): FeS2 = S + FeS;
- разложением сероводорода: H2S = H2 + S.
Применение серы:
- как ингредиент для получения серной кислоты;
- в качестве инсектицида;
- для вулканизации каучука;
- в производстве пороха, спичек, лекарственных препаратов, красителей.
2.3.2. Химические свойства кислорода и серы
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств.
Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию.
Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 oC и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах:
- PbS + 4O3 = PbSO4 + 4O2
- Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном:
- 2Ag + O3 = Ag2O + O2
- Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода:
- 2KI + O3 + H2O = I2↓ + O2 + 2KOH
Химические свойства серы
Сера как химический элемент может существовать в нескольких аллотропных модификациях. Различают ромбическую, моноклинную и пластическую серу.
Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения.
Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8. Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
- Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
- Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления:






