- Физические свойства оксидов
- Таблица 1: Температуры плавления и кипения некоторых оксидов (при давлении 101,3 кПа)
- Классификация оксидов по химическим свойствами
- Закономерности изменения свойств оксидов
- Классификация оксидов
- Большая Рнциклопедия Нефти Рё Газа
- ПОИСК
- 10. Химические свойства оксидов: основных, амфотерных, кислотных. — Проект "Получи максимальный балл на ОГЭ по химии"
Оксиды – это соединения, образованные атомами двух элементов, одним из которых является кислород в степени окисления (-2).
К оксидам относятся все соединения элементов с кислородом, например Fe2O3, P4O10, кроме содержащих атомы кислорода, связанные химической связью друг с другом:
- пероксиды (Na2O2);
- надпероксиды (KO2);
- озониды (KO2).

и соединения фтора с кислородом (OF2, O2F2), которые следует назвать не оксидами фтора, а фторидами кислорода, так как степень окисления кислорода в них положительная.
Физические свойства оксидов
Температуры плавления и кипения оксидов меняются в очень широком интервале. При комнатной температуре они, в зависимости от типа кристаллической решетки, могут находиться в различных агрегатных состояниях. Это определяется природой химической связи в оксидах, которая может быть ионной или ковалентной полярной.
В газообразном и жидком состояниях при комнатной температуре находятся оксиды, образующие молекулярные кристаллические решетки. С увеличением полярности молекул температуры плавления и кипения повышаются (таблица 1).
Таблица 1: Температуры плавления и кипения некоторых оксидов (при давлении 101,3 кПа)
| CO2 | CO | SO2 | ClO2 | SO2 | Cl2O7 | H2O | |
| Tплавления,⁰C | -78 (Tвозгонки) | -205 | -75,46 | -59 | -16,8 | -93,4 | |
| Tкипения, ⁰C | -191,5 | -10,1 | 9,7 | 44,8 | 87 | 100 |
Оксиды, образующие ионные кристаллические решетки, например, CaO, BaO и другие являются твердыми веществами, имеющими очень высокие температуры плавления (>1000⁰C)/
В некоторых оксидах связи ковалентные полярные. Они образуют кристаллические решетки, где атомы связаны несколькими «мостиковыми» атомами кислорода, образуя бесконечную трехмерную сеть, например, Al2O3, SiO2, TiO2, BeO и эти оксиды тоже имеют очень высокие температуры плавления.
Классификация оксидов по химическим свойствами
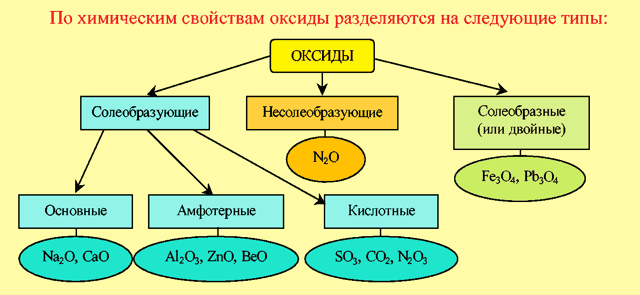
- Несолеобразующие оксиды – оксиды, которым не соответствуют ни кислоты, ни основания.
- Солеобразные оксиды – это двойные оксиды, в состав которых входят атомы одного металла в разных степенях окисления.
Металлы, проявляющие в соединениях несколько степеней окисления, образуют двойные, или солеобразные оксиды. Например, Pb3O4, Fe3O4, Mn3O4 (формулы этих оксидов могут быть записаны также в виде 2PO·PbO2, FeO·Fe2O3, MnO·Mn2O3 соответственно).
Например, Fe3O4→FeO·FeO3: представляет собой основной оксид FeO химически связанный с амфотерным оксидом Fe2O3, который в данном случае проявляет свойства кислотного оксида.
И Fe3O4 формально можно рассматривать как соль, образованную основанием Fe(OH)2 и кислотой [HFeO2], которая не существует в природе: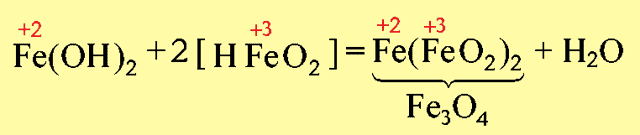
От гидрата оксида свинца (IV), как от кислоты, и Pb(OH2), как основания, могут быть получены два двойных оксида Pb2O3, Pb3O4(сурик), которые можно рассматривать как соли. Первый является свинцовой солью метасвинцовой кислоты (H2PbO3), а второй – ортосвинцовой кислоты (H4PbO4).
Среди оксидов, особенно среди оксидов d–элементов, много соединений переменного состава (бертолиды), содержание кислорода в которых не соответствует стехиометрическому составу, а изменяется в довольно широких пределах, например, состав оксида титана (II) TiO изменяется в пределах TiO0,65 – TiO1,25.
Солеобразующие оксиды – это оксиды, которые образуют соли. Оксиды этого типа делятся на три класса: основные, амфотерные и кислотные.
- Основные оксиды – оксиды, элемент которых при образовании соли или основания становится катионом.
- Кислотные оксиды – это оксиды, элемент которых при образовании соли или кислоты входит в состав аниона.
- Амфотерные оксиды – это оксиды, которые в зависимости от условий реакции могут проявлять как свойства кислотных, так и свойства основных оксидов.
- При образовании солей степени окисления элементов, образующих оксиды, не изменяются, например:
- Если при образовании соли происходит изменение степеней окисления элементов, образующих оксиды, то получившуюся соль следует отнести к соли другой кислоты или другого основания, например:
- Fe2(SO4)3 представляет собой соль, образованную серной кислотой и гидроксидом железа (III)- Fe(OH)3, которому соответствует оксид Fe2O3.
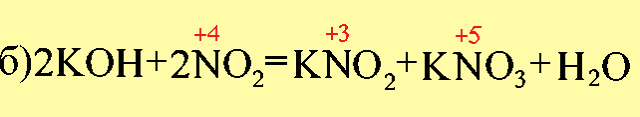
- Образовавшиеся соли являются солями азотистой (H+3NO2) и азотной (H+5NO3) кислот, которым соответствуют оксиды:
Закономерности изменения свойств оксидов
Увеличение степени окисления и уменьшение радиуса его иона (при этом происходит уменьшение эффективного отрицательного заряда на атоме кислорода –δ0) делают оксид более кислотным. Это и объясняет закономерное изменение свойств оксидов от основных к амфотерным и далее к кислотным.
А) В одном периоде при увеличении порядкового номера происходит усиление кислотных свойств оксидов и увеличение силы соответствующих им кислот.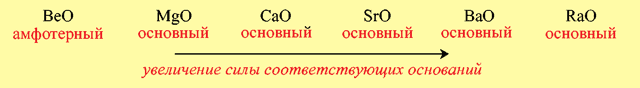
Таблица 2: Зависимость кислотно-основных свойств оксидов от эффективного заряда на атоме кислорода
| Оксид | Na2O | MgO | Al2O3 | SiO2 | P4O1023 | SO3 | Cl2O7 |
| Эффективный заряд δ0 | -0,81 | -0,42 | -0,31 | -0,23 | -0,13 | -0,06 | -0,01 |
| Кислотно- основные свойства оксида | Основный | Основный | Амфотерный | Кислотный |
- Б)В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов:
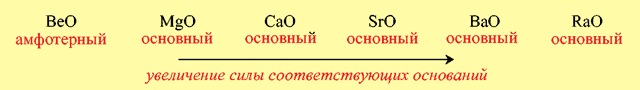
- В)При повышении степени окисления элемента усиливаются кислотные свойства оксидов и ослабевают основные:
- Таблица 3: Зависимость кислотно-основных свойств от степени окисления металлов
Список литературы: Общая и неорганическая химия, Ю. М. Коренев, В. П. Овчаренко, 2000г Ю. М. Коренев Источник: Общая и неорганическая химия, Ю. М. Коренев, В. П. Овчаренко, 2000г Дата в источнике: 2000 год
Классификация оксидов
- Тема: Основные классы соединений, их свойства и типичные реакции
- Урок: Оксиды
- 1. Классификация оксидов
Оксиды – это соединения, состоящие из двух элементов, одним их которых является кислород в степени окисления -2. Например, оксид кальция: Са+2О-2. Не стоит путать оксиды и пероксиды.
В состав пероксида входит кислород в степени окисления -1. Например, Н+12О-12, атомы кислорода связаны друг с другом.
Классификация оксидов
По строению оксиды могут быть ионными или ковалентными соединениями. К ионным соединениям относятся оксиды щелочных и щелочноземельных металлов. Остальные оксиды – это оксиды с ковалентной полярной связью. Такие оксиды в твердом состоянии могут иметь либо атомную (SiO2), либо ионную кристаллическую решетку (твердые СО2 или SO2).
По кислотно-основным свойствам оксиды делятся на:
Кислотным оксидам соответствуют кислоты. Основным оксидам соответствуют основания. Амфотерным – амфотерные соединения. Несолеобразующими называются те оксиды, которым не соответствуют ни кислота, ни основание.
— Основные оксиды
К основным оксидам относятся оксиды металлов главной подгруппы первой и второй групп и оксиды некоторых переходных металлов в низших степенях окисления. (Ag2O, HgO, NiO, Cu2O).
- — Кислотные оксиды
- Кислотные оксиды – это оксиды неметаллов (CO2, SO2, SiO2, SO3, P2O5) и некоторых переходных металлов в высоких степенях окисления (CrO3, Mn2O7, V2O5).
- — Амфотерные оксиды
- К амфотерным оксидам относятся оксиды некоторых металлов в степени окисления +2, +3, +4.
- Это: BeO, ZnO, Cr2O3, Al2O3, SnO, TiO2, MnO2 .
- — Несолеобразующие оксиды
- Несолеобразующие оксиды представлены в основном такими: CO, NO, N2O, H2O, F2O, SiO.
- 2. Физические свойства оксидов
Оксиды обладают физическими свойствами. Многие оксиды неметаллов при стандартных условиях газообразны CO2, SO2, SO3, оксиды азота. Есть жидкие оксиды. Это, например, Mn2O7, Сl2O7. Большинство оксидов металлов – твердые (Ag2O, HgO, NiO, Cu2O)

Рис. 1
Оксиды бывают бесцветными (CO2, SO2.) или имеют окраску, например, NO2- , бурый газ (лисий хвост). Рис. 1.
- 3. Химические свойства оксидов
- 1. Отношение к воде:
- С водой реагируют оксиды щелочных и щелочноземельных металлов. (Li2O, Na2O, K2O, Pb2O, Cs2O, CaO, SrO, BaO, RaO)
- Na2O + H2O →2 NaOH (1)
- CaO + H2O → Ca (OH) 2 (2)
- Оксиды, которым соответствуют нерастворимые основания, с водой не реагируют.
Кислотные оксиды реагируют с водой с образованием кислот. Исключение – SiO2.
- N2O5 + H2O → 2HNO3 (3)
- SO3 + H2O → H2SO4 (4)
- Амфотерные и несолеобразующие оксиды с водой не взаимодействуют.
2. Важным химическим свойством оксидов являются реакции, приводящие к образованию солей.
- В реакциях солеобразования участвуют вещества, обладающие противоположными кислотно-основными свойствами.
- Основные оксиды взаимодействуют с кислотами с образованием соли и воды.
- MnO +2 HCl → MnCl2 + H2O (5)
- Амфотерные оксиды реагируют как с кислотами с образованием соли и воды, так и со щелочами.
- ZnO +2 HCl → ZnCl2 + H2O (6)
- ZnO +2 KOH → K2ZnO2 + H2O (7)
Такая реакция (7) может протекать как в растворе, так и при сплавлении. При этом образуются различные продукты, в которых металл, образующий оксид, находится в ионной форме.
- Кислотные оксиды реагируют с основаниями, с образованием соли и воды.
- SO2 +2 KOH → K2SO3 + H2O (8)
- Основные и кислотные оксиды способны взаимодействовать между собой с образованием солей.
- MnO + SO2 → MnSO3 (9)
- 3CaO + P2O5 → Ca3(PO4)2 (10)
- 4. Получение оксидов
1. При горении простых веществ. Не реагируют благородные газы, галогены, золото и платина.
Li +O2 →Li2O (11)
4P + 5O2 →2P2O5 (12)
2. При горении сложных веществ.
CH4 + 2O2 → CO2 +2H2O (13)
2H2S + 3O2 → 2SO2 +2H2O (14)
3. Термическое разложение некоторых сложных веществ.
- Mg(OH) MgO + H2O
- H2SiO3 SiO2 + H2O
- (CuOH)2CO3 2CuO + CO2+ H2O
- 2Cu(NO3)2 CuO + 4 NO2+ H2O
- 5. Оксиды в природе
Оксиды – это довольно распространённый тип соединений. Примером такого соединения является вода, которая очень важна для жизни всех живых организмов, а также кварц и огромное количество его разновидностей. Рис. 2. Массовая доля кварца и его разновидностей в земной коре составляет 60%.
К оксидам относится углекислый газ, ржавчина и очень многие известные минералы.
Диоксид циркония – чрезвычайно стабильное соединение, поэтому его образование очень выгодно и приводит к выделению большого количества энергии. Из-за этого, если удается поджечь цирконий, его практически невозможно затушить, потому что он отбирает кислород даже у углекислого газа и песка. Затушить горящий цирконий можно только инертными газами.

Рис. 2
Большая Рнциклопедия Нефти Рё Газа
- Cтраница 1
- �онные оксиды являются основными. [1]
- При образовании ионных оксидов металлов необходимо также затратить энергию на испарение и ионизацию металла. [2]
Поэтому только нерастворимые в воде ионные оксиды инертны по отношению к ней. �онные оксиды представляют собой ангидриды оснований. [3]
Объясните, почему кислород образует многочисленные ионные оксиды, хотя присоединение двух электронов к атому кислорода требует затраты 711 кДж / моль теплоты. [4]
РћРєСЃРёРґС‹ EuO Рё YbO — полупроводники; РѕР±Р° — ионные РѕРєСЃРёРґС‹ двухвалентных металлов. [5]
| Три способа изображения молекулы Р4О 0. [6] |
Если одни структуры характерны только для связей определенного типа ( например, структура рутила для преимущественно ионных оксидов и фторидов АХ2), то другие простые структуры АтХ могут реализоваться при разных типах связи. [7]
Поэтому только нерастворимые в воде ионные оксиды инертны по отношению к ней. �онные оксиды представляют собой ангидриды оснований. [8]
Существуют и другие типы оксидов.
РќРѕ это РЅРµ кислотно-основная, Р° окислительно-восстановительная реакция, приводящая Рє РњРї2 Рё РЎР¬ — Есть РјРЅРѕРіРѕ ионных РѕРєСЃРёРґРѕРІ нестехиометрического состава, являющихся предметом изучения обширной области С…РёРјРёРё — С…РёРјРёРё смешанных РѕРєСЃРёРґРѕРІ металлов. Если элемент образует несколько РѕРєСЃРёРґРѕРІ, то самым кислым РёР· РЅРёС… является тот, РІ котором элемент находится РІ формально самой высокой степени окисления. Так, РЎРіРћ — РѕСЃРЅРѕРІРЅРѕР№ РѕРєСЃРёРґ; РЎРі2Рћ3 — амфотерный, Р° РЎРіРћ3 проявляет только свойства кислотного РѕРєСЃРёРґР°. [9]
К характеристическим соединениям относятся только оксиды, подчиняющиеся правилу формальной валентности, а анионоизбыточные и катионоизбыточные оксиды таковыми не являются.
В характеристических оксидах доминирующим типом связи является ионно-ковалентная, поэтому их можно подразделить на два типа: с преимущественно ионной и преимущественно ковалент-ной связью.
�онные оксиды всегда имеют координационную структуру.
�онно-ковалентное взаимодействие характерно и для анионо-избыточных кислородных соединений, однако они обладают особыми свойствами и обычно рассматриваются отдельно. [11]
Основные растворы получаются также в тех случаях, когда вещества реагирую. К наиболее распространенным из них относятся оксиды.
�онные оксиды металлов, в особенности Na2O и СаО, часто используются в промышленных условиях для получения сильных оснований.
[12]
Оксиды элементов, находящихся в левой части таблицы, являются сильными основаниями.
Для них характерно наличие большого отрицательного заряда на атомах кислорода, и по типу связи они принадлежат к ионным соединениям.
Температуры плавления этих ионных оксидов, как правило, достигают 2000 С, но многие из них разлагаются уже при более низких температурах. [13]
Рти элементы образуют смешанные РѕРєСЃРёРґС‹, СЃ РґСЂСѓРіРёРјРё металлами.
Синтетический рубин, голубой сапфир и белый сапфир ( драгоценный корунд) производятся в большом количестве.
Такие соединения, как NaA102, который можно получить при нагревании А12Оз с окса-латом натрия при 1000 С, также представляют собой смешанные ионные оксиды. [14]
Страницы: 1 2
ПОИСК
Все характеристические оксиды, как известно, относятся к оснбвным й кислотным. Первые являются оксидами металлов, вторые генетически связаны с неметаллами. Поскольку нет четкой границы между металлами и неметаллами, существует большая группа амфотерных оксидов.
Амфотерность определяется не только положением элемента в Периодической системе, но и зависит от его степени окисления. Ориентируясь на разность ОЭО, можно утверждать, что оксиды металлов должны быть преимущественно ионными, а оксиды неметаллов — преимущественно ковалентными.
Поскольку для одного и того же элемента с увеличением степени окисления его электроотрицательность растет, то в этом направлении — от низших к высшим оксидам — растет ковалентный вклад.
Вследствие этого наблюдается изменение свойств оксидов от основных к кислотным, например ОЭО (Сг2+) = 1,4, ОЭО (СгЗ ) = 1,6, ОЭО (Сгв ) = 2,4, и свойства оксидов закономерно изменяются [c.267]
Высокие анодные потенциалы необходимы для генерирования частиц радикального типа из молекул субстрата, растворителя и (или) соответствующих компонентов раствора (например, Р из НР или Р ).
Образование таких частиц и их дальнейшие превращения определяются не только собственно высоким значением потенциала электрода, но и структурой поверхностного слоя, включающего в себя оксиды, адсорбированные ионы и органические частицы (см. гл. 3).
Синтез продуктов радикальных превращений возможен и при реакции деструктивного окисления исходных органических веществ до воды, оксида углерода (IV), оксида углерода (И), формальдегида и т. п. [c.289] Связь в оксидах металлов подгруппы кальция преимущественно ионная. [c.263]
С другой стороны, многие гидриды, оксиды, карбиды и т. п. обладают металлическими свойствами и относятся к металлидам . Следовательно, в этом случае неметаллический компонент не выступает в роли анионообразователя, и приведенная номенклатура становится условной.
Фундаментальной характеристикой химического соединения, определяющей все его особенности — структуру, состав и свойства, является доминирующий тип химической связи. Только на этом основании можно осуществить систематику бинарных соединений.
По этому признаку все бинарные соединения следует подразделить на 3 типа преимущественно ионные (солеобразные), ковалентные и металлоподобные. Следует также различать координационные ковалентные и молекулярные ковалентные соединения.
А преимущественно ионные и металлические бинарные соединения могут быть только координационными в силу ненаправленного и ненасыщенного характера химических связей в них. [c.49]
Для оксидов металлов с преимущественной ионной связью (координационные решетки) нарушение стехиометрии термодинамически обосновано, так как при этом растет энтропия системы. Нестехио-метричные оксидные фазы могут быть как односторонними (FeO), так и двусторонними (TiO) . [c.315]
По характеру химической связи халькогениды (как и оксиды) подразделяются на ионные, ковалентные и металлические. Преимущественно ионным характером обладают лишь халькогениды наиболее активных металлов, подчиняющиеся правилу формальной валентности. Так, все халькогениды щелочных ме галлов и [c.274]
Он похож на оксиды щелочноземельных металлов он обладает основными свойствами, связь носит преимущественно ионный характер. [c.123]
Простые соли — соединения типичных металлических элементов с окислительными элементами (оксоидами). Связь между атомами в молекулах простых солей, находящихся в газовом состоянии, преимущественно ионная, по крайней мере для типичных случаев (т. е.
для соединений наиболее активных, например щелочных, металлов с активными оксоидами, например галогенами). Простые соли характеризуются кристаллическими решетками ионного типа, а в жидком состоянии — ионной электропроводностью.
Несомненно, что к классу простых солей должны быть отнесены оксиды и нитриды активных металлов, поскольку они характеризуются теми же типичными для солей признаками гидриды наиболее активных (например, щелочных) металлов также являются простыми солями, обладая всеми их признаками.
Характерной химической функцией простых солей является их способность бьта донорами положительно и отрицательно заряженных элементарных ионов, сочетаниями которых они являются. [c.51]
Структура неорганических веществ отличается большим многообразием в зависимости от природы и числа частиц, входящих в кристаллическую решетку. При этом частицы одного вида соединяются друг с другом посредством металлической связи (элементы левой части таблицы Д. И.
Менделеева), ковалентной связи с образованием полимерного каркаса (элементы середины таблицы), связи частично ионной и частично ковалентной (некоторые элементы П1, IV и V групп таблицы Д. И. Менделеева), ковалентной связи с образованием отдельных молекул и ван-дер-ваальсовых сил между этими молекулами.
При наличии в составе соединения частиц двух видов связь между ними может быть ионной или близкой к ней при значительной разности электроотрицательностей между элементами (фториды, хлориды, ряд оксидов) при малой разности электроотрицательностей — преимущественно ковалентной (SO2, СО т. д.
), а также связью, сочетающей признаки и ионной, и ковалентной (большинство оксидов, карбиды, нитриды, бо-риды, силициды). При наличии же в составе соединения трех и более элементов картина может быть еще более сложной.
Отдельные элементы за счет преимущественно ковалентной связи между ними могут образовать самостоятельные структурные группировки — радикалы типа SO42-, Si04 -, А104 и т. д., остальные же элементы вследствие передачи своих электронов этим радикалам могут связываться с ними посредством преимущественно ионной связи (Na+, Са2+, АР+ и т. д.).
Более того, могут возникать группировки в виде цепей, лент, слоев и даже каркасов, имеющих заряды, равномерно локализованные по фрагментам этих группировок, связанных друг с другом через катионы металлов. Б случае же незаряженных структурных единиц, например слоев у некоторых глинистых минералов, связь между слоями является ван-дер-ваальсо-вой, или водородной. [c.25]
В периодах с -элементов 1ПБ группы начинается заполнение электронами -орбиталей. Свойства элементов 1ПБ группы сущ -ственно отличаются от -элементов середин больших периодоз. В их оксидах и галогенидах связи преимущественно ионные склонность к комплексообразованию с неорганическими лигандами малохарактерна (основными типами являются ацидокомплексы [c.504]
Очевидно, что при таком подходе выявляются особенности химической связи в образующихся сложных соединениях. Чем резче бинарные соединения отличаются друг от друга по свойствам, тем более вероятно возникновение сильно полярного взаимодействия между структурными фрагментами сложного соединения.
Так, взаимодействие основных оксидов с кислотными приводит к образованию солей, основных оксидов с водой — к образованию оснований, а кислотных с водой — кислот.
Если же бинарные соединения, из которых можно образовать сложные, различаются по характеру пе сильно, то преимущественно ионное взаимодействие не реализуется ( uFeS2). [c.82]
Оксиды металлов. Характер химической связи в оксидах металлов тесно связан с их химическим и кристаллохимическим строением. Оксиды с преимущественной ионной связью (например, щелочных и щелочно-земельных металлов) характеризуются координационными структурами с координационным числом кислорода 6 или 8. С ростом степени окисления металлического элемента возрастает ковалентный вклад в химическую связь химическое строение таких оксидов — молекулярное. При этом координационное число металлического элемента возрастает, а координационное число кислорода, наоборот, уменьшается (например, СгОз, МпаО,, ReaO, и OSO4). Для таких оксидов нарушение стехиометрии невозможно. [c.314]
Систематизируя кис.лородные соединения элементов по доминирующему типу химической связи, можно выделить три основных типа соединений с металлической, преимущественно ионной и ковалентной связью. К характеристическим соединениям относятся только оксиды, подчиняющиеся правилу формальной валентности.
В характеристических оксидах доминирующим типом связи являет ся ионно-ковалентная, поэтому их можно подразделить на два типа с преимущественно ионной и преимущественно ковалентной связью. Последние, в свою очередь, по структурному признаку подразделяются на координационные и молекулярные (например, SiO . и СО2).
Ионные оксиды всегда имеют координационную структуру. Ионно-ковалентное взаимодействие характерно и для анионоизбыточных кислородных соединений, однако они обладают особыми свойствами и обычно рассматриваются отдельно. Такую же специфическую группу составляют и металлоподобные оксиды.
Принимая во внимание зависимость типа кристаллической структуры оксидов от характера химической связи, можно сделать вывод, что в немолекулярных структурах с ковалентной связью координационные числа не должны превышать 4, а в ионных кристаллических решетках реализуются более высокие координационные числа.
Так, в кубической структуре Si02 (/i -кристобалит) к.ч (Si) 4, а к.ч. (О) 2 (рис. 130), в структуре Т1О2 (рутил) к.ч. (Ti) [c.266]
Оксиды металлов. Оксиды с преимущественно ионной связью (например, щелочных и щелочно-земельных металлов) характеризуются координационными структурами с к.ч. (кислорода) 6 или 8. С ростом степени окисления металлического элемента возрастает ковалентный вклад в химическую связь.
Химическое строение таких оксидов молекулярное (например, СгОз, МП2О7, НсгО и OsO ). Для таких оксидов нарушение стехиометрии невозможно. Для оксидов металлов с преимущественно ионной связью (координационные решетки) нарушение стехиометрии термодинамически обосновано, так как при этом растет энтропия системы.
Нестехиометричные оксидные фазы могут быть как односторонними (FeO), так и двусторонними (TiO). [c.434]
Для строения галогенидов металлов справедливы два обобщающих положения.
Во-первых, фториды отличаются по структуре от других галогенидов данного металла, за исключением случаев молекулярных галогенидов (например, кристаллические ЗЬРз и 5ЬС1з имеют молекулярное строение) и галогенидов щелочных металлов, образующих кристаллы с преимущественно ионным типом связи.
Очень часто фторид металла имеет трехмерную каркасную структуру, тогда как хлорид, бромид и йодид образуют кристаллы, состоящие из слоев, а иногда и цепей. (Исключением из этого правила среди галогенидов МХз—МХб являются в основном фториды см. табл. 9.9). Во- зторых, многие фториды изоструктурны оксидам той же сте- [c.85]
Если одни структуры характерны только для связей определенного типа (например, структура рутила для преимущественно ионных оксидов и фторидов АХг), то другие простые структуры АтХ могут реализоваться при разных типах связи. Например, структура Na l оказывается выгодной не только [c.82]
Структуры комплексных ионных кристаллов. Термин комплексный ионный кристалл приложим к твердым фазам двух классов. В МдА1г04 или КМ Рз связи между всеми парами соседних атомов преимущественно ионного характера, так что такие кристаллы должны рассматриваться как трехмерные наборы ионов. Анионами являются О , Р» или реже 5 или С1 .
Структуры многих из этих комплексных ( смешанных ) оксидов или галогенидов родственны со структурами простых оксидов или галогенидов и выводятся из более простых структур А,, Х упорядоченным или статистическим замещением атомов А ионами различных металлов (см., например, табл. 13.1, разд. 13.
2), хотя известны также и структуры, характерные только для комплексных оксидов илп галогенидов. Они описаны в гл. 10 и 13.
Во второхм большом классе кристаллов можно различить прочно соединенные группы атомов, внутри которых в определенной степени реализуется обобщение электронов общий заряд группы распределяется по периферическим атомам, Такие комплексные ионы могут быть конечными либо бесконечно простирающимися в одном, двух или трех измерениях. [c.391]
В предыдущих разд. 3 и 4 простые модели химической связи— электростатическая для ионных соединений и ковалентная для молекулярных соединений — применялись для объяснения физических и химических свойств соединений. В этом разделе рассмотрена связь между структурой и свойствами твердых веществ, как ионных, так и ковалентных.
Кристаллические вещества с преимущественно ионными связями, например оксид магния, имеющий структуру Na l, и кристаллические вещества с чисто ковалентными связями, например алмаз с sp -гибридизацией каждого атома углерода (рис. 5.1), оказываются похожими по своим физическим свойствам.
Эти кристаллические вещества — плотные, механически прочные, не проводят электрический ток, имеют весьма высокие температуры плавления (для MgO 2852 °С, для алмаза 3550 °С) и нерастворимы в большинстве растворителей.
Заметное различие между твердыми веществами этих двух типов состоит в том, что ионные соединения могут растворяться в жидкостях с высокой диэлектрической проницаемостью, например в воде, а полученные растворы, как и расплавы ионных соединений, проводят электрический ток, что не присуще самим твердым веществам с ионной структурой. [c.132]
10. Химические свойства оксидов: основных, амфотерных, кислотных. — Проект "Получи максимальный балл на ОГЭ по химии"
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом
Названия оксидов строится таким образом: сначала произносят слово «оксид», а затем называют образующий его элемент. Если элемент имеет переменную валентность, то она указывается римской цифрой в круглых скобках в конце названия:NaI2O – оксид натрия; СаIIО – оксид кальция;SIVO2 – оксид серы (IV); SVIO3 – оксид серы (VI).
По химическим свойствам оксиды делятся на две группы:1. Несолеобразующие (безразличные) – не образуют солей, например: NO, CO, H2O;2.
Солеобразующие, которые, в свою очередь, подразделяются на:– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и II групп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO, MnO);– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3, Mn2O7);– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3, ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3, MnO2).Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами.
Основным оксидам соответствуют основания.
Например, оксиду кальция CaO отвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмия Cd(OH)2.
Химические свойства основных оксидов1. Основные оксиды взаимодействуют с водой с образованием оснований.
Условие протекания реакции: должны образовываться растворимые основания!Na2O + H2O → 2NaOHCaO + H2O → Ca(OH)2
Al2O3 + H2O → реакция не протекает, так как должен образовываться Al(OH)3, который нерастворим.2. Взаимодействие с кислотами с образованием соли и воды:CaO + H2SO4 → CaSO4 + H2O.3. Взаимодействие с кислотными оксидами с образованием соли:СaO + SiO2 → CaSiO3
4. Взаимодействие с амфотерными оксидами:СaO + Al2O3 → Сa(AlO2)2
Кислотные оксиды
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Им соответствуют кислоты.
Например, оксиду серы (IV) соответствует сернистая кислота H2SO3.
Химические свойства кислотных оксидов
1. Взаимодействие с водой с образованием кислоты:Условия протекания реакции: должна образовываться растворимая кислота.
P2O5 + 3H2O → 2H3PO42. Взаимодействие со щелочами с образованием соли и воды:
Условия протекания реакции: с кислотным оксидом взаимодействует именно щелочь, то есть растворимое основание.
SO3 + 2NaOH → Na2SO4 + H2O3. Взаимодействие с основными оксидами с образованием солей:SO3 + Na2O → Na2SO4
Амфотерные оксиды
Оксиды, гидратные соединения которых проявляют свойства как кислот, так и оснований, называются амфотерными.Например: оксид алюминия Al2O3, оксид марганца (IV) MnO2.
Химические свойства амфотерных оксидов
1. C водой не взаимодействуют2. Взаимодействие с кислотными оксидами с образованием солей при сплавлении (основные свойства):ZnO + SiO2 → ZnSiO33. Взаимодействие с кислотами с образованием соли и воды (основные свойства):ZnO + H2SO4 → ZnSO4 + H2O4. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды (кислотные свойства):Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]Al2O3 + 2NaOH → 2NaAlO2 + H2O
5. Взаимодействие с основными оксидами (кислотные свойства):Al2O3 + CaO → Ca(AlO2)2
Интернет-источники
http://www.vsuet.ru/school-y-chemist/methodical/oksidi.htm






