- p-Комплексы
- Синтез и применение
- Синтез
- Применение
- Катализ
- Полимеризация олефинов
- Гидрирование кратных связей
- Реакции оксида углерода
- Реакции окисления
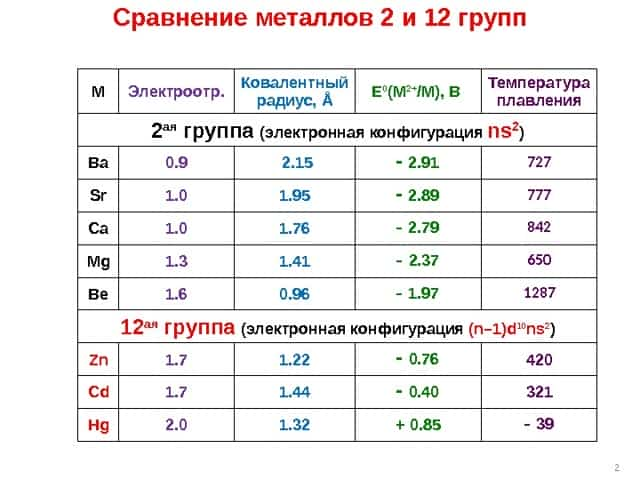
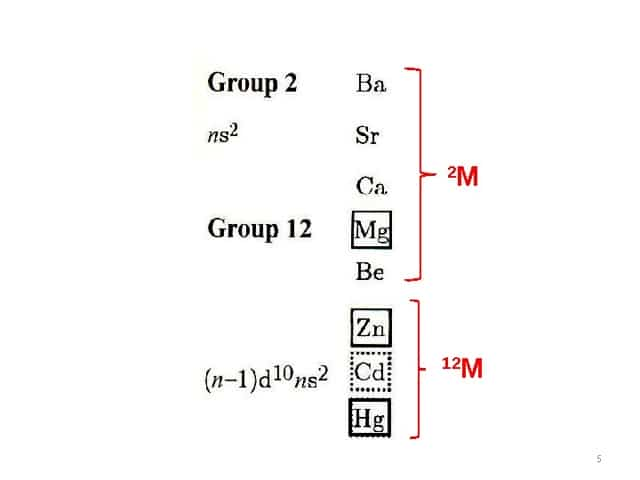
- 1 Металлоорганические соединения металлов 2 и 12 групп
- 12. ЭЛЕМЕНТООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- Металлоорггнические соединения
- МЕТАЛЛООРГАНИ́ЧЕСКИЕ СОЕДИНЕ́НИЯ
- Большая Рнциклопедия Нефти Рё Газа
Содержание статьи
Металлоорганические соединения, химические соединения, в которых углеродные атомы или органические группы связаны непосредственно с атомами металлов.
Металлоорганические соединения играют важную роль в химии, во-первых, поскольку удобны для синтеза других соединений, во-вторых, потому что структуры некоторых из них привели химиков к новым полезным концепциям химической связи и, в-третьих, благодаря тому, что участвуют как нестойкие промежуточные соединения (интермедиаты) в каталитических реакциях.
Первое металлоорганическое соединение, диэтилцинк (C2H5)2 Zn, выделено в 1847 английским химиком Э.Франклендом, который пытался удалить атом иода из этилиодида C2H5I посредством реакции с цинком. В действительности реакция протекала по уравнению
2C2H5I + 2Zn → (C2H5)2 Zn + ZnI2
и Франкленд получил бесцветную жидкость, диэтилцинк, которая самовоспламенялась при контакте с воздухом и бурно реагировала с водой.
(Большинство металлоорганических соединений чрезвычайно реакционноспособны и обычно возгораются на воздухе.) Примерно в то же время в Копенгагене датский химик В.
Цейзе также случайно получил соль K[PtCl3C2H4] (соль Цейзе), содержащую, как стало известно позднее, этилен, связанный с платиной.
Эти вещества являются представителями двух главных классов металлоорганических соединений: тех, у которых связи металла с углеродом (M–C) локализованы, и тех, где они делокализованы (в случае переходных металлов).
В соединениях первого класса, образуемых всеми металлами, органические группы объединены простыми связями, например, M–CH3 или M–C6H5.
Существуют также соединения типов M=CR2 и MєCR, с двойными и тройными металл-углеродными связями, – это карбеновые и карбиновые соединения соответственно.
Другой большой класс металлоорганических соединений – p-комплексы.
Их называют так потому, что в химическом связывании с d-орбиталями переходных металлов участвуют p-электроны и p-орбитали ненасыщенных органических соединений с C=C-, CєC-, C=N- и т.п. связями (см.
также ХИМИЯ ОРГАНИЧЕСКАЯ; МОЛЕКУЛ СТРОЕНИЕ). p-Комплексы включают все соединения, где органическая группа с кратными углерод-углеродными связями присоединена к переходному металлу.
p-Комплексы
У этилена связь направлена перпендикулярно оси связи C=C (а); циклические олефины могут быть связаны по схеме б; ароматические кольца – нейтральные, как в бензоле C6H6, или заряженные, как у циклопентадиенил-аниона C5H5–, — могут быть связаны по схеме в. Первое и наиболее известное из таких «сандвичевых» соединений — ферроцен (C5H5)2Fe — имеет структуру типа в. Ацетилены могут быть связаны с двумя атомами металлов по схеме г. Известны тысячи p-комплексов, многие из них — со сложными структурами.
Синтез и применение
Синтез
Металлоорганические соединения щелочных металлов и магния широко используются как реагенты в органическом синтезе. Их можно приготовить в виде эфирных растворов по реакциям типа (1) и (2):
Смешанные магнийорганические соединения типа RMgX, где X = Cl, Br или I, известны под названием «реактивы Гриньяра» по имени французского химика В.
Гриньяра, разработавшего условия их применения для органического синтеза (впервые их получил в 1899 Ф.Барбье – учитель Гриньяра).
Реактивы Гриньяра вступают в многочисленные реакции и могут быть использованы, в частности, для синтеза других металлоорганических соединений, например:
- и
- Литийорганические соединения типа RLi широко применяются в фармацевтической промышленности для получения разнообразных органических соединений. Примером может служить синтез P(CH3)3:
- Алюминийорганические соединения можно получить по реакции типа:
Применение
Относительно немногие металлоорганические соединения используются как таковые; это, в основном, — кремнийорганические соединения (см. также КРЕМНИЙОРГАНИЧЕСКИЕ ПОЛИМЕРЫ) и тетраэтилсвинец Pb(C2H5)4, применявшийся как антидетонатор для бензина (см. также НЕФТЬ И ГАЗ).
Оловоорганические соединения используются в красках, препятствующих биологическому обрастанию судов и подводных сооружений, и как катализаторы в производстве некоторых пластмасс. Ртутьорганические соединения применялись в сельском хозяйстве в качестве фунгицидов, но их использование запрещено во многих странах по экологическим соображениям, т.к.
ртутьорганические соединения превращаются микроорганизмами в водорастворимый и токсичный ион метилртути CH3Hg+ (послуживший причиной экологического бедствия в Минамате в Японии).
В природе важную роль играет витамин B12, кобальторганическое соединение, дефицит которого в организме приводит к анемии; его действие, по-видимому, заключается в переносе органических групп путем образования Co–C-связей (см. также ПЛАСТМАССЫ; ВИТАМИНЫ).
Катализ
В промышленности большое значение имеют каталитические реакции, в которых металлоорганические соединения возникают в виде нестойких интермедиатов.
Эти реакции могут протекать гомогенно в растворах или гетерогенно, с участием металлоорганических частиц на таких носителях, как оксид алюминия, силикагель или уголь (см. также КАТАЛИЗ).
Ниже приводятся примеры катализируемых металлами реакций, имеющих важное промышленное значение.
Полимеризация олефинов
Полимеризация этилена и пропилена протекает с участием каталитической смеси алкилалюминия и хлорида титана. Катализаторы этого типа называются катализаторами Циглера – Натта, так как процесс был разработан К.
Циглером (ФРГ) и Д.Натта (Италия), которые получили в 1963 Нобелевскую премию за эту работу. Бутадиен и сходные непредельные соединения могут быть заполимеризованы в каучук в присутствии алкиллития или алкилнатрия.
Соединения молибдена и вольфрама катализируют родственную реакцию, называемую реакцией метатезиса (диспропорционирования) олефинов:
Гидрирование кратных связей
Эта важная реакция может быть гетерогенной или гомогенной. Гомогенная реакция с катализатором Уилкинсона RhCl[P(C6H5)3]3 применяется в фармацевтической промышленности; используя оптически активные фосфиновые лиганды, можно осуществить экономичный асимметрический синтез таких лекарственных средств, как L-ДОФА (L-3,4-дигидроксифенилаланин).
Родственная реакция, называемая гидросилилированием, состоит в присоединении триалкилсилана к олефину:
Реакции оксида углерода
CO. Промышленный синтез на основе оксида углерода(II) проводят с участием кобальторганических или родийорганических промежуточных соединений, в которых ацильная группа связана с металлом, R–CO–M.
Реакция состоит в превращении M–R в M–COR путем «внедрения» оксида углерода по связи углерод – металл.
Соединение M–R в некоторых случаях можно получить по реакции гидрида металла с олефином, например:
- Важное место в промышленном синтезе занимают реакция гидроксиформилирования (оксо-синтез):
- продуктами которой являются альдегиды или спирты, и процесс Монсанто – превращение метанола в уксусную кислоту с участием иодида родия:
- В этих процессах металлоорганические соединения возникают на поверхности катализатора как интермедиаты.
Реакции окисления
- Многие реакции окисления органических соединений катализируются металлами, как, например, вакер-процесс – превращение этилена в ацетальдегид при помощи медно-палладиевого катализатора:
- Интермедиатом в этом процессе служит этиленовый p-комплекс, сходный с солью Цейзе.
1 Металлоорганические соединения металлов 2 и 12 групп





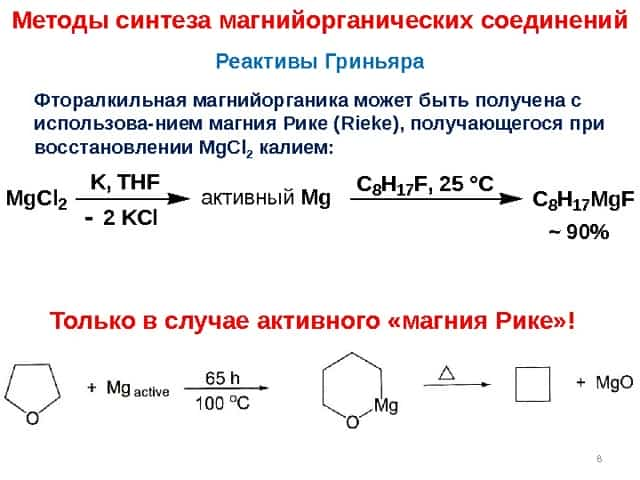

11 L = донорный растворитель, чаще всего – эфир Константа равновесия K = 0. 2 в случае Et. Mg. Br. Равновеси Шленка ( Schlenk )Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R
Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R 2 Сдвиг равновесия «диспропорционирования» за счет образования осадка: Можно, и даже лучше, использовать нециклические полиэфиры Me(OCH 2 ) n OMe
13 Mg. Et 2 – полимер, бесконечные цепи Строение магнийорганических соединений Бинарные магний органические соединения Mg. R 2 C оединения RMg. X При высоких концентрациях образуются олигомерные цепи :
14 Строение магнийорганических соединений Бинарные магний органические соединения Mg. R 2 Полимерные цепи могут быть «разбиты» такими лигандами как краун-эфиры с образованием структур ротаксанового типа Mg – O 2. 78 Å Mg – C 2. 10 Å
15 Реакции магнийорганических соединений Поведение реактивов Гриньяра RMg. X в растворе Растворы RMg. X в Et 2 O – слабо, но проводят ток! Электролиз растворов реактивов Гриньяра : Если радикалы достаточно долгоживущие, происходит их рекомбинация путем сдваивания:
16 Реакции магнийорганических соединений Использование реактивов Гриньяра RMg. X в органической химии
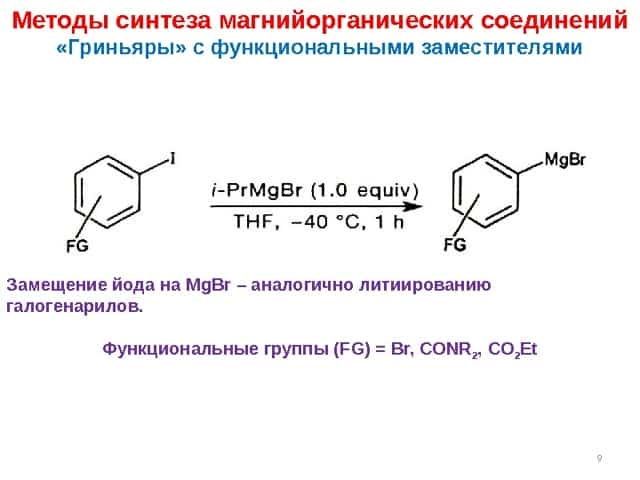
17 Реакции магнийорганических соединений Использование реактивов Гриньяра RMg. X для синтеза металлоорганических соединений RMg. X являются источниками R , как и литийорганические соедине-ния, но несколько менее реакционноспособны, поэтому легче управлять синтезом (CH 3 ) 3 Sb + RLi [(CH 3 ) 4 Sb]Li – “ate complexes”В случае RLi возможна дальнейшая реакция
19 Реакции магнийорганических соединений Бинарные магнийорганические соединения Mg. R 2 В основном: Mg. R 2 – источник R –. Химия подобна той, которую проявляют RMg. X Преимущество по сравнению с RMg. X : очень хорошая растворимость в углеводородах (алканы, ароматика). Недостаток: существенно сложнее синтезировать.
20 Реакции магнийорганических соединений Бинарные магнийорганические соединения Mg. R 2 Специфические реакции, невозможные для RMg. X : Синтез магнийорганических гидридов Частичный алкоголиз
21 Реакции магнийорганических соединений Бинарные магнийорганические соединения Mg. R 2 Синтез магниевых “ate complexes” Двухэлектронная трехцентровая связь как в [Ph. Li(TMEDA)] 2 в растворе в кристалле
22 Сэндвичи [Cp* 2 2 M] R 2 M + 2 Cp*H 2 RH + Cp* 2 M в углеводородах. Для Ca, Sr, Ba: Для Be и Mg:
23 Сэндвичи [Cp* 2 2 M] особенности строения
24 Как создать связь металл-металл?
M 0 M 0 M 0 M 0 M 0 M 0 M n+M n+ M n+ M n+Вариант 1: добавим избыток восстановителя , но не добавим лиганда M n+ + ne = M
M n+ M n+M n+ M n+Вариант 2: добавим избыток лиганда , но не добавим восстановителя M n+LL L L LM n+ L L LM n+LL L L L LM n+LLLL L LM n+LL L L LLM n + LLL M n+ + 6 L = [ML 6 ] n+
M n+ + (n-x)e = M x+ x n M n+M n+ M n+ M n+Вариант 3: добавим немного лиганда и и недостаток восстановителя. L LMx+ L LM x+L L L LMx+ LLM x+L L L L Кластер !!!!!! M x+ + 4 L = {ML 4 } x+ 3{ML 4 } x+ = [M 3 L 12 ] x+ M n+ L L LL LM n+
Вопросы, которые нужно решить при планировании синтеза кластера 1. Из чего исходить, чтобы получить нужные фрагменты? 2. Что есть «недостаток» восстановителя и «немного» лиганда? 3. Какие среду и условия нужно выбрать для проведения синтеза?
Возможна ли связь Mg–Mg ? ? Mg: 1 s 2 2 p 6 3 s 2 – электроны спарены, связь невозможна Mg 2+ : 1 s 2 2 p 6 3 s 0 – электронов нет, связь невозможна Mg 1+ : 1 s 2 2 p 6 3 s 1 – есть неспаренный электрон, связь возможна!!! Но как получить Mg 1+ ? ? ? 2 I-Mg-I + 2 K I- Mg – Mg — I + 2 KI K – e = K + Mg 2+ + e = Mg +
S. P. Green, C. Jones, A. Stasch , Science , 2007, 318 , p. 17542 KСинтез первого соединения со связью Mg–Mg 2 KI
Zn- органические соединения Методы синтеза
32 Методы синтеза R 2 Zn – [1 а ] , [ 2 ] , [4] [1 а ] [4][2] Zn. Cl 2 + 2 RLi R 2 Zn + Li. Cl Zn. Cl 2 + 2 RMg. X R 2 Zn + Mg. XCl 3 Zn(OAc) 2 + 2 R 3 Al 3 R 2 Zn + 2 Al(OAc) 3 Zn + R 2 Hg R 2 Zn + Hg. C 2 H 5 I + Zn(Cu) “C 2 H 5 Zn. I” + (C 2 H 5 ) 2 Zn + Zn. I
Синтез соединений RZn. X 33 Можно остановить на первой стадии!R 2 Zn + Zn. X 2 2 RZn. X 1 3 CH 2 N 2 + Zn. X 2 XCH 2 Zn. X + N 22 X = галоген Упрощенные формулы
34 Строение RZn. X в действительности: Олигомеры циклического или полициклического строения
Zn- органические соединения Строение
Zn Диэтилцинк жидкость d = 1. 205 г/см 3 Т (плавл. ) = – 28 °C Т (кипения) = 117 °CАлкильные соединения R 2 Zn мономерны! [(t-Bu) 2 Zn]
37 Комплексы [R 2 Zn(L) n ] [Et 2 Zn(TMEDA)]
38 Арильные соединения Ar 2 Zn и их производные Могут быть димерными и мономерными в зависимости от природы Ar Дифенилцинк твердое в-во Т (плавл. ) = 102– 106 °C Т (кипения) = 280– 285 °
39 Арильные соединения Ar 2 Zn и их производные [Ph 2 Zn(Py) 2 ] [Ph 2 Zn(18 -crown-6)]
402. 09 Å 1. 93 ÅСэндвичевые соединения [Cp * 2 Zn] = [( 5 -Cp*)( 1 -Cp*)Zn] Число валентных электронов: 5 e(Cp*) + 12 e(Zn) = 18 e 1. 51 Å1. 83 ÅH [Cp 2 Be] = [( 5 -Cp)( 1 -Cp)Be] Число валентных электронов: 5 e(Cp) + 1 e(Cp) + 2 e(Be) = 8 e
41 Полусэндвичевые соединения Аналогично для цинка , [Cp*Zn. Me] : [Cp. Be. Me] : 1. 71 Å 1. 50 Å 1. 93 Å
42 Декаметилдицинкоцен – первое соединение со связью Zn–Zn I. Resa, E. Carmona, E. Gutierrez-Puebla, A. Monge , Science , 2004, 305 , p. 1136 d(Zn–Zn) = 2. 30 Å, d(Zn– центр кольца ) = 2. 04 Å, Для сравнения: d(Zn– центр кольца ) = 1. 93 Å в [Cp* 2 Zn] и [Cp*Zn. CH 3 ]
Zn- органические соединения Реакции
44 Двухэлектронная трехцентровая связь. Реакция с гидридом цинка
45 «Мягкое» замещение галогенов В отличие от литий- и магнийорганики реакция протекает «чисто» , не приводит к смеси продуктов разной степени замещения
46 Реакция Реформатского превращение α -галоген-замещенных сложных эфиров в -гидроксо-замещенные сложные эфиры с наращиванием углеродной цепи Аналогия: RMg. X + R’ 2 C=O RR’ 2 C–OMg. X + H + RR’ 2 C–OHДля реакции может быть использован цинк Рике.
47 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений Метод Кнохеля ( Knochel ) Преимущества цинкорганических соединений: могут быть получены с очень большим набором функциональных групп! Соль [Cu. CN 2 Li. X] может быть использована в каталитических кол-вах. [Cu. CN 2 Li. X] , в отличие от Cu. CN , прилично растворяется в ТГФ. Строение FG R–Cu(CN)Zn. X 2 Li. X не установлено, но методика работает.
48 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений Метод Кнохеля ( Knochel ) Примеры:
49 Campbell, 1989 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений метод Кемпбелла Требуется катализатор – комплексы Pd, Ni, Ti ! Например, [ ( dppf ) Pd. Cl 2 ] : Fe PPh 2 Pd Cl Cl
50 Zn- органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет
51 Zn- органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет Маршрут реакции не включает в себя стадию образования карбена!
52( )-3 — экзо -диметиламиноизоборнеол Энантиоселективное алкилирование прохиральных карбонильных соединений ( Noyori , Нобелевская премия, 2001 )
53 Hg- органические соединения Синтез, строение и свойства
Hg Cl Hg. Hg 22 Cl. Cl 22 ( ( Каломель )) Вероятно , , первый синтетический кластер, известный с 12 12 гого века вв Индии d(Hg-Hg) = 2. 53 Å в Hg 2 Cl 2 d(Hg-Hg) = 3. 00 Å в Hg металл. Соединения ртути в степени окисления +
55 Металлоорганические соединения ртути в степени окисления +1 По сути, отсутстствуют! Соединение типа R–Hg–Hg–R надежно охарактеризовано только одно: R = Si(Si. Me 2 Si. Me 3 ) 3 (Apeloig, 1999)
562 Na + Hg + 2 CH 3 Br (CH 3 ) 2 Hg + 2 Na. Brсолнечный свет (история) [1 а ] [1 б ] Металлоорганические соединения ртути в степени окисления +2 [1 2 ] [ 4 ]
57 [ 7 ] [ 10 ] [ 11 ] [ электроалкилирование ]Металлоорганические соединения ртути в степени окисления +
58 Свойства связи Hg–C, общие свойства R 2 Hg и RHg. X Связь Hg–C практически неполярна. Соединения R 2 Hg и RHg. X абсолютно устойчивы к воде и кислороду воздуха. Легкость восстановления Hg ( II ) до Hg( 0 ) обеспечивает легкость трансметаллирования.
59( CH 3 ) 2 Hg CH 3 Hg + CH 3 D 1 (Hg – C) = 214 к. Дж/моль ( CH 3 ) Hg Hg + CH 3 D 2 (Hg – C) = 29 к. Дж/моль Применение: генерация свободных углеводородных радикалов Металлоорганические соединения ртути в степени окисления +
60 Свойства связи Hg–C, общие свойства R 2 Hg и RHg. X В R 2 Hg у ртути практически отсутствуют свойства кислоты Льюиса: известны комплексы с дополнительными лигандами только для R = сильный акцептор ( CF 3 , например) [(CF 3 ) 2 Hg(dppe)] (dppe = Ph 2 PCH 2 PPh 2 ) Координация лигандов к атому ртути в RHg. X приводит к «диспропорционированию» :
61 Строение R 2 Hg и RHg. X мономерны и линейны В попытке «изогнуть» R 2 Hg в 1978 г. Brown предпринял следующую реакцию: о-фениленртуть d(Hg–C) = 2. 10 Å d(Hg…Hg) = 3. 58 Å для сравнения: d(Hg–Hg) = 3. 02 Å в металлической Hg
62 Дициклопентадиенилртуть (не сэндвич!) Комплекс дициклопентадиенилртуть может быть получен в водном растворе.
63 Дициклопентадиенилртуть (не сэндвич!) В ИК-спектре дициклопентадиенилртути имеется полоса колебаний — связи Hg–C , но: ЯМР 1 H дициклопентадиенилртути при 25 о С содержит только один сигнал от протонов C 5 H 5. Объяснение: быстрая гаптотропная перегруппировка
64 Соединение декаметилдициклопентадиенилртуть не получено! Может быть получен только комплекс Cp*Hg. Cl
65 Карбонильные комплексы ртути ( Willner , 1996) «Неклассический карбонил» – связь Hg–C – одинарная, нет обратного — донирования!
66 Немного подробнее о меркурировании Электрофильное замещение H + на [Hg(OAc)] + кроме аренов могут реагировать алкины, нитроалканы, 1, 3 -дикетоны т. е. соединения с достаточной C–H кислотностью Катализ хлорной кислотой:
67 Сольвомеркурирование/демеркурирование HY = растворитель или компонент реакционной среды Y = OH , RO , Ac. O , R 2 N и т. п. Электрофильное присоединение по кратной связи (по правилу Марковникова) + последующее восстановление. Пример:
Hg- органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет Маршрут реакции включает в себя стадию образования карбена!
6969 Hg- органические карбеноиды Циклопропанирование Реакция протекает в мягких условиях, но есть «но» : • Нельзя использовать алкены (-ины) с группировками – COOH, –OH и –NR 2 • Промежуточный продукт Ph. Hg. CX 2 X’ не может быть использован “in situ” , он должен быть выделен
70 Hg в живых (пока еще) организмах Болезнь Минамата Массовое отравление произошло из-за слива в воду отходов, содержащих ртуть (1953 -1960 гг), компанией “Chisso”.
В рыбе в заливе Минамата содержание метилртути составляло от 8000 до 36 000 мкг/кг, в устрицах — до 85 000 мкг/кг, в то время как в воде её содержалось не более 680 мкг/л.
Основной отравляющий компонент – катион [CH 3 Hg] + Метилирование ртути происходит в биологических системах. Достаточно принять 0. 0003 г CH 3 Hg. X , чтобы проявились симптомы болезни Минамата.
71 Hg в живых (пока еще) организмах образование метилртути в биологических системах
72 Hg в живых (пока еще) организмах проникновение ртути в биологическую систему
73 Hg в живых (пока еще) организмах проникновение ртути в биологическую систему Аденин Меркурированный аденин Замещение всех атомов H! [CH 3 Hg] + вызывает изменения хромосом, мутации, генные болезни и т. д.
74 Hg в живых (пока еще) организмах Диметилртуть Hg(CH 3 ) 2 В 1997 году зафиксирован случай, когда после попадания нескольких капель Me 2 Hg на руки исследователя, он внезапно умер через 10 месяцев ! Me 2 Hg проникает сквозь латексные перчатки! При попадании Me 2 Hg на перчатки, до кожи она добирается в течение нескольких секунд! Если кто-то по соседству начнет заниматься ртутьорганикой, сообщите заранее, чтоб успеть уехать подальше!
12. ЭЛЕМЕНТООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Органические соединения, которые содержат в составе своей молекулы атом металла (Na, К, Li, Zn, Al, Mg, Sn, Hg, Pb и др.) или неметалла (Р, Si, As, В и др.), связанный непосредственно с атомом углерода, называются элементоорганическими соединениями:
Металлоорггнические соединения
Металлоорганические соединения могут быть двух типов:
1. Полные — у которых все валентности металла затрачены на соединение с атомами углерода:
Названия металлоорганических соединений Яроизводятся от названий углеводородных радикалов и металлов, входящих в состав их молекул:
Наиболее распространенным общим методом получения металлоорганических соединений является действие металлов на галоидные алкилы.
Этот метод пригоден для получения как полных, так и смешанных металлоорганических соединений.
Так, например, при действии цинка на ибдистый метил вначале образуется смешанное металлоорганическое соединение — иодистый метилцинк, который при нагревании превращается в диметилцинк:
Свойства. Полные металлоорганнческйе соединения представляют собой в большинстве случаев жидкости; смешанные — кристаллические вещества.
Металлорганические соединения отличаются очень большой реакционной способностью, которая объясняется слабой связью атома металла с углеродом. Благодаря большой реакционной способности, относительной простоте их получения и использования металлоорганнческйе соединения получили широкое применение в органическом синтезе.
Из очень большого числа металлоррганических соединений мы рассмотрим лишь соединения металлов второй группы периодической системы — цинка и магния, играющие наиболее важную роль для получения органических соединений различных классов.
Смешанные магнийорганические соединения быстро разлагаются под действием воды:
Обычно их получают, прибавляя галоидный алкил к стружкам магния, находящимся под слоем обезвоженного («абсолютного») эфира, который играет роль как растворителя, так и катализатора реакции. Через некоторое время после прибавления галоидного алкила начинается бурная реакция и образуется эфирный раствор смешанного магнийорганического соединения,
Для проведения дальнейших синтезов с помощью магнийорганических соединений последние обычно не выделяют в чистом виде, а применяют их эфирные растворы.
Синтезы с помощью магнийорганических соединений. 1. Получение предельных углеводородов из галоидных алкилов. Сначала действуют металлическим магнием на галоидный алкил, а затем разлагают образовавшееся магний-, органическое соединение водой:
2. Синтез спиртов. Первичные спирты получают при действии магнийорганических соединений на формальдегид:
- торичнйе спирты получают из любых других альдегидов, например:
- Третичные спирты получают из кетонов, например:
3. Синтез карбоновых кислот. Если через эфирный раствор магнийорганического соединения пропустить получится смешанная магниевая соль карбоновой и галоидоводородной кислот:
- При разложении этой соли водой образуется кароновая кислота: у
Из металлоорганических соединений других металлов особое место занимает тетраэтилсвинец — бесцветная, тяжелая жидкость (плотность с неприятным запахом, очень ядовитая.
Тетраэтилсвинец нерастворим в воде, хорошо растворим в органических растворителях. Горюч. Прибавляется в количестве 0,1-0,3% к бензину в качестве антидетонатора.
Получается взаимодействием хлористого этила со сплавом натрия и свинца:
Из элементоорганических соединений, содержащих неметаллические атомы, рассмотрим производные кремния, фосфора и мышьяка.
МЕТАЛЛООРГАНИ́ЧЕСКИЕ СОЕДИНЕ́НИЯ
Авторы: Д. А. Леменовский
МЕТАЛЛООРГАНИ́ЧЕСКИЕ СОЕДИНЕ́НИЯ, химические соединения, содержащие одну или неск. связей металл – углерод; наиболее многочисл. группа элементоорганических соединений. М. с. известны для большинства элементов-металлов. Присоединённые к металлу углеродсодержащие группы называют лигандами.
Гомолигандные комплексы, в которых атом металла связан с одинаковыми лигандами, составляют лишь малую часть известных М. с. В подавляющем большинстве М. с. с атомом металла связаны лиганды разной природы; это т. н. смешанно-лигандные производные. М. с. могут содержать неск.
атомов металла, связанных между собой непосредственно или через мостиковые лиганды (см., напр., в ст. Железоорганические соединения). Иногда к М. с. относят органич. производные металлов, в которых атом углерода отделён от металла к.-л. гетероатомом (напр., гетерокупраты; см. в ст.
Медьорганические соединения).
Первым из полученных М. с. был комплекс платины с органич. лигандами – соль Цейзе $ce{K[PtCl_3(C_2H_4)]}$, синтезированная дат. химиком В. Цейзе в 1827. В дальнейшем в истории М. с. известно неск.
качественно новых этапов, важнейшими из которых стали появление универсальных органич. реагентов – реактивов Гриньяра (см. в ст. Магнийорганические соединения) в нач. 20 в. и открытие ферроцена во 2-й пол. 20 в.
Практически неограниченные возможности в конструировании новых М. с. обусловлены огромным разнообразием известных органич. соединений. В природе М. с. встречаются очень редко; пример природных М. с.
– коферментные формы витамина B12 (см. Кобальторганические соединения).
Классификация М. с. включает в себя, помимо собственных, также классификационные признаки органических и координационных соединений. Осн. классами следует считать М. с. с $σ$-связью металл – углерод, карбонильные М. с.
, а также соединения с $π$-связью между металлом и лигандами – ненасыщенными органич. молекулами. Все остальные М. с. обычно рассматриваются как производные представителей одного из этих трёх классов или родственные им.
Органич. комплексы, содержащие $σ$-связи металл – углерод, наиболее характерны для непереходных металлов. В этих М. с. общее число присоединённых к металлу групп обычно хорошо соответствует типичным степеням окисления металла; напр.
, для $ce{Sn^{2+}}$ и $ce{Sn^{4+}}$ это $ce{R_2Sn}$ и $ce{R_4Sn}$, для $ce{Tl^+}$ и $ce{Tl^{3+} – RTl}$ и $ce{R_3Tl}$; $ce{R}$ – одинаковые или разные органические (по крайней мере одна) и неорганические группы. Связи металл – углерод в $σ$-органических соединениях обычно рассматриваются как двухэлектронные ковалентные. В М. с. др.
типов, прежде всего в М. с. переходных металлов, характер связи намного сложнее. В них, как правило, реализуются кратные связи металл – лиганд и многоцентровые связи. Так, напр., в комплексе бензолхромтрикарбонил связь металл – арен рассматривается как тройная и семицентровая, а связь металл – карбонил как тройная двухцентровая.
Исследование типов связей в М. с. сыграло большую роль в развитии представлений о природе химич. связи.
Полярность связей металл – лиганд для разл. М. с.
изменяется в широких пределах – от сильно полярной ионной (циклопентадиенид натрия $ce{CpNa}$) до слабо полярной ковалентной ($ce{R_2Hg, R_4Sn, Cp_2Fe}$), и соответственно различаются свойства таких соединений. Большинство М. с.
высоко реакционноспособные соединения, неустойчивы на воздухе, многие нестабильны при комнатной темп-ре, некоторые фоточувствительны. Для всех М. с., в т. ч. и для наиболее устойчивых, можно говорить только о кинетич. стабильности.
Типичными превращениями М. с. являются: реакции, затрагивающие только атом металла; реакции, затрагивающие только лиганды; реакции, затрагивающие связь металл – лиганд (в частности, реакции, приводящие к разрушению М. с.); комбиниров. превращения.
Разнообразие методов синтеза М. с. очень велико, однако можно выделить две большие группы этих методов: прямое металлирование, когда связь металл – углерод создаётся впервые, и переметаллирование – когда протекают обменные процессы и для синтеза одних М. с. используются другие М. с., полученные заранее.
Многие М. с. токсичны (см., напр., Ртутьорганические соединения, Свинецорганические соединения).
В осн. М. с. используют как стехиометрические реагенты в тонком органич. синтезе, а также как катализаторы важных пром. процессов. Чаще всего М. с. применяются в процессах, в ходе которых создаются новые связи углерод – углерод и углерод – элемент (см., напр.
, в статьях Алюминийорганические соединения, Литийорганические соединения, Цинкорганические соединения). Кроме того, некоторые М. с.
используются в качестве лекарственных препаратов, антиоксидантов, регуляторов процессов горения; оловоорганические соединения – в качестве бактерицидов, фунгицидов и пр. На основе М. с. создаются новые материалы (в т. ч.
анизотропные), использующиеся в высоких технологиях (напр., галлийорганические соединения и металлоцены применяют для получения полупроводниковых материалов).
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Органические соединения переходных металлов в последние 30 лет исследуются очень интенсивно, что обусловлено двумя важными причинами.
Во-первых, эти соединения являются реагентами, интермедиатами или катализаторами целого ряда практически интересных синтетических методов.
Р’ лабораторной практике органические соединения переходных металлов привлекают внимание прежде всего тем, что, как правило, реакции СЃ РёС… участием РІ качестве катализаторов обладают уникально высокой регио — Рё стереоселективностью. [1]
Органические соединения переходных металлов, за исключением органических соединений цинка, кадмия и ртути, неустойчивы, причем иногда их не удается выделить. [2]
Органические соединения переходных металлов, за исключением органических соединений цинка, кадмия и ртути, неустойчивы, причем иногда их не удаетгя выделить.
Подобные производные образуются, как уже отмечалось выше, например, при взаимодействии магнийорганических соединений с безводными хлоридами Fe, Co и Ni, обусловливающими гемолитическое разложение этих соединений. [3]
Многие органические соединения переходных металлов весьма широко применяются в органическом синтезе в качестве исходных соединений и катализаторов ряда важнейших реакций. Они являются источниками таких частиц, как гидрид-ион, карбашюны, кар-бокатионы, карбены и свободные радикалы. [4]
Среди органических соединений переходных металлов в настоящее время имеется необычайное разнообразие типов связи. [5]
Среди органических соединений переходных металлов соединения кобальта в некоторых отношениях занимают особое положение.
Первое, Рѕ чем уже упоминалось, — это СЏРІРЅРѕРµ нарушение правила конфигурации инертного газа РІ электронном комплекте его гексаметилбензольного комплекса.
Можно представить себе, однако, что это несоответствие является причиной его второй особенности, а именно каталитической способности в ацетиленовых конденсациях.
Рто его поведение отражено РІ табл. 8 — 4, РІ которой приведены результаты взаимодействия димезитилкобальта Рё бутина-2 РІ тетра-гидрофуране. [6]
Р’ принципе органические соединения переходных металлов СЃ Рѕ-СЃРІСЏР·СЊСЋ Рњ — РЎ образуются РІ обычных реакциях между галогенида-РјРё переходных металлов Рё активными металлорганическими соединениями РїСЂРё РЅРёР·РєРёС… температурах. [8]
Р’Рѕ-вторых, органические соединения переходных металлов часто имеют необычные структуры. Например, ферроцен ( Р±РёСЃ-циклопентадиенил — железо), открытый РІ 1951 Рі.
, по рентгено-структурным данным оказался сэндвичем, в котором атом железа находится между двумя параллельными циклопентадиенильными кольцами, образующими антипризму. [9]
Металл-углеродная связь органических соединений переходных металлов легко окисляется кислородом.
Моноалкильные или арильные соединения титана, ванадия Рё РґСЂСѓРіРёС… переходных металлов IV Рё V гругап РІ углеводородных растворах Рё РІ СЃРІРѕР±РѕРґРЅРѕРј состоянии поглощают полуэквямольные РїРѕ отношению Рє Me-РЎ — СЃРІСЏР·Рё количества кислорода. [10]
Особенно РЅРёР·РєРёРµ потенциалы ионизации имеют органические соединения переходных металлов, РІ которых, как правило ( РЅРѕ РЅРµ всегда), высшими занятыми орбиталями являются несвязывающие rf — СѓСЂРѕРІРёРё металла ( СЃРј. РіР». Р’ алкильных соединениях непереходных металлов высшими занятыми, как правило, являются связывающие СЃС‚-орбитали связей углерод-металл. Следовательно, метаплоорганические соединения обладают восстановительными свойствами, что хорошо нзвестио ( РіР». [11]
Неустойчивые промежуточные состояния, характерные для органических соединений переходных металлов, обеспечивают возможность использования их в разнообразных синтезах.
�менно высокая реакционная способность алкильной группы в координационной сфере переходного металла является необходимым условием каталитической активности.
Р’ СЃРІСЏР·Рё СЃ этим следует полагать, что РЅРµ стабилизация, Р° ослабление СЃРІСЏР·Рё переходный металл — углерод должно предшествовать различным актам химических превращений СЃ участием металлоорганических соединений переходных металлов. [12]
В настоящем разделе рассмотрены наиболее важные реакции органических соединений переходных металлов. [13]
Рта соль бьша первым синтезированным РІ лаборатории органическим соединением переходного металла. [14]
Монография включает РІ себя разделы, посвященные С…РёРјРёРё органических соединений переходных металлов ( металлалкилов, — комплексов), механизму Рё кинетике полимеризации олефинов РІ гетеро — Рё гомогенных системах, Р° также механизму полимеризации полярных винильных мономеров. Обращено внимание РЅР° полифункциональность рассматриваемых систем, проявляющуюся РІ способности инициировать как РёРѕРЅРЅСѓСЋ, так Рё свободнорадикальную полимеризацию, проводится анализ относительной роли действующих РїСЂРё этом факторов. [15]
Страницы: 1 2 3 4






