МЕХАНИЗМ АНОДНОГО РАСТВОРЕНИЯ МЕТАЛЛОВ В АКТИВНОМ СОСТОЯНИИ
[c.104]
Известны многочисленные экспериментальные данные, свидетельствующие о прямом участии анионов в процессе анодного растворения металлов в активном состоянии. Поэтому те уравнения, посредством которых описывается кинетика этого процесса, например формула
[c.104]
Рассматривая адсорбцию кислорода (или ОН-ионов) как причину пассивации металла, следует иметь а виду прямо противоположный эффект адсорбции анионов, приводящий к-увеличению скорости растворения металла в активном состоянии. Очевидно поэтому, что важным является вопрос о том, в каких случаях происходит торможение растворения (т. е.. пассивация) и в каких — активирование процесса ионизации. металла.
[c.120]
Это говорит о том, что скорость анодного процесса растворения металлов в активном состоянии (при постоянном потенциале) с повышением температуры возрастает.
[c.25]
Уравнение (1.4) описывает анодное растворение металлов в активном состоянии.
[c.15]
Закономерности растворения металлов в активном состоянии 93
[c.93]
Анодная реакция ионизации металлов. Основные стадии реакции. Закономерности растворения металлов в активном состоянии.
[c.118]
На коррозионную стойкость алюминия влияет кислород, растворенный в воде. В деаэрированной воде потенциал коррозии алюминия отвечает пассивному состоянию.
При увеличении концентрации кислорода в воде до 8—10 мг/л, что соответствует насыщению воды воздухом, потенциал коррозии алюминия увеличивается, но остается в пределах пассивной области, т. е. скорость коррозии не изменяется.
В аэрированных же растворах с большой концентрацией хлорид-ионов (0,01 моль/л и выше) значения потенциала коррозии алюминия находятся в пределах области активного растворения металла.
Очевидно, что увеличение концентрации кислорода должно привести к интенсификации катодных процессов, возрастанию потенциала коррозии алюминия и скорости анодного растворения металла в активном состоянии. Так, увеличение парциального давления кислорода с 0,1 до 2,3 МПа приводит к возрастанию скорости коррозии чистого металла (99,00%) в речной воде.
[c.55]
Наиболее наглядно кинетика анодного процесса может быть представлена зависимостью между плотностью анодного тока и потенциалом электрода, т. е. анодной поляризационной кривой. На рис.
26 приведена подобная обобщенная анодная поляризационная (потенциостатическая) кривая для идеального случая, когда скорость процесса саморастворения электрода невелика и внешний анодный ток может быть принят эквивалентным общей скорости растворения электрода.
На горизонтальной оси отложена плотность анодного тока, на вертикальной — потенциал электрода. Точка а соответствует равновесному значению потенциала металла в данных условиях.
Кривая Е ЛВС соответствует логарифмической (тафелевской) зависимости потенциала электрода от плотности тока при растворении металла в активном состоянии, например, по реакции
[c.42]
Анодное растворение металлов в активном состоянии протекает обычно с менее заметной поляризацией, и для этого процесса наклон поляризационной кривой мал, что можно видеть из результатов, полученных при растворении кадмия в серной кислоте и щелочи с различным значением pH [c.28]
Таким образом, исследуемые галоидные соли оказывают преимущественное влияние на растворение металла в активном состоянии, не облегчая, а наоборот, затрудняя при этом пассивирование.
[c.47]
| Рис. 45. Типичная потенциостатическая поляризационная диаграмма стали 1,2 — соответственно катодная и анодная поляризационные кривые — стационарный потенциал пас — потенциал пассивации — критический ток пассивации — скорость растворения металла в пассивном состоянии пер — потенциал перепассивации — потенциал начала пассивной области область активного растворения металла D — область пассивного состояния металла ВС — переходная область (от активного к пассивному состоянию) DE — область активного растворения, связанная с явлением перепассивации | 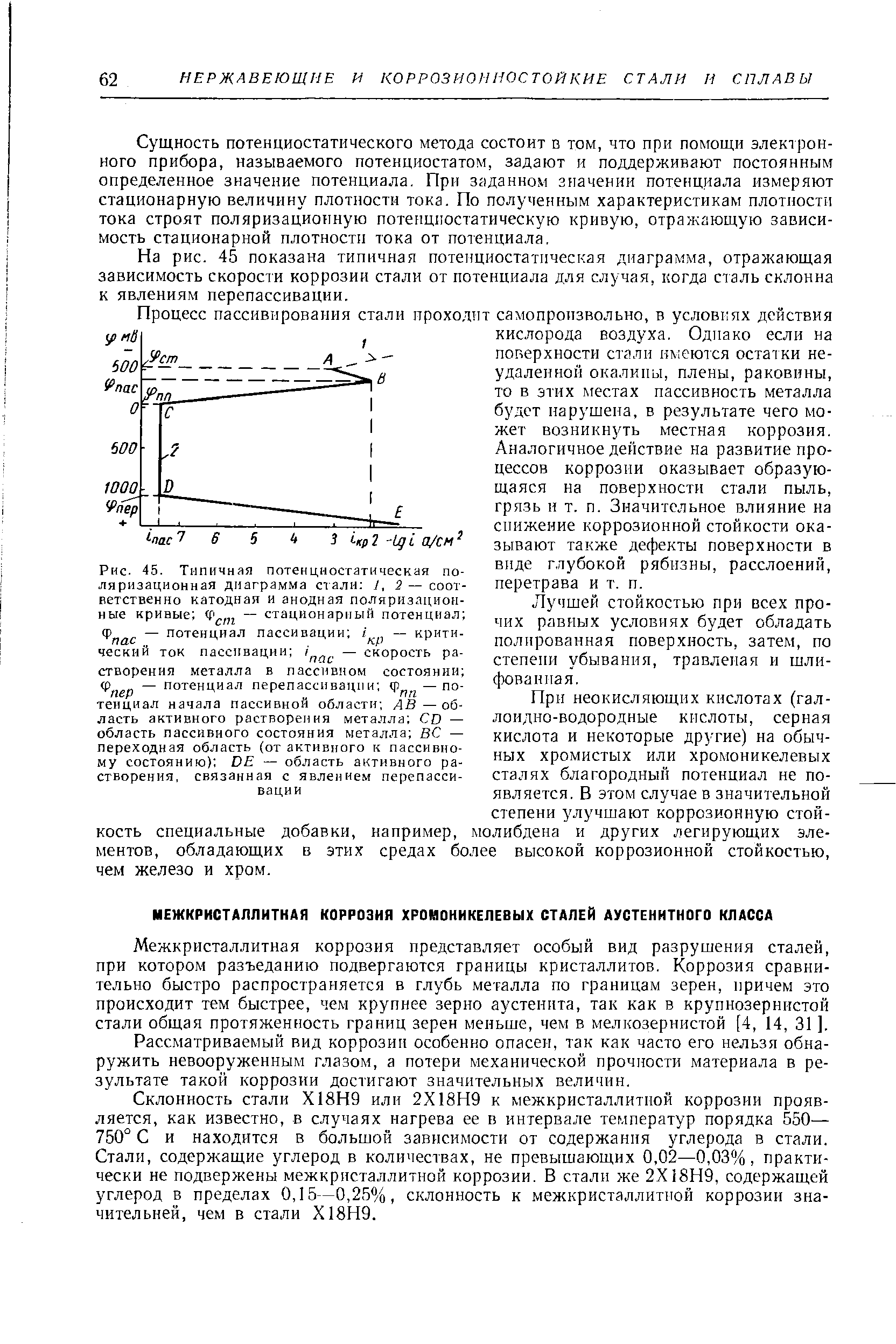 |
Если коррозионный процесс на основной поверхности изделия протекает с кислородной деполяризацией, то вследствие диффузионных затруднений доставки кислорода в места щелей и зазоров раствор в них будет обеднен кислородом. Это особенно важно для случая коррозии оборудования, находящегося в пассивном состоянии, например, для коррозии оборудования химической промышленности, изготовленного из нержавеющих сталей. Снижение скорости катодной реакции вследствие уменьшения концентрации кислорода в растворе может привести к переводу металла в активное состояние, то есть к резкому (на несколько порядков величины) возрастанию скорости его растворения.
[c.130]
Очень высокие чувствительность и селективность имеет атомно-абсорбционный спектральный метод анализа продуктов коррозии. Он с успехом используется для изучения скорости растворения металлов в активном и пассивном состоянии [1]. Большой интерес для этой цели представляют радиохимические методы [2].
[c.8]
Таким образом, для основного металла при его коррозии в обычных условиях (растворении в активном состоянии) катодные контакты могут быть опасными, а анодные — защитными.
[c.358]
При создании условий, когда плотность анодного тока на свежеобразованной поверхности близка к плотности, которая была после разрыва оксидной пленки (т.е.
металл находится в активном состоянии, и защитная пленка или не растет, или постоянно пробивается), происходит электрохимическое и химическое растворение активного металла.
На величину электродного потенциала и плотность анодного тока влияют химическая и структурная неоднородность металла и появление локаль-
[c.60]
Потенциометрический метод имеет преимущество перед гальвано-статическим, так как позволяет изучить зависимость скорости растворения от потенциала в широкой области, в том числе в области, соответствующей переходу металла из активного состояния в пассивное и наоборот. Гальваностатический метод этим свойством не обладает.
[c.139]
Сплавы, склонные к коррозии под напряжением, характеризуются по крайней мере двумя анодными кривыми — основным фоном металла и участком, на котором возникает надрез с пиком напряжения, имеющим наиболее высокую скорость растворения.
Такими участками могут быть структурные составляющие, границы зерен, блочных структур, кристаллографические плоскости и плоскости скольжения, дислокационные структуры.
Наиболее интенсивно коррозия под напряжением развивается, когда надрезы находятся в активном состоянии или в состоянии пробоя.
[c.39]
Поэтому относительное увеличение кажущейся плотности тока растворения деформируемого металла в пассивном состоянии (по сравнению с недеформированным) может существенно превосходить эту величину для состояния активного растворения.
[c.86]
Кривая (Ум )обр AB на рис. 216 соответствует логарифмической (тафелевской) зависимости V от г а при растворении металла в активном состоянии по уравнению (271).
Точка В соответствует 1/адс или Уме о,пп,2 нзчалу здсорбции кислорода или образованию защитной пленки, что приводит к дополнительной поляризации процесса и отклонению поляризационной кривой от простой логарифмической зависимости.
[c.315]
При потенциалах, близких к мак -еимуму тока на поверхноети металла начинается хемосорбция кислорода, который образуется из молекул воды или кислорода, находящегося в растворе.
Максимум тока ( кр) соответет-вует максимальному (критическому) току растворения металла в активном состоянии.
При высоких скоростях растворения металла концентрация образующихся катионов металла и анионов из раствора может превысить концентрацию насыщенного раствора соответствующей соли, и на поверхности металла образуется пленка соли, скорость растворения которой будет зависеть от диффузии ионов в глубь раствора. Однако в большинстве случаев при потенциалах, близких к Еа, на поверхности металла начинается хемо-сорбция кислорода из молекул воды, которая усиливается о ростом потенциала.
[c.26]
На силу тока в активном, пассивном и перепассивном состоянии металла оказывает влияние pH и температура.
Если молекулы воды участвуют в процессе растворения, то с ростом pH области основных состояний металла смещаются в сторону более отрицательных значений потенциала.
При этом перенапряжение анодного растворения металла в активном состоянии и состоянии перепассивации уменьшается. Скорость коррозии металла в пассивном состоянии в большинстве случаев уменьшается с ростом
[c.29]
В большинстве случаев с повышением температуры скорость коррозии металлов возрастает. Однако возможен и более сложный ход зависимости скорости коррозии от температуры [1,11]. Рассмотрим, как влияет температура на кинетику электроводных процессов.
При растворении металлов в активном состоянии с повышением температуры анодная поляризационная кривая, выражающая зависимость скорости растворения металла от его потенциала для меди, железа, никеля и ряда других металлов, смещается в сторону более отрицательных потенциалов [1,12].
[c.25]
На рис. 1-7 приведена подобная обобщенная анодная поляризационная (потендиостатическая) кривая для идеального случая, когда скорость процесса саморастворения электрода невелика и внешний анодный ток может быть принят эквивалентным общей скорости растворения электрода.
На горизонтальной оси отложена плотность анодного тока, на вертикальной — потендиал электрода. Точка а соответствует равновесному значению потендиала металла в данных условиях.
Кривая % ABD соответствует логарифмической зависимости потендиала электрода от плотности тока при растворении металла в активном состоянии, например, по реакции
[c.22]
Обычно перенапряжение ионизации металла при растворении металлов в активном состоянии имеет низкие значения. Торможение анодного процесса вследствие затруднения диффузии в растворе ионов металла, т. е. концентрационная поляризация, исходя из установленных в электрохимии закономерностей [14, 17, 18], соответствует величине 0,0591g С, для одновалентных ионов или 0,0291g С для двухвалентных ионов (/=25 °С), где С — концентрация (точнее, активность) собственных ионов металла в растворе непосредственно у поверхности металла. Поэтому торможение анодного процесса в большинстве случаев коррозии также относительно невелико. Более значительное торможение анодного процесса может наблюдаться вследствие наступления явления анодной пассивности металла, т. е. резкого торможения анодного процесса при достижении анодом определенного потенциала в результате образования на поверхности анода адсорбционных или фазовых пассивных пленок (обычно имеющих оксидный или гидро-ксидный характер). Механизм и современная теория пассивности рассмотрены в следующей главе.
[c.31]
Переход поверхности металла в активное состояние облегчается, если в растворе присутствуют некоторые анионы. К числу шльных активаторов в порядке их способности к депассивации относятся С1 > Вг > 3 .
Особенно часто в растворах встречается хлор-ион. Его активирующее действие проявляется как 3 кислотах, так и в нейтральных или щелочных растворах. Характерным является то, что в присутствии.
хлор-попа растворение металла часто идет не по всей поверхности, а толь1[c.61]
Установленная, в наших опытах деформационная мнкроэлект-рохимическая гетерогенность области пачки линий скольжения (рис.
74) указывает на ускорение анодного растворения пластически деформируемого металла в активном состоянии потенциал линий скольжения существенно отрицательнее потенциала остальной поверхности металла следовательно, механохимическая активность линий скольжения значительно выше активности взаимодействия с агрессивной средой ненарушенной поверхности металла.
[c.183]
К числу металлов с низкой электронной проводимостью окис лов принадлежат алюминий, титан, цирконий, тантал, известные своей способностью подвергаться оксидированию при высоких анодных потенциалах (см. 34).
Что касается растворения металла в пассивном состоянии, то оно существенно отличается от перехода в раствор ионов металла на активном участке поляризационной кривой. Это отличие прежде всего количественное.
При сохранении постоя,иного потенциала анодный ток в пассивной области обнаруживает тенденцию к постепенному и очень медленно идущему уменьшению, снижаясь до крайне низких значений порядка 10- °а/сл[c.118]
Рассматриваемые металлы при —0,5 в по скорости растворения располагаются в ряд Ni
Анодное растворение и пассивность металлов
Электрохимическое растворение металлов включает в себя две группы процессов : растворение за счет внешнего тока (анодное растворение) и в результате взаимодействия с компонентами среды (коррозия).
Анодное растворение металла с переходом его в раствор в виде простых гидратированных (или в виде комплексных) ионов во многом представляет собой обращение процесса катодного выделения металлов.
Анодный процесс начинается с разрушения кристаллической решётки и заканчивается образованием ионов металла в растворе; вместо стадий формирования кристаллической решётки появляются стадии её разрушения, вместо разряда ионов — ионизация атомов металла и т. д.
Общую реакцию анодного растворения металла, если образуются простые гидратированные ионы, можно записать в виде уравнения :
[М] + х Н2О = Мn+ × х Н2О + ne-
Металлы растворяются анодно обычно при потенциалах более положительных, чем соответствующие равновесные потенциалы, т. е. их растворение сопровождается анодной поляризацией. Её значение можно определить из уравнения :
Djа = ji — jp
Появление анодной поляризации можно связать с замедленностью одной из стадий : транспортировки, разрушения твёрдой фазы или ионизации. При катодном выделении металлов замедленность транспортировки, т. е. недостаточная начальная скорость доставки разряжающихся ионов к электроду, смещает его потенциал в отрицательную сторону.
При анодном растворении металла замедленность стадии отвода приводит к накоплению перешедших в раствор ионов вблизи электрода и, соответственно, смещает его потенциал в положительную сторону. Аналогичная картина должна наблюдаться и при замедленном протекании других стадий.
В связи с этим при не слишком больших удалениях от состояния равновесия обнаруживается некоторая симметрия в протекании процессов катодного выделения металлов и их анодного растворения.
Поведение металлов в процессе анодного растворения исследовано не так полно, как при их катодном осаждении. Всё же полученные опытные данные подтверждают применимость основных положений теории электрохимического перенапряжения к металлам группы железа. Так, кинетика анодного растворения железа и никеля описывается формулой Тафеля :
- ha = a + b lg ia.
- Помимо стадий переноса электрона суммарная реакция анодного растворения металлов группы железа включает чисто химические стадии, протекающие с участием анионов, прежде всего ионов гидроксила, каталитически ускоряющих анодный процесс. Растворение железа в концентрированных растворах серной кислоты можно описать, например, следующей схемой :
- Fe + OH- = FeOHадс + e-
- FeOHадс = FeOH+адс + e-
- FeOH+адс + n H2O = Fe2+ × n H2O + OH-
где вторая стадия определяет скорость всего процесса. В настоящее время имеется много данных, указывающих на участие ионов OH- в процессе анодного растворения и других металлов. Кинетика анодного растворения металлов зависит не только от концентрации гидроксильных ионов, но и вообще от анионного состава раствора.
Металл, растворяющийся под действием анодной поляризации, может при изменении условий потерять эту способность и превратиться в нерастворимый анод. Такое превращение растворимого анода в нерастворимый представляет собой частный случай пассивности металлов. Явление пассивности металлов было открыто М.В.Ломоносовым (1738).
Перевод металла в пассивное состояние достигается не только при действии соответствующих окислителей (например, пассивация железа концентрированной азотной кислотой), но и др. способами, в частности, анодной поляризацией. Наиболее отчетливо это явление обнаруживается на потенциостатических кривых потенциал анода — плотность тока (типичная потенциостатическая кривая — см. рис.).
В области потенциалов, не очень удалённых от равновесного или стационарного потенциала металла в данных условиях, при смещении его в положительную сторону наблюдается увеличение скорости растворения металла в виде обычных для него ионов. Эта область потенциалов отвечает активному состоянию металла, когда он ведёт себя как растворимый анод.
При достижении некоторого значения потенциала (более положительного, чем исходная величина) плотность тока резко падает, что указывает на внезапное замедление процесса растворения. В довольно широких пределах потенциалов плотность тока , а следовательно, и скорость растворения почти не изменяются, оставаясь очень малыми.
Эта область потенциалов отвечает пассивному состоянию. Участок потенциостатической поляризационной кривой, соединяющей область активного состояния с областью пассивности, называется переходной областью.
Дальнейшее смещение потенциала в положительную сторону может привести к новому подъёму плотности тока и к увеличению скорости растворения. Эта зона потенциалов называется областью перепассивации или транспассивности.
Для неё характерно растворение металла в виде ионов более высокой валентности, чем при его растворении в активном состоянии. Таким образом, при изменении потенциала в сторону более положительных значений металл последовательно проходит через активное, переходное (или предпассивное), пассивное и транспассивное состояния.
Смещая потенциал от положительных значений к отрицательным, можно заставить металл пройти через те же состояния, но в обратном порядке. Для характеристики потенциостатической кривой наиболее важны точки перехода из одного состояния в другое.
Потенциал jп,при котором начинается переход металла из активного состояния в пассивное, называется потенциалом начала пассивации или потенциалом пассивации. При потенциале jакт металл уже пассивен.
Однако даже его незначительное отклонение в отрицательную сторону нарушает пассивное состояние, и металл начинает активироваться.
Потенциал jактназывают обычно потенциалом активации или Фладе-потенциалом (по имени немецкого учёного, обнаружившего его существование), причём последний термин часто употребляют и для потенциала пассивации jп .
Следующим характеристическим потенциалом является потенциал депассивации jдп, при котором металл из области пассивного состояния вступает в область транспассивности. Для каждой из областей потенциостатической кривой, разграниченных критическими точками, характерен свой закон измененияскорости растворения (изменения анодной плотности тока) с потенциалом. Область активного состояния отличается тем, что смещение потенциала в положительную сторону вызывает увеличение скорости растворения, т. е. наклон прямой di/dj > 0. В переходном состоянии скорость растворения уменьшается с ростом потенциала и di/dj < 0. В пассивном состоянии скорость растворения практически не зависит от потенциала и di/dj » 0. В транспассивном состоянии, так же как и в активном, di/dj > 0, но наклон оказывается обычно иным.
Область перепассивации (переход металла в новое активное состояние) наблюдается не всегда.
Тем не менее и в этих случаях после достижения некоторого значения потенциала обнаруживается подъем плотности тока, однако здесь он отвечает не возобновлению растворения металла, а началу выделения кислорода.
Известны также случаи, когда после перепассивации наступает вторая область пассивности, которая может затем смениться новым подъемом тока, связанным с растворением металла (в виде других ионов) или с выделением кислорода.
Детальное разграничение областей, отвечающих различным состояниям металла, сделалось возможным благодаря применению потенциостатического метода снятия поляризационных кривых.
Пока пользовались обычным гальваностатическим методом, удавалось обнаружить только внезапные изменения потенциала, которые при прямом (от малых плотностей тока к большим) и обратном (от больших плотностей тока к малым) снятии поляризационных кривых наступали не при одних и тех же плотностях тока, что указывало на существование каких-то гистерезисных явлений.
Основные закономерности перехода металла в разные состояния были исследованы многими авторами; следует указать на работы Г.А.Акимова, В.П.Батракова, Я.М.Колотыркина, Н.Д.Томашева, Пражека, Бонгофера, Франка, Штерна, Эделану, Окамото и др.
Явление перепассивации металлов было впервые количественно обосновано Батраковым (1953) и Томашевым (1954).
Колотыркин (1958) впервые снял полную потенциостатическую кривую и экспериментально доказал, что все переходы металла из одного состояния в другое можно получить как его поляризацией, так и введением в раствор различных окислителей, обеспечивающих создание соответствующих потенциалов. Он сделал весьма важный для теории пассивности вывод о том, что решающим фактором в установлении того или иного состояния металла является не природа окисляющего агента, а потенциал металла.
Для объяснения явления пассивности были предложены две теории — пленочная и адсорбционная.
В пленочной, или фильмовой теории пассивности (Кистяковский) предполагается, что переход металла из активного состояния в пассивное вызван образованием на его поверхности тонкого, обычно оксидного, слоя, отделяющего металл от окружающей среды и препятствующего его растворению.
Образующийся оксидный слой имеет толщину в несколько молекулярных слоев, и его можно рассматривать как фазовый оксид. Чем совершеннее структура оксидного слоя, чем меньше в нем разрывов и дефектов, тем полнее пассивация и тем меньше скорость растворения металла в пассивном состоянии.
Кистяковский, Изгарышев, Акимов экспериментально доказали существование поверхностных пленок фазового характера. Эвансу (1930) удалось, подбирая специальные растворы, отделить пленку от металла и сделать ее видимой.
Перепассивация по пленочной теории объясняется изменением состава и структуры поверхностного оксида в результате образования ионов более высокой валентности, что может привести к нарушению сплошности пленки. Защитное действие пленки при этом уменьшается, и снова становится возможным растворение металла, но уже при более положительных потенциалах и в виде ионов с большей валентностью.
Согласно адсорбционной теории наступление пассивного состояния не обязательно связано с образованием полимолекулярной оксидной пленки.
Оно может быть также достигнуто за счет торможения процесса растворения, вызванного адсорбированными атомами кислорода.
Адсорбированные атомы кислорода пассивируют металл, или создавая на его поверхности сплошной мономолекулярный слой, или блокируя наиболее активные участки поверхности, или изменяя величину скачка потенциала на границе металл — раствор.
Независимо от того, какую из этих теорий считать более справедливой, пассивное состояние должно быть связано с уменьшением скорости анодной реакции. Поэтому предложено определять пассивность как состояние повышенной устойчивости металла (сплава), обусловленное торможением анодного процесса (Н.Д.Томашев).
Следует упомянуть о питтинге и о потенциале питтингообразования jпит.
При потенциале jпит наблюдается резкий подъем тока, обусловленный крайне локализованным процессом растворения, при котором практически вся поверхность металла остается пассивной, а переход его ионов в раствор происходит при очень высоких плотностях тока в отдельных точках — питтингах (от англ. pit — булавочный укол). Обычно появление питтинга происходит в растворах, содержащих ионы хлора.
ПОИСК
Закономерности типичного процесса ЭХП металлов можно проследить на классическом примере полирования меди в фосфорной кислоте. На рис. 12.1. приведена анодная поляризационная кривая, характеризующая этот пример.
На участке АБ поляризационной кривой ( активное растворение металла) в результате проявления энергетических неоднородностей различных граней поликристаллического металла происходит травление поверхности анода, поверхность после обработки шероховатая.
Прн анодном растворении металлов и сплавов в активном состоянии проявляется неоднородность структуры, фазового состава, различие в скорости растворения компонентов сплава. [c.
76] В ряде работ установлено уменьшение скорости активного растворения металлов с увеличением плотности упаковки атомов в кристаллографической плоскости, в результате чего снижается поверхностная энергия и повышается энергия активации ионизации металла. Плотность упаковки атомов может также влиять на [c.
326]
Кривая (Кме)обр ЛВС соответствует активному растворению металла, не осложненному побочными явлениями. В точке В возможна адсорбция кислорода на поверхности металла, что приводит к затормаживанию анодной реакции в местах осаждения кислорода.
С изменением потенциала от точки В к точке О происходит наряду с растворением формирование защитной пленки адсорбционного или оксидного типа на металлах, способных пассивироваться в данном растворе. При достижении потенциала Ук.и при токе пассивации ( скорость реакции анодного растворения резко уменьшается, достигая миниму.ча в точке Е при потенциале полной пассивации Ув.п- Металл перешел в пассивное состояние. Скорость процесса не зависит от потенциала в довольно широком диапазоне, определяясь скоростью процесса химического растворения пленки в электролите. [c.22]
Характерными точками потенциостатической кривой являются потенциал пассивации ф , Фладе-потенциал и потенциал депассивации фд (рис. 191). При отклонении от Фладе-потенциала в катодную сторону начинается активное растворение металла. [c.381]
Максимальная плотность тока, при которой начинается пассивирование, может быть повышена введением в раствор активаторов анодного растворения, например ионов С1″, которые хорошо адсорбируются металлом и вытесняют кислород. Поэтому применение растворов, содержащих ионы СГ, позволяет повысить скорость активного растворения металла. [c.372]
При фазовых превращениях одна фаза может перейти в другую или вследствие возникновения зародышей новой фазы, или, если процессы связаны с растворением металла, — путем образования пустотных зародышей. Пустотные зародыши образуются в центрах активного растворения металлов, в местах нарушения кристаллической решетки. [c.242]
Исходя из предпосылки, что процесс электрокристаллизации является частным случаем фазовых превращений при образовании кристаллического зародыша внутри газообразной фазы или расплава, Фольмер делает вывод, что перенапряжение здесь играет такую же роль, как пересыщение при кристаллизации из раствора или температурный градиент при кристаллизации из расплава. При фазовых превращениях одна фаза может перейти в другую или вследствие возникновения зародышей новой фазы или, если процессы связаны с растворением металла, — путем образования пустотных зародышей. Пустотные зародыши образуются в центрах активного растворения металлов, в местах нарушения кристаллической решетки. [c.357]
Зависимость плотности тока от потенциала при пассивации различных металлов приведена на рис. 4.7. Эта зависимость имеет одинаковый характер. Участки I во всех случаях соответствуют активному растворению металлов, например, по реакции [c.368]
На коррозионную стойкость алюминия влияет кислород, растворенный в воде. В деаэрированной воде потенциал коррозии алюминия отвечает пассивному состоянию.
При увеличении концентрации кислорода в воде до 8—10 мг/л, что соответствует насыщению воды воздухом, потенциал коррозии алюминия увеличивается, но остается в пределах пассивной области, т. е. скорость коррозии не изменяется.
В аэрированных же растворах с большой концентрацией хлорид-ионов (0,01 моль/л и выше) значения потенциала коррозии алюминия находятся в пределах области активного растворения металла.
Очевидно, что увеличение концентрации кислорода должно привести к интенсификации катодных процессов, возрастанию потенциала коррозии алюминия и скорости анодного растворения металла в активном состоянии. Так, увеличение парциального давления кислорода с 0,1 до 2,3 МПа приводит к возрастанию скорости коррозии чистого металла (99,00%) в речной воде. [c.55]
Кривая 1 на рис. 17, а отвечает тому случаю, когда металл в отсутствие внешней поляризации находится в равновесии с собственными ионами (идеализированная анодная кривая) и потенциал до наложения тока отвечает обратимому потенциалу металла Ег.
При смещении потенциала в положительную сторону скорость растворения металла увеличивается и достигает максимального значения при Е = Ец,п, где Еа.п — потенциал начала пассивации.
В области потенциалов между Е и Е , происходит так называемое активное растворение металла, наклон на этом участке положителен [c.49]
Для химических очисток котлов допустимо применение только концентрата НМК, являющегося более очищенным продуктом по сравнению с водным конденсатом .
Это позволяет избежать образования на поверхности труб в процессе очистки маслянистых пленок, которые могли бы снизить эффект очистки и вызвать значительные трудности при дальнейшей эксплуатации оборудования.
Недостатками концентрата НМК являются малая растворимость в нем соединений трехвалентного железа и образование за счет активного растворения металла и закиси железа большого количества взвеси в растворе.
Образующаяся взвесь мелкодисперсна по количеству ее в растворе концентрат НМК можно сравнить с растворами фталевого ангидрида и адипиновой кислоты. Растворение железоокисных и смешанных отложений ускоряется с ростом скорости движения раствора и концентрации реагента.
Оптимальными для удаления железоокисных и смешанных отложений в количестве 200—400 г/м из котлов высоких параметров оказались следующие условия разбавление концентрата НМК в 10 раз (6— 7%), температура 90—100°С, скорость движения раствора 0,5— 1,0 м/с. Для выноса взвеси из контура необходимы скорости движения при водных отмывках не менее [c.126]
Катодные ингибиторы замедляют катодные реакции или активное растворение металла. Для предотвращения локальной коррозии более эффективны анионные ингибиторы. Часто для лучшей защиты металлов используют композиции ингибиторов с различными добавками. При этом может наблюдаться [c.299]
Анализируя потенциостатическую анодную кривую, можно прийти к выводу о возможности с помощью внешнего катода перевести металл, находящийся в активном состоянии, в пассивное. В этом случае контакт с более благородным металлом как бы оказывается полезным (ср.
на диаграмме влияния катода ki и ks). Хотя в принципе такая возможность и имеется, но на практике она редко реализуется. Дело в том, что при активном растворении металлов катодные процессы, как правило, протекают с гораздо большей поляризацией, нежели анодные.
Поэтому катодные процессы обычно протекают не столь эффективно и потенциал катода подтягивается к потенциалу анода.
Для того чтобы с помощью внешнего катода запассивировать металл, находящийся в активном состоянии, необходимо, чтобы катодный процесс на нем протекал с весьма большой скоростью например, для железа в нейтральном электролизе [c.38]
На рис. 190 представлена зависимость количества возникающих на поверхности точечных анодов и их глубины от плотности анодного тока.
Эта зависимость в логарифмических координатах описывается уравнением прямой с показателем степени п = , что указывает на наличие прямой пропорциональности между числом возникающих питтингов и плотностью тока.
Средняя глубина питтингов при анодной поляризации возрастает с плотностью тока очень медленно, а начиная с определенной плотности тока (5-10 а/см ) она падает (рис. 190, кривая 2). С увеличением плотности поляризующего тока на поверхности металла возникает все больше мелких питтингов (табл. 55).
Это является результатом того, что металл в большинстве питтингов пассивируется и они со временем перестают функционировать. Проявляется двойственная роль анодной поляризации в одних центрах она способствует активному растворению металла, в других — пассивированию поверхности.
В активном состоянии остается лишь небольшое число активных центров, в которых, очевидно, не был достигнут ток пассивации. В этих центрах скорость растворения металла возрастает непрерывно с плотностью тока вследствие того, что поляризующий ток распределяется на малое число активных центров (рис. 190, кривая 3). [c.356]
Если известна основная ступень коррозии, которая тормозится каким-то методом защиты, то можно заранее указать, в каких условиях применение этого метода наиболее эффективно. Например, уменьшить скорость коррозии металла снижением в нем эффективных катодных примесей можно только тогда, когда основной контролирующей стадией коррозии является перенапряжение катодного деполяризующего процесса (например, при активном растворении металла в кислотах). В противоположность этому при коррозии с кислородной деполяризацией, когда контролирующим фактором является диффузия кислорода, повышение чистоты металла не даст положительного эффекта. При коррозии же с анодным контролем, т. е. когда возможно установление пассивного состояния, наличие катодных примесей, наоборот, будет способствовать снижению скорости коррозии. [c.48]
Сущность механизма активного растворения металлов при малом перенапряжении раскрыта еще недостаточно.
Можно полагать, что растворение металла состоит из нескольких последовательных стадий 1) из взаимодействия поверхности анода с молекулами воды или анионами гидроксила 2) из образования вследствие этого адсорбированных соединений типа МеОН , слабо связанных с кристаллической решеткой, и типа МеОН , не принадлежащих ей 3) из реакций указанных комплексов с компонентами раствора, в результате чего образуются вторичные продукты процесса. При анодном растворении железа можно дать следующую схему перехода в раствор катионов положительно заряженного металла. [c.25]
На активное растворение металла могут оказывать влияние содержащиеся в растворе активирующие анионы, например СГ, [c.25]
В активном состоянии металлы поляризуются анодно сравнительно слабо, что видно из пологого хода начального участка АБ анодной поляризационной кривой (рис. 14). На участке кривой АБ протекает процесс активного растворения металла с незначительным смещением потенциала в положительном иаправ- [c.34]
АВ —область активного растворения металла ВС — об- ласть активно-пассивного состояния С/ область устоИ-ЧИИ010 пассивного состояния ОЕ — область перепассивации Я1 — потенциал начала пасснвации 2— потенциал начала активации Ез — потенциал перепассивации 1 — критический ток пасснвации 2 — ток полной пассивации [c.343]
Для проведения измерений может быть использована трехэлектродная ячейка, в которой пространсхва для рабочего и вспомогательного электродов разделены краном или впаянным стеклянным фильтром (см. например, рис. 1.4). В качестве вспомогательного электрода обычно используют платиновую проволоку. Поскольку скорость.
электрохимического процесса в области активного растворения металла может быть весьма велика, для уменьшения омического падения потенциала (особенно это важно для растворов с малой проводимостью) желательно использовать электрод сравнения, снабженный капилляром Луггина.
Собственно электродом сравнения может быть каломельный, хлорсеребряный, водородный в том же растворе или любой другой. [c.277]
В качестве исследуемого электрода может быть использована фольга, пластина или проволока. Фольгу или пластину желательно вырезать в форме флажка, примерные размеры которого (в мм) показаны на рис. 4.43. Верхняя часть электрода делается узкой для того, чтобы снизить погрешность в определении площади рабочего электрода.
Площадь рабочего электрода подбирается исходя из возможностей по-тенцирстата (максимального тока потенциостата) и максимальных токов в области активного растворения металла. Так, на железе в области активного растворения в 0,5 М Н 504 токи достигают — ЮСмА/см. Максимальный выходной ток потенциостата П-5827М [c.
277]
Изучена анодная поляризация Р1, Рсерной кислоты. Измерены стационарные потенциалы металлов. Установлено, что стационарные потенциалы металлов лежат в большом диапазоне значений от — 0,27 В у РЬ до + 0,64 В у КН.
Изменение состава электролита в различной степени оказывает влияние на значения потенциалов металлов Анализ поляризационных кривых показал, что все исследованные металлы, за исключением свинца, анодно растворяются в серноыюлых растворах тиокарбамида.
Установлено, что благородные металлы растворяются со значительной поляризацией. Изучена анодная поляризация Аи, Ag, Си и нержавеющей стали в растворе, содержащем 50 г/л тиоционата калия и 50 г/л карбоната калия.
Установлено, что Ли, Аз и Си растворяются со значительной поляризацией. Определены потенциалы активного растворения металлов [c.70]
Механизм щелочного КР пока не выяснен. Имеются две основные гипотезы. Согласно первой, в наиболее напряженных участках разрушается пассивная пленка и идет активное растворение металла с образованием соединений типа ферратов или ферритов (Стэл и др.). [c.127]
По Феттеру , коррозию пассивных металлов нельзя свести к активному растворению металла в порах. Об этом свидетельствуют количественные наблюдения, приводящие к субатомарным размерам пор , а также качественное состояние продуктов коррозии или соотношение между толщиной слоя, потенциалом и скоростью коррозии (см. 187).
Поэтому коррозию пассивного металла нужно рассмаривать как растворение беспористого пассивирующего слоя в электролите, имея в виду, что в отсутствие внешнего тока анодный процесс, идущий на восполнение растворяющегося пассивирующего слоя, компенсируется катодной реакцией восстановления окислителя (например, растворение железа в азотной кислоте или щелочном электролите, содержащем кислород). [c.803]
Процесс пассивирования был подробно рассмотрен Хором [137]. Активное растворение металла возникает на дефектных местах, которые занимают тдаько весьма малую Долю о ей поверхности металла. Пассивность связывается с адсорбцией молекул воДи на металле этот процесс может происходить на всей поверхности. [c.209]
С другой стороны, аиодная поляризация должна влиять в прямо противоположном направлении КР, обусловленное активным растворением металла в щели, должно ускоряться, а водородная хрупкость ослабляться, поскольку скорость разряда водорода по мере снижения потенциала в положительную сторону должна падать, а при достижении определенного значения адсорбированный металлом водород начнет растворяться. [c.126]
При воздействии совершенно безводных кислых спиртовых растворов или растворов органических кислот на коррозионно-стойкие стали, Mg, А1, РЬ, Сг, Ti Fe иЛй его сплавьт происходит активное растворение металла.
Отсутствует цассивность Zr в солянокислых растворах этанола сплавов ЭП 814, ЭП-567 в растворах НС1 (1. ..
20 %) в метаноле, этаноле, изопропиловом спирте, бутаноле, октаноле, изооктаноле коррозионно-стойких сталей в безводной уксусной кислоте сплава Ti—8А1—Мо—Va в растворе НС1 (0,4 %) в метаноле/ [c.343]
До наступления этих отчетливо выраженных задержки и последующего продолжения развития активного растворения металла имеется еще слабо выраженное увеличение роста скорости растворения металла, происходящее без заметного смещения уровня потенциалов. Оно обнаруживается по отчетливо выражеггной задержке увеличения скорости окисления среды (фиг. 5 и 9). [c.12]
Сравнение представленных в табл. 2 значений с наблюдаемым потенциалом начала пассивирования титана в 2 н. Н2304 при 25° С (рис.
1) показывает, что образование окисных пленок на титане при анодной поляризации должно происходить даже в области потенциалов, отвечающих активному растворению металла.
Таким образом, нельзя связать начало пассивирования титанового анода с достижением потенциала реакции образования какого-либо из его окислов. [c.20]






