- Общая характеристика
- Немного истории
- Терминология и состояния
- Растворение в воде
- Краткий обзор
- Классификация соединений
- Место в курсе химии
- Области применения
- Кристаллогидраты
- Купоросы | это… Что такое Купоросы?
- КУПОРОСЫ
- Виды кристаллогидратов и реакции их образования
- Общая формула, молярная масса
- Какие бывают виды, классификация с примерами
- Образование кристаллогидратов, примеры соединений, где применяются

Так, современную промышленность нельзя представить без алебастра, жженого гипса, силикагеля, глауберовой соли, буры, алюмогеля и многих других веществ, относящихся к группе кристаллогидратов.
Общая характеристика
Кристаллогидратами называются химические соединения, в которых присутствуют молекулы воды. Они создаются, когда катионы вещества кристаллической решетки образуют связи с водными молекулами. Соединения более прочные, чем связи анионов и катионов в кристаллах безводной соли.
Примечательным свойством кристаллогидратов является то, что при низких температурах содержащаяся в них жидкость связывается с катионами и ионами солей. Основания, кислоты, а также значительное количество солей из водных растворов в осадок выпадают кристаллогидратами, завершая кристаллизационный процесс.
Кристаллогидратами являются известные и распространённые природные минералы — карналлит, гипс, кристаллическая сода, купорос (медный и железный).
Немного истории
История этих химических элементов начинается с 1826 года, когда были открыты гидраты спирта.

Дальнейшее продолжение их изучения связано с Д. И. Менделеевым. В процессе исследования реакции соединения воды и спирта он определил, что при этом образуются новые соединения, которые сопровождают химические и физические процессы.
В 1880 году понятие гидраты было введено в химии для характеристики определённых соединений веществ, растворенных в жидкости. Однако систематическое и подробное изучение кристаллогидратов, возможность рассчитать их массовую долю, выявление и установление составляющих началось только в 1889 году.
Терминология и состояния
Если молекулы растворителя связываются с анионами растворяемых в нем веществ, то образуются соединения, которые называют сольватами, а сам процесс — сольватацией.
Когда растворителем является вода, то получаемые соединения называют гидратами, а процесс — гидратацией. Таким образом, гидраты — это химические соединения, в которых жидкость присоединилась к ионам, атомам и молекулам растворенного в ней вещества. Их состояние может быть газообразным, жидким и твёрдым.

Гидраты, находящиеся в твердом состоянии, называют кристаллогидратами. Это соединения, включающие в себя частицы H2O. В них атом кислорода соединен с двумя водородными атомами ковалентными связями. Частицы H2O находятся в соединении с иными атомами посредством химических либо межмолекулярных связей. Вода в таких соединениях называется кристаллизационной.
К представителям этих химических соединений относятся многочисленные вещества, к которым причисляют кристаллоамиакаты, кристаллоалкоголяты, кристаллоэфираты и иные соединения.
Растворение в воде
Растворение кристаллогидратов в воде — сложный химико-физический процесс. При этом решетка кристаллическая у соединения может рушиться, а образуемые вследствие этого элементы (частички) распространяются по всему раствору. Такое преобразование способно выдать значительную тепловую энергию.

Объём в соединениях воды может быть различным: от молей дробного числа на моль вещества до значительного молярного объема.
В зависимости от состояния температуры среды одно и то же вещество может иметь в себе различное количество молекул воды. Отдельные кристаллогидраты при попадании на воздух могут терять кристаллизационную воду самостоятельно (самопроизвольно), что называется выветриванием.
В большинстве случаев, чтобы удалить жидкость (воду) искусственно, привести ее к обезвоживанию, используют нагревание и прокаливание.
Краткий обзор
Основная масса кристаллогидратов — соли. Их химический состав выражается формулой, в которой указывают молекулярное число кристаллизационной воды, ее долю на одну молекулу вещества.
Для обозначения формулы конкретного кристаллогидрата указывают молекулярное число воды, используя приставки из греческого алфавита. Их список:

- моно (1);
- ди (2);
- три (3);
- тетра (4);
- пента (5);
- гекса (6);
- гепта (7);
- окта (8);
- нона (9);
- дека (10).
Пример: 5Н2O — пента, 7Н2O — гепта, 10H2O — дека. Кристаллогидрат гептагидрата сульфата цинка — ZnSO4 7H2O.
Соединения сульфатов металлов принято называть купоросами. Среди наиболее известных: CuSO4 5H2O — медный купорос (кристаллогидрат сульфата меди), FeSO4 7H2O — купорос железный.
Некоторые популярные и востребованные в промышленности виды называются техническими. Их названия: сода кристаллическая — Na2CO3 10H2O, глауберова соль — Na2SO4 10H2O, горькая (английская) соль — MgSO4 7H2O.
Классификация соединений
- Рассматриваемые вещества в химии относятся к сложным соединениям, состоящих из атомов нескольких химических элементов.
- Принято осуществлять их классификацию по ряду параметров:

- По связи структуры безводного вещества и кристаллогидрата. Определенный состав — кристаллогидраты при удалении из них воды сжимают свою кристаллическую решетку. В основном это многоосновные кислоты, основания и клатраты. Неопределенный состав — при удалении воды структура кристалла не изменяется. Это возможно при наличии в кристаллах больших свободных промежутков. Пример — цеолиты.
- По числу молекул воды, которые входят в формулу конкретного кристаллогидрата.
- По соединению, участвующему в создании кристаллогидрата: неорганические и органические.
- По агрегатному состоянию гидратообразователя: твердое (соли), газообразное и жидкость (кислота серная, спирт этиловый).
- По классу соединений: кислоты, основания и соли.
- По температурной устойчивости. Первые — стабильные при отрицательных температурах, вода удерживается силами Ван-дер-Ваальса. Вторые — вода кристаллизационная без проблем удаляется нагреванием и удерживается в веществе межмолекулярными слабыми связями. Третьи — связи воды сильные (химические), вещество теряет ее при высоких температурах либо она разлагается с образованием иных химических веществ при нагревании.
- По состоянию воды. Внутрисферные — связи кристаллизационной воды происходят посредством ковалентного взаимодействия с катионам. Смешанные — вода удерживается водородными связями. К этой группе относятся купоросы, в которых пятая водяная молекула такую связь и выдает. Еще одна группа — соединения, создающие водяные молекулярные цепи благодаря связыванию двух катионов. Молекулы воды образуют слои, которые объединяются ионами соли. Структура таких веществ подобна льду.
Место в курсе химии
С учетом того, что современное развитие общества и промышленности неразрывно связано с химией, базовые знания по ней начинают преподавать в школе. Тогда же молодое поколение в знакомится с кристаллогидратами.
Школьный курс химии знакомит учеников с определениями этих веществ, предлагает найти решения различным задачам, связанным с получением и видоизменением этих соединений, в том числе с помощью практических занятий и разнообразных поучительных презентаций.
Области применения
Кристаллогидраты нашли применение в различных отраслях народного хозяйства. Так, гипс используется в медицинской сфере (в стоматологии, хирургии, ортопедии).

В медицине широко применяются сульфат натрия (Na2SO4), сульфат магния (MgSO), сульфат цинка (ZnSO4), цитрат натрия (Na3C6H5O7), хлорид кальция (CaCl2), нитрат кальция (Ca (NO3)2), хлористое железо (FeCl2).
Медный купорос известен как красящее вещество для тканей. Его растворами защищают древесину, протравливают семена.
Метан в природных условиях в виде кристаллогидрата залегает в недрах Земли в огромных количествах, являясь перспективным моторным топливом.
Кристаллогидраты


Средняя оценка: 4.6
Всего получено оценок: 71.
Средняя оценка: 4.6
Всего получено оценок: 71.
Выделить растворённое вещество из раствора можно путём выпаривания воды. В некоторых случаях образуются гидраты в кристаллическом виде или кристаллогидраты. Они содержат молекулы воды, которые называются кристаллизационной водой.
Кристаллогидраты образуются благодаря взаимодействию катионов кристаллической решётки вещества с молекулами воды. Это возможно, если связь между катионами и анионами кристалла более слабая.
К кристаллогидратам в первую очередь относятся соли. Типичными кристаллогидратами являются природные минералы – гипс, карналлит, алебастр, бура. Также кристаллогидраты образуют кислоты и основания.
Рис. 1. Кристаллогидраты.
Название вещества зависит от количества молекул воды. Для этого используют приставки, обозначающие число:
- 1 – моно;
- 2 – ди;
- 3 – три;
- 4 – тетра;
- 5 – пента;
- 6 – гекса;
- 7 – гепта;
- 8 – окта;
- 9 – нона;
- 10 – дека.
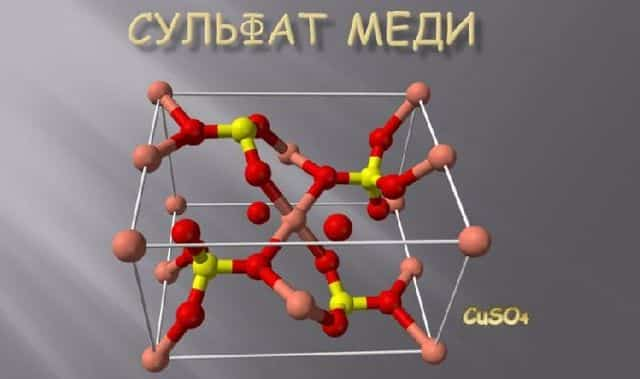 Рис. 2. Строение молекулы кристаллогидрата.
Рис. 2. Строение молекулы кристаллогидрата.
Например, кристаллогидрат FeSO4, содержащий одну молекулу воды, называется моногидрат сульфата железа (II). Если в кристаллогидрате семь молекул воды, он называется гептагидрат сульфата железа (II).
Вода из кристаллогидрата в большинстве случаев удаляется ступенчато. Например, при нагревании медного купороса, он переходит в тригидрат, затем в моногидрат. При нагревании до 250°С медный купорос полностью обезвоживается до сульфата меди (II).
Формула кристаллогидрата состоит из двух частей. Сначала записывается формула вещества. Через точку (знак умножения) указывается количество молекул воды. Например, ZnSO4 ∙ 7H2O, CuSO4 ∙ H2O, Na2CO3·10H2O, H2SO4 · H2O.
 Рис. 3. Пентагидрат сульфата меди (II) и сульфат меди (II).
Рис. 3. Пентагидрат сульфата меди (II) и сульфат меди (II).
При прокаливании кристаллогидраты разлагаются на сухое вещество и воду. Чтобы вычислить массовую долю вещества используется следующая формула:
ω(сух. в-ва) = m(сух. в-ва) / m(кр-та).
Для расчёта массовой доли воды применяется схожая формула:
ω(H2O) = m(H2O) / m(кр-та).
- Рассмотрим решение задачи с применением формулы.
- Необходимо вычислить массовую долю кристаллизационной воды в тригидрате нитрата меди (II) (Cu(NO3)2 ∙ 3H2O).
- Решение:
- Сначала запишем молярные массы воды и нитрата меди (II):
- M (Cu(NO3)2) = 187,5 г/моль;
- M (H2O) = 18 г/моль.
В 1 моле кристаллогидрата содержится 1 моль нитрата меди (II) и 3 моль воды, поэтому получаем по формуле m = n ∙ M массу воды и массу соли в кристаллогидрате:
- m (H2O) = 3 ∙ 18 = 54 г;
- m (Cu(NO3)2) = 1 ∙ 187,5 = 187,5 г.
Высчитаем общую массу вещества:
m (Cu(NO3)2 ∙ 3H2O) = 187,5 + 54 = 241,5 г.
Остаётся вычислить массовую долю воды:
ω(H2O) = m(H2O) / m(кр-та) = 54 / 241,5 = 0,22 или 22 %.
Ответ: массовая доля воды в тригидрате нитрата меди (II) 22 %.
Некоторые вещества невозможно обезводить без разложения. Например, соединение BeC2O4·H2O устойчиво только в форме кристаллогидрата.
Кристаллогидратами называются вещества, содержащие молекулы воды за счёт их притяжения катионами кристаллической решётки. В формуле кристаллогидратов, а также в названии вещества указывается количество воды. Например, CuSO4 ∙ H2O – моногидрат сульфата меди (II). Если известны массы воды и сухого вещества, можно вычислить их массовую долю.
Чтобы попасть сюда — пройдите тест.
- Пока никого нет. Будьте первым!
Средняя оценка: 4.6
Всего получено оценок: 71.
А какая ваша оценка?
Гость завершил
Тест «После бала»с результатом 7/10
Гость завершил
Тест на тему «Мягкий знак»с результатом 5/10
Гость завершил
Тест 2 том «Войны и мира»с результатом 7/12
Гость завершил
Тест «Смерть чиновника»с результатом 8/8
Гость завершил
Тест «Тихое утро»с результатом 8/10
Не подошло? Напиши в х, чего не хватает!
Купоросы | это… Что такое Купоросы?
- КУПОРОСЫ — кристаллогидраты сульфатов некоторых двухвалентных металлов: железный FeSO4.7Н2О, медный CuSO4.5Н2О, никелевый NiSO4.7Н2О, цинковый ZnSO4.7Н2О … Большой Энциклопедический словарь
- КУПОРОСЫ — нек рые соли серной кислоты (железная, медная, цинковая и др.). Общая характерная особенность К. устойчивость окраски и дезинфицирующие свойства. Наиболее употребительны К. медный и железный. Первый представляет собой крупные полупрозрачные… … Технический железнодорожный словарь
- КУПОРОСЫ — КУПОРОСЫ, сернокислые соли нек рых двухвалентных металлов, образующие изоморфные ряды, наприм. кристаллизующиеся в триклинной системе пентагидратьг медный купорос CuS04 . 5Н20, железный ■ FeS04.5H20, марганцовый MnS04 . 5Н20; магниевый… … Большая медицинская энциклопедия
- купоросы — Технич. назв. кристаллогидратов сульфатов нек рых тяж. металлов. В пром ти, сельск. хоз ве, медицине широко применяются медный (CuSO4 • 5Н2О), железный (FeSO4 • 7Н2О), цинковый (ZnSO4 • 7Н2О), кобальтовый (CoSO4 • 7Н2О),… … Справочник технического переводчика
- КУПОРОСЫ — техническое название водных сернокислых солей (сульфаты) некоторых тяжёлых металлов. Наибольшее практическое значение имеют К.: медный CuS04∙5H20 (синие кристаллы); железный FeS04∙7H20 (голубовато зелёные кристаллы); цинковый ZnS04∙7H20 … Большая политехническая энциклопедия
- купоросы — кристаллогидраты сульфатов некоторых двухвалентных металлов: железный FeSO4·7H2O, медный CuSO4·5H2O, никелевый NiSO4·7Н2O, цинковый ZnSO4·7H2О. * * * КУПОРОСЫ КУПОРОСЫ, кристаллогидраты сульфатов некоторых двухвалентных металлов: железный… … Энциклопедический словарь
- Купоросы — (vitriols, hydrous sulfates] техническое название кристаллогидратов сульфатов некоторых тяжелых металлов. В промышленности, сельском хозяйстве, медицине широко применяются медный (CuSO4 • 5H2О), железный (FeSO4 • 7H2О), цинковый (ZnSO4 • 7H2О),… … Энциклопедический словарь по металлургии
- Купоросы — техническое название кристаллогидратов сернокислых солей (сульфатов) некоторых тяжёлых металлов. В промышленности, сельском хозяйстве, медицине широко применяются след. К.: медный CuSO4·5H2O, железный FeSO4·7H2O цинковый ZnSO4·7H2O,… … Большая советская энциклопедия
- Купоросы — (медн., цинк. и пр.) см. Соли соответствующих элементов … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
- КУПОРОСЫ — технич. назв. кристаллогидратов сульфатов нек рых тяжёлых металлов. Наибольшее практич. значение имеют железный К. FeSO4*7H2O (голубовато зелёные кристаллы), медный К. CuSO4*5Н2О (синие), никелевый К. NiSO4*7H2O (изумрудно зелёные), цинковый К.… … Большой энциклопедический политехнический словарь
КУПОРОСЫ
КУПОРОСЫ – это сульфаты некоторых переходных металлов (меди, железа, марганца, цинка, кобальта, никеля), содержащие кристаллизационную воду.
В древнеиндийских источниках, относящихся к началу новой эры, можно найти описание использования в кустарном производстве, а также в медицинских целях редких природных минералов – медного и железного купоросов.
Медный купорос CuSO4·5H2O (минерал халькантит; к этой же группе минералов относятся джококуит MnSO4·5H2O и сидеротил FeSO4·5H2O) встречается в виде кристаллов и натечных масс, которые находят в рудниках, где добывают медь.
Наиболее значительные отложения халькантита (до 12% в медной руде) были найдены в Чили. Воды, вытекающие из таких шахт, всегда содержат растворенную соль меди. Плиний описывал медные рудники в Испании, где получали медь осаждением ее железом из раствора медного купороса.
В год таким способом из одной шахты можно было получить до 100 тонн меди. Этот способ сохранился и в средние века, когда из рудничных вод получали медь близ Уиклоу на восточном побережье Ирландии.
Железный купорос FeSO4·7H2O изредка встречается в природе в виде минерала мелантерита. Обычно это натечные образования в виде сталактитов и очень редко – зеленые или серые из-за примесей хрупкие кристаллы, обладающие стеклянным блеском.
Мелантерит образуется в результате окисления дисульфида железа – пирита под действием кислорода воздуха в присутствии влаги.
Очень часто этот минерал содержит в больших или меньших количествах медь – от смешанных кристаллов состава (Fe,Cu)SO4·7H2O вплоть до чисто медного бутита CuSO4·7H2O.
К группе мелантерита относятся также минералы биберит (кобальтовый купорос) CoSO4·7H2O, маллардит (марганцевый купорос) MnSO4·7H2O и цинкмелантерит – смешанный сульфат состава (Zn, Mn, Fe2+)SO4·7H2O. В природе найден также минерал госларит (белый, или цинковый купорос) ZnSO4·7H2O.
Многие из перечисленных веществ имеют бытовое название купоросов. С химической точки зрения купоросы – это кристаллогидраты некоторых сульфатов двухвалентных металлов с общей формулой MSO4·nH2O, где M – катионы Fe2+, Co2+, Ni2+, Zn2+, Mn2+ (n = 7) и Cu2+ (n = 5). Происхождение слова «купорос» в точности неизвестно. Оно пришло в русский язык в 17 в.
, в опубликованном в 1704 словаре Ф.Поликарпова приведено и другое название – копервас. Так что не исключено, что купорос – это искаженное старонемецкое Kupferwasser (дословно «медная вода»). По другой версии, купорос произошел от латинского cuprirosa – «медный цветок».
В пользу этого свидетельствует средневековое английское название медного купороса – coperose, которое позже перешло в copperas. Так же называли «зеленый, синий и белый купоросы» – гидратированные сульфаты железа, меди и цинка. Во многих европейских языках современное название купороса – vitriol. Это слово, известное с 14 в., происходит от латинского vitrum – стекло.
Кристаллы медного и железного купоросов действительно выглядят так, как будто изготовлены из цветного стекла (в античное время все стекла были окрашены примесями).
Старинное название концентрированной серной кислоты – купоросное масло или купоросный спирт (spiritus vitrioli) связан со способом ее получения, который известен с 11 в. и сохранился вплоть до 18.
По этому способу серную кислоту получали прокаливанием железного купороса и обе соли при нагревании обезвоживаются, а при температуре выше 600° С разлагаются: 2FeSO4 = Fe2O3 + SO2 + SO3; 2KAl(SO4)2 = K2SO4 + Al2O3 + 3SO3. Разбавляя продукт перегонки водой, получали серную кислоту желаемой крепости. Немецкий химик 17 в.
Иоганн Глаубер называл концентрированную серную кислоту, полученную таким способом, «кислым купоросным маслом» (acidum oleum vitrioli).
Нагреванием смеси селитры, медного или железного купороса и квасцов получали азотную кислоту. Фактически это был прообраз более позднего лабораторного способа получения азотной кислоты из селитры: 2KNO3 + H2SO4 = K2SO4 + HNO3.
Из всех купоросов наиболее известен медный купорос – пятиводный кристаллогидрат сульфата меди(II). Это самая распространенная в лабораториях медная соль, а также наиболее устойчивая из кристаллогидратов сульфата меди.
Медный купорос образует прекрасно оформленные кристаллы в форме косых параллелепипедов красивого яркосинего цвета, хорошо растворимых в воде (14,3 г при 0° С в расчете на безводный сульфат, 20,5 г при 20° С, 75,4 г при 100° С).
При хранении в сухой атмосфере или при нагревании до 105о С кристаллы медного купороса теряют две молекулы воды, переходя в синий тригидрат CuSO4·3H2O. При 150о С образуется моногидрат CuSO4·H2O, а полное обезвоживание происходит при 250° С.
При этом синяя соль превращается в белый порошок (примеси обычно придают ей серый цвет). Безводная соль и моногидрат жадно притягивают воду и могут служить осушителями.
В результате гидролиза растворы медного купороса имеют кислую реакцию. В щелочных растворах медный купорос образует основные соли, например, CuSO4·3Cu(OH)2·nH2O, где n = 0, 2, 5.
При избытке сульфата щелочного металла образуются двойные соли (шёниты) бледного сине-зеленого цвета, которые кристаллизуются из растворов в виде кристаллогидратов состава M2Cu(SO4)2·6H2O, где М = NH4+, K+, Rb+, Cs+. Известны и смешанные сульфаты (двойные купоросы) медного купороса с сульфатом марганца, цинка, кадмия, кобальта, никеля, железа(II).
При добавлении даже к сильно разбавленному бледно-голубому раствору медного купороса аммиака раствор приобретает глубокий сине-фиолетовый цвет в результате образования комплексных аммиакатов меди.
В природе медный купорос встречается в виде минерала халькантита; известны также минералы с другим содержанием воды: бонаттит (тригидрат CuSO4·3H2O), бутит (гептагидрат CuSO4·7H2O), халькокианит (безводный сульфат).
Получают медный купорос растворением оксида меди или медных отходов в разбавленной серной кислоте (в последнем случае окислителем меди служит продуваемый через раствор воздух), при обжиге сульфидов меди, как побочный продукт при очистке меди методом электролиза с растворимым медным анодом.
Медный купорос применяют как протраву при крашении тканей, для консервирования древесины, протравливания семян. Известный инсектицид бордосская жидкость представляет собой смесь растворов медного купороса и известкового молока; последний добавляют для нейтрализации раствора, чтобы растения не получили кислотного ожога.
В медицине разбавленный (0,25%-ный) раствор медного купороса применяют как антисептическое и вяжущее средство, 5%-ный раствор – при ожогах белым фосфором, а 0,5%-ный раствор – внутрь при отравлениях белым фосфором.
Это применение основано на переводе фосфора в нерастворимый фосфид и частично – в металлическую медь; процесс приблизительно можно передать уравнением 18P + 20CuSO4 + 32H2O = 8H3PO4 + 5Cu + 5Cu3P2 + 20H2SO4.
Малые дозы медного купороса (несколько капель 1%-ного раствора в молоке) назначают иногда при анемии для усиления кроветворения.
Железный купорос получают растворением железа в разбавленной серной кислоте без доступа воздуха (чтобы исключить окисление двухвалентного железа), прокаливанием пирита FeS2 с последующим растворением образовавшегося сульфата FeSO4 в воде. Чистый купорос FeSO4·7H2O – голубовато-зеленые призматические прозрачные кристаллы, хорошо растворимые в воде.
При нагреве до 64о С они плавятся (растворяются в собственной кристаллизационной воде). При длительном хранении на воздухе, особенно при повышенной температуре, кристаллы купороса частично теряют воду и выветриваются, при этом зеленые кристаллы белеют.
При частичном их окислении до сульфата железа(III) на поверхности кристаллов появляется желтая корочка; этот процесс катализируется присутствием в железном купоросе ионов Fe3+.
При нагревании кристаллов FeSO4·7H2O до 60–80° С происходит отщепление от гептагидрата трех молекул воды c образованием тетрагидрата FeSO4·4H2O, еще три молекулы отщепляются при 110–160° С и только при температурах 540–550° С соль теряет последнюю молекулу кристаллизационной воды. При более сильном прокаливании сульфат железа разлагается, что раньше использовали для получения серной кислоты.
Водные растворы железного купороса обладают восстановительными свойствами, что используется в аналитической химии.
Но так как кристаллический железный купорос на воздухе нестабилен (выветривается), для получения растворов сульфата железа(II) с точно известной концентрацией используют устойчивый двойной сульфат железа – аммония (соль Мора) (NH4)2Fe(SO4)2·6H2O. В растворе ионы Fe2+ легко окисляются до ионов Fe3+ многими окислителями, например:
- 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O);
- FeSO4 + 3AgNO3 = Fe2(SO4)3 + Fe(NO3)3 + 3Ag.
- При окислении водных растворов железного купороса выпадает осадок основного сульфата железа(III) Fe(OH)SO4, а в растворе остается Fe2(SO4)3.
Железный купорос в виде растворов применяют как компонент электролитов в гальванотехнике, для пропитки древесины с целью предохранить ее от гниения, для получения железосодержащих пигментов.
В медицине железный купорос входит в состав антианемических средств, назначаемых при нехватке в организме железа.
Для лучшего усвоения и для предохранения от окисления железный купорос в различных препаратах смешивают с различными органическими соединениями, например, с аскорбиновой кислотой (препарат «Ферроплекс», «Фенюльс» и др.).
Очень интересно старое применение железного купороса для изготовления чернил. На нижних сторонах дубовых листьев, обычно к концу лета, часто встречаются красивые круглые орешки-галлы. Иногда их бывает так много, что листья тяжело свисают вниз.
Сначала галлы зеленые, потом краснеют и выглядят как маленькие яблочки, прилипшие к листу. Самому дубу галлы ни к чему – они образуются на листьях дуба от укуса крохотной мушки – орехотворки.
Самка мушки, откладывая яйца, ранит дубовый лист, вызывая образование на нем патологических наростов. Развивающиеся личинки находят внутри этих наростов надежную защиту. Когда орешки-галлы созреют, из них выводятся маленькие крылатые насекомые с четырьмя прозрачными клетчатыми крылышками.
Галлы интересны тем, что содержат много танина – смеси дубящих веществ (танин содержится и в дубовой коре, но там его в 2–3 раза меньше).
Еще в древности галлы применяли в медицинской практике, для выделки кож, называя их «дубильными орешками». Но самое известное их применение было изготовление чернил; отсюда другое название галлов – «чернильные орешки». Для получения чернил к соку из галлов добавляли железный купорос.
На воздухе полученный раствор приобретал глубокий фиолетово-черный цвет. Реакция эта очень чувствительная: окраска появляется даже с очень малым количеством железа. Еще в 17 в. Р.
Бойль установил, что «одна крупинка купороса, растворенная в таком количестве воды, которое в шесть тысяч раз превышает ее вес, способна дать с дубильным орешком пурпурную настойку». Добавление к чернилам камеди – густого сока некоторых деревьев, например, вишневого – придавало чернилам красивый блеск.
Вот один из старинных рецептов приготовления черных чернил: камеди – 3 части, железного купороса – 2 части, чернильных орешков – 3 части, воды – 30 частей. Чернила эти очень устойчивы: сохранились, например, написанные ими средневековые рукописи.
Сразу после высыхания эти чернила имели черный цвет, а со временем приобретали темно-коричневый оттенок. При большой концентрации железного купороса в исходном растворе чернила частично «проедали» бумагу, так что написанное становилось видно с другой стороны листа.
Цинковый купорос ZnSO4·7H2O начали получать из цинковых руд еще в 17 в. Для этого природный сульфид цинка обжигали при невысокой температуре и выщелачивали образовавшийся сульфат цинка водой. В настоящее время его получают действием серной кислоты на цинковую обманку. Растворы цинкового купороса из-за гидролиза имеют кислую реакцию.
При кристаллизации из растворов выделяются бесцветные прозрачные ромбические кристаллы, очень хорошо растворимые в воде: 41,8 г в 100 г воды при 0° С (в расчете на безводную соль), 54,1 г при 20° С и 74,8 г при 70° С; при более высоких температурах растворимость снижается.
При нагревании кристаллов цинкового купороса они постепенно теряют воду, а при сильном прокаливании до 930° С превращаются в оксид цинка ZnO с отщеплением SO3.
Цинковый купорос применяют в производстве вискозы, в качестве микроудобрения, как добавку к кормам, для пропитки древесины (например, шпал), чтобы предохранить ее от гниения.
Раствор цинкового купороса – электролит при выделении цинка электролизом в процессах цинкования металлов для их защиты от коррозии.
В медицине цинковый купорос применяют как антисептическое и вяжущее средство при конъюнктивитах (глазные капли), при хроническом ларингите (смазывание 0,5%-ным раствором).
Кобальтовый купорос CoSO4·7H2O – красные кристаллы, хорошо растворимые в воде с образованием розовых растворов.
При нагревании до 43° С гептагидрат превращается в оранжево-красный гексагидрат CoSO4·6H2O, при дальнейшем нагревании идет постепенная потеря еще пяти молекул, а полное обезвоживание происходит при 250° С.
Растворы кобальтового купороса – компоненты электролита для покрытия других металлов кобальтом. Его используют также для получения пигментов для керамики и стекла.
Никелевый купорос NiSO4·7H2O – изумрудно-зеленые ромбические кристаллы, хорошо растворимые в воде; при 31,5° С они плавятся и переходят в гексагидрат NiSO4·6H2O. Выше 85° С устойчив моногидрат NiSO4·H2O, который полностью обезвоживается при 280° С.
В природе никелевый купорос встречается в виде минерала моренозита в сульфидных никелевых рудах. Никелевый купорос широко используется как для электрохимического выделения чистого никеля из растворов, так и для никелирования различных металлов с целью защитить их от коррозии и придать красивый внешний вид.
Его применяют также в качестве фунгицида для борьбы с грибковыми и бактериальными болезнями сельскохозяйственных растений.
Иногда к купоросам относят гептагидрат сульфата марганца MnSO4·7H2O – розовые кристаллы, хорошо растворимые в воде (52,9 г на 100 г воды при 0° С в расчете на безводную соль).
Гептагидрат – редкое соединение, поскольку оно устойчиво только при температуре ниже 8,6° С, а при более высоких отщепляет сначала две молекулы воды, переходя в пентагидрат MnSO4·5H2O, выше 27° С образуется MnSO4·4H2O, выше 43° С – MnSO4·2H2O, выше 60 – 100° С – MnSO4·H2O, а последняя молекула воды отщепляется при нагревании выше 200° С.
Илья Леенсон
Виды кристаллогидратов и реакции их образования
В разных сферах современной промышленности активно используют алебастр, жженый гипс, силикагель, глауберовую соль, алюмогель и другие материалы, являющиеся кристаллогидратами.
Эти вещества обладают кристаллической структурой и содержат в своём составе воду.
Обязательным условием формирования кристаллогидратов является образование межмолекулярных связей молекул воды с ионами кристаллической решетки.
Определение
Во многих случаях соли, образующиеся в виде осадка из водных растворов, являются кристаллогидратами.
К группе кристаллогидратов относят природные минералы, которые всем известны и широко распространены. К ним причисляют карналлит, гипс, кристаллическую соду, медный и железный купорос и др.
Общая формула, молярная масса
Примечание
где х является коэффициентом, который относится к формуле воды.
Записать уравнение для кристаллогидрата можно, если вычислить коэффициент х. При знании масс безводного вещества и воды достаточно просто определить их количества. Допустим, что масса кристаллогидрата равна 100 грамм. В таком случае, его компоненты по массам будут соответствовать их массовым долям, которые записаны в процентах.
В качестве примера можно рассмотреть вещество А, массовая доля которого составляет 20% от 100% соединения. Таким образом, 100 грамм кристаллогидрата содержат 20 грамм вещества А.
Существуют стандартные приемы для решения задач на кристаллогидраты. Например, имеется 300 мл воды, в которой растворено 7,6 г медного купороса (CuSO4·5H2O). Требуется определить, какова массовая доля CuSO4 в полученной смеси. Решить этот пример можно двумя методами.
В первом случае, следует отметить, что в кристаллогидрате медного купороса соблюдается следующее соотношение частиц кристаллогидрата и сульфата меди (II) — 1:1. На каждые две единицы кристаллогидрата приходятся две частицы сульфата меди и так далее.
Аналогичным образом, 1 часть (моль) частиц кристаллогидрата соотносится с 1 частью (1 моль) частиц сульфата меди (II).
Можно сделать вывод о том, что молярное соотношение (отношение количества вещества) кристаллогидрата CuSO4·5H2O и сульфата меди (II) равноCuSO41:1
- n(CuSO4·5H2O):n(CuSO4)=1:1
- Другая форма записи уравнения:
- n(CuSO4·5H2O)=n(CuSO4)
- С помощью формулы можно определить молярные массы кристаллогидрата и сульфата меди (II):
- М(CuSO4·5H2O)=64+32+64+5·18=250г/моль
- М(CuSO4)=64+32+64=160г/моль
- Количество вещества кристаллогидрата:
- n(CuSO4·5H2O)=m/M=7,6/250=0,0304моль
- n(CuSO4)=n(CuSO4·5H2O)=0,0304моль
- Масса сульфата меди в составе кристаллогидрата:
- m(CuSO4)=M·n=160г/моль·0,0304моль=4,864г
- ω(CuSO4)=m(CuSO4)/mр-ра(CuSO4)=4,864г/307,6г=0,0158 или 1,58%
- Второй метод расчета массовой доли CuSO4 в полученной смеси начинается с записи формулы для расчета искомого показателя:
- ω(CuSO4)=М(CuSO4)/М(CuSO4·5H2O)=160г/моль/250г/моль=0,64 или 64%
- При известной массовой доле сульфата меди можно определить массу сульфата меди в количестве кристаллогидрата массой 7,6 г:
- m(CuSO4)=ω(CuSO4)·m(CuSO4·5H2O)=0,64·7,6г=4,864г
- Масса исходной воды составляет:
- m(H2O)=ρ·V=1г/мл·300мл=300г
- Согласно принципу материального баланса, можно вычислить массу раствора сульфата меди (II).
- mр-ра(CuSO4)=m(CuSO4·5H2O)+m(H2O)=7,6г+300г=307,6г
- Массовая доля сульфата меди (II) в полученной смеси составит:
- ω(CuSO4)=m(CuSO4)/mр-ра(CuSO4)=4,864г/307,6г=0,0158 или 1,58%
- В результате вычислений, ω(CuSO4) равна 0,0158 или 1,58%
Какие бывают виды, классификация с примерами
Кристаллогидраты являются сложными соединениями, в состав которых входят атомы нескольких химических элементов. Основой классификации кристаллогидратов служат следующие признаки:
- Связь структуры безводного вещества и кристаллогидрата. Определенный состав — кристаллогидраты в процессе обезвоживания способны уменьшать в размерах свою кристаллическую решетку. В распространенных случаях к ним относят многоосновные кислоты, основания и клатраты (соединения включения). Неопределенный состав — в процессе обезвоживания кристаллогидрата кристаллическая решетка остается стабильной, что объясняется большими свободными промежутками в кристаллах. В качестве примера можно привести цеолиты.
- Выделяют кристаллогидраты, формулы которых отличаются по количеству молекул воды.
- В зависимости от соединения, которое участвует в формировании кристаллогидрата, вещества могут быть органическими и неорганическими.
- Другим параметром классификации служит агрегатное состояние гидратообразователя: твердое (соли), газообразное (хлороводород) и жидкость (серная кислота, спирт этиловый).
- Класс соединений: кислоты, основания и соли.
- Температура стабильности.
- Состояние воды. Внутрисферные кристаллогидраты характеризуются наличием связей кристаллизационной воды, которые формируются за счет координационного взаимодействия с катионами. В смешанных кристаллогидратах удержание воды обеспечено водородными связями. В качестве примера таких соединений можно привести купоросы.
Образование кристаллогидратов, примеры соединений, где применяются
В распространенных случаях соединения, как правило, соли, выкристаллизовываются из водных растворов и принимают вид кристаллогидратов. В качестве примера можно привести медный купорос с формулой:
CuSO4·5H2O
Растворение кристаллогидратов в водной среде сопровождается сложными физико-химическими процессами. Конечным результатом такого взаимодействия является диссоциация вещества. В результате происходит отделение кристаллизационной воды и её смешивание с растворителем. Условно процесс растворения записывают с помощью следующего уравнения:
CuSO4·5H2O→CuSO4+5H2O
Наиболее часто в решении задач по химии можно встретить следующие названия кристаллогидратов:
- CuSO4·5H2O — медный купорос, пентагидрат сульфата меди (II);
- Na2CO3·10H2O— кристаллическая сода, декагидрат карбоната натрия;
- ZnSO4·7H2O— цинковый купорос, гептагидрат сульфата цинка.
В том случае, когда кристаллогидраты растворяются в водной среде, высока вероятность разрушения кристаллической решетки соединения. Полученные в результате частицы распределяются по всей смеси. В процессе можно наблюдать выделение значительной тепловой энергии.
Исходя из температурного режима, одинаковые вещества могут содержать разное число молекул воды. Некоторые кристаллогидраты в воздушной среде утрачивают кристаллизационную воду без постороннего воздействия. Данный процесс называют выветриванием. Для искусственного удаления воды, то есть обезвоживания вещества, его нагревают или прокаливают.
В большинстве своем кристаллогидраты представлены солями. Химический состав вещества записывают в виде формулы с молекулярным числом кристаллизационной воды, ее долей на одну молекулу вещества. Для того чтобы обозначить формулу определенного кристаллогидрата, принято указывать молекулярное число воды с помощью наложения приставок из греческого алфавита. Список таких приставок:
- моно (1);
- ди (2);
- три (3);
- тетра (4);
- пента (5);
- гекса (6);
- гепта (7);
- окта (8);
- нона (9);
- дека (10).
В качестве примера можно рассмотреть следующие соединения: 5Н2O — пента, 7Н2O — гепта, 10H2O — дека. Кристаллогидрат гептагидрата сульфата цинка — ZnSO47H2O. Соединения сульфатов металлов зачастую называют купоросами. К наиболее известным относят следующие вещества: CuSO45H2O — медный купорос (кристаллогидрат сульфата меди), FeSO47H2O — купорос железный.
Активно применяют в современной промышленности технические кристаллогидраты. К данной группе относят:
- соду кристаллическую — Na2CO310H2O;
- глауберову соль —Na2SO410H2O;
- горькую (английскую) соль — MgSO47H2O.
Кристаллогидраты используют в таких сферах, как:
- народное хозяйство;
- медицина, в том числе, стоматология, хирургия, ортопедия.
Популярностью в медицинской отрасли пользуются следующие кристаллогидраты:
- сульфат натрия (Na2SO4);
- сульфат магния (MgSO);
- сульфат цинка (ZnSO4);
- цитрат натрия (Na3C6H5O7);
- хлорид кальция (CaCl2);
- нитрат кальция (Ca(NO3)2);
- хлористое железо (FeCl2).
С помощью медного купороса окрашивают ткани. Растворами данного вещества покрывают древесину, что позволяет защитить ее от неблагоприятного внешнего воздействия, а также протравливают семена растений.
Метан в природе в форме кристаллогидрата образует огромные залежи в недрах нашей планеты.
Соединение рассматривают в качестве сырья для приготовления перспективного моторного топлива с уникальными свойствами.






