Решение:
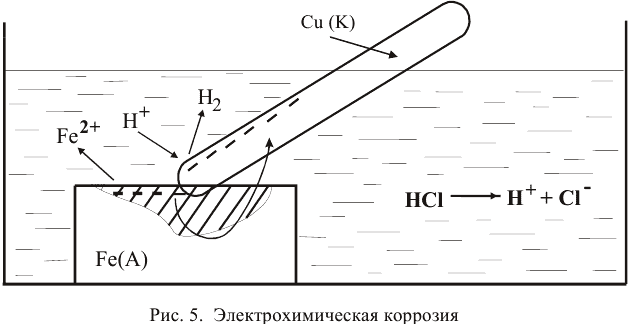
При касании железа медью образуется короткозамкнутый гальванический элемент, состоящий из железного и медного электродов, загруженных в раствор электролита. Медный электрод играет роль катода, так как он имеет более высокий электродный потенциал. На катоде должен протекать процесс восстановления, а на аноде — железной пластине — процесс окисления:
Таким образом, железо продолжает растворяться, причем скорость электрохимического процесса выше, чем скорость обычного окислительно-восстановительного процесса.
На катоде происходит деполяризация, т.е. процесс восстановления каких-либо частиц, называемых деполяризатором, избытком электронов.
В кислой среде роль деполяризатора играют катионы водорода:
Таким образом, водород выделяется с поверхности меди, несмотря на отсутствие взаимодействия с ней. Продукт коррозии — . Процессы, происходящие при электрохимической коррозии, представлены на рис. 5.
Задача 75
Две пластинки — одна железная, а другая магниевая -погружены раздельно в разбавленную соляную кислоту. Что изменится, если соединить обе пластинки?
Решение:
При объединении пластин образуется короткозамкнутый гальванический элемент, и протекает электрохимическая коррозия. Магний, будучи более активным металлом, играет роль анода. На аноде происходит процесс окисления:
На катоде — железной пластинке — будет происходить водородная деполяризация:
Таким образом, при соприкосновении двух пластин наблюдается усиление выделения водорода с поверхности железа, хотя разрушение железа резко уменьшается, а активизируется процесс разрушения магниевой пластины. Выделение водорода с поверхности магния резко сокращается.
Задача 76
Кладут в один стакан, содержащий солевой раствор, кусочек чистого железа, а в другой стакан, содержащий такой же солевой раствор, — кусочек железа, соединенный с кусочком свинца. В оба стакана есть доступ кислороду воздуха. Через несколько дней определяют содержание ионов железа в обоих стаканах. В каком из стаканов концентрация ионов железа будет больше ?
Решение:
Кислород растворяется в водном растворе. Железо, погруженное в солевой раствор, в присутствии растворенного кислорода будет подвергаться коррозии, хотя и медленно, так как оно чистое, а чистые металлы медленно корродируют (обычно присутствие примесей в железе (чугуне) резко увеличивает скорость коррозии).
Процесс коррозии чистого железа может быть представлен следующей схемой:
где , — один из компонентов ржавчины.
Железо в контакте с менее активным свинцом играет роль анода и подвергается электрохимической коррозии с кислородной деполяризацией на свинцовом катоде:
легко окисляется до . Таким образом, продуктом коррозии является :
Скорость электрохимической коррозии намного выше скорости химической коррозии, поэтому в стакане, содержащем железо, соединенное со свинцом, концентрация ионов железа будет выше, чем в стакане с чистым железом.
Задача 77
- Описать процессы электрохимической коррозии, протекающие на оцинкованном железе при наличии трещин в защитном слое:
- а) в кислой среде;
- б) в нейтральной среде в присутствии кислорода.
- Решение:
- Покрытие железа цинком относится к анодным покрытиям, так как металл покрытия более активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль анода.
В кислой среде на поверхности катода, т.е. на поверхности железа, протекает водородная деполяризация (рис.6):
В нейтральной среде в присутствии кислорода на поверхности катода (железа) протекает кислородная деполяризация (рис.7):
Продукт коррозии, образующийся по реакции
— гидроксид цинка.
Задача 78
- Описать процессы электрохимической коррозии,
- протекающей на хромированном железе при наличии трещин в защитном слое:
- а) в кислой среде;
- б) в нейтральной среде в присутствии кислорода.
- Решение:
- Покрытие железа хромом относится к катодным покрытиям, так как металл покрытия менее активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль катода.
Защищаемый металл играет роль анода, т.е. подвергается разрушению.
В кислой среде на поверхности катода, т.е. на поверхности хрома, протекает водородная деполяризация (рис.8):
В нейтральной среде в присутствии кислорода на поверхности катода (хрома) протекает кислородная деполяризация (рис.9):
Продукт коррозии, образующийся по реакции
на воздухе окисляется:
Задача 79
- Объяснить, почему в стальном сосуде застойная зона подвергается интенсивной коррозии (нейтральная среда в присутствии кислорода воздуха), тогда как в цинковом сосуде, наоборот, застойная зона подвергается коррозии в незначительной степени.
- Решение:
- Интенсивность (скорость) электрохимической коррозии зависит от ЭДС образующегося короткозамкнутого элемента: чем больше величина ЭДС, тем интенсивнее электрохимическая коррозия.
- Для электрохимической коррозии ЭДС рассчитывается аналогично расчету ЭДС гальванического элемента:
- где — электродный потенциал электродной полуреакции деполяризации;
- — электродный потенциал металла, подвергающегося разрушению.
- Для электродной полуреакции кислородной деполяризации
В зоне, подверженной воздействию кислорода, электродный потенциал катодных участков будет выше, чем в застойной зоне (концентрация кислорода в растворе находится в числителе).
Таким образом, в начальный момент ЭДС микрогальваноэлементов в зоне, подверженной воздействию кислорода, будет выше, чем ЭДС микрогальваноэлементов в застойной зоне, а значит, коррозия анодных участков в зонах, подверженных воздействию кислорода, будет значительной.
Эта коррозия в начальный момент приводит к накоплению анионов по реакции , а следовательно, к увеличению pH. Известно, что в щелочной среде железо пассивирует. Таким образом, в следующий момент коррозия в зонах, подверженных воздействию кислорода, прекращается, тогда как в застойных зонах (рис. 10) она продолжается. Вот почему застойные зоны стальных сосудов подвергаются интенсивной коррозии.
В сосуде из цинка коррозия зон, подверженных воздействию кислорода, всегда будет очень интенсивной, так как щелочная среда не пассивирует цинк, а наоборот, способствует его разрушению:
Поэтому застойная зона меньше подвергается коррозии, чем аэрируемая.
Задача 80
- Показать необходимыми расчетами, что платина в контакте с золотом никогда не подвергается электрохимической коррозии, тогда как медь в контакте в золотом подвергается электрохимической коррозии только в присутствии кислорода в щелочной среде.
- Решение:
- Для процесса кислородной деполяризации
электродный потенциал определяется по формуле Нернста:
В нейтральной среде
В щелочной среде
Для того, чтобы протекала электрохимическая коррозия, необходимо следующее:
Отсюда
Таким образом, электродный потенциал металла (анода) должен быть ниже 0 В в нейтральной среде или ниже 0,401 В в сильно щелочной среде (рН=14). Если находятся в контакте золото и платина, платина играет роль анода, но ее стандартный электродный потенциал .
Хотя в реальных условиях из-за низкой концентрации катионов платины электродный потенциал платины будет ниже, чем ее стандартный потенциал, однако он остается выше, чем 0,401 В, а значит, электрохимической коррозии с кислородной деполяризацией не будет.
- Медь в контакте с золотом может подвергаться электрохимической коррозии с кислородной деполяризацией, особенно в щелочной среде, так как , а это ниже 0,401 В.
- Остается показать отсутствие электрохимической коррозии с водородной деполяризацией для обоих случаев.
- Электродный потенциал водородной деполяризации выражается уравнением:
- В кислой среде
- В слабокислой среде
- Таким образом, металлы, имеющие электродный потенциал выше 0 В, в кислой среде не подвергаются электрохимической коррозии с водородной деполяризацией.
- Эти задачи взяты со страницы решения задач по неорганической химии:
- Задачи с решением по неорганической химии
- Возможно эти страницы вам будут полезны:
Подготовка к ОГЭ по русскому языку 2020. Задание №2. Синтаксический анализ. (на основе материала сайта ФИПИ)
Задание 2 ФИПИ Синтаксический анализ.
1. Прочитайте текст.
(1)Перед человечеством стоят глобальные проблемы: рост населения мира, ликвидация социального неравенства, проблемы использования Мирового океана и космического пространства, природных ресурсов и защиты окружающей среды.
(2)В связи с этим сотрудничество учёных различных стран призвано сыграть свою роль в решении этих проблем. (3)Говоря о значении научных открытий и изобретений, следует помнить и о возросшей ответственности учёных за будущее человечества.
(4)К сожалению, в мире всё больше растёт непонимание места и роли науки, а мистические представления вытесняют целостное научное мировоззрение.
(5)Поэтому вопрос о месте науки в общественном сознании, в выработке новых ценностей современного мира становится основным вопросом научного сообщества, системы образования, а также средств массовой информации.
Укажите варианты ответов, в которых дано верное утверждение. Запишите номера ответов.
-
Предложение 1 осложнено однородными членами предложения с обобщающим словом.
-
Предложение 2 односоставное безличное.
-
Предложение 3 содержит 2 (две) грамматические основы.
-
Предложение 4 осложнено вводным словом.
-
Предложение 5 сложносочинённое.
Ответ: 14
2. Прочитайте текст.
(1)Натуралистов всегда поражала особенность охоты сов: птицы охотятся в темноте на мелких грызунов и вылавливают их немало – десятки за ночь.
(2)Может быть, совы разыскивают добычу с помощью какого-нибудь необычного чувства? (3)Некоторые учёные считают, что совы видят инфракрасные лучи, которые излучает тело жертвы.
(4)Возможно, что глаза совы улавливают невидимые для нашего зрения инфракрасные, то есть тепловые, лучи. (5)Установлено, что инфракрасные лучи представляют собой тепловое излучение всякого нагретого предмета.
Укажите варианты ответов, в которых верно определена грамматическая основа в одном из предложений или в одной из частей сложного предложения текста. Запишите номера ответов.
-
натуралистов поражала (предложение 1)
-
может быть (предложение 2)
-
считают (предложение 3)
-
возможно (предложение 4)
-
установлено (предложение 5)
Ответ:45
3. Прочитайте текст.
(1)Потенциал энергетических ресурсов Мирового океана огромен. (2)Он заключён в энергии морских волн, в суточных приливно-отливных движениях.
(3)Суммарная мощность последних на нашей планете оценивается учёными от одного до шести миллиардов киловатт, причём первая из этих цифр намного превышает показатели энергетического потенциала всех рек земного шара.
(4)Установлено, что возможности для сооружения крупных приливных электростанций имеются в 25–30 местах. (5)Самыми большими ресурсами приливной энергии обладают Россия, Франция, Канада, Великобритания, Австралия, Аргентина, США.
Укажите варианты ответов, в которых дано верное утверждение. Запишите номера ответов.
-
Предложение 1 простое нераспространённое.
-
В предложении 2 составное именное сказуемое.
-
Предложение 3 содержит 2 (две) грамматические основы.
-
Предложение 4 простое, осложнено вводным словом.
-
Предложение 5 осложнено однородными подлежащими.
Ответ: 235
4. Прочитайте текст.
(1)В истории человечества есть две формы коммуникации: устная и письменная. (2)Сегодня с появлением Интернета, новой сферы общения, можно утверждать, что появился некий промежуточный тип коммуникации, который в каком-то смысле является письменным (визуальным), а в каком-то – устным.
(3)По способу восприятия это, без сомнения, визуальная речь, то есть воспринимаемая глазами. (4)К тому же мы можем делать длительные паузы в процессе интернет-разговора, что недопустимо во время устной беседы, так как «живой» диалог предполагает мгновенные реплики.
(5)Итак, технически это письменная речь, а вот с точки зрения структуры используемого в Интернете языка, безусловно, устная.
Какие из перечисленных утверждений являются верными? Укажите номера ответов.
-
Предложение 1 простое двусоставное.
-
В первой части предложения 2 грамматическая основа – можно утверждать.
-
Предложение 3 односоставное назывное.
-
Предложение 4 сложное.
-
В предложении 5 содержится 3 (три) грамматические основы.
Ответ: 124
(1)Хотя диалог обычно противопоставляют монологу, но в таком противопоставлении полюсы неравноправны. (2)Диалог – живая форма общения, он может длиться долго; напротив, монолог – искусственная форма речи, и обычно он длится недолго. (3)Правда, на сцене монолог звучит более естественно, чем в жизни.
(4)Это объясняется тем, что, во-первых, сценический монолог предполагает фоном всю пьесу и, во-вторых, сами зрители выступают как бы в роли молчаливого собеседника актёра, произносящего монолог.
(5)И всё же известная условность монолога сохраняется и на сцене, чем объясняется его постепенное вытеснение с подмостков: в пьесах нашего времени монолог занимает гораздо более скромное место, чем раньше.
Укажите варианты ответов, в которых дано верное утверждение. Запишите номера ответов.
-
Первая часть предложения 1 – односоставное неопределённо-личное предложение.
-
Предложение 2 содержит 4 (четыре) грамматические основы.
-
В предложении 3 первая грамматическая основа – правда.
-
Две части предложения 4 осложнены вводными словами.
-
Предложение 5 сложносочинённое.
Ответ: 124
Коррозия металлов
Большинство широко используемых металлов подвергаются химическому воздействию воды и водных растворов, а также газов, составляющих воздух, включая и непостоянные примеси в нем. Возникающие химические реакции идут на поверхности металлов. Они приводят к более или менее
быстрому разрушению металлических изделий и конструкций. Продукты реакций спадают и смываются с поверхности металлов, что ведет к непрекращающемуся процессу разрушения.
Процесс химического разрушения металлов йод действием факторов окружающей среды называется коррозией.
Результаты коррозии часто можно наблюдать в виде ржавого металлолома, покрывшихся зелеными солями бронзовых памятников, потемневших изделий из серебра. Можно наглядно убедиться и в том, что коррозия идет относительно быстро.
Достаточно оставить на несколько часов обычный столовый нож в соприкосновении с каплями воды, как он покрывается рыжеватыми пятнами ржавчины. Коррозия, как и всякий другой химический процесс, сильно ускоряется при повышении температуры. Особенно быстро корродируют трубопроводы для горячей воды и водяного пара.
Ускоряется коррозия металлов в больших городах, особенно вблизи химических заводов, где значительно возрастает количество примесей в воздухе.
Наиболее просто протекает процесс коррозии в газовой среде. На поверхности металла образуются соответствующие соединения: оксиды, сульфиды, основные карбонаты и др. В некоторых случаях эти продукты хорошо удерживаются на поверхности и препятствуют дальнейшему разрушению металла.
Иначе обстоит дело при воздействии па металл жидкой среды — воды и растворенных в ней веществ. Образующиеся при этом соединения могут растворяться, вследствие чего коррозия распространяется дальше вглубь металла.
Кроме того, вода, содержащая растворенные вещества, является проводником электрического тока, из-за чего постоянно возникают электрохимические процессы, являющиеся одним из главных факторов, обусловливающих и усиливающих коррозию.
Металлы с малым содержанием примесей (чистые металлы) во многих случаях почти не подвергаются коррозии. Даже железо в особо чистом виде почти не ржавеет.
Но обыкновенные технические металлы содержат значительное количество примесей, что способствует коррозии.
Чтобы понять, почему примеси влияют па коррозию, посмотрим, что происходит, когда два различных металла соприкасаются, находясь во влажной среде.
Рис. 25.4. Схема коррозии алюминия в контакте с медью
Представим себе медные листы, соединенные алюминиевой заклепкой (рис. 25.4). Поверхность металлов будет покрыта тончайшей пленкой
адсорбированной воды. В воде имеются ионы Н'4 и ОН . Кроме того, ионы образует поглощаемый из воздуха углекислый газ:
Следовательно, медь и алюминий как бы погружены в раствор, содержащий ионы. Получается гальванический элемент, в котором отрицательным электродом является алюминий, а положительным медь.
Поскольку заклепка соприкасается с медью, электрическая цепь замкнута и элемент работает: алюминий отдает ионы в раствор, а избыточные электроны переходят к меди, у поверхности которой они разряжают ионы водорода.
В растворе ионы алюминия реагируют с ионами ОН-, образуя гидроксид, оседающий на поверхности металла:
Таким образом, алюминий подвергается коррозии. Смысл участия в этом процессе меди состоит в том, что водород образуется за счет электронов алюминия на поверхности меди, не препятствуя переходу ионов Л13+ в раствор. Процесс идет непрерывно, но довольно медленно, так как в гальваническом элементе велико электрическое сопротивление из-за низкой концентрации ионов.
Правильность этих рассуждений можно подтвердить опытом с использованием электролита с хорошей проводимостью — раствором кислоты. В раствор соляной кислоты в пробирке внесем гранулу химически чистого цинка.
На поверхности цинка медленно появляются пузырьки водорода. Вокруг поверхности металла образуется барьер из положительно заряженных ионов цинка, отталкивающих ионы водорода. Это мешает их восстановлению.
Теперь коснемся поверхности цинка очищенной медной проволокой.
По всей поверхности проволоки начинается образование пузырьков водорода (рис. 25.5).
Раствор остается бесцветным, чем исключается возможность реакции окисления меди до ионов Си2 Электроны отдают атомы цинка, превращаясь в ионы 2п2 и эти электроны, проходя через медный проводник, восстанавливают водород. Это тот же процесс коррозии активного металла в контакте с неактивным металлом, идущий при значительной концентрации электролита.
Приблизительно так же, как в примере с алюминиевой заклепкой, происходит первая стадия коррозии стали, находящейся в контакте с медью. Здесь окисляются атомы железа и образуется гидроксид Ре(ОН)2. Этот продукт далее окисляется при участии кислорода воздуха, образуя характерную ржавчину:
Рис. 25.5. Выделение водорода на меди при ее контакте с цинком
В обоих примерах причиной коррозии алюминия и стали является контакт с менее активным металлом медью. Такую же роль, как и медь, могут играть различные примеси, всегда содержащиеся в технических металлах.
Например, обыкновенная сталь при исследовании ее под микроскопом оказывается состоящей из мелких зерен (неправильно ограненных кристаллов) чистого железа, перемешанных с зернами карбида железа — цементита Ре3С и других примесей. Получается бесчисленное множество гальванических пар, в которых зерна цементита играют роль положительных электродов, а зерна железа — отрицательных.
При соприкосновении с влажным воздухом возникают гальванические токи, способствующие коррозии. Аналогичным образом в других сплавах коррозия идет легче, чем в чистых металлах.
На скорость коррозии металлов, помимо примесей, влияют и другие факторы: структура металла, способ его обработки, примеси в корродирующей среде. Но во всех случаях процесс коррозии может быть замедлен добавлением некоторых веществ, главным образом органических, получивших название ингибиторов (замедлителей) коррозии.
Действие ингибиторов иногда настолько эффективно, что некоторые металлы и сплавы становятся практически нерастворимыми в кислотах, к которым прибавлен соответствующий ингибитор.
Замедляя растворение металла, ингибиторы в то же время совершенно не влияют на скорость растворения оксидов гидроксидов и других веществ. Поэтому, применяя ингибиторы, можно очищать кислотами поверхности металлов от соединений, образовавшихся в результате коррозии. Такими растворами можно удалить ржавчину со стального изделия, накипь со стенок котла и т.д.
Так как металлы расположены в ряду напряжений по убывающей активности, то следовало бы ожидать, что чем левее стоит металл в этом ряду, тем сильнее он будет подвергаться коррозии. В действительности это не всегда имеет место. Например, алюминий, находящийся в ряду намного левее водорода, довольно устойчив к атмосферной коррозии.
Причиной этого является образование на поверхности алюминия тонкого, но очень плотного и хорошо удерживаемого поверхностью металла слоя оксида алюминия. Этот слой защищает алюминий от дальнейшего воздействия атмосферного кислорода.
И действительно, стоит только тем или иным способом удалить этот слой, как алюминий начинает быстро корродировать.
Смочим хорошо вычищенную наждачной бумагой алюминиевую пластинку раствором хлорида ртути(П) НйС12. Алюминий вытесняет ртуть и образует с ней сплав — амальгаму ртути, препятствующую возникновению плотной защитной пленки.
Поэтому оставленная на воздухе пластинка быстро покрывается рыхлыми хлопьями гидроксида алюминия, являющегося продуктом коррозии.
В данном случае коррозия усиливается еще и вследствие контакта алюминия с малоактивным металлом ртутью.
Защитный слой на некоторых металлах может возникать в результате специальной обработки поверхности. Вещества, способствующие возникновению на металле защитной пленки, носят название пассивирующих агентов. Таковыми для многих металлов могут быть сильные окислители.
Для железа хорошим пассивирующим агентом служат ионы ОН”. Многие довольно активные металлы, включая и алюминий, пассивируются под действием концентрированной азотной кислоты.
Образование на металле тончайшего оксидного слоя при воздействии азотной кислоты доказывается различными методами: поляризацией отраженного света, рентгенографическим и др.
Некоторые вещества разрушают поверхностные пленки или ослабляют их защитное действие. Такие вещества называют активаторами коррозии. Особенно энергичным активатором коррозии для всех металлов является ион хлора.
Коррозионное разрушение подводных участков корпусов морских судов объясняется главным образом присутствием ионов С1” в морской воде. Очень энергичными активаторами для коррозии многих металлов являются ионы водорода.
Кислород, растворенный в воде, также сильно ускоряет коррозию, реагируя с первичными продуктами реакции, например, окисляя гидроксид железа(И) (см. выше).
Коррозия причиняет огромные убытки хозяйству. Ежегодно из-за коррозии приходят в негодность стальные изделия, по массе равные четверти годового производства стали. Поэтому процессы коррозии изучаются, совершенствуются методы ее предотвращения или замедления.
Способы борьбы с коррозией весьма разнообразны. Наиболее простой из них заключается в защите поверхности металла от непосредственного соприкосновения с окружающей средой путем покрытия красками, лаком, эмалью или, наконец, слоем другого металла. С теоретической точки зрения наибольший интерес представляют металлические покрытия. Рассмотрим подробнее этот вид защиты от коррозии.
Будем считать, что сначала нанесенный на поверхность изделия слой защищающего металла не имеет дефектов, и изделие ведет себя так, как если бы оно целиком состояло из защищающего металла. Коррозия защищенного металла отсутствует.
Но с течением времени на поверхности появляются царапины, трещины, сколы и т.д., обнажающие поверхность материала и создающие условия для возникновения коррозии.
В зависимости от относительного положения металлов в ряду напряжений процесс коррозии пойдет по-разному.
Разберем сначала случай так называемого катодного покрытия, когда защищающий металл стоит в ряду напряжений правее защищаемого, т.е. менее активен. Типичным примером может служить коррозия луженой, т.е. покрытой оловом, стали (белая жесть).
Олово само по себе очень стойко и хорошо защищает металл, пока покрывает его сплошным слоем. При нарушении целостности защитного слоя и соприкосновении металла с влагой образуется гальваническая пара, в которой положительным электродом (катодом) служит олово, а отрицательным (анодом) — сталь.
Начинается процесс, уже рассмотренный для случая контакта двух металлов в сплаве или изделии, состоящем из двух металлов.
Электроны с железа перетекают на олово, и на его поверхности восстанавливаются ионы водорода, а сталь подвергается коррозионному разрушению (рис. 25.6, а). Таким образом, в месте повреждения луженая сталь ржавеет гораздо быстрее, чем нелуженая.
Рис. 25.6. Схема коррозии стали:
а — луженая сталь; б — оцинкованная сталь
Совершенно иначе протекает коррозия, если защищающий металл стоит в ряду напряжений левее защищаемого, т.е. более активен (анодное покрытие). Примером является оцинкованная жесть.
В этом случае при повреждении защитного слоя тоже получается гальваническая пара, но теперь железо служит катодом, а цинк анодом. Электроны перетекают от цинка на железо (рис. 25.6, 6), и разрушается цинк.
Защита действует до тех пор, пока не будет разрушено все цинковое покрытие, на что требуется достаточно много времени.
Для защиты стальных конструкций, погруженных в воду (портовые сооружения и др.), вместо защитных покрытий применяются металлические протекторы.
Это цинковый лист или болванка, соединенные с конструкцией медным проводником.
Электроны с протектора переходят на конструкцию, и протектор постепенно растворяется, сохраняя в хорошем состоянии саму конструкцию. По мере необходимости протекторы заменяют.
Из сказанного ясно, что для защиты от коррозии целесообразно применять более активный металл в виде покрытия или протектора. Однако другие соображения нередко заставляют применять также покрытия из менее активных металлов.
В качестве активного покрытия стали нередко применяется кадмий, однако из-за ядовитости образующихся соединений кадмия применение его для этой цели следует строго ограничить.
Из менее активных металлов для покрытия стали используют, кроме олова, медь, никель, серебро и золото.
Покрытые никелем стальные изделия имеют красивый вид, чем объясняется широкое распространение никелирования. При повреждении слоя никеля коррозия происходит менее интенсивно, чем при повреждении слоя меди или олова, так как разность потенциалов для пары никель — железо гораздо меньше, чем для пар медь — железо и олово — железо.
В прикладных областях науки постоянно ведется поиск синтетических материалов, заменяющих металлы и, таким образом, устраняющих проблему их коррозии. Замену металлических корпусов изделий и многих рабочих деталей на пластмассовые можно видеть на многих примерах хозяйственной техники.
Крайне актуальна проблема замены металлических трубопроводов трубами из композиционных материалов, включающих высокостойкие полимеры, в частности фтороуглеродные (тефлон).
Достигается увеличение срока эксплуатации труб в несколько раз, и этим сокращаются земляные и другие виды работ, связанных с ремонтом подземных коммуникаций.






