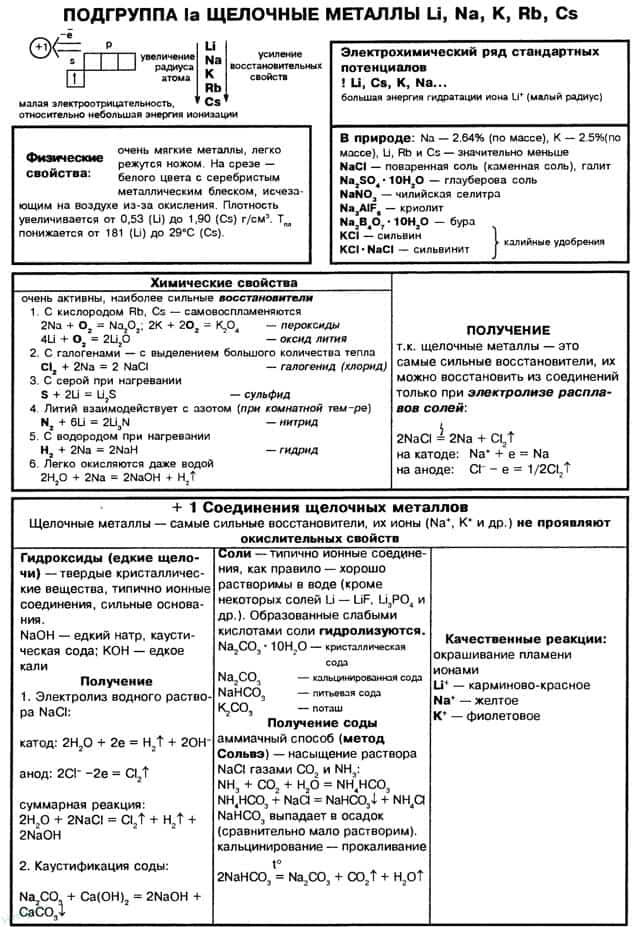
- Характерные химические свойства щелочных металлов
- 2. Реакция щелочных металлов с кислородом:
- 3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 4. Реакция щелочных металлов с кислотами
- 5. Взаимодействие щелочных металлов с аммиаком
- 6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
- 7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
- Получение щелочных металлов
- Особенности химических свойств s-элементов I группы и их физиологическое действие
- Атомы элементов 1(Ia) группы
- Физические свойства щелочных металлов
- Химические свойства щелочных металлов
- Получение и применение щелочных металлов
- I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- 2.2.1. Характерные химические свойства щелочных металлов
- Взаимодействие щелочных металлов с неметаллами
- с кислородом
- с галогенами
- с азотом
- с фосфором
- с водородом
- с серой
- с водой
- с галогенпроизводными углеводородов (реакция Вюрца):
- со спиртами и фенолами
Щелочные металлы
Сегодня мы поговорим о строении и свойствах атомов элементов I A группы, о физических и химических свойствах щелочных металлов, об основных соединениях щелочных металлов, истории открытия некоторых щелочных металлов и ещё много чего интересного.
Как вы помните, к щелочным металлам относятся элементы I A группы. Это литий, натрий, калий, рубидий, цэзий, франций. Франций является редким радиоактивным элементом.
Теперь рассмотрим строение и свойства атомов элементов I A группы.
Посмотрев в Периодическую таблицу, мы видим, что на внешнем энергетическом уроне у этих атомов один электрон, потому что все они расположены в I A группе, этот внешний электрон находится далеко от ядра, поэтому он легко отрывается и атом превращается в ион. Для всех элементов этой группы характерна только степень окисления +1.
Все щелочные металлы являются восстановителями из-за способности отдавать электроны. Причём восстановительные свойства сверху вниз в группе увеличиваются, так как увеличиваются радиусы атомов, металлические свойства также усиливаются сверху вниз. Элементы I A группы – типичные металлы.
Строение мы разобрали, а теперь поговорим о физических свойствах щелочных металлов.
Как вы уже знаете, это серебристо-белые мягкие металлы. Наиболее твёрдым является литий, но он также как и все щелочные металлы легко режется ножом.
Посмотрите таблицу, здесь указана температура плавления, температура кипения и плотность щелочных металлов.
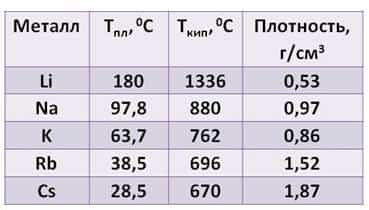
- Из таблицы видно:
- · плотность их увеличивается от лития к цезию
- · температура плавления, в отличие от плотности, уменьшается от лития к цезию
- · температура кипения тоже уменьшается от лития к цезию.
Все щелочные металлы лёгкие. Например, плотность лития примерно в два раза ниже плотности воды. А температура плавления цезия меньше температуры человеческого тела.
С физическими свойствами мы разобрались, теперь можем перейти и к химическим свойствам.
Элементы I A группы обладают очень высокой химической активностью. В лабораториях эти металлы хранят под слоем керосина, с которым они не взаимодействуют.
В реакции с кислородом оксид образует только литий, при этом образуется оксид лития, степень окисления лития +1, а кислорода -2. А натрий в реакции с кислородом образует пероксид натрия, в этом соединении, в отличие от оксида, степень окисления кислорода -1, а натрия степень окисления +1.
В реакцию с азотом при обычной температуре вступает только литий, при этом образуется нитрид лития, в этих бинарных соединениях степень окисления азота -3, а лития +1. Остальные щелочные металлы реагируют с азотом тольлко при нагревании.
В реакции с водородом щелочные металлы образуют гидриды. Так в реакции водорода с натрием образуется гидрид натрия. Степень окисления натрия +1, а водорода -1.
С галогенами щелочные металлы образуют галогениды. Так в реакции калия с бромом образуется бромид калия, где степень окисления калия +1, брома -1, в реакции натрия с хлором образуется хлорид натрия, где степень окисления натрия +1, а хлора -1.

С серой эти щелочные металлы образуют сульфиды. Например в реакции лития с серой образуется сульфид лития, где степень окисления лития +1, а серы -2.
- Как вы помните, все щелочные металлы активно реагируют с водой с образованием щелочей, при этом вода восстанавливается до водорода.
- Например, в результате взаимодействия натрия с водой образуется газ водород, который можно собрать методом вытеснения воздуха.
- Так в реакии натрия с водой образуется щёлочь – гидроксид натрия и выделяется водород.
- Причём скорость взаимодействия металла с водой будет увеличиваться от лития к цэзию, ведь металлические и восстановительные свойства также усиливаются.
Все щелочные металлы легко растворяются в растворах кислот с образованием соответствующих солей и водорода. Однако эти реакции проводят редко из-за того, что идут побочные реакции с водой. Например, в реакции калия с соляной кислотой образуется соль – хлорид калия и газ водород, в реакции натрия с серной кислотой образуется соль – сульфат натрия и газ водород.
Сами щелочные металлы получают путём электролиза расплавленных хлоридов или гидроксидов. Например, твёрдый хлорид натрия под действием электрического тока разлагается на металл натрий и газ – хлор.
- Вы убедились, что щелочные металлы обладают высокой химической активностью, поэтому в свободном виде они не встречаются, а только в виде соединений.
- Познакомимся с некоторыми из них.
Оксиды щелочных металлов – твёрдые вещества, обладают ярко выраженными основными свойствами, они реагируют с водой, кислотами и кислотными оксидами.
Так, в реакции оксида лития с водой образуется гидроксид лития, в реакции оксида натрия с серной кислотой образуется соль – сульфат натрия и вода, в результате взаимодействия оксида калия с оксидом углерода четыре, образуется соль – карбонат калия.
Оксиды натрия и калия получают, прокаливая пероксиды с соответствующими металлами. Это окислительно-восстановительная реакция, при которой кислород меняет свою степень окисления с минус -1 до -2, а натрий повышает свою степень окисления с 0 до +1.
Гидроксиды элементов I A группы – твёрдые белые вещества, хорошо растворимые в воде с образованием щелочей, очень гигроскопичны, поэтому расплываются на воздухе.
Растворы щелочей мыльные на ощупь. При растворении их в воде выделяется большое количество теплоты.
Гидроксиды щелочных металлов – сильные основания, они реагируют с кислотами, кислотными оксидами, солями, амфотэрными оксидами и гидроксидами.
Например, в рекции гидроксида калия с серной кислотой, образуетсся соль – сульфат калия и вода. В реакции гидроксида натрия с кислотным оксидом серы (VI) – образуется соль – сульфит натрия и вода.
В результате взаимодействия гидроксида натрия с солью сульфатом меди (II) , образуется соль – сульфат натрия и нерастворимое основание гидроксид меди (II). В реакции гидроксида калия с амфотэрным оксидом цинка, образуется соль – цинкат калия и вода.
В результате взаимодействия гидроксида калия с амфотэрным гидроксидом цинка в водной среде , образуется комплексная соль – тэтрагидроксоцинкат натрия.
Естественно, что гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов с водой или их оксидов с водой. При зиимодействии натрия с водой образуется гидроксид натрия и водород, в результате реакции оксида натрия с водой также образуется гидроксид натрия.
Рассморим свойства и применения соединений щелочных металлов.
Например, гидроксид натрия – NaOH – в технике известен как едкий натр, каустическая сода, а также каустик, а вот гидроксид калия – KOH называют в технике едкое кали. Оба этих гидроксида разъедают ткани и бумагу, поэтому их называют едкими щелочами.
Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, производства мыла и волокон, а едкое кали – для производства жидкого мыла.
Соли щелочных металлов – твёрдые кристаллические вещества с ионным типом кристаллической решётки. В прошлом из-за соли нередко вспыхивали войны и народные волнения (соляные бунты), а в некоторых странах куски соли служили разменной монетой.
- Рассмотрим наиболее значимые соли.
- Кристаллическую соду – Na2CO3 ∙ 10 H2O – используют при производстве стекла, бумаги, мыла, в быту и стиральных порошках.
- Питьевую соду – NaHCO3используют в быту и пищевой промышленности, а также в медицине.
- Поташ, или карбонат калия – K2CO3используют при производстве жидкого мыла, в качестве удобрения и получения тугоплавкого стекла.
- Кристаллогидрат сульфата натрия, или глауберова соль –
- Na2SO4 ∙ 10 H2O применяется для производства соды и стекла, в качестве слабительного средства.
Поваренная соль, или хлорид натрия – NaCl используется при производстве соляной кислоты, гидроксида натрия, хлора, натрия и соды, для консервирования, как приправа к пище, при производстве мыла. Хлорид натрия – галит содержится в моской воде и при высыхании морей образует мощные пласты каменной соли.
Биологическая роль ионов натрия и калия очень велика. Так, ионы натрия содержатся в крови и лимфе, ионы калия – основной внутриклеточный ион.
Соотношение концентраций этих ионов регулирует давление крови, обеспечивает перемещение растворов солей из корней в листья растений. В организме человека концентрация ионов калия внутри клеток выше, чем ионов натрия.
В межклеточном постранстве, наоборот, концентрация ионов натрия выше, чем ионов калия. Различные концентрации этих ионов внутри и снаружи клеток позволяет регулировать водные потоки через мембраны.
Кроме этого, калий поддерживает работу сердечной мышцы.
Взрослому человеку в сутки необходимо три с половиной грамма калия. Калий содержится в кураге, сое, фасоле, зелёном горошке, черносливе, изюме и других продуктах.
Ребята, решите интересную задачу. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
В условии задачи нам сказано, что в 100 г кураги содержится 2,034 г калия, а в сутки человеку необходимо 3,5 г калия. Найти необходимо массу кураги.
Для решения этой задачи составим выражение: 2 г калия содержится в 100 г кураги, 3,5 г калия содержится в Х граммах кураги, найдём Х. Для этого 3,5 умножим на 100 и разделим на 2,034, получаем 172 г.
Для того, чтобы получить суточную норму калия человеку необходимо съесть 172 г кураги.
Калий нужен и растениям. Он является одним из элементов питания. Ежегодно большое количество калия уходит из почвы. Недостаток калия в почве, понижает интенсивность фотосинтеза. Это приводит:
- · к уменьшению содержания сахаров в корнеплодах свёклы и крахмала в зерне
- · отмиранию листьев растений
- · повышению восприимчивости к грибковых и бактериальным заболеваниям
- · снижению всхожести семян.
- Поэтому для получения высоких урожаев сельскохозяйственных культур необходимо внесение калийных удобрений, таких солей калия, как хлорид, нитрат, карбонат, сульфат калия.
- Соли щелочных металлов окрашивают пламя в различные цвета: литий – в карминово-красный цвет, натрий – в жёлтый, калий, рубидий и цэзий – в фиолетовый.
Для того чтобы это доказать, проведём лабораторный опыт. Возьмём лучинку и закрепим на ней спираль из проволоки. Обмакнём её сначала в соляную кислоту, затем в сухую соль натрия и поднесём к пламени спиртовки. Пламя, окрашивается в жёлтый цвет.
Сейчас возмём лучинку со спиралью из проволоки, обмакнём в кислоту, но теперь поместим в сухую соль калия и поднесём к пламени спиртовки. Пламя окрашивается в фиолетовый цвет.
Открытии щелочных металлов. Так, литий был открыт в 1817 году шведским химиком Арфвэдсоном и назван литием, так как литос от греческого означает камень, потому что он был обнаружен в камне.
Натрий и калий был получен английским химиком Дэви в 1807 году при электролизе едких щелочей. Натрий от арабского натрун означает сода, а калий от арабского алкали – щёлочь.
Сделаем вывод: щелочные металлы – это элементы I А группы, у них один электрон на внешнем энергетическом уровне. Все они – восстановители, проявляют степень окисления равную +1.
Это мягкие металлы и легко режутся ножом, у них сравнительно невысокие температуры плавления, они обладают высокой химической активность, реагируют с простыми и сложными веществами .
Их получают в результате электролиза расплавов, встречаются в природе только в виде соединений, соединения щелочных металлов имеют большое значение в жизни человека и в народном хозяйстве.
Характерные химические свойства щелочных металлов
- •Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
- •Все соединения щелочных металлов имеют ионный характер.
- •Практически все соли растворимы в воде.
- •Низкие температуры плавления,
- •Малые значения плотностей,
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги.
Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
-

- 2Na + 2H 2 O → 2NaOH + H 2
- 2Li + 2H 2 O → 2LiOH + H 2
2. Реакция щелочных металлов с кислородом:
- 4Li + O 2 → 2Li 2 O (оксид лития)
- 2Na + O 2 → Na 2 O 2 ( пероксид натрия)
- K + O 2 → KO 2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 2Li + Cl 2 → 2LiCl (галогениды)
- 2Na + S → Na 2 S (сульфиды)
- 2Na + H 2 → 2NaH (гидриды)
- 6Li + N 2 → 2Li 3 N (нитриды)
- 2Li + 2C → Li 2 C 2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H 2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH 3 = 2LiNH 2 + H 2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2 ;
2K + 2C 6 H 5 OH = 2C 6 H 5 OK + H 2 ;
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
- Li + – карминово-красный

- Na + – желтый
- K + , Rb + и Cs + – фиолетовый
Получение щелочных металлов
- Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl 2 В небольших масштабах используется также вакуум-термическое получение натрия и калия:
- 2NaCl+CaC 2 =2Na+CaCl 2 +2C; 4KCl+4CaO+Si=4K+2CaCl 2 +Ca 2 SiO 4 .
- Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).
-
Особенности химических свойств s-элементов I группы и их физиологическое действие
Электронная конфигурация атома лития 1s 2 2s 1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li + со стабильной конфигурацией инертного газа (гелия).
Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл.
От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li + сильно сольватирован; его окружают несколько десятков молекул воды.
Литий по величине энергии сольватации — присоединения молекул растворителя, стоит ближе к протону, чем к катионам щелочных металлов.
Малый размер иона Li + , высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е — , занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s 2 2s 2 2p 6 3s 1 . Единственная степень окисления натрия +1.
Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na + значительно больше, чем Li + , и сольватация его не так велика.
Однако в растворе в свободном виде он не существует.
Физиологическое значение ионов К + и Na + связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами.
Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К + , вследствие чего внутриклеточная концентрация К + значительно выше, чем ионов Na + . В то же время в плазме крови концентрация Na + превышает содержание в ней калия. С этим обстоятельством связывают возникновение мембранного потенциала клеток.
Ионы К + и Na + ‑ одни из основных компонентов жидкой фазы организма. Их соотношение с ионами Са 2+ строго определенно, а его нарушение приводит к патологии. Введение ионов Na+ в организм не оказывает заметного вредного влияния.
Повышение же содержания ионов К + вредно, но в обычных условиях рост его концентрации никогда не достигает опасных величин. Влияние ионов Rb + , Cs + , Li + еще недостаточно изучено.
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв.
Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте.
При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов.
В соединениях калия связь более ионная, а в виде иона К + он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39 К, 40 К, 41 К. Один из них 40 К ‑ радиоактивен и определенная доля радиоактивности минералов и почвы связана с присутствием этого изотопа.
Его период полураспада велик ‑ 1,32 млрд. лет. Определить присутствие калия в образце довольно легко: пары металла и его соединения окрашивают пламя в фиолетово-красный цвет. Спектр элемента довольно прост и доказывает наличие 1е — на 4s-орбитали.
Изучение его послужило одним из оснований для нахождения общих закономерностей в строении спектров.
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р.
Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей.
Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации.
Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (39 0 C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах.
Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно.
Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах.
В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li 3 N (до 75%) и Li 2 O. Остальные щелочные металлы образуют пероксиды (Na 2 O 2 ) и надпероксиды (K 2 O 4 или KO 2 ).
- Перечисленные вещества реагируют с водой:
- Li 3 N + 3 H 2 O = 3 LiOH + NH 3 ;
- Na 2 O 2 + 2 H 2 O = 2 NaOH + H 2 O 2 ;
- K 2 O 4 + 2 H 2 O = 2 KOH + H 2 O 2 + O 2 .
- Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
- Na 2 O 2 +CO 2 =Na 2 CO 3 +0,5O 2 ;
- K 2 O 4 + CO 2 = K 2 CO 3 + 1,5 O 2 .
- В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных. Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
- 2Li+H 2 =2LiH.
- Гидрид лития используется как сильный восстановитель.
- Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
- SiO 2 +2NaOH=Na 2 SiO 3 +H 2 O.
- Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 1300 0 С). Некоторые соединения натрия называют содами :
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na 2 CO 3 ; б) кристаллическая сода – кристаллогидрат карбоната натрия Na 2 CO 3 . 10H 2 O; в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO 3 ; г) гидроксид натрия NaOH называют каустической содой или каустиком.
Атомы элементов 1(Ia) группы
| Порядковый номер | 3 | 11 | 19 | 37 | 55 | 87 |
| Атомная масса (относительная) | 6,94 | 22,98 | 39,09 | 85,46 | 132,9 | 223 |
| Плотность (н.у.), г/см3 | 0,534 | 0,971 | 0,856 | 1,53 | 1,87 | 1,87 |
| tпл, °C | 180 | 97 | 63 | 39 | 28 | 18 |
| tкип, °C | 1339 | 882 | 773 | 668 | 667 | 640 |
| Энергия ионизации, кДж/моль | 513,3 | 495,8 | 418,8 | 403,0 | 375,7 | 380 |
| Электронная формула | [He]2s1 | [Ne]3s1 | [Ar]4s1 | [Kr]5s1 | [Xe]6s1 | [Rn]7s1 |
| Электроотрицательность (по Поллингу) | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,7 |
Электронные формулы инертных газов:
- He — 1s2;
- Ne — 1s22s22p6;
- Ar — 1s22s22p63s23p6;
- Kr — [Ar]3d104s24p6;
- Xe — [Kr]4d105s25p6;
- Rn — [Xe]4f145d106s26p6.
Соединения щелочных металлов:
В 1 группу(Ia группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 6 металлов: литий, натрий, калий, рубидий, цезий, франций (см. таблицу выше). Эти металлы принято называть щелочными, поскольку при взаимодействии с водой эти металлы (и их оксиды) образуют щелочи.
Самым распространенным из щелочных металлов в земной коре является натрий (2,3% по массе), далее идут калий (2,1%), рубидий (0,009%), литий (0,002%), цезий (0,0003%). Щелочные металлы по причине их высокой активности в природе в свободном виде не встречаются.
Природные соединения и минералы, богатые натрием и калием:
- NaCl — галит;
- KCl — сильвит;
- KCl·NaCl — сильвинит;
- K[AlSiO3O8] — ортоклаз.
Все атомы элементов 1(Ia) группы на внешнем энергетическом уровне имеют по одному валентному s-электрону (см. Электронная конфигурация атомов), с которым в химических соединениях достаточно легко «расстаются» с целью завершения внешнего энергетического уровня, который становится в таком случае устойчивым, по аналогии с завершенным энергетическим уровнем инертных газов.
Таким образом, отдавая «ненужный» электрон щелочные металлы в химических соединениях проявляют степень окисления +1.
Нетрудно заметить, что с ростом порядкового номера щелочного металла увеличивается не только общее кол-во электронов (энергетических уровней), но также и радиус атома, что в свою очередь, обуславливает уменьшение энергии ионизации (соответственно усиление металлических свойств элемента) в направлении от лития к францию (по мере увеличения радиуса атома щелочного элемента) — франций со своим s-электроном расстается гораздо легче, чем литий. Говоря другими словами, с ростом радиуса атома (номера элемента) возрастает реакционная (восстановительная) способность щелочного металла.
Физические свойства щелочных металлов
Многие физические свойства щелочных металлов обусловлены металлическими связями, возникающими между атомами этих металлов по причине их низкой энергии ионизации:
- щелочные металлы имеют серебристо-белый цвет;
- низкую плотность;
- низкую температуру плавления (температуры плавления уменьшаются в подгруппе сверху-вниз);
- обладают высокой пластичностью;
- высокой электро- и теплопроводностью.
Химические свойства щелочных металлов
Как уже было сказано выше, щелочные металлы очень легко вступают в химические реакции с другими элементами, отдавая при этом «ненужный» валентный электрон (см. Валентность) и превращаясь в положительно заряженный ион (катион).
Щелочные металлы легко реагируют со многими простыми веществами:
- с кислородом щелочные металлы образуют оксиды (Li), пероксиды (Na), суперпероксиды: 4Li + O2 = 2Li2O; 2Na + O2 = Na2O2; K + O2 = KO2;
- с серой образуют сульфиды:2Na+S = Na2S
- с водородом образуют гидриды:2Na+H2 = 2NaH
- взаимодействуют с галогенами (F, Cl, Br, I), образуя галогениды: 2Li + F2 = 2LiF;
- бурно реагируют с водой (активность возрастает с ростом атомного номера — натрий воспламеняется, а рубидий взрывается): 2Na + 2H2O = 2NaOH + H2;
- бурно реагируют с кислотами:
- с соляной и разбавленной серной реагируют с выделением водорода: 2K + H2SO4(рзб) = K2SO4 + H2;
- с концентрированной серной восстанавливают серу до степени окисления -2: 8Na + 5H2SO4(кнц) = 4Na2SO4 + H2S + 4H2O;
- с разбавленной азотной продуктом восстановления является нитрат аммония (ст. ок. -4) или аммиак: 8Na + 10HNO3(рзб) = 8NaNO3 + NH4NO3 + 3H2O;
- с концентрированной азотной продуктом восстановления является оксид азота (I): 8Na + 10HNO3(кнц) = 8NaNO3 + N2O + 5H2O.
Щелочные металлы окрашивают пламя в следующие цвета:
- Li — светло-красный;
- Na — желтый;
- K — сине-фиолетовый;
- Rb — темно-красный;
- Cs — бледно-голубой.
Получение и применение щелочных металлов
Промышленным способом щелочные металлы получают электролизом расплавов хлоридов (гидроксидов) этих металлов.
NaCl → Na++Cl- (700°C)
Na++e- → Na0 (катод)
2Cl—2e- → Cl20 (анод)
2NaCl → 2Na+Cl2↑
Металлотермические методы получения щелочных металлов (рубидий и цезий получают в вакуумной среде):
- 3LiO + 2Al = Al2O3 + 3Li;
- Na + KCl = NaCl + K;
- 2RbCl + Ca = 2Rb + CaCl2;
- 2CsCl + Mg = 2Cs + MgCl2.
Применение щелочных металлов:
- Li:
- придает легкость сплавам, его применяют при производстве медных, магниевых и алюминиевых сплавов;
- в металлургии при помощи лития удаляют из металлических расплавов шлаки, содержащие азот, кислород и серу;
- в органическом синтезе.
- Na:
- в качестве наполнителей газоразрядных ламп;
- в качестве теплоносителя в ядерных реакторах;
- в органическом и неорганическом синтезе;
- в металлургии при производстве металлов и сплавов.
- K:
- для получения металлов;
- в качестве теплоносителя в ядерных реакторах;
- в фотоэлементах в качестве преобразователя световой энергии в электрическую.
- Rb, Cs:
- в источниках инфракрасного излучения;
- в фотоэлементах.
I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
- Литий Li,
- Натрий Na,
- Калий K,
- Цезий Cs,
- Рубидий Rb
- Франций Fr
- Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
- Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Литий
- Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
- Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Na2CO3 + 2C = 2Na + 3CO
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.:
- KCl + Na = K + NaCl
- KOH + Na = K + NaOH
- В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
- Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Качественные реакции — окрашивание пламени солями щелочных металлов
Цвет пламени:
Li — карминно-красныйNa — желтыйK — фиолетовыйRb — буро-красныйCs — фиолетово-красный
С кислородом
4Li + O2 = 2Li2O
- Натрий образует пероксид:
2Na + O2 = Na2O2
- Калий образует надпероксид:
- K + O2 = KO2
- С галогенами (F, Cl, Br, I)
- Щелочные металлы образуют галогениды:
- 2Li + F2 = 2LiF
- 2Na + Cl2 = 2NaCl
- 2K + I2 = 2KI
- С водородом
- Щелочные металлы образуют гидриды:
- 2Na + H2 = 2NaH
- С серой
- Щелочные металлы образуют сульфиды:
- 2Na + S = Na2S
- С азотом
- При комнатной температуре взаимодействует только литий:
- 6Li + N2 = 2Li3N
- Остальные щелочные металлы
реагируют с азотом при
нагревании: - 6Na + N2 = 2Na3N
- С углеродом
- Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
- 2Na + 2C → Na2C2 (t = 150-200 °C)
- С фосфором
- Щелочные металлы активно
реагируют с фосфором образуя фосфиды: - 3Na + P → Na3P
- С водой
- Щелочные металлы реагируют с водой при обычных
условиях: - 2Na + 2H2O = 2NaOH + H2
- Видео Взаимодействие щелочных металлов с водой
- С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
2K + H2SO4(разб) = K2SO4 +
H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 8Na + 5H2SO4(конц) = 4Na2SO4 +
H2S + 4H2O; - с разбавленной азотной
- 8Na + 10HNO3(разб) = 8NaNO3 + NH4NO3 + 3H2O;
- с концентрированной азотной
- 8Na + 10HNO3(конц) =
8NaNO3 + N2O + 5H2O. - 2СH3COOH + 2Li → 2CH3COOOLi + H2↑
- С солями
- В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
- 3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.
2.2.1. Характерные химические свойства щелочных металлов
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
- Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
- Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
- 4Li + O2 = 2Li2O
- Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
- 2Na + O2 = Na2O2,
- а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
- K + O2 = KO2
- Rb + O2 = RbO2
с галогенами
- Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
- 2Li + Br2 = 2LiBr бромид лития
- 2Na + I2 = 2NaI иодид натрия
- 2K + Cl2 = 2KCl хлорид калия
с азотом
- Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
- 6Li + N2 = 2Li3N нитрид лития
- 6K + N2 = 2K3N нитрид калия
с фосфором
- Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
- 3Na + P = Na3Р фосфид натрия
- 3K + P = K3Р фосфид калия
с водородом
- Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
- Н2 + 2K = 2KН-1 гидрид калия
- Н2 + 2Rb = 2RbН гидрид рубидия
с серой
- Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
- S + 2K = K2S сульфид калия
- S + 2Na = Na2S сульфид натрия
- Взаимодействие щелочных металлов со сложными веществами
с водой
- Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
- 2HOH + 2Na = 2NaOH + H2↑
- 2K + 2HOH = 2KOH + H2↑
- Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
- ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
- 2CH3OH + 2К = 2CH3OК + H2↑
- метилат калия
- 2C6H5OH + 2Na = 2C6H5ONa + H2
- фенолят натрия






