- Реакции замещения
- Кислотно-основные свойства Кислотные свойства уменьшаются в ряду, а основные возрастают:
- Кислотные свойства
- Основные свойства
- Реакции этерификации
- Реакции отщепления
- Реакции окисления
- Качественные реакции на спирты
- Спирты
- Классификация спиртов
- Номенклатура и изомерия спиртов
- Получение спиртов
- Химические свойства спиртов
- Спирты — химические свойства, формулы и получение
- Классификация спиртов
- По количеству гидроксогрупп
- По типу атома углерода, с которым связана гидроксогруппа
- По строению углеводородного радикала
- Номенклатура спиртов
- По систематической номенклатуре ИЮПАК (IUPAC)
- Радикально-функциональная номенклатура
- Тривиальная номенклатура
- Структурная
- Межклассовая
- Пространственная (оптическая)
- Получение спиртов
- Гидролиз галогенопроизводных алканов
- Гидратация алкенов
- Восстановление альдегидов и кетонов
- Реакция Канниццаро
- Гидролиз сложных эфиров
- Синтез Гриньяра
- Получение метанола из синтез-газа
- Получение этанола
- Реакция Вагнера
- Гидролиз жиров
- Физические свойства спиртов
- Температуры кипения спиртов
- Кислотно-основные свойства
- Замещение гидроксогруппы
- Реакция с использованием реактива Лукаса
- Дегидратация спиртов
- Реакция этерификации — получение сложных эфиров
- Взаимодействие с аммиаком
- Окисление
- Химические свойства многоатомных спиртов
- Кислотные свойства
- Взаимодействие со свежеосажденным гидроксидом меди (II)
- Окисление йодной кислотой и ее солями
- Образование эфиров с азотной кислотой
- Вопросы для самопроверки
- Физические и химические свойства одноатомных спиртов
- Физические свойства одноатомных спиртов
- Химические свойства одноатомных спиртов
- Химические свойства спиртов ROH определяются наличием полярных связей , и неподеленных электронных пар на атоме кислорода. В химических реакциях спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы)
- O–H (с отщеплением водорода)
- Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н+) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О — свойства основания и нуклеофильного реагента.
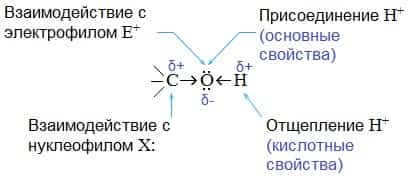
- С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
- Различают два основных типа реакций спиртов с участием функциональной группы –ОН:
- 1) Реакции с разрывом связи О-Н:
- а) взаимодействие спиртов со щелочными металлами с образованием алкоголятов;
- б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров;
- в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений.
- 2) Реакции сопровождающиеся разрывом связи С-О:
- а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация);
- б) замещение группы –ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов.
Спирты – амфотерные соединения.
Реакции замещения
Кислотно-основные свойства Кислотные свойства уменьшаются в ряду, а основные возрастают: 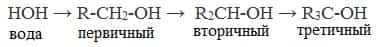
Кислотные свойства
- 1. Взаимодействие со щелочными и щелочноземельными металлами (Li, Na, K, Ca, Ba, Sr)
- Реакции с разрывом связи О-Н
- При действии на спирты активных металлов в безводной среде атом водорода гидроксильной группы замещается на металл:
- Образующиеся соединения (соли спиртов) называются алкоголятами — производные метилового спирта – метилатами, производные этилового спирта – этилатами.
- Видеоопыт «Взаимодействие спиртов с металлическим натрием»
- Алкоголяты химически не стабильны и при действии воды они полностью гидролизуются с образованием исходного спирта и щелочи:
Эта реакция показывает, что спирты по сравнению с водой являются более слабыми кислотами (сильная кислота вытесняет слабую). При взаимодействии с растворами щелочей спирты не образуют алкоголяты.
![]()
Спирты не взаимодействуют с водными растворами щелочей.
Основные свойства
2.Взаимодействие с галогенводородными кислотами
Реакции с разрывом связи С-О
Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной минеральной кислоты (например, конц. H2SO4). При этом спирты проявляют свойства слабых оснований:
Видеоопыт «Взаимодействие этилового спирта с бромоводородом»
Реакции этерификации
Реакции с разрывом связи О-Н
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
- Отличительной особенностью этой реакции является то, что атом Н отщепляется от спирта, а группа ОН – от кислоты:
- Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
Реакции отщепления
- 1. Дегидратация (отщепление воды)
- Реакции с разрывом связи С-О
- При действии на спирты водоотнимающих реагентов, например, концентрированной серной кислоты, происходит отщепление воды – дегидратация.
- Она может протекать по двум направлениям: с участием одной молекулы спирта (внутримолекулярная дегидратация, приводящая к образованию алкенов) или с участием двух молекул спирта (межмолекулярная дегидратация, приводящая к получению простых эфиров).
- При переходе от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов и уменьшается способность образовывать простые эфиры.
- а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R-O-R'. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:
- Такие реакции отщепления называются реакциями элиминирования.
- Первый член гомологического ряда алканолов – метанол СН3ОН – не вступает в реакции внутримолекулярной дегидратации.
- Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
- 2. Дегидрирование
- Реакции с разрывом связей О-Н и С-Н
- а) При дегидрировании первичных спиртов образуются альдегиды:
Реакция происходит при пропускании нагретых до 3000С паров спирта без доступа воздуха над металлическими катализаторами (Cu или металлы платиновой группы – Pd, Pt, Ni). Ni является типичным катализатором дегидрирования или гидрирования, т.е. отщепления или присоединения водорода.
- В организме человека этот процесс происходит под действием (алкогольдегидрогеназы).
- б) При дегидрировании вторичных спиртов образуются кетоны:
- Третичные спирты не подвергаются дегидрированию.
Реакции окисления
Для спиртов характерны реакции горения с образованием углекислого газа и воды, а также реакции окисления, приводящие к получению альдегидов, кетонов и карбоновых кислот.
В лабораторных условиях для окисления спиртов обычно используют подкисленные растворы перманганата или дихромата калия, оксид меди и т.д.
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла. С увеличением массы углеводородного радикала – пламя становится всё более коптящим.
- Видеоопыт «Горение спиртов»
- При сгорании спиртов выделяется большое количество тепла:
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В этом случае энергия химических связей переходит в тепловую энергию, а затем в механическую, что позволяет двигаться автомобилям. В лабораторной практике этанол применяется как горючее для «спиртовок».
- 2. Неполное окисление
- 1). В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
- Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
- При окислении вторичных спиртов образуются кетоны.
- Например:
- Видеоопыт «Окисление этилового спирта раствором перманганата калия»
- Видеоопыт «Окисление этилового спирта кристаллическим перманганатом калия»
- Видеоопыт «Каталитическое окисление этанола»
- Видеоопыт «Окисление этанола (тест на алкоголь)»
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Качественные реакции на спирты
- 1. Окисление спиртов дихроматом (Na2Cr2O7) или перманганатом (КMnО4)
- Качественная реакция на первичные и вторичные спирты!
- В кислой среде
- Окисление Na2Cr2O7
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с раствором дихромата натрия. Для повышения скорости реакции ее проводят при нагревании, для создания кислой среды добавляют серную кислоту.
Первичные спирты окисляются дихроматом натрия до альдегидов.
Растворы дихроматов имеют оранжевый цвет и содержат хром в степени окисления +6. В кислой среде они переходят в растворы солей хрома в степени окисления +3 и приобретают зеленый цвет.
- На изменении цвета соединений хрома также основана работа алкотестеров, когда пары спирта, содержащиеся в выдыхаемом водителем воздухе, восстанавливают дихромат в стеклянной трубочке.
- Вторичные спирты окисляются дихроматом натрия до кетонов.
- Третичные спирты в реакции с дихроматами не вступают.
- Окисление KМnO4
Т.к. перманганат калия в кислой среде более сильный окислитель, чем дихромат, то окисление спирта не останавливается на стадии альдегида и продолжается дальше до карбоновой кислоты.
Раствор перманганата калия содержит марганец в степени окисления +7 и имеет розово-фиолетовый цвет. Если спирт взять в достаточном количестве, то произойдет обесцвечивание раствора. В кислой среде марганец перейдет в степень окисления +2.
Также как и дихроматом натрия, перманганатом калия вторичные спирты могут окисляться до кетонов. Далее возможна деструкция, т.е. разрушение органической молекулы и получение смеси веществ, которые не имеют практического применения.
- В жёстких условиях с перманганатом калия третичные спирты окисляются с расщеплением связей С-С и образованием смеси веществ.
- Метиловый спирт окисляется перманганатом калия до углекислого газа.
- 2. Окисление спиртов оксидом меди (II)
- Качественная реакция на первичные спирты!
- Первичные спирты окисляются оксидом меди (II) до альдегидов.
- Видеоопыт «Окисление этилового спирта оксидом меди (II)»
- Видеоопыт «Качественная реакция на этанол»
- Вторичные спирты окисляются оксидом меди (II) до кетонов.
- Третичные спирты оксидом меди (II) не окисляются.
- Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования.
- Предельные одноатомные спирты
Спирты
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д.
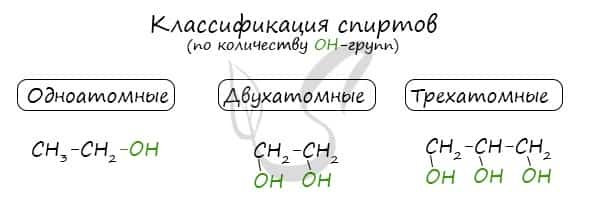
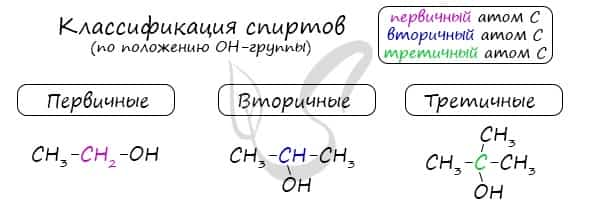
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
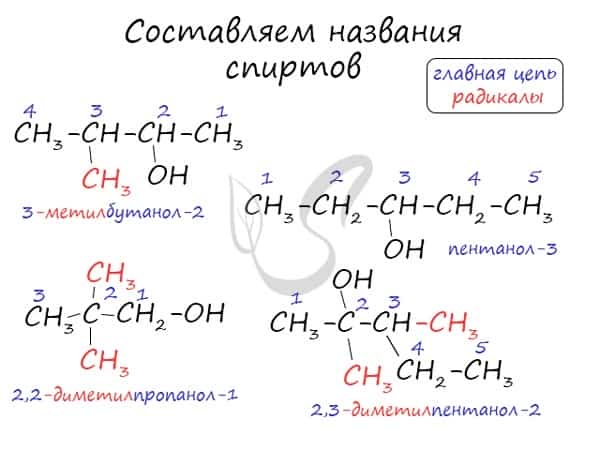
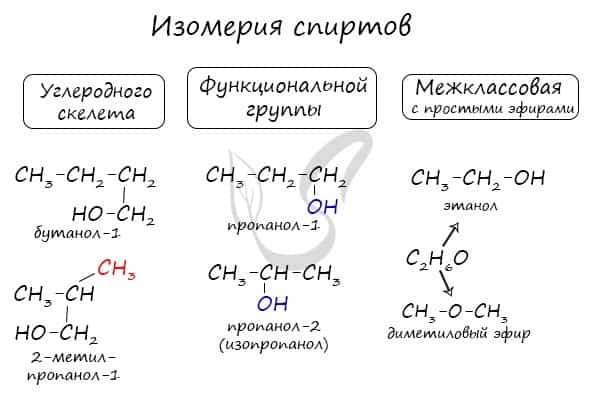
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
- Гидратация алкенов
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
- Получение этанола брожением глюкозы
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты. 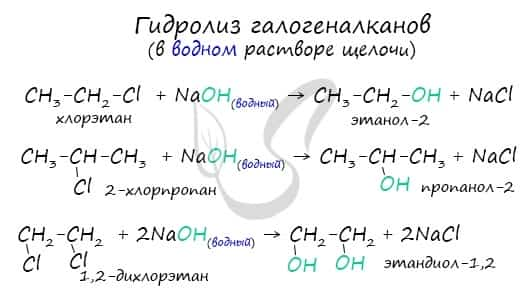
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода. 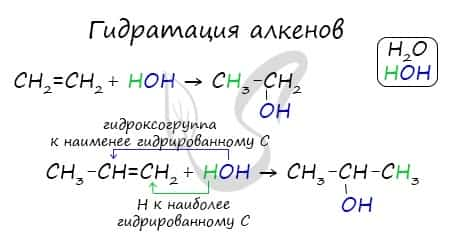
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты. 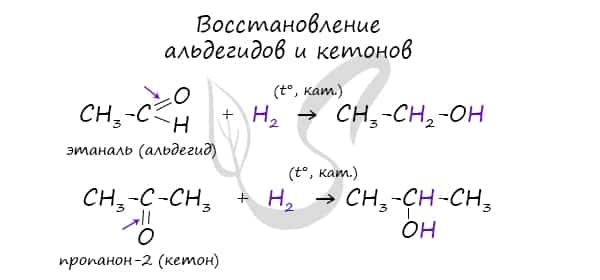
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола. CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол. 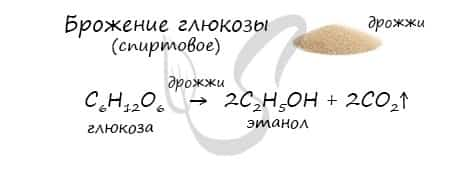
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль). 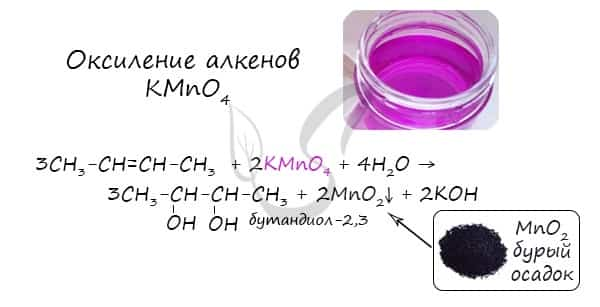
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д. 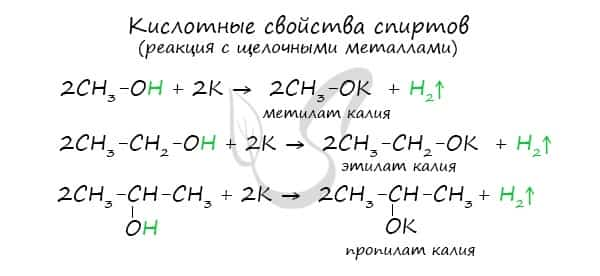 Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента. Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены. Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
Спирты — химические свойства, формулы и получение
Спирты — это большая группа химических соединений, производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу ОН−.
Гидроксильная группа является функциональной группой спиртов.
Классификация спиртов
Спирты классифицируют по различным признакам: по количеству гидроксильных групп; по типу атома углерода, с которым связана гидроксогруппа; а также по строению углеводородного радикала.
По количеству гидроксогрупп
- По этому признаку выделяют одноатомные и многоатомные спирты.
- У одноатомных спиртов одна группа ОН−. Пример — этиловый спирт (этанол):
- CH3—CH2—OH(C2H5OH).
- У многоатомных — несколько групп ОН−.
- Например, предельный двухатомный спирт этиленгликоль (этандиол):
- HO—CH—CH—OH.
Трехатомный спирт глицерин:
HO—CH2—CH(OH)—CH2—OH.
Современное название многоатомных спиртов — полиолы (диолы, триолы и т. д.).
По типу атома углерода, с которым связана гидроксогруппа
Выделяют первичные, вторичные и третичные спирты. Показали примеры каждого вида спиртов в таблице.

По строению углеводородного радикала
По строению углеводородного радикала спирты бывают:
- Предельные (этанол СН3—СН2—ОН);
- Непредельные (пропенол СН2=СН—СН2—ОН);
- Ароматические (фенилметанол С6Н5—СН2ОН).
Номенклатура спиртов
По систематической номенклатуре ИЮПАК (IUPAC)
Спиртам дают название по названию углеводорода с добавлением суффикса -ол и цифры, которая показывает положение гидроксильной группы. Для того, чтобы правильно определить, с каким по счету атомом углерода соединена гидроксильная группа, необходимо учитывать следующие правила:
-
Выбрать самую длинную углеводородную цепь, в состав которой входит гидроксильная группа. Таким образом устанавливают число атомов углерода и соответственно формируют название.
-
Нумерацию длинной цепи осуществляют с того края, к которому ближе расположена гидроксильная группа.
-
Местоположение гидроксогруппы в названии определяют написанием цифры после суффикса -ол.
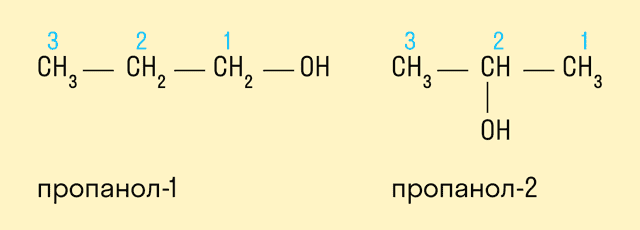
Если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа. В таком случае перед названием указывают цифрой, от какого атома углерода идет ответвление.
Радикально-функциональная номенклатура
По такому способу название спирта формируется от названия радикала с добавлением слова «спирт». Например:
- СH3—OH — метанол или метиловый спирт;
- C2H5OH — этанол или этиловый спирт;
- CH3—CH2—CH2—СН2—OH — бутанол или бутиловый спирт.
Тривиальная номенклатура
Тривиальные названия были даны спиртам по источнику природного получения. Например, метанол называют древесным спиртом, а этанол — винным спиртом. Показали некоторые тривиальные названия спиртов в таблице:
| CH3—OH | Метанол | Древесный спирт |
| CH3—CH2—OH | Этанол | Винный спирт |
| CH3—CH2—CH2—CH2—CH2—OH | Пентанол-1 | Амиловый спирт |
| Этандиол-1,2 | Этиленгликоль | |
| Пропантриол-1,2,3 | Глицерин |
Изомерия — это явление существования соединений, у которых одинаковый качественный и количественный состав, но различное строение, а значит, разные свойства.
Давайте рассмотрим виды изомерии, которые характерны для спиртов.
Структурная
-
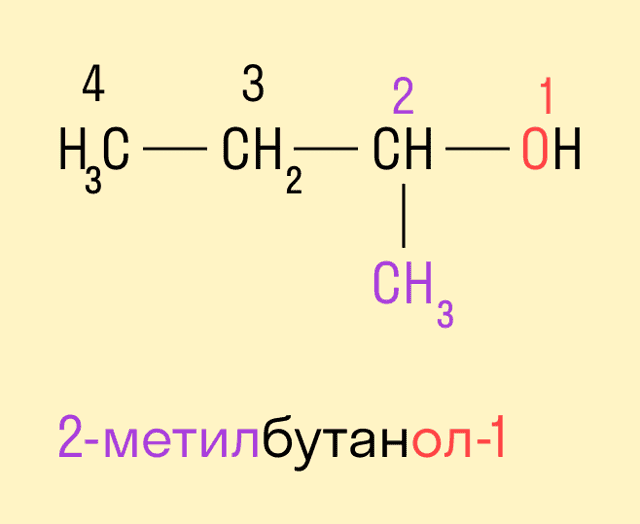
Изомерия углеродного скелета характерна для спиртов, в состав которых входит четыре и более атомов углерода.
-
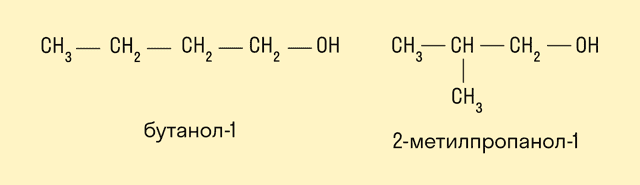
Изомерия положения гидроксильной группы.
Межклассовая
Межклассовые изомеры — это вещества, которые относятся к разным классам и имеют различное строение, но одинаковый состав.
Для спиртов межклассовыми изомерами являются простые эфиры. Общая формула спиртов и простых эфиров — CnH2n+2O.
Пространственная (оптическая)
Например, бутанол-2, в молекуле которого второй атом углерода соединен с четырьмя различными заместителями, существует в форме двух различных оптических изомеров.
Получение спиртов
Гидролиз галогенопроизводных алканов
Галогенпроизводные алканов реагируют с водным раствором щелочей, результатом реакции является образование спиртов. Атом галогена в галогеналкане замещается на гидроксогруппу.
Гидратация алкенов
Присоединение молекул воды происходит в присутствии минеральных кислот и при нагревании.
Если в реакцию вступают несимметричные алкены, то процесс гидратации подчиняется правилу Марковникова. Атом водорода присоединяется к наиболее гидрированному атому углерода, а гидроксогруппа соединяется с соседним атомом углерода, наименее гидрированным.
Восстановление альдегидов и кетонов
Восстановление проводят каталитическим гидрированием карбонильной группы. Катализаторами могут быть никель, платина, палладий. Первичные спирты образуются из альдегидов, вторичные — из кетонов.
- СН3—СНО + Н2 → CH3—CH2—OH
- CH3—C(O)—CH3 + H2 → CH3—CH(OH)—CH3
- Альдегиды и кетоны можно восстанавливать, действуя на них разными восстановителями, например, комплексным алюмогидридом лития LiAlH4.
Реакция Канниццаро
Это окислительно-восстановительная реакция диспропорционирования альдегидов в первичные спирты и карбоновые кислоты под действием оснований.
2СH3—CHO + NaOH → CH3—CH2—OH + CH3—COONa
Гидролиз сложных эфиров
Процесс гидролиза заключается в том, что под действием воды происходит расщепление сложных эфиров. Гидролиз может протекать в кислой и щелочной среде. Гидролиз в щелочной среде является процессом необратимым, так как происходит омыление, т. е. образование солей карбоновых кислот.
Синтез Гриньяра
Синтез с использованием реактива Гриньяра. Реактивы Гриньяра — магнийорганические соединения, содержащие ковалентную связь C—Mg. Чаще всего их получают из органилгалогенидов вида R—X, где X = Cl, Br, I и магния в безводной среде.
- Первичные спирты получают из муравьиного альдегида.
- Уксусный альдегид и другие альдегиды дают вторичные спирты.
- Кетоны и сложные эфиры образуют третичные спирты.
Получение метанола из синтез-газа
Основной промышленный метод получения метанола состоит из двух этапов:
-
Получение синтез-газа с помощью паровой, парокислородной или пароуглекислотной конверсии природного газа.
-
Синтез метанола путем восстановления оксида и диоксида углерода водородом на катализаторе.
Получение этанола
Этанол можно получить путем ферментативного брожения глюкозы (спиртовое брожение).
С6Н12О6 → 2C2H5OH + 2CO2
Реакция Вагнера
Окисление алкенов холодным раствором перманганатом калия в нейтральной среде (реакция Вагнера).
3CH2=CH2 + 2KMnO4 + 4H2O → HO—CH2—CH2—OH + 2MnO2 + 2KOH
Гидролиз жиров
Многоатомные спирты можно получить путем гидролиза жиров. При взаимодействии кислот с жирами происходит образование глицерина и карбоновых кислот.
Физические свойства спиртов
В основном все виды спиртов — это жидкости, имеющие относительно высокие температуры кипения. Температуры кипения выше у многоатомных спиртов и фенолов.
Температуры кипения спиртов
| Метанол | CH3—OH | 64 |
| Этанол | CH3—CH2—OH | 78 |
| Пропанол-1 | CH3—CH2—CH2—OH | 92 |
| Бутанол-1 | CH3—CH2—CH2—CH2—OH | 118 |
| Этандиол-1,2 (этиленгликоль) | 197 | |
| Пропантриол-1,2,3 (глицерин) | 290 |
Общая формула одноатомных предельных спиртов: CnH2n+1OH. В спиртах, одноатомных и многоатомных, помимо связи между углеродом и водородом (С—ОН), есть еще одна связь между кислородом и водородом (О—Н). Поэтому химические реакции проходят с разрывом одной из цепей:
- реакции восстановления проходят с отщеплением гидроксильной группы от молекулы спирта;
- реакции окисления — с отщеплением водорода.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Кислотно-основные свойства
Согласно теории Бренстеда-Лоури спирты — достаточно слабые кислоты. Кислотность спиртов уменьшается по мере усложнения углеродного скелета.
- Взаимодействие со щелочными металлами: 2С2Н5ОН + 2Na → 2C2H5ONa + H2.
- Взаимодействие со щелочами: С2H5OH + NaOH ⇄ C2H5ONa + H2O.
Спирты — более слабые кислоты, чем вода, поэтому невозможна реакция с водными растворами щелочей. Взаимодействие с твердыми щелочами возможно, реакция обратима. Равновесие сильно смещено влево.
Основность кислот увеличивается по мере увеличения углеродного скелета.
Замещение гидроксогруппы
Гидроксогруппа является плохо уходящей. Энергия разрыва связи С—О довольно высока, поэтому непосредственное замещение группы ОН на другую группу невозможно.
Для того, чтобы замещение было возможно, группу ОН превращают в хорошо уходящую, т. е. понижают энергию разрыва связи. Для этого:
- проводят реакцию в кислой среде;
- переводят гидроксигруппу в сульфогруппу применяя H2SO4;
- применяют кислоты Льюиса.
- R—OH + PCl5 → R—Cl + POCl3 + HCl
- R—OH + SOCl2 → R—Cl + SO2 + HCl
- R—OH + HCl → R—Cl + H2O
- R—OH + PBr → R—Br + H3PO3
- R—OH + KBr + H2SO4 → R—Br + KHSO4 + H2O
Реакция с использованием реактива Лукаса
Реактив Лукаса — это смесь ZnCl2 и HCl. Скорость реакции убывает при упрощении углеродного скелета. Внешним признаком реакции служит расслоение реакционной смеси в случае образования хлоруглеводорода R—Cl, представляющего собой маслообразное нерастворимое вещество.
- Быстрее всего реагируют третичные спирты, слой нерастворимого алкилгалогенида появляется фактически сразу же после смешения реагентов — меньше чем за минуту.
- Вторичные спирты вначале растворяются в реактиве, но затем раствор мутнеет, в течение 5 минут появляются капли алкилгалогенида.
- Растворы первичных спиртов остаются прозрачными, они образуют хлориды только при нагревании.
Дегидратация спиртов
При температуре &rt; 140°C и в присутствии серной кислоты происходит внутримолекулярная дегидратация. В результате реакции получается алкен.
При температуре < 140°C и в присутствии серной кислоты происходит межмолекулярная дегидратация. В результате образуется простой эфир.
Реакция этерификации — получение сложных эфиров
Предельные одноатомные спирты вступают в химические реакции с карбоновыми кислотами, продукты таких реакций — сложные эфиры.
Взаимодействие с аммиаком
Эта реакция происходит при нагревании и в присутствии катализатора. Гидроксогруппа замещается на аминогруппу. Продукт реакции — амин.
Окисление
-
Горение спиртов: C2H5OH + 3O2 → 2CO2 + 3H2O.
-
Жидкофазное окисление с применением хромовой смеси K2Cr2O7 + H2SO4: 3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COOH + K2SO4 + Cr2(SO4)3 + H2O.
-
Окисление оксидом меди (II) при нагревании: CH3—CH2—OH + CuO → CH3—CHO + Cu + H2O.
Первичные спирты при окислении образуют альдегиды, вторичные переходят в кетоны, третичные окисляются с разрушением углеродного скелета.
Химические свойства многоатомных спиртов
В целом многоатомные спирты сходны с одноатомными, но имеют особенности: проявляют более сильные кислотные свойства и вступают в специфические реакции.
Кислотные свойства
Многоатомные спирты взаимодействуют с щелочными металлами:
Взаимодействие со свежеосажденным гидроксидом меди (II)
Это качественная реакция на многоатомные спирты:
Окисление йодной кислотой и ее солями
Образование эфиров с азотной кислотой
Вопросы для самопроверки
-
Что такое спирты?
-
Что образуется при межмолекулярной дегидратации спиртов?
-
Какую качественную реакцию имеют многоатомные спирты?
-
Какой характерной реакцией можно получить этанол?
-
Напишите все виды изомерии для пентанола-1.
-
Как классифицируют спирты?
Учёба без слёз
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой
Физические и химические свойства одноатомных спиртов
Физические и химические свойства одноатомных спиртов отличаются от ранее рассмотренных органических соединений в связи с наличием гидроксильной группы в молекуле спирта.
Физические свойства одноатомных спиртов
Спирты с числом углеродных атомов С1 — С15 представляют собой жидкости, более С15 – твердые вещества. Имеют резкий запах. Первый член ряда – метанол очень токсичен (смертельная доза для человека — 30 г).
Температура кипения. Размер молекулы спирта определяет его температуры кипения и плавления. Обычно, чем больше размер спирта, тем выше температура кипения. Это связано с тем, что с увеличением размера молекул спирта растет сила Ван-дер-Ваальса между ними. Изменение температур кипения спиртов в гомологическом ряду составляет ~ 20°С.
Спирты и все органические гидроксилсодержащие соединения способны образовывать водородную связь и объединяться в ассоциаты:
Поэтому точки их кипения выше, чем у их исходных молекул. Причем, чем меньше алкильных групп окружают гидроксильную группу, тем легче протекает ассоциация и тем выше температура кипения вещества. Поэтому, Ткип спиртов нормального строения выше, чем у их разветвленных изомеров.
Изменение температур кипения одноатомных спиртов нормального строения отражены на рисунке ниже:
Воспламеняемость спиртов уменьшается с увеличением размера и массы молекул.
При сгорании ковалентные связи молекул разрушаются, поэтому по мере того как размер и масса молекул увеличиваются, возрастает число ковалентных связей, которые нужно разрушить.
Следовательно, для разрыва связей требуется больше энергии, поэтому воспламеняемость спиртов уменьшается с увеличением размера и массы молекул.
Растворимость в воде и органических растворителях. Спирты растворимы в воде. Это связано с наличием гидроксильной группы в молекуле спирта, которая способна образовывать водородные связи с молекулами воды.
По мере увеличения длины углеводородной цепи спирта растворимость в воде снижается – проявляется так называемый гидрофобный эффект.
Так, метиловый, этиловый и пропиловые спирты смешиваются с водой в любых соотношениях, бутанол растворяется в воде лишь на 10 %, а спирты, содержащие более 9 углеродных атомов в воде нерастворимы.
Спирты хорошо растворимы во многих органических растворителях.
Химические свойства одноатомных спиртов
Спирты проявляют амфотерные свойства – являются и слабыми основаниями и слабыми кислотами, даже слабее, чем вода (Кд(вода) = 10-16; Кд(метанол) = 10-17; Кд(этанол) = 10-18).
Кислотные свойства спиртов уменьшается в ряду: Первичные > Вторичные > Третичные
1) Взаимодействие с щелочными металлами (образование алкоголятов). Подобно воде, спирты взаимодействуют с щелочными металлами, образуя алкоголяты (по другому их называют алкоксиды). Под действием воды алкоголяты гидролизуются с образованием спирта и основания:
- Спирты не реагируют с водными растворами щелочей, однако взаимодействуют с их спиртовыми растворами, образуя также алкоголяты:
- Алкоголяты щелочных металлов имеют сильно полярную связь О – Ме и диссоциируют в спиртовом растворе на алкоксид – анионы и катионы металла, например, метилат (метоксид) натрия диссоциирует на метоксид – анион и катион натрия:
- СH3ONa → СH3O— + Na+
- 2) Взаимодействие с минеральными и органическими кислотами (образование сложных эфиров). Такие реакции называются реакциями этерификации:
3) Взаимодействие с хлористым тионилом ведет к образованию галогеналканов:
4) Взаимодействие с хлорангидридами минеральных (неорганических) и органических кислот (образование сложных эфиров). Реакции с первичными спиртами:
При действии на первичные спирты PBr3 и PI3 может происходить обмен гидроксила на галоид:
Реакции со вторичными и третичными спиртами сопровождаются в основном обменом гидроксила на галоид
5) Внутримолекулярная дегидратация спиртов (образование алкенов) протекает при нагревании с кислотами или при пропускании спирта над окисью алюминия при ~375°С:
Наиболее легко вода отщепляется от третичных спиртов.
6) Межмолекулярная дегидратация спиртов (образование простых эфиров) происходит при слабом нагревании с кислотами или другими водоотнимающими веществами:
Простые эфиры можно получить, используя синтез Вильямсона:
7) Взаимодействие одноатомных спиртов с бихроматом или перманганатом калия приводит к их окислению. При окислении первичного спирта образуется альдегид, вторичного – кетон. При дальнейшем окислении альдегида можно получить карбоновую кислоту:
Как и другие органические соединения спирты горят с образованием углекислого газа и воды.
Таковы основные физические и химические свойства одноатомных спиртов, а в предыдущем разделе рассмотрены Способы их получения и отрасли применения






