- Общее описание
- Физические характеристики
- Химические свойства
- Соли кислоты
- Получение вещества
- Вред сероводорода
- Применение дигидросульфида
- В нормальном состоянии
- При патологических изменениях
- Использование при анабиозе
- Сероводород — H2S
- Что такое сероводород?
- Актуальность проблемы очистки газа от сероводорода
- Современные технологии очистки газа от сероводорода FRAMES
- Сероводород (H2S) Свойства, риски и использование / химия
- Где производится сероводород?
- Физико-химические свойства
- Реактивность и опасности
- ингаляция
- Контакт с кожей
- Зрительный контакт
- приложений
- 1- Производство серы
- 2- Аналитическая химия
- 3- Другое использование
- ссылки
- Сероводород. Что это такое? Формула, соединения и примеры
- Строение и физические свойства сероводорода
- Способы получения сероводорода
- Химические свойства сероводорода
- Горение
- Растворимость в воде
- Свойства кислот
- Взаимодействие с аммиаком
- Окисление металлов
- Реакции с галогенами
- Качественные реакции
- Восстановительные свойства
- Вопросы для самопроверки
- Сероводород H2S
- Области применения
- Влияние сероводорода на организм человека
- Сероводород | это… Что такое Сероводород?
- Физические свойства
- Химические свойства
- Сульфиды
- Получение
- Соединения, генетически связанные с сероводородом
- Применение
- Биологическая активность
- Токсикология
- Примечания
- Соединения серы (II). Сероводород и сульфиды
- Физические свойства
- Сероводород в природе
- Способы получения
- Химические свойства H2S
- H2S — сильный восстановитель
- Реакции с простыми веществами окислителями
- Реакции с окисляющими кислотами (HNО3, H2SO4(конц.)
- Реакции с солями — окислителями
- Водный раствор H2S проявляет свойства слабой кислоты
- Особенности реакций H2S с солями сильных кислот
- Качественная реакция на сульфид-анион
- Сульфиды
- Обратимый гидролиз растворимых сульфидов
- Необратимый гидролиз сульфидов
- Нерастворимые сульфиды
- Окислительный обжиг сульфидов
- Способы получения сульфидов
Общее описание
Вещество в природных условиях встречается в смеси нефтяных газообразных углеводородов, содержится в составе вулканических выделений.
В водной среде находится в форме раствора, например, в Черном море содержится в толще воды на глубине более 200 м.
Гидросульфит выделяется в процессе разложения белков, которые имеют в составе цистеин или метионин (аминокислоты с содержанием серы). Малое количество сернистого водорода выделяется из кишечных газов животных и человеческих организмов.
Физические характеристики

Вещество относится к термически устойчивым соединениям в агрегатном состоянии, при повышении температуры свыше +400ºС разделяется на простые компоненты — Н2 и S. Молекула вещества представляется в изогнутой форме и отличается полярностью (μ = 0,34. 10-29 Кл.м). Водороды не обнаруживаются в дигидросульфидах, в отличие от воды, поэтому в нормальных условиях вещество в жидкое состояние не преобразуется.
Физические свойства сероводорода:
- При растворении дигидросульфида в водной среде получается малая по силе сероводородная кислота, которая становится сверхпроводником при понижении температуры до -70ºС и показателе давления 150 ГПа.
- В жидком состоянии H2S обладает сниженной электропроводимостью, по сравнению с водной средой, так как сернистый водород отличается слабой диэлектрической проницаемостью. В таком виде соединение получает свойства органического раствора, который почти не растворяет лед.
- Твердый дигидросульфид отличается плотностью молекулярного строения, при этом у всех частиц есть 12 расположенных рядом соседей (связи явно различаются со структурным сцеплением льда).
- Плавится серный водород при показателе 2,5 кДж/моль, а испаряется в случае достижения условий 18,7 кДж/моль.
- Вещество весит больше воздуха и подвергается сжатию при достижении температуры -60,2ºС. Полное сжатие проходит при -85,7ºС.
В воздушной среде происходит горение вещества с образованием воды и серного диоксида, реакция выражается уравнением: 2H2S + 3O2 = 2SO2 + 2H2O.
Если в огонь поместить холодный твердый предмет, то окисление идет до свободной серы, которая образует остаток желтого цвета: O2 + 2H2S = 2S + 2H2O.
Чтобы растворить 2,5 объема сернистого водорода, потребуется всего 1 объем жидкости, при этом раствор будет называться сероводородной водой. Смесь становится мутной при содержании на воздухе и на свету, так как происходит кислотная реакция между гидросульфидом и воздухом.
Химические свойства
В результате охлаждения насыщенного раствора можно получить кристаллогидрат H2S . 6H2O. Растворимость сероводородного компонента в органике происходит более активно, чем в воде. В одной порции спирта растворяется 7 частей сероводорода. Интенсивность растворимости достигает максимума при температуре 350ºС, что объясняется получением полисульфидов.
В воде вещество окисляется йодом с выделением свободной серы, а в газовой среде сера окисляет йодистый водород до появления свободного йода по схеме:
- I2 + H2S = S + 2HI.
- S + 2HI = I2 + H2S + 6 кДж.

В газово-воздушной среде при температуре ниже -50ºС образуется молярное соединение H2S . I2. Константа диссоциации сероводородной кислоты слабее угольной, децинормальная смесь имеет кислотность pH = 4.1. Сера с водородом не вступает во взаимодействие в обычных обстоятельствах, только при увеличении температуры идет реакция: S + H2 = H2S + 21 кДж.
Химические свойства сероводорода позволяют выступать ему в качестве восстановителя, примером служит список реакций:
- Br 2 + H 2 S-2 = 2HBr + S0.
- 4Cl 2 + 4H 2 O +H 2 S-2 = H 2 S + 6SO 4 + 8HCl.
- 2FeCl 3 + H2S-2 = S0 + 2FeCl 2 + 2HCl.
Серебро получает черный оттенок, если реагирует с сероводородом, что является результатом взаимного влияния растворимых сульфидов и дигидросульфидов в химии.
Средние соли с содержанием аниона S2- носят название сульфидов, а кислые массы с анионом HS относятся к классу гидросульфидов. Соли имеют различную цветность, несмотря на то, что ионы являются бесцветными.
Сульфиды в воде почти не растворяются, а гидросульфиды реагируют и образуют водные растворы.
Соли кислоты
Вещества растворяются в воде, если находятся в таблице щелочных металлов. Остальные соединения подобного типа не взаимодействуют с водой. Сульфиды выпадают в осадок в результате реакции гибридизации, когда вводятся металлические соли или соль сероводородной кислоты.
У щелочноземельных и щелочных металлов есть гидросульфиды М2+(Н S)2 и M+ HS. Нестойкими являются гидросульфиды Ca2+ Sr2+ . Растворимые сульфиды героизируются в воде, так как относятся к слабым солям кислоты. Часто такая реакция является необратимой с появлением осадка в виде нерастворимого гидроксида.
Получение вещества
Практическое получение сероводорода проходит в реакции сульфида железа и разбавленных кислот.
Другим удобным методом является нагревание сплавленной серы в виде порошка до 170ºС в сочетании с частицами асбеста и парафином. Концентрация смеси составляет 3:2:5, соответственно.
В охлажденном состоянии взаимодействие прекращается, а активизируется реакция с повышением температуры.
Начальный сплав заготавливается заранее и расходуется в случае необходимости, при этом 1 г дает 150 г сероводорода. Для получения чистого вещества смесь пропускается вместе с серными парами над разогретыми глыбами пемзы, при этом температура равняется 100ºС, а давление составляет 90 атм. Температурная диссоциация сероводорода наступает при 400ºС и достигает апогея при достижении 1700ºС.
Вред сероводорода
Взрывоопасной является смесь вещества с воздухом, при этом температура 300ºС ведет к воспламенению и дальнейшему взрыву в случае содержания 5−46% H2S. Ядовитость вещества часто недооценивается и деятельность с ним без защитных средств ведет к отравлению. Всего 0,1% концентрация сероводорода в атмосфере помещения вызывает неприятные последствия для организма.
После вдыхания сероводородных паров наступает потеря обоняния, затем обморок или паралич дыхания, что ведет к смерти человека. Помогает быстрое удаление пострадавшего из проблемного помещения.
Симптомами отравления является головная боль, нарушение сознания и тошнота. Иногда обмороки наступают позднее, когда человек уже не работает с газом.
Средства защиты необходимы, при этом требуется тщательно запахнуть респираторы и другие предметы предохранения.
Применение дигидросульфида
Сероводород в качестве сульфидов используется в технике, например, с его применением изготавливаются люминофоры, полупроводники. В этом производстве задействуются сульфиды кадмия и цинка. В качестве основы смазок берется дисульфид молибдена.
Польза от применения сероводорода:

- в области неорганической химии вещество применяется в качестве реагента для выделения осадка тяжелых металлов, если их сульфиды относятся к категории слаборастворимых;
- в медицине используется в виде искусственных и природных ванн и вводится в состав минеральных вод;
- серный водород участвует в производстве сульфидов, элементарной серы и серной кислоты;
- используется в синтезе меркаптанов и тиофена.
В последние годы рассматривается возможность применения вещества из глубин моря. Его планируется использовать в области сероводородной энергетики в виде химического и электронного сырья.
В нормальном состоянии
Эндогенный дигидросульфид в небольшой массе производится клетками живых организмов и является важным компонентом многих биологических действий.
Вещество является третьим из найденных ранее трансмиттеров после угарного газа и азотной окиси. Этот тип соединения выделяется в организме с помощью цистеина и относится к группе спазмолитиков и вазодилататоров.
Он активно действует на ЦНС, повышает трансмиссию нейронов и способствует функционированию памяти.

Впоследствии вещество окисляется до ионов сульфитов в митохондриях с помощью тиосульфат-редуктазы, затем превращается в ионы сульфатов при воздействии специального фермента. Из организма в конечном виде выводится мочевыми протоками.
В организме человека эндогенный сероводород считается важным фактором для защиты от заболеваний сердца и сосудов, благодаря аналогичности со свойствами азотной окиси.
Несмотря на схожесть, действие сероводорода и оксида азота различаются, хотя они оба оказывают кардиопротективное действие.
Азот активирует гуанилатциклазу, а дисульфид приводит в тонус чувствительные каналы поставки калия в гладких мышцах.
Исследования показывают, что для поддержания сосудистого тонуса важно сочетание азота, сероводорода и угарного газа.
Окись азота в условиях физиологической нормы расширяет крупные артерии и вены, а серный водород отвечает за расслабление периферических сосудов крови.
В организме выявляется взаимодействие сигнальных путей азота и сероводорода, что говорит о зависимости спазмолитического, цитопротекторного и противовоспалительного действия газов друг от друга.
В теле человека серный водород реагирует с внутриклеточными ферментами, при этом образуется HSNO (нитрозотиол). Веществу отводится ведущая роль контроля внутриклеточной концентрации энзимов.
При патологических изменениях
В случае инфаркта выявляется дефицит эндогенного сероводородного газа, что негативно сказывается на состоянии сосудов. Сниженная биологическая доступность серного водорода и окиси азота ведет к некрозу мышцы сердца. Дефицит сероводорода способствует высвобождению большого числа радикалов и наступает экссудативный внутриклеточный стресс.
При недостатке серного водорода активность ферментов изменяется и угнетается биологическое воспроизводство азота. В это время применяется сероводородная терапия прекурсорами вещества или донорами, например, диалил-трисульфидами для увеличения содержания газа в крови и мышцах больного. В результате опасность патологии и повреждений сердечной мышцы становится минимальной.
В организме серный водород может запасаться в виде сульфат-серы. Это промежуточный компонент, который образуется при взаимодействии избыточного вещества с кислородом и используется при необходимости. Порции запасного сероводорода вступают в реакцию с кислородом и активизируют выработку азота, что уменьшает число свободных радикалов.
При заболевании Альцгеймера снижается уровень сероводородного компонента в сосудах мозга, как и у пациентов с недугом Паркинсона. Введение прекурсоров вещества дает улучшение самочувствия вплоть до полного избавления от характерных симптомов. При синдроме Дауна, наоборот, содержание сероводорода обнаруживается в очень завышенной концентрации.
Использование при анабиозе
Теоретически и практически доказано, что продукция сернистого водорода у особей, которые впадают в зимнюю спячку, повышается в несколько раз. Дыхание замедляется и составляет около 10 движений в минуту, а температура тела снижается на 2º. На опытах с мышами было установлено, что гипотермия мозга при этом уменьшает повреждение в органе при инсульте или травматическом воздействии.

Если бы удалось воспроизвести такое действие в организме человека, то сероводородная гибернация стала бы полезным открытием в клинике спасения жизней после травм, инсультов и инфарктов, а также для хранения органов от донора.
Исследования показывают, что эндогенный серный водород влияет на скорость метаболизма, регулирует естественным способом уровень обменных процессов. Последние опыты показали, что эффект гибернации не возникает у крупных животных, а развивается исключительно у мышей.
Анабиозу с помощью сероводородного компонента нельзя подвергнуть свиней или овец, что было практически доказано. Клинические испытания действия сероводорода на человека в части анабиоза были начаты, но неожиданно прекратились медицинской компанией без объяснения причин.
Сероводород — H2S
Что такое сероводород?
СЕРОВОДОРОД, H2S, (сернистый водород, сульфид водорода) — бесцветный горючий газ с резким запахом, t кипения 60,35 °C. Водный раствор — сероводородная кислота. Сероводород часто встречается в месторождениях нефти и газа.
Сероводород H2S токсичен: острое отравление человека наступает уже при концентрациях 0,2–0,3 мг/м3, концентрация выше 1 мг/м3 — смертельна.
Сероводород H2S является агрессивным газом, провоцирующим кислотную коррозию, которую в этом случае называют сероводородной коррозией.
Растворяясь в воде, он образует слабую кислоту, которая может вызвать точечную коррозию в присутствии кислорода или диоксида углерода.
https://www.youtube.com/watch?v=0xrrjFGDAH4
В этой связи, без современных станций подготовки газа и модулей сероочистки, сероводород способен наносить сильнейший ущерб людям. Предельно допустимая концентрация сероводорода в воздухе рабочей зоны составляет 10 мг/м3, а в смеси с углеводородами С1–С3 равна 3 мг/м3.
Без станций очистки от сероводорода серьезно страдает и выходит из строя самое различное оборудование в нефтяной, энергетической, транспортной и газоперерабатывающей отраслях.
Что происходит с металлами, если сероводород не удален?
Сероводород реагирует почти со всеми металлами, образуя сульфиды, которые по отношению к железу играют роль катода и образуют с ним гальваническую пару. Разность потенциалов этой пары достигает 0,2–0,48 В. Способность сульфидов к образованию микрогальванических пар со сталью приводит к быстрому разрушению технологического оборудования и трубопроводов.
Бороться с сероводородной коррозией чрезвычайно трудно: несмотря на добавки ингибиторов кислотной коррозии, трубы из специальных марок нержавеющей стали быстро выходят из строя.
И даже полученную из сероводорода серу перевозить в металлических цистернах можно в течение ограниченного срока, поскольку цистерны преждевременно разрушаются из-за растворенного в сере сероводорода. При этом происходит образование полисульфанов HSnH.
Полисульфаны более коррозионно-активные элементы, чем сероводород.
Сероводород, присоединяясь к непредельным соединениям, образует меркаптаны, которые являются агрессивной и токсичной частью сернистых соединений — химическими ядами.
Именно они значительно ухудшают свойства катализаторов: их термическую стабильность, интенсифицируют процессы смолообразования, выпадения и отложения шлаков, шлама, осадков, что вызывает пассивацию поверхности катализаторов, а также усиливают коррозийную активность материала технологических аппаратов.
H2S значительно усиливает процесс проникновения водорода в сталь. Если при коррозии в кислых средах максимальная доля диффундирующего в сталь водорода составляет 4% от общего количества восстановленного водорода, то в сероводородсодержащих растворах эта величина достигает 40%.
Присутствие в газе кислорода значительно ускоряет процессы коррозии. Опытным путем было найдено, что наиболее коррозионным является такой газ, в котором отношение кислорода к сероводороду составляет 114:1. Это отношение называется критическим.
Наличие влаги в газе влечет коррозию металла, одновременное же присутствие H2S, O2 и H2O является наиболее неблагоприятным с точки зрения коррозии.
Коррозионные действия на металл указанных примесей резко возрастают при увеличении давления.
Скорость коррозии газопроводов прямо пропорциональна давлению газа, проходящего через этот газопровод. При давлении до 20 атм. и влажном газе достаточно даже следов сероводорода 0,002–0,0002% об., чтобы вызвать значительные коррозионные поражения металла труб, ограничивая срок службы газопровода 5–6 годами.
- Вследствие коррозионных действий сероводорода, присутствующего в газах, значительно сокращается срок службы силового генерационного оборудования (ГПЭС — ГТУ) и аппаратуры при добыче, транспорте, переработке и использовании газа.
- В промысловых условиях особенно большому коррозионному воздействию подвергаются трубы, задвижки, камеры сгорания и поршни силовых установок электростанций, счетчики газа, компрессоры, холодильники.
- Значительная часть сероводорода реагирует с металлом и может отложиться в виде продуктов коррозии на клапанах силовых установок, компрессоров, на внутренних стенках аппаратуры, коммуникаций и магистрального газопровода.
Актуальность проблемы очистки газа от сероводорода
- Актуальность проблемы очистки газа от сероводорода усиливается требованиями обеспечения экологической безопасности при разработке сернистых месторождений, сокращением вредных выбросов в атмосферу.
- При этом особое внимание уделяется совершенствованию действующих и разработке новых технологий сероочистки, исключающих выбросы токсичного сероводорода и продуктов его горения в окружающую среду.
- Несмотря на все перечисленные минусы, сероводород является ценным химическим сырьем, поскольку из него можно получить огромное количество неорганических и органических соединений.
Современные технологии очистки газа от сероводорода FRAMES
Современные технологии очистки газа от сероводорода FRAMES позволяют:
- иметь газ, пригодный для бытового, энергетического и промышленного использования;
- получить путем переработки очищенных газов продукты надлежащего качества без примесей сернистых соединений;
- предохранить оборудование от разъедания при транспортировке, переработке и использовании газа;
- иметь в некоторых случаях выгоду от извлечения элементарной серы.
Для получения технико-коммерческого предложения на строительство надежной, инновационной станции подготовки попутного газа Вам необходимо заполнить опросный лист.
Для получения технико-коммерческого предложения на поставку модуля сероочистки попутного газа Вам надо заполнить опросный лист.
Сероводород (H2S) Свойства, риски и использование / химия
сероводород это общее название сероводорода (H2S). Это можно рассматривать как гидразидную кислоту в растворе (H2S (aq)).
Рассмотрение сульфгидрильной кислоты дано несмотря на низкую растворимость в воде этого химического соединения. Его структура представлена на рисунке 1 (EMBL-EBI, 2005).
Поэтому сероводород мало растворим в воде. При растворении образует кислый сульфид-ион или гидросульфид (HS-). Водный раствор сероводорода или сероводорода бесцветен и при воздействии воздуха медленно окисляет элементарную серу, которая не растворяется в воде.
Сера Дианион С2- существует только в сильно щелочных водных растворах; Это исключительно основной с рКа> 14.
H2S возникает практически там, где элементарная сера вступает в контакт с органическим материалом, особенно при высоких температурах. Сероводород представляет собой ковалентный гидрид, химически связанный с водой (H2O), поскольку кислород и сера производятся в той же группе, что и периодическая таблица.
Это часто происходит, когда бактерии разрушают органическое вещество в отсутствие кислорода, например, в болотах и канализации (наряду с процессом анаэробного сбраживания). Это также происходит в вулканических газах, природном газе и некоторых колодезных водах..
Также важно помнить, что сероводород является центральным участником серного цикла, биогеохимического цикла серы на Земле (рисунок 2)..
Как упомянуто выше, восстанавливающие серу и сульфатвосстанавливающие бактерии получают энергию окисления из водорода или органических молекул в отсутствие кислорода путем восстановления серы или сульфата до сероводорода.
Другие бактерии выделяют сероводород из аминокислот, которые содержат серу. Несколько групп бактерий могут использовать сероводород в качестве топлива, окисляя его до элементарной серы или сульфата, используя кислород или нитрат в качестве окислителя..
Чистые серные бактерии и зеленые серные бактерии используют сероводород в качестве донора электронов при фотосинтезе, в результате чего образуется элементарная сера.
Фактически, этот режим фотосинтеза старше, чем режим цианобактерий, водорослей и растений, который использует воду в качестве донора электронов и выделяет кислород (База данных метаболома человека, 2017).
индекс
- 1 Где производится сероводород?
- 2 Физические и химические свойства
- 3 Реактивность и опасности
- 3.1 Вдыхание
- 3.2 Контакт с кожей
- 3.3 Попадание в глаза
- 4 использования
- 4.1 1- Производство серы
- 4.2 2- Аналитическая химия
- 4.3 3- Другое использование
Где производится сероводород?
Сероводород (H2S) встречается в природе в сырой нефти, природном газе, вулканических газах и горячих источниках. Это также может быть результатом бактериальной деградации органического вещества. Это также произведено человеческими и животными отходами.
Бактерии, обнаруженные во рту и желудочно-кишечном тракте, вырабатывают сероводород из бактерий, которые расщепляют материалы, содержащие растительные или животные белки..
Сероводород также может возникать в результате промышленной деятельности, такой как пищевая промышленность, коксовые печи, крафт-бумаги, кожевенные заводы и нефтеперерабатывающие заводы (Агентство по регистрации токсичных веществ и заболеваний, 2011 г.).
Физико-химические свойства
Сероводород — бесцветный газ с сильным запахом тухлых яиц. Водный раствор сероводорода бесцветный без характерного аромата.
Соединение имеет молекулярную массу 34,1 г / моль, водный раствор имеет плотность 1,334 г / мл. Он имеет температуру плавления -82 ° С и температуру кипения -60 ° С. Он слабо растворяется в воде и способен растворять всего 4 грамма на литр этого растворителя при 20 ° C (Royal Society of Chemistry, 2015).
Сероводород реагирует как кислота и как восстановитель. Он взрывается при контакте с дифторидом кислорода, пентафторидом брома, трифторидом хлора, оксидом дихлорида и фульминатом серебра. Он может воспламениться и взорваться под воздействием медного порошка в присутствии кислорода..
Он может реагировать аналогичным образом с другими порошкообразными металлами. Воспламеняется при контакте с оксидами и пероксидами металлов (пероксид бария, триоксид хрома, оксид меди, диоксид свинца, диоксид марганца, оксид никеля, оксид серебра, диоксид серебра, триоксид таллия, пероксид натрия, оксид ртути, оксид кальция).
Зажигается броматом серебра, гипохлоритом свинца (II), хроматом меди, азотной кислотой, оксидом свинца (IV) и оксидом. Он может воспламениться, если пройдет через ржавые железные трубы. Экзотермически реагирует с основаниями.
Тепло реакции с кальцинированной содой, гидроксидом натрия, гидроксидом калия, гидроксидом бария может вызвать возгорание или взрыв непрореагировавшего участка в присутствии воздуха / кислорода (HYDROGEN SULFIDE, 2016).
Реактивность и опасности
H2S считается стабильным соединением, хотя он легко воспламеняется и чрезвычайно токсичен.
https://www.youtube.com/watch?v=-PEOXouB1j0u0026t=75s
Смесь тяжелее воздуха и может перемещаться на значительное расстояние от источника возгорания и обратно. Может образовывать взрывоопасные смеси с воздухом в широком диапазоне.
Он также вступает в взрывную реакцию с пентафторидом брома, трифторидом хлора, трийодидом азота, трихлоридом азота, дифторидом кислорода и хлоридом фенилдиазония.
При нагревании до разложения он выделяет высокотоксичные пары оксидов серы. Несовместим со многими материалами, включая сильные окислители, металлы, сильную азотную кислоту, пентафторид брома, трифторид хлора, трийодид азота, трихлорид азота, дифторид кислорода и хлорид фенилдиазония.
Сероводород (H2S) несет ответственность за многие случаи профессионального токсического воздействия, особенно в нефтяной промышленности. Клинические эффекты Н2S зависит от его концентрации и продолжительности воздействия.
H2S немедленно приводит к смертельному исходу, когда концентрации превышают 500-1000 частей на миллион (ppm), но воздействие более низких концентраций, таких как 10-500 ppm, может вызывать различные респираторные симптомы, начиная от ринита до острой дыхательной недостаточности..
H2S также может поражать несколько органов, вызывая временные или постоянные нарушения в нервной, сердечно-сосудистой, почечной, печеночной и гематологической системах..
Представлен случай профессионального воздействия H2Это приводит к поражению нескольких органов, острой дыхательной недостаточности, организации пневмонии и шока, сходных с острым сепсисом. В этом случае у пациента также развилось легкое обструктивное и рестриктивное заболевание легких и периферическая невропатия (Al-Tawfiq, 2010).
ингаляция
В случае вдыхания выносите его на улицу и держите в покое в удобном для дыхания положении. Если не дышите, примените искусственное дыхание. Если дыхание затруднено, обученный персонал должен дать кислород.
Контакт с кожей
При попадании на кожу ее следует промыть большим количеством воды. Жидкость под давлением может вызвать обморожение. В случае воздействия жидкости под давлением зону замораживания следует немедленно нагреть теплой водой, не превышающей 41 ° C..
Температура воды должна быть терпимой к нормальной коже. Прогревание кожи следует поддерживать в течение не менее 15 минут или до тех пор, пока в пораженный участок не вернется нормальная окраска и ощущение. В случае массивного воздействия одежду снимают во время душа теплой водой.
Зрительный контакт
В случае попадания в глаза тщательно промыть глаза водой не менее 15 минут. Держите веки открытыми и подальше от глазных яблок, чтобы убедиться, что все поверхности тщательно промыты..
Проглатывание не считается возможным путем воздействия. Во всех остальных случаях требуется немедленная медицинская помощь (Praxair, 2016).
приложений
1- Производство серы
Установка извлечения серы Claus состоит из печи сгорания, котла-утилизатора, конденсатора серы и ряда каталитических ступеней, каждая из которых использует подогрев, слой катализатора и конденсатор серы. Обычно используются две или три каталитические стадии.
Процесс Клауса превращает сероводород в элементарную серу посредством двухстадийной реакции.
Первая стадия включает контролируемое сгорание исходного газа для превращения приблизительно одной трети сероводорода в диоксид серы и некаталитическую реакцию сероводорода, не сгоревшего с диоксидом серы..
- На второй стадии реакции Клауса сероводород и диоксид серы реагируют на катализаторе с образованием серы и воды.
- Количество воздуха для горения строго контролируется, чтобы максимизировать извлечение серы, то есть поддержание соответствующей реакционной стехиометрии от сероводорода 2: 1 до диоксида серы через последующие реакторы.
- Как правило, извлечение серы может достигать 97% (Национальная медицинская библиотека США, 2011).
2- Аналитическая химия
Уже более века сероводород играет важную роль в аналитической химии, в качественном неорганическом анализе ионов металлов..
В этих анализах ионы тяжелых металлов (и неметаллов) осаждаются (например, Pb (II), Cu (II), Hg (II), As (III)) из раствора после воздействия H2S. Полученный осадок снова растворяется с некоторой селективностью и, таким образом, идентифицируется.
3- Другое использование
Это соединение также используется для отделения оксида дейтерия или тяжелой воды от обычной воды с помощью процесса сульфида Гирдлера..
Ученые из Университета Эксетера обнаружили, что клеточное воздействие небольшого количества сероводорода может предотвратить повреждение митохондрий.
Когда клетка подвергается стрессу из-за болезни, ферменты притягиваются к клетке, образуя небольшое количество сероводорода. Это исследование может иметь больше последствий в профилактике инсультов, болезней сердца и артрита (Stampler, 2014).
Сероводород может обладать антивозрастными свойствами, блокируя разрушительные химические вещества в клетке, имея свойства, подобные ресвератролу, антиоксиданту, обнаруженному в красном вине.
ссылки
- Агентство по регистрации токсичных веществ и заболеваний. (3 марта 2011 г.). Сероводород Карбонилсульфид. Получено от atsdr.cdc.gov.
- Аль-Тауфик, Б. Д. (2010). Воздействие сероводорода у взрослого мужчины. Летопись саудовской мед. 30 (1) , 76-80.
- EMBL-EBI. (2005, 13 декабря). сероводород. Восстановлено с ebi.ac.uk.
- Британская энциклопедия. (S.F.). Сероводород. Восстановлено с britannica.com.
- База данных метаболома человека. (2017, 2 марта). Сероводород . Получено с hmdb.ca.
- ВОДОРОДНЫЙ СУЛЬФИД. (2016). Получено с сайта cameochemicals.noaa.gov.
- (2016, 17 октября). Паспорт безопасности сероводорода. Восстановлено от praxair.com.
- Королевское химическое общество. (2015). Сероводород. Получено с chemspider.com.
- Стамплер Л. (2014, 11 июля). Исследование показывает, что вонючее соединение может защищать от повреждения клеток. Получено с time.com.
- С. Национальная медицинская библиотека. (2011, 22 сентября). Сера, Элементаль. Получено с toxnet.nlm.nih.gov.
Сероводород. Что это такое? Формула, соединения и примеры
Сероводород — это молекулярное соединение с ковалентной полярной связью. По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S.
Строение и физические свойства сероводорода
Сероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит.
Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению. Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода. В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора.
Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
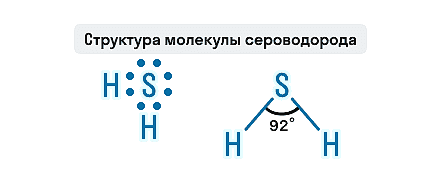
Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни.
Способы получения сероводорода
Сероводород встречается в природе в вулканических газах и водах минеральных источников. Также он образуется в результате разложения белков погибших животных и растений, при гниении пищевых отбросов.
-
При высокой температуре сера взаимодействует с водородом, в результате образуется газ — сероводород:
H2 + S → H2S.
-
Практический способ получения сероводорода — действие разбавленных кислот на сульфиды:
FeS (тв) + 2HCl (разб) → H2S + FeCl2.
-
Полный гидролиз, в результате которого выделяется газ и выпадает осадок:
Al2S3 + 6H2O → 3H2S + 2Al(OH)3.
-
Сероводород можно получить путем нагревания смеси парафина и серы:
С20H42 + 21S → 21H2S + 20C.
-
Действие концентрированной серной кислоты на щелочные и щелочноземельные металлы:
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S + 4H2O.
Химические свойства сероводорода
Горение
На воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях:
-
Полное горение. Продукты реакции — диоксид серы и вода:
2H2S + 3O2 → 2SO2 + 2H2O.
-
Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета:
2H2S + O2 → 2S + 2H2O.
Растворимость в воде
Сероводород растворим в воде. Его раствор называют сероводородной водой или сероводородной кислотой. Формула сероводородной кислоты — H2S. Если кислота долго находится на воздухе и особенно на свету, она мутнеет, т. к. сера окисляется.
Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени:
-
H2S ⇄ H+ + HS−.
-
HS− ⇄ H+ + S2−.
Свойства кислот
Так как раствор сероводорода является кислотой, то для него характерны свойства кислот:
- изменение цвета индикатора — лакмус становится розовым в растворе сероводорода;
- взаимодействие с активными металлами:
H2S + Mg → MgS + H2; - раствор сероводорода реагирует с основными оксидами:
H2S + BaO → BaS + H2O; -
- взаимодействие со щелочами:
- H2S + NaOH → NaHS + H2O;
- H2S + 2NaOH → Na2S + 2H2O;
-
сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид:
H2S + CuCl2 → CuS↓ + 2HCl.
Взаимодействие с аммиаком
Раствор сероводородной кислоты взаимодействует с аммиаком:
H2S + 2NH3 → (NH4)2S.
Окисление металлов
Сероводород может окислять малоактивные металлы в присутствии кислорода:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O.
Реакции с галогенами
Сероводород вступает в реакции с галогенами:
H2S + Cl2 → S + 2HCl.
Качественные реакции
Качественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
Восстановительные свойства
В молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя. При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
- в реакции с бромной водой наблюдается обесцвечивание раствора:
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr; - окисление сероводорода подкисленным раствором перманганата калия:
5H2S + 2KMnO4 + 3H2SO4 → 5S + K2SO4 + 2MnSO4 + 8H2O; - сероводород в кислой среде реагирует с дихроматом калия:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O; -
- взаимодействие с кислотами-окислителями (HNO3, H2SO4):
- 3H2S + 8HNO3 (разб) → 3H2SO4 + 8NO + 4H2O;
- H2S + 8HNO3 (конц) → H2SO4 + 8NO2 + 4H2O;
- H2S + H2SO4 (конц) → S + SO2 + 2H2O.
Вопросы для самопроверки
-
Охарактеризуйте физические свойства сульфида водорода.
-
Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов?
-
Схеме превращений S−2 → S+4 соответствует уравнение:
- 2H2S + O2 → S + 2H2O
- H2SO3 + H2O2 → H2SO4 + H2O
- PbS + 4H2O2 → PbSO4 + 4H2O
- 2H2S + 3O2 → 2SO2 + 2H2O
-
Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2.
-
Верны ли следующие суждения?
А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые.
Б. Сероводород — восстановитель.
-
Верно только А
-
Верно только Б
-
Оба верны
-
Оба неверны
-
Сероводород H2S
Бесцветный газ с неприятным запахом тухлых яиц. Также является побочным продуктом нефтепереработки
- Сероводород (сернистый водород, сульфид водорода, дигидросульфид) H2S — самое активное из серосодержащих соединений.
- В нормальных условиях — бесцветный газ с неприятным запахом тухлых яиц.
- Газ — потому что атомы водорода в молекуле не образуют прочных водородных связей, в отличие от молекул воды,.
Растворим в воде (в 1V H2O растворяется 3V H2S при н.у.), растворяется в этаноле.
- Растворимость H2S в углеводородной фазе выше, чем в водной, коэффициент распределения H2S между фазами зависит в 1ю очередь от состава углеводородной фазы: в бензоле — 5 9 — 6 0; в керосине — 2 4 — 2 5; в легкой нефти — 1,5 — 1,75.
- Взрывоопасен в смеси с воздухом в диапазоне 4 — 45% об.
- Вызывает сильную коррозию металлов.
- Также является продуктом нефтепереработки.
Области применения
Используется в химической промышленности в оргсинтезе для получения тиофена и меркаптанов, получения серы, серной кислоты, сульфидов.
В медицине используется в сероводородных ваннах.
Влияние сероводорода на организм человека
- Сероводород — токсичный газ 3 класса опасности, действующий непосредственно на нервную систему.
- Сероводород притупляет обонятельный нерв и интоксикация может произойти внезапно.
- Ощутимый запах — при концентрации H2S 1,4 — 2,3 мг/м3, значительный запах — 4 мг/м3, тяжелый запах — от 7 мг/м3.
- Острое отравление наступает уже при концентрациях 0,2 — 0,3 мг/л, концентрация более 1 мг/л ( 0,1% концентрация газа в воздухе) — смертельна для человека.
- Признаки сильного отравления сероводородом: отек легких, судороги, паралич нервов, последующая кома.
- Если в содержится от 0,02% H2S, то ощущается головокружение, головная боль, тошнота и довольно скорое привыкание к запаху тухлых яиц.
- При хроническом отравлении ухудшается зрение, поражается слизистая оболочка глаза, вероятен конъюнктивит, светобоязнь.
- При отравлении H2S, нужно срочно выйти на свежий воздух, принять сердечные и дыхательные аналептики, препараты железа, глюкозу, витамины.
Предельно-допустимая концентрация (ПДК) H2S в воздухе в рабочей зоне — 10 мг/м3 (ГН 2.2.5.1313-03 Предельно допустимые концентрации вредных веществ в воздухе рабочей зоны), в смеси с углеводородами — 3 мг/м3.
Сероводород | это… Что такое Сероводород?
Сероводоро́д (серни́стый водоро́д, сульфид водорода, дигидросульфид) — бесцветный газ с запахом протухших яиц и сладковатым вкусом. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях разъедает многие металлы. Концентрационные пределы воспламенения с воздухом составляют 4,5 — 45 % сероводорода.
В природе встречается очень редко в виде смешанных веществ нефти и газа. Входит в состав вулканических газов. Образуется при гниении белков. Сероводород используют в лечебных целях, например в сероводородных ваннах.[1]
Физические свойства
Термически устойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2). Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34·10−29 Кл·м). В отличие от молекул воды, атомы водорода в молекуле не образуют прочных водородных связей, поэтому сероводород является газом. Раствор сероводорода в воде — очень слабая сероводородная кислота.
Химические свойства
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
Ka = 6.9·10−7 моль/л; pKa = 6.89.
Реагирует с основаниями:
(обычная соль, при избытке NaOH)
(кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. На воздухе горит синим пламенем:
при недостатке кислорода:
(на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO42−, например:
Сульфиды
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов раствора сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са²+ и Sr2+ очень нестойки. Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями (например, Al2S3, Cr2S3 и др.) часто проходит необратимо.
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь).
Получение
- Взаимодействие разбавленных кислот на сульфиды:
- Сплавлением парафина с серой.
Соединения, генетически связанные с сероводородом
Является первым членом в ряде полисульфидов (сульфанов) — H2Sn (n=1±9).
Применение
Сероводород из-за своей токсичности находит ограниченное применение.
Биологическая активность
Сероводород является газотрансмиттером, в микромолярных концентрациях имеет цитопротекторные свойства (антинекротические и антиапоптические). В малых концентрациях стимулирует продукцию cAMP, активирует антиоксидантные системы, имеет противовоспалительное действие. В миллимолярных концентрациях цитотоксичен. [2]
Токсикология
Очень токсичен. Вдыхание воздуха с небольшим содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу.
При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться.
Во рту возникает сладковатый металлический привкус [3]
При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается.
Примечания
- ↑ Польза сероводородных ванн
- ↑ Szabó C. Hydrogen sulphide and its therapeutic potential. Nature Reviews 2007;6: 918—935
- ↑ Long-term effects on the olfactory system of exposure to hydrogen sulphide / AR Hirsch and G Zavala Smell and Taste Treatment and Research Foundation, Chicago, IL 60611, USA.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001
- Малин К. М. Справочник сернокислотчика. — М.: Химия, 1971
Соединения серы (II). Сероводород и сульфиды
Все водородные соединения подгруппы серы имеют молекулярную структуру и ковалентную полярную связь.
Химическое строение молекул H2S аналогично строению молекул Н2O: (угловая форма)
Но, в отличие от воды, молекулы H2S малополярны; водородные связи между ними не образуются; прочность молекул значительно ниже.
Физические свойства
При обычной температуре H2S — бесцветный газ с чрезвычайно неприятным удушливым запахом тухлых яиц, очень ядовитый (при концентрации > 3 г/м3 вызывает смертельное отравление). Сероводород тяжелее воздуха, легко конденсируется в бесцветную жидкость.H2S растворим в воде (при обычной температуре в 1 л H2O растворяется — 2,5 л газа).
Сероводород в природе
H2S присутствует в вулканических и подземных газах, в воде серных источников. Он образуется при гниении белков, содержащих серу, а также выделяется в процессе жизнедеятельности многочисленных микроорганизмов.
Способы получения
- 1. Синтез из простых веществ:
- S + Н2 = H2S
- 2. Действие неокисляющих кислот на сульфиды металлов:
- FeS + 2HCI = H2S↑ + FeCl2
3.Действие конц. H2SO4 (без избытка) на щелочные и щелочно-земельные Me:
- 5H2SO4(конц.) + 8Na = H2S↑ + 4Na2SO4 + 4H2О
- 4. Образуется при необратимом гидролизе некоторых сульфидов:
- AI2S3 + 6Н2О = 3H2S↑ + 2Аl(ОН)3↓
Химические свойства H2S
H2S — сильный восстановитель
Взаимодействие H2S с окислителями приводит к образованию различных веществ (S, SО2, H2SO4),
Реакции с простыми веществами окислителями
- Окисление кислородом воздуха
- 2H2S + 3О2(избыток) = 2SО2↑ + 2Н2О
- 2H2S + О2(недостаток) = 2S↓ + 2Н2О
- Окисление галогенами:
- H2S + Br2 = S↓ + 2НВr
Реакции с окисляющими кислотами (HNО3, H2SO4(конц.)
- 3H2S + 8HNО3(разб.) = 3H2SO4 + 8NO + 4Н2О
- H2S + 8HNО3(конц.) = H2SO4 + 8NО2↑ + 4Н2О
- H2S + H2SO4(конц.) = S↓ + SО2↑ + 2Н2О
Реакции с солями — окислителями
- 5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8Н2О
- 5H2S + 6KMnO4 + 9H2SO4 = 5SО2 + 6MnSO4 + 3K2SO4 + 14Н2О
- H2S + 2FeCl3 = S↓ + 2FeCl2 + 2HCl
Водный раствор H2S проявляет свойства слабой кислоты
- Сероводородная кислота H2S 2-основная кислота диссоциирует ступенчато
- 1-я ступень: H2S → Н+ + HS-
- 2-я ступень: HS- → Н+ + S2-
- Для H2S в водном растворе характерны реакции, общие для класса кислот, в которых она ведет себя как слабая кислота.
Взаимодействует:
- а) с активными металлами
- H2S + Mg = Н2↑ + MgS
- б) с малоактивными металлами (Аg, Си, Нg) в присутствии окислителей
- 2H2S + 4Аg + O2 = 2Ag2S↓ + 2Н2O
- в) с основными оксидами
- H2S + ВаО = BaS + Н2O
- г) со щелочами
- H2S + NaOH(недостаток) = NaHS + Н2O
- д) с аммиаком
- H2S + 2NH3(избыток) = (NH4)2S
Особенности реакций H2S с солями сильных кислот
- Несмотря на то, что сероводородная кислота — очень слабая, она реагирует с некоторыми солями сильных кислот, например:
- CuSO4 + H2S = CuS↓ + H2SO4
- Реакции протекают в тех случаях, если образующийся сульфид Me нерастворим не только в воде, но и в сильных кислотах.
Качественная реакция на сульфид-анион
- Одна из таких реакций используется для обнаружения анионов S2- и сероводорода:
- H2S + Pb(NO3)2 = 2HNO3 + PbS↓ черный осадок.
- Газообразный H2S обнаруживают с помощью влажной бумаги, смоченной раствором Pb(NO3)2, которая чернеет в присутствии H2S.
Сульфиды
Сульфидами называют бинарные соединения серы с менее ЭО элементами, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
Наибольшее значение имеют сульфиды металлов, поскольку многие из них представляют собой природные соединения и используются как сырье для получения свободных металлов, серы, диоксида серы.
Обратимый гидролиз растворимых сульфидов
- Сульфиды щелочных Me и аммония хорошо растворимы в воде, но в водном растворе они подвергаются гидролизу в очень значительной степени:
- S2- + H2O → HS- + ОН-
- Поэтому растворы сульфидов имеют сильнощелочную реакцию
- Сульфиды щелочно-земельных Me и Mg, взаимодействуя с водой, подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
- 2CaS + 2НОН = Ca(HS)2 + Са(ОН)2
- При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
- HS- + H2O → H2S↑ + ОН-
Необратимый гидролиз сульфидов
- Сульфиды некоторых металлов подвергаются необратимому гидролизу и полностью разлагаются в водных растворах, например:
- Al2S3 + 6H2O = 3H2S↑ + 2AI(OH)3↓
- Аналогичным образом разлагаются Cr2S3, Fe2S3
Нерастворимые сульфиды
- Большинство сульфидов тяжелых металлов в воде практически не растворяются и поэтому гид
ролизу не подвергаются. Некоторые из них растворяются под действием сильных кислот, например: - FeS + 2HCI = FeCl2 + H2S↑
- ZnS + 2HCI = ZnCl2 + H2S↑
- Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
Окислительный обжиг сульфидов
- Окисление сульфидов кислородом воздуха при высокой температуре является важной стадией переработки
сульфидного сырья. Примеры: - 2ZnS + 3O2 = 2ZnO + 2SO2
- 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
Способы получения сульфидов
- 1. Непосредственное соединение простых веществ:
- Fe + S = FeS
- 2.Взаимодействие H2S с растворами щелочей:
- H2S + 2NaOH = 2H2O + Na2S сульфид натрия
- H2S + NaOH = H2O + NaHS гидросульфид натрия
- 3.Взаимодействие H2S или (NH4)2S с растворами солей:
- H2S + CuSO4 = CuS↓ + H2SO4
- H2S + 2AgNO3 = Ag2S↓ + 2HNO3
- 4. Восстановление сульфатов прокаливанием с углем:
- Na2SO4 + 4С = Na2S + 4СО
- Этот процесс используют для получения сульфидов щелочных и щелочно-земельных металлов.






