- Мир металлов глазами химика. 9 класс. Разработка урока
- Этапы урока
- 1. Организациооный момент. Введение
- II. Подготовка к основному этапу усвоения учебного материала
- III. Усвоение новых знаний и способов действия
- Проводим лабораторный опыт «Изучение образцов металлов»
- IV. Первичная проверка степени усвоения материала
- V. Рефлексия
- VI. Подведение итогов
- Конспект занятия "Металл и его свойства"
- Общие сведения о металлах и сплавах
- Тема: «Общая характеристика металлов»
Как
известно, из 118 химических элементов 95 относится к металлам.
В
периодической системе металлы располагаются левее и ниже
условной линии, проходящей от бора к астату, а также в побочных подгруппах V, VI, VII, VIII группы. К металлам
относятся почти все s-элементы, кроме H, He, половина p-элементы, d- и f-элементы
(лантаниды и актиниды).
Металлы
s- и p-семейства
– это металлы главных подгрупп, а d- и f-семейства – это металлы
побочных подгрупп.
У
большинства атомов металлов на внешнем энергетическом уровне содержится
небольшое число (до 3) электронов, только у некоторых p-элементов,
как Sn, Pb, Bi,
Po их больше (4-6). Валентные электроны атомов металлов
слабо связаны с ядром, что и отличает их от атомов неметаллов. Кроме этого,
атомы металлов имеют сравнительно большие радиусы атомов и небольшую
электроотрицательность.

Поэтому
металлы относительно легко отдают электроны другим атомам, выступая в
химических реакциях только в качестве восстановителей и превращаясь при
этом в положительно заряженные катионы.
У
металлов побочных подгрупп с увеличением заряда ядра радиус атома изменяется
незначительно, так как заполняется предвнешний энергетический уровень. Поэтому
электроны сильнее притягиваются к ядру и восстановительные свойства ослабевают.
В
отличие от неметаллов для атомов металлов характерны только положительные
степени окисления от +1 до +8. Степень окисления металлов определяется
валентными электронами внешнего и предвнешнего энергетического уровня.

Например,
степень окисления натрия в соединениях только +1, у магния ― +2, а вот у марганца
– элемента d-семейства – возможны степени окисления +2,
+4, +6 и +7.
Чем
легче атом металла отдаёт свои электроны, тем он более сильный восстановитель.
Если
расположить в ряд металлы в порядке уменьшения их восстановительной способности
в водных растворах, мы получим известный нам вытеснительный ряд металлов,
который называется также электрохимическим рядом напряжений
(или рядом активности) металлов.

К
наиболее распространённым металлам в земной коре относятся алюминий (8,8%),
железо (4,65%), кальций (3,38%), натрий (2,64%), калий (2,41%), магний (2,35%)
остальная часть приходится на другие металлы.
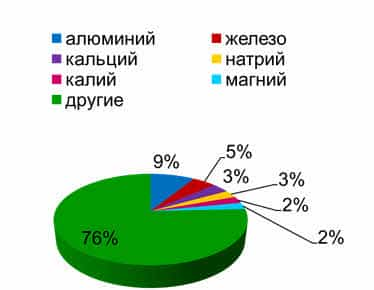
Элементы,
массовая доля которых в земной коре составляет менее 0,01%, называются редкими.
К числу редких металлов относятся лантаниды.
Если элемент не способен
концентрироваться в земной коре, то есть не образует собственных руд, а
встречается в качестве примеси с другими элементами, то его относят к рассеянным
элементам.
Это такие элементы, как Sc, Ga, In, Tl, Hf.
В
40-х годах 20 века немецкие учёные Вальтер и Ида Ноддак высказали мысль о том,
что в каждом булыжнике на мостовой присутствуют все химические элементы
периодической системы.
Вначале
эти слова были встречены их коллегами далеко не с единодушным одобрением.
Однако по мере появления все более точных методов анализа учёные всё больше
убеждались в справедливости этих слов.
Например,
в организме взрослого человека массовая доля неорганических веществ составляет
6%. Из металлов здесь присутствуют Mg, Ca, Na, K.
В
составе многих ферментов, и иных биологически активных веществ в нашем
организме содержатся V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr и некоторые другие металлы.
В
организме взрослого человека содержится в среднем около 140 г ионов калия и
около 100 г ионов натрия. С пищей мы ежедневно потребляем от 1,5 г до 7 г ионов
калия и от 2 г до 15 г ионов натрия.
Как
известно, у металлов металлическая химическая связь,
которая предопределяет ряд свойств металлов. При обычных условиях почти все
металлы (кроме ртути) представляют собой твёрдые вещества, имеющие
кристаллическое строение.
В
металлическом кристалле атомы и катионы металлов располагаются в строго
определённых местах пространства – узлах кристаллической решётки.
Кристаллическая
решётка каждого металла имеет свою повторяющуюся во всех направлениях
пространства характерную структуру – элементарную ячейку.
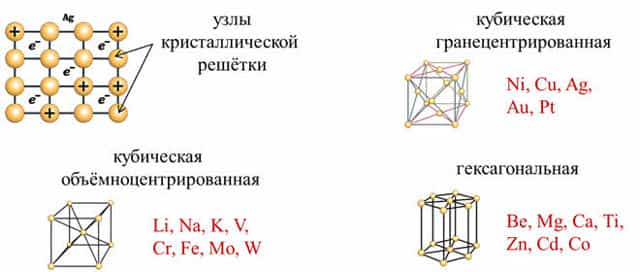
- Известно
много типов элементарн6ых ячеек, но наиболее распространёнными являются
кубическая объёмноцентрированная, как у Li, Na, K, V, Cr, Fe, Mo, W, кубическая гранецентрированная, как у Ni,
Cu, Ag, Au,
Pt и гексагональная, как у Be, Mg, Ca, Ti, Zn, Cd, Co. - Для
металлов характерна высокая электро- и теплопроводность,
ковкость и пластичность, способность образовывать сплавы, металлический блеск.
По
температуре плавления различают металлы тугоплавкие, у
которых температура плавления больше 1000 0С и легкоплавкие,
у которых температура плавления меньше 1000 0С. Самым тугоплавким
металлом является W (3400 0C),
а самым легкоплавким – Hg (-39 0C). Это свойство вольфрама позволяет использовать его в нитях
ламп накаливания.
- Самым
электропроводным является серебро (Ag), вслед за ним
идут Cu и Al.
Наиболее
низкая электропроводность среди металлов у Mn. При
понижении температуры электропроводность металлов возрастает, при абсолютном
нуле у большинства металлов появляется сверхпроводимость.
Лучшим
проводником теплоты является Ag, а худшим – Bi. Теплопроводность металлов позволяет использовать их для
изготовления металлической посуды.
По
твёрдости металлы очень сильно различаются. Самыми твёрдыми среди
металлов являются Mo и Cr. Твёрдость щелочных металлов крайне низкая и не превышает
твёрдости пластилина – их легко можно резать ножом.
По
плотности металлы делят на лёгкие и тяжёлые.
Если плотность металла меньше 5 г/см3, то этот металл является
лёгким, если плотность металла больше 5 г/см3, то этот металл
считается тяжёлым. Лёгкими считаются такие металлы, как Al,
Ti, Mg, а тяжёлыми Fe, Cu, Pb, Hg.
Такое
свойство металлов, как пластичность выражается в их способности деформироваться
под действием механической нагрузки. Поэтому металлы можно ковать, вытягивать в
проволоку, прокатывать. Наиболее пластичными металлами являются золото, серебро
и медь.
Например,
из золота можно изготовить фольгу толщиной 0,003 мм. Такие тонкие листы фольги
можно использовать при золочении. Вспомните Янтарную комнату или изделия из
золота, которые дошли до нас спустя не одно тысячелетие.
Металлы
имеют металлический блеск. Наибольше светоотражающей способностью обладает
ртуть, поэтому ранее её использовали для изготовления знаменитых венецианских
зеркал.
В
настоящее время для изготовления зеркал, прожекторов и фар используют алюминий,
палладий и серебро, потому что они имеют также высокую светоотражающую
способность и неядовиты, в отличие от ртути.
Многие
металлы в порошке теряют блеск и приобретают чёрную или серую окраску, только
магний и алюминий сохраняют её. Поэтому алюминий используют для изготовления
краски «серебрянка».
- Большинство
металлов имеют серебристо-белый цвет, только золото имеет жёлтый цвет, а медь –
красный цвет, а стронций – светло-жёлтый.
Некоторые
металлы, в зависимости от условий, могут кристаллизоваться в двух и более
кристаллических формах. Такое явление называется полиморфизмом
(аллотропия).
- Например,
белое олово, или β-олово устойчиво при температуре 13,2 0С,
серое олово, или α-олово, устойчиво при температуре ниже 13,2 0С. - Железо
имеет четыре кристаллические модификации: α, β, γ, δ. - Металлы
также отличаются и по их отношению к магнитному полю: металлы ферромагнитные
– намагничиваются, как никель и α-железо, парамагнитные –
слабо намагничиваются – это алюминий, хром и диамагнитные,
которые не притягиваются к магниту, а отталкиваются – это олово и медь. - Для
d-элементов характерно образование ковалентных связей,
как для вольфрама, молибдена, хрома, осмия, поэтому они тугоплавкие, твёрдые и
тяжёлые. - Поэтому,
по степени близости физических, химических свойств выделяют группы металлов:
щелочные и щелочноземельные.
Познание
человеком металлов своими корнями уходит в глубокую древность. Полагают, что
первыми металлами. С которыми столкнулся человек и которые он начал
использовать на практике, были медь, золото и серебро.
Причина
заключается в том, что именно эти металлы встречаются в природе в самородном
состоянии и легко могли быть случайно найдены нашими предками. Древние медные
изделия были найдены при раскопках на Анатолийском плоскогорье в Турции и
датируются 6,5 – 5,5 тыс. лет до н.э.
Одним
из наиболее важных этапов в использовании человеком металлов стало освоение процесса
получения железа из его природных руд. Но для получения железа из руд
необходима высокая температура, поэтому получать железо стали примерно к 1500
г до н. э.
История
открытия алюминия связана с фамилией А. Маргграфа, который в 1754 году получил
оксид алюминия из «квасцовой земли».
- А. Маргграф
- (1709 – 1782 гг.)
Только
в 1825 году в виде металла алюминий был получен Г. Эрстедом. В то время
стоимость алюминия превышала стоимость золота из-за чрезвычайной сложности его
получения.
Таким
образом, атомы металлов всегда выступают в химических реакциях в
качестве восстановителей, заряд ядра атома, радиус атома
оказывает влияние на восстановительные свойства металлов, в вытеснительном
ряду металлов их восстановительная активность уменьшается слева направо, в отличие
от неметаллов для атомов металлов характерны только положительные
степени окисления. Для металлов характерна металлическая
химическая связь, которая определяет физические свойства металлов.
Мир металлов глазами химика. 9 класс. Разработка урока
Урок 2 «Мир металлов глазами химика» является начальным звеном изучения темы «Металлы» (24 часа) по программе О.С. Габриеляна.
- В классе есть несколько учащихся, интересующихся химией, предмет привлекателен для них практической направленностью, разнообразием смены деятельности, наглядностью при изучении материала.
- Тип урока: изучение нового материала
- Вид урока: урок-исследование
Цели урока: изучить положение металлов в П.С.Х.Э., раскрыть причины общих физических свойств металлов.
- Виды познавательной деятельности: Постановка проблемы, наблюдение за экспериментом, умение выделять главное, сравнивать, обобщать, логически излагать мысли.
- Способы управления познавательной деятельностью: Ознакомление с целями и задачами урока, видом контроля.
- Формы организации учебной деятельности:индивидуальная и групповая деятельность, лабораторный опыт.
- Методы организации учебной деятельности:беседа, демонстрационный эксперимент, метод проблемная ситуация.
- Средства обучения:
- Учебники: О.С. Габриелян «Химия»9 кл.
- Коллекции образцов металлов, алюминиевая фольга, железный гвоздь, спиртовка, елочная игрушка, зеркало, стеклянные пластинки, периодическая система.
- Средства ТСО: компьютер, проектор, экран.
- Программное обеспечение: Power Point.
Этапы урока
1. Организациооный момент. Введение
Интересные факты-загадки о металлах: (слайд№2)
- Этот элемент особенно нужен растущему детскому организму. У взрослого человека без него ломаются кости, не свертывается кровь, сердце работает плохо. Моллюск без него дома не построит, черепаха без крыши останется, а курице и яйцо упаковать не во что будет. (Кальций)
- Если вы разбили термометр, то не играйте блестящей капелькой. Ее пары ядовиты. (Ртуть)
- Название данного химического элемента с древнеармянского языка переводится как «капнувший с неба», но на нас он уже с неба не капает, хотя наш организм в нем нуждается. (Железо)
- Вещество, образованное данным химическим элементом, обладает бактерицидным действием. Известно, что в древности хранили воду в сосудах, изготовленных из этого вещества, поэтому она долго не портилась. (Серебро)
- Вещество, образованное данным химическим элементом, чрезвычайно стойко химически и в тоже время совместимо с тканями человека. Поэтому он незаменим в восстановительной хирургии. (Тантал)
Вопрос учителя: К какой группе химических элементов относятся перечисленные на слайде? (металлы)
Сообщение темы и цели урока.
II. Подготовка к основному этапу усвоения учебного материала
Алхимики считали, что» семь металлов создал свет по числу семи планет». Назовите эти элементы и соответствующие им планеты. (Учебник стр. 22)
Выслушав ответы, читаем отрывок из записок алхимика (перевод Н. Морозова):
Семь металлов создал свет По числу семи планет: Дал нам космос на добро медь, железо, серебро, Злато, олово, свинец… Сын мой. Сера их отец. И спеши, мой сын, узнать:
Всем им ртуть — родная мать.
Вопрос учителя: Что означает слово Металл? Каков его смысл? (слово металл может означать химический элемент и простое вещество.)
Схема:
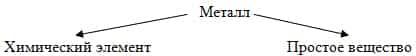
Учитель: Что такое химический элемент? (совокупность атомов) Совместно с учащимися выясняем особенности строения атомов металлов на основании их положения в ПСХЭ.
Учитель: Если провести диагональ от В к At через элементы главных подгрупп, то по этой диагонали (B-Si-As-Te-At) и над ней будут располагаться неметаллы, а под ней- металлы. В итоге из 110 элементов ПС к металлам относятся 88 элементов. Однако, деление элементов на металлы и неметаллы условно.
Так, например, металл германий обладает многими неметаллическими свойствами. Хром, алюминий и цинк — типичные металлы, но образуют соединения, в которых проявляют неметаллические свойства: NaAlO2, K2ZnO2, K2CrO4, K2Cr2O7.
Из положения металлов в ПС можно определить и особенности строения их атомов: (слайд №3)
- Небольшое число электронов на внешнем уровне.
- Сравнительно большой атомный радиус
- Способность отдавать внешние электроны и проявлять восстановительные свойства. (Проблема: почему бор, атомы которого имеют три электрона на внешнем уровне, но проявляют типичные неметаллические свойства?)
Вспомним, как соединяются атомы металлов между собой. Атомы металлов соединяются за счет металлической связи. Металлическая связь — это связь в металлах и сплавах между атом-ионами металлов, расположенных в узлах кристаллической решетки, осуществляемая обобществленными электронами. (Демонстрация моделей кристаллических решеток металлов)
- Схема связи: атом Ме —пЕ= ион Ме
- Делаем общий вывод: что такое металл как химический элемент?
- Под химическим элементом — металлом будем понимать вид атомов, способных легко отдавать электроны, а также образовывать простые вещества с характерными физическими свойствами.
III. Усвоение новых знаний и способов действия
Переходим к изучению физических свойств простых веществ-металлов.
Проводим лабораторный опыт «Изучение образцов металлов»
На каждом столе имеются 4 пластинки из различных металлов. Каждую пластинку учащиеся рассматривают, пытаясь распознать металлы, называют их отличительные признаки. Результаты наблюдений заносят в таблицу (Приложение №1)
Великий русский ученый М. В.Ломоносов так говорил о металлах: «Металлом называется твердое, непрозрачное и светлое тело, которое на огне плавить и холодное ковать можно». О каких физических свойствах металлов здесь идет речь? (Cлайд №4)
Ковкость (пластическая деформация) Под пластической деформацией металла следует понимать изменение внешней формы под воздействием механических факторов, не приводящих к разрушению его на части.
Для того чтобы понять это явление, учащиеся проводят эксперимент. Две стеклянные пластинки накладывают друг на друга. Их легко разъединить. Затем на поверхность пластин наносят несколько капель воды.
Пластины легко скользят одна относительно другой, но с трудом отрываются друг от друга.
В качестве подтверждения пластичности металлов приводим интересные сведения о золоте. (Сообщение учащегося).
Следующее свойство – твердость. Металлы бывают мягкие и твердые. Калий, натрий (демонстрация) можно резать ножом. Из вольфрама и хрома изготавливают режущие, бурильные инструменты. По внешним признакам определяем твердость пластин. Данные в таблицу.
Обратите внимание на внешний вид пластин, посмотрите в зеркало. Какое свойство металлов используют при изготовлении зеркал, елочных игрушек? Металлический блеск, непрозрачность. По металлическому блеску на первом месте стоит серебро. Сравнить блеск гранулы цинка и порошка цинка. Данные в таблицу.
Следующее свойство металлов — электропроводность и теплопроводность. Наиболее электропроводные металлы: серебро, медь, золото. Наиболее теплопроводные — серебро, медь, алюминий, железо.
Важное свойство металлов — их температура плавления. Учащиеся проводят эксперимент: нагревают железный гвоздь и алюминиевую фольгу. Почему фольга изменяет форму, а гвоздь нет? ( Температура пламени спиртовки не позволяет расплавить железо). Итак, металлы бывают легкоплавкие и тугоплавкие, (см. слайд №4).
Плотность металлов различна. Самым легким является литий, его плотность 0,54 г/см3, а самым тяжелым — осмий, плотность которого 22,6 г/см3. (Повторяем общие физические свойства металлов по слайду.)
Учитель: Чем обусловлены общие свойства металлов? (Особенностью строения кристаллической решетки) Например, пластичность определяется способностью слоев кристаллической решетки смещаться друг относительно друга без разрыва связи.
(Скольжение) Металлический блеск объясняется способностью электронов кристаллической решетки отражать световые лучи, а не пропускать их, как стекло. Электро-и теплопроводность металлов объясняется присутствием свободных электронов, которые направленно перемещаются под действием электрического тока.
Большие различия в твердости, температурах плавления и кипения отдельных металлов свидетельствуют о значительной разнице в энергии металлической связи. В чем причина общих физических свойств металлов? Выслушиваем ответы учащихся.
Используя полученные знания, школьники, называют металлы, которые они исследовали в ходе лабораторного опыта (железо, цинк, медь, алюминий).
IV. Первичная проверка степени усвоения материала
- Проверяем полученные знания через тестовую работу, самоконтроль. (Слайд № 5,6)
- В заключение, определяем значимость металлов в жизни человека. (Слайд № 7)
- Люди каких профессий работают с металлами?
V. Рефлексия
Будет ли ваша жизнь или ваша будущая профессия, каким-то образом связана с металлами?
VI. Подведение итогов
Итак, на сегодняшнем уроке мы убедились в огромном значении металлов для нашей жизни, выяснили особенности физических свойств металлов как простых веществ. Также необходимо отметить вашу продуктивную деятельность на уроке. Вы не только разобрались в вопросах темы, провели мини — исследование, но сумели его проанализировать, сделать выводы и оформили результаты.
Домашнее задание: п. 5–6, творческое задание о металлах (ребус).
Конспект занятия "Металл и его свойства"
- Конспект занятия по ознакомлению с предметным и социальным окружением.
- Металл и его свойства.
- Старшая группа
- Цель: познакомить детей в ходе исследовательской работы с металлом и его свойствами
- Задачи: Познакомить детей со свойствами и качествами металла, его использованием; научить находить металлические предметы в ближайшем окружении.
2. Упражнять детей в отгадывании загадок.
3. Развивать познавательную активность ребенка в процессе исследовательской деятельности и знакомства со скрытыми свойствами магнита.
4.Воспитывать любознательность.
- Предварительная работа:
- Отгадывание загадок, предшествующие занятия по ознакомлению со свойствами стекла, дерева, ткани, игры – эксперименты «Из чего сделаны предметы».
- Материалы и оборудование:
- Гвоздь ржавый и не ржавый, металлические предметы, картинки с изображением металлических предметов (ножницы, иголка, утюг), магниты, палаца металлическая и деревянная, металлический и деревянный шарик, металлическая пластина, карточки с заданиями, игрушка Самоделкин.
- Ход занятия :
Воспитатель: Ребята, к вам в гости пришел робот Самоделкин. Но пришел он не просто так, а хочет спросить у вас, из чего он сделан. А чтобы вам было легче отгадать, он будет загадывать вам загадки, а потом показывать картинки.
- 1. Бьют парнишку по фуражке,
- Чтоб пожил он в деревяшке.
- (гвоздь)
- 2. В Полотняной стране
- По реке Простыне
- Плывет пароход то назад, то вперед,
- А за ним такая гладь –
- Ни морщинки не видать.
- (утюг)
- 3. Всех на свете обшивает
- Что сошьет не надевает.
- (иголка)
- 4. Два кольца, два конца,
- Посередине гвоздик.
- (ножницы)
- 5. Две стройные сестрицы
- В руках у мастерицы.
- Весь день ныряли в петельки…
- И вот он – шарф для Петеньки.
- (спицы)
- Воспитатель: А из чего сделаны все эти предметы?
- Воспитатель: Значит, какие они?
- Дети: Металлические
- Показать детям несколько предметов из металла, определить, особенности формы, структуру поверхности ( путем ощупывания), температуру.
- Воспитатель: Что произойдет с предметами, если их опустить в воду?
- Дети: Они утонут.
- Воспитатель: Если оставить на солнце или подержать в руках?
Дети: Нагреются. Все эти предметы обладают теплопроводностью.
Воспитатель: У нашего робота Самоделкина есть небольшая проблема – пока он шел в наш детский сад, он наступил в лужу и теперь перестал ходить. Как вы думаете, что с ним случилось?
(ответы детей)
Воспитатель: Если металл некоторое время полежит в воде или будет находиться во влажной среде – он заржавеет (показать ржавый гвоздь и не ржавый). Вот и наш Самоделкин заржавел. Чтобы он опять начал ходить, мы его накормим маслом, т.е. смажем его, и он опять начнет ходить как раньше.
Воспитатель: Еще одно свойство металла – магнетизм. Что же это такое? Есть такой металл, называется он магнит, он притягивает к себе металлические предметы, они как бы прилипают к нему. Магнит можно применять, собирая мелкие гвозди и другие мелкие предметы. Магниты применяют в радиотехнике, в магнитофонах, в компьютерах.
Магнит не притягивает пластмассу, дерево, резину, а изделия из металлов (железа, стали и др.), наоборот притягиваются к нему; при соединении двух магнитов они могут то притягиваться, то отталкиваться друг от друга (показать на примере).
А теперь давайте проведём несколько опытов, чтобы убедиться, что мы с вами назвали правильно все свойства металла.
Опыт № 1.Дети стучат сначала деревянными палочками, а потом – металлическими. Выясняют, какой звук был громче и почему. Педагог. Самоделкин, а ты умеешь различать металлические предметы от не металлических? Может быть, мы с детьми тебе поможем в этом? Самоделкин.
Да я и сам это умею делать, давайте проверим, как это умеете делать вы. Вот у меня есть сундук, а в нем много всякого добра. Самоделкин заталкивает сундук в группу. Высыпает предметы на пол и говорит, верно ли ,что все они сделаны из металла. Педагог.
Дети, давайте покажем нашему гостю, как мы умеем отличать металлические предметы от не металлических. Игра «Наведи порядок в сундуке».Цель: классификация предметов по материалу изготовления. Дети берут предмет, называют его и говорят, из чего он сделан. Педагог.
Дети, а вы знаете, что еще можно сделать из металла?
Ответы детей.
Самоделкин. А я тоже знаю такие предметы! Педагог. Ну, хорошо, назови нам, что сделано из металла? Самоделкин(задумывается). Стул. Стул можно сделать из металла, но ты его не сможешь поднять. Металл очень тяжелый, и мы с детьми сейчас это докажем. Опыт № 2.Дети берут два шарика – одинаковые по размеру, но разные по материалу (металлический и деревянный, взвешивают на ладонях и определяют, какой шарик тяжелее. Педагог. А давайте мы проверим, правда ли, что металлический шарик тяжелее. Опыт № 3.В емкость с водой дети сначала опускают деревянный шарик, а потом металлический. Педагог. Что произошло с шариками? Дети. Деревянный шарик не утонул, а металлический – утонул. Педагог. Почему утонул металлический шарик? Дети. Потому что он тяжелее. Педагог. Что тяжелее: металлический шарик, деревянный шарик или вода? Дети. Металлический шарик тяжелее деревянного и тяжелее воды. Опыт № 4.Педагог нагревает металлическую пластину на свече. Через некоторое время дети могут потрогать пластинку и отмечают, сто она стала теплой. Самоделкин (берет в руки металлическую пластинку). Фу, какая холодная! Опыт №5.Дети кладут пластинку на батарею, через некоторое время трогают и отмечают, что она стала теплой. Педагог. Самоделкин, а сейчас тебе и детям я покажу фокус. У меня есть волшебная рукавичка. Я сейчас надену рукавичку на руку и все предметы прилипнут к ней. Опыт №6.Педагог надевает рукавичку и проводит ей над мелкими предметами. Педагог. Что произошло и почему?
Дети отвечают и с помощью педагога делают выводы о том, что только металлические предметы притягиваются магнитом.
- Воспитатель: Посмотрите вокруг себя и назовите металлические предметы, которые вы видите.
- (ответы детей)
- Воспитатель: Ребята, давайте еще раз назовем свойства, которыми обладает металл. (ответы детей)
- Игра «Четвёртый лишний» (на карточке найди и зачеркни не металлический предмет)
Воспитатель: С каким еще интересным металлом вы познакомились, что можно рассказать о его свойствах? (магнит, притягивает к себе металлические предметы).
Воспитатель: Нарисуйте металлические предметы, которые вам запомнились. Расскажите, что вы нарисовали, для чего нужен этот предмет?
-Молодцы, вы очень хорошо поработали сегодня.
Воспитатель: Робот Самоделкин благодарит вас за интересное занятие и за вашу помощь ему. Ему уже пора возвращаться домой, а наше занятие закончено.
Общие сведения о металлах и сплавах
Металлы — кристаллические вещества, характеризующиеся высокими электро- и теплопроводностью, ковкостью, способностью хорошо отражать электромагнитные волны и другими специфическими свойствами. Свойства металлов обусловлены их строением: в их кристаллической решетке есть не связанные с атомами электроны, которые могут свободно перемещаться.
В технике обычно применяют не чистые металлы, а сплавы, что связано с трудностью получения чистых веществ, а также с необходимостью придания металлам требуемых свойств.
Сплавы — это системы, состоящие из нескольких металлов или металлов и неметаллов. Сплавы обладают всеми характерными свойствами металлов. В строительстве применяют сплавы железа с углеродом (сталь, чугун), меди и олова (бронза) и меди и цинка (латунь) и др. На практике термин «металлы» распространяют и на сплавы, поэтому далее он относится и к металлическим сплавам.
Применяемые в строительстве металлы делят на две группы: черные и цветные.
К черным металлам относятся железо и сплавы на его основе (чугун и сталь).
Сталь — сплав железа с углеродом (до 2,14%) и другими элементами. По химическому составу различают стали углеродистые и легированные, а по назначению — конструкционные, инструментальные и специальные.
Чугун — сплав железа с углеродом (более 2,14%), некоторым количеством марганца (до 2%), кремния (до 5%), а иногда и других элементов. В зависимости от строения и состава чугун бывает белый, серый и ковкий.
К цветным металлам относятся все металлы и сплавы на основе алюминия, меди, цинка, титана и др.
Широкое использование металлов в строительстве и других отраслях экономики объясняется сочетанием у них высоких физико-механических свойств с технологичностью.
Металлы обладают высокой прочностью, причем прочность на изгиб и растяжение у них практически такая же, как и на сжатие (у каменных материалов прочность на изгиб и растяжение в 10… 15 раз ниже прочности на сжатие).
Так, прочность стали более чем в 10 раз превышает прочность бетона на сжатие и в 100…200 раз прочность на изгиб и растяжение; поэтому, несмотря на то что плотность стали (7850 кг/м ) в 3 раза выше плотности конструкционного бетона (2400 + 50 кг/м ), металлические конструкции при той же несущей способности значительно легче и компактнее бетонных.
Этому способствует также высокий модуль упругости стали (в 10 раз выше, чем у бетона и других каменных материалов). Еще более эффективны конструкции из легких сплавов.
Металлы очень технологичны: во-первых, изделия из них можно получать различными индустриальными методами (прокатом, волочением, штамповкой и т. п.), во-вторых, металлические изделия и конструкции легко соединяются друг с другом с помощью болтов, заклепок и сварки.
Однако с точки зрения строителя металлы имеют и недостатки. Высокая теплопроводность металлов требует устройства тепловой изоляции металлоконструкций зданий. Хотя металлы негорючи, но металлические конструкции зданий необходимо специально защищать от действия огня.
Это объясняется тем, что при нагревании прочность металлов резко снижается и металлоконструкции теряют устойчивость и деформируются. Большой ущерб экономике наносит коррозия металлов.
Металлы широко применяют в других отраслях промышленности, поэтому их использование в строительстве должно быть обосновано экономически.
- —-
- Наука, изучающая состав, строение и свойства металлов и сплавов, а также зависимость между внутренним строением (структурой) и свойствами металлических сплавов называется металловедением.
- Отличительными особенностями металлов являются: блеск, ковкость, непрозрачность, теплопроводность и электропроводность.
Таким образом, под термином «металлы» понимают всю группу металлических материалов — чистые металлы и сплавы. Чистые металлы используют только в тех случаях, когда от материала требуются высокие показатели теплопроводности, электропроводности и высокая температура плавления. Эти свойства у них всегда выше, чем у сплавов.
- Основными материалами при монтаже металлоконструкций, трубопроводов и оборудования являются сплавы, имеющие по сравнению с чистыми металлами следующие преимущества: – более высокую прочность; – способность изменять свойства при изменении химического состава; » – способность улучшать свойства под влиянием термической обработки; – более низкую температуру плавлеиия; – большую текучесть в расплавленном состоянии; – меньшую усадку.
- Указанные свойства сплавов имеют большое практическое значение, так как позволяют получать всевозможные металлоконструкции с показателями, отвечающими требуемым эксплуатационным условиям.
- Применяемые в строительстве сплавы делят на две группы: I группа — сплавы на основе железа (сталь, чугун);
II группа—сплавы на основе металлов (сплавы на медной, алюминиевой, магниевой и другой основе — бронза, латунь, силумины и др.).
К физическим свойствам металлов относятся: удельный вес, теплопроводность, электропроводность и температура плавления.
Удельный вес — это вес 1 см3 металла, сплава или любого другого вещества, выраженный в граммах. Например, удельный вес железа равен 7,88 г/см3. Удельные веса наиболее распространенных металлов приведены в табл. 1.
Теплопроводность — способность металлов и сплавов проводить тепло. Теплопроводность измеряется количеством тепла, которое проходит по металлическому стержню сечением 1 см2 за 1 мин.
Электропроводность — способность металлов и, сплавов проводить электричество. Это свойство наиболее характерно для чистых металлов. Для сплавов более характерным является свойство, обратное электропроводности — электросопротивление.
Удельным электрическим сопротивлением называется сопротивление проводника сечением 1 мм2 и длиной 1 м, выраженное в омах.
Температура плавления — степень нагрева, при которой металл переходит из твердого состояния в жидкое (табл. 1).
- К механическим свойствам металлов и сплавов относят: твердость, прочность, упругость, пластичность.
- Эти свойства обычно являются решающими показателями, определяющими способность металлов сопротивляться прилагаемым к детали, узлам и металлоконструкциям внешним нагрузкам, характеризующим пригодность сплава” или изделия к различным условиям эксплуатации.
- Твердость — способность металла сопротивляться внедрению в его поверхность другого, более твердого тела. ,
- Прочность — способность металла сопротивляться разрушению при действии на него нагрузки.
- Упругость—способность металла принимать первоначальную форму и размеры после прекращения действия нагрузки.
- Пластичность (вязкость) — способность металла изменять первоначальные формы и размеры под действием нагрузки и сохранять приданные формы и размеры после прекращения ее действия.
- К технологическим свойствам относят обрабатываемость резанием, ковкость, жидкотекучесть, усадку, свариваемость и другие свойства, определяющие пригодность материала к обработке тем или иным способом.
- Обрабатываемость резанием — способность металла более или менее легко обрабатываться острым режущим инструментом.
- Ковкость — способность металла поддаваться обработке давлением, принимать новую форму и размеры под влиянием прилагаемой нагрузки без нарушения целостности.
- Жидкотекучесть — способность расплавленного металла или сплава заполнять литейную форму.
- Усадка—уменьшение объема отливки при охлаждении сплава.
- Свариваемость — способность металлов образовывать прочные соединения отдельных металлических заготовок путем их местного нагрева до расплавленного или пластического состояния.
Химические свойства металлов — это способность металлов вступать в соединения с различными веществами, и в первую очередь с кислородом. Чем легче металл вступает в соединение с другими элементами, тем легче он разрушается. Разрушение металлов и сплавов под действием окружающей среды называется коррозией.
Тема: «Общая характеристика металлов»
Пожалуйста, оцените работу! (Нет оценок)
Тема: «Общая характеристика металлов»
Образовательная задача: Повторить и обобщить знания учащихся о периодической системе химических элементов Д.И.Менделеева в свете теории строения атома, на примере строения атомов металлов главных и побочных подгрупп.
Ознакомить с металлической связью, кристаллическими решетками металлического типа и опираясь на строение объяснить общие физические свойства металлов.
Развивающая задача: ; развивать умения выделять главное, сравнивать и обобщать. Развивать умения учащихся владеть своими знаниями, применять их при изучении нового материала.
- Воспитательная задача: Формирование представления мировоззренческих взглядов: умения устанавливать причинно-следственные связи между строением и свойствами металлов, доказывать подход количественных изменений в качественные. развивать представление о познаваемости мира
- Методы: словесный, наглядный, проблемно-поисковый, контроль знаний.
- Оборудование:
- 1.Коллекция «металлы и сплавы»
- 2.Модель кристаллических решеток металлов
- 3.Образцы металлов: Al, Zn, Си, Sn, Fe ( на ученических столах)
- 4.Горячий стакан воды
- 5.Ложки; серебренные, алюминиевые и стальные
4.Слайды (от № 1 по № 22.)
I.Изучение нового материала
Знать:
- Строение атомов металлов.
- изменение металлических свойств в группе и в периоде.
- Металлическую связь.
- Кристаллическую решетку металлов.
- Уметь: На примере строения атомов, вида химической связи объяснить общие свойства металлов
Слайд №1 Тема урока «Общая характеристика металлов»
Слайд № 2 Происхождение слова «металл»
Вопрос 1. Какие вещества называются простыми?
Вопрос 2. На какие группы делятся простые вещества?
У вас на ученических столах находятся химические элементы. Посмотрите и определите, к каким химическим элементам они относятся; к металлам или неметаллам?
По внешним признакам химических элементов вы определили, что элементы являются металлами, т.е вы рассказали об элементах как о простом веществе.
Слайд №3
Вопрос 3. Какие элементы обладают металлическими свойствами?
Ответ учащихся Металлическими свойствами обладают элементы, у которых на наружном энергетическом уровне мало электронов (от 1 до 3)
Слайд №4
Вопрос 4. Зная строение атомов металлов, определите в каких группах в периодической системе химических элементов расположены металлы?
Ответ учащихся: (металлы расположены в I, II, III группах т.к содержат на внешнем энергетическом уровне от 1 до 3 электронов).
Вопрос 5. Как изменяются металлические свойства в главных группах?
Слайд №5
Вопрос 6. С увеличением заряда ядра в главных подгруппах металлические свойства усиливаются. Объясните причину усиления металлических свойств?
- Вывод 1. Главных подгруппах IV, V, VI металлические свойства усиливаются с увеличением заряда ядра, следовательно
- Ge, Sn, Pb хотя содержат 4 электрона,
- Sb, Bi ———————5————— металлы
- Ро ———————6—————
- Рассмотрим строение элементов побочных подгрупп.
- Слайд №6
- К каким элементам относятся элементы побочных подгрупп к металлам или неметаллам?
Вывод 2. Все элементы побочных подгрупп металлы т.к на наружном энергетическом уровне 1 или 2 электрона, у них накопление электронов происходит на предпоследнем энергетическом уровне
Вопрос 7. Каких элементов больше металлов или неметаллов?
Слайд №7
Вывод 3. Каждый элемент обладает определенной долей металличности и неметалличности.
Строение
Металлы часто кристаллизируются в виде правильных геометрических структур.
- В металлах кристаллическая решетка металлическая
- Демонстрация металлических решеток
- Слайд №8.(Виды металлических решеток)
4.В узлах атомы и положительные ионы, электроны свободно перемещаются по всему куску металла.
- Слайд №9 (Определение металлической связи)
Вопрос 6. Как вы думаете металлическая связь прочная или слабая?
- Ответ. Металлическая связь прочная, так как притягиваются заряженные частицы, положительные ионы и свободнодвижущиеся электроны
- Слайд №10
- Связь прочная, электростатическая
- Физические свойства
- Если связь прочная, то это какие вещества жидкие газообразные или твердые?
- 1 Твердые.
- 2. Нелетучие
- 3. Беззапаха
- 4. t плавления
- Высокие
- t кипения
Вопрос 7. Что такое электрический ток?
Вопрос 8. Будут, ли металлы проводить электрический ток ?
5.Электропроводны – так как имеют свободнодвижущиеся электроны,
Вопрос 9. Как вы думаете, с повышением температуры электропроводность снижается или увеличивается?
Ответ. С повышением температуры электропроводность снижается, увеличиваются колебательные движения электронов, (+) ионов и атомов, в результате электроны сталкиваются друг с другом мешая передвижению.
Слайд №11
Вопрос 10. Проводят ли металлы тепло? Если проводят, то почему?
6.Темплопроводны – переносчиками тепла являются электроны.
Демонстрационный опыт в 3 стаканчика помещаем серебряную, стальную и алюминиевую ложки, наливаем горячую воды. Какая ложка быстрее нагрелась?
- Ответ учащихся. Быстрее нагревается серебренная ложка, алюминиевая затем стальная ложка
- Вы знаете из жизненных примеров, что металлы ковки, пластичны, чем это объясняется, как вы думаете?
- Слайд №12
7. Пластичны — изменение формы объясняется смешением пластов из ионов относительно друг к другу, но разрыва не происходит, так как металлическая связь не разрывается.
- Вопрос Почему у веществ имеющих кристаллическую решетку атомную и ионную нет пластичности
- Слайд № 13
- Слайд № 14
- 8. Металлы блестят, потому что при поглощении света электроны металла начинают испускать свои вторичные волны излучения, которую мы воспринимаем как металлический блеск
- Слайд № 15
9. В зависимости от физических свойств металлы условно подразделяются на легкие и тяжелые, мягкие и твердые.
- Слайд № 16
- Твердость — это сопротивление поверхностных слоев материала нагрузкам
- Слайд № 17
- Слад № 18
- Закрепление тест
- Слайд № 19-22
Домашняя работа § 34,36 упр 2.3.4.8.9 стр 112
Просмотреть свитедельство о публикации






