Презентация на тему: обобщение по теме Металлы 9 класс
Скачать эту презентацию
Получить код Наши баннеры 





Скачать эту презентацию
№ слайда 1
Описание слайда:
Обобщение по теме «Металлы» учитель: Лысоконь И.А
№ слайда 2
Описание слайда:
Эпиграф «Металлов много есть, но дело не в количестве В команде работящей металлической Такие мастера, такие личности! Преуменьшать нам вовсе не пристало Заслуги безусловные металлов.»
№ слайда 3
Описание слайда:
N, Hg, O, H, W, S, Li, Сr, F, Ag Hg, W, Сr, Li, Ag – самый легкий металл; – самый тугоплавкий металл; – жидкий металл; – самый электропроводный металл; – самый твердый металл. Li W Hg Ag Сr
№ слайда 4
Описание слайда:
Игра “Чудо – дерево” А у наших у ворот Чудо – дерево растет. Чудо, чудо, чудо, чудо Расчудесное. Не листочки на нем, Не цветочки на нём – Апельсинчики, лимоны, Чудо – яблоки. (К. И Чуковский)
№ слайда 5
Описание слайда:
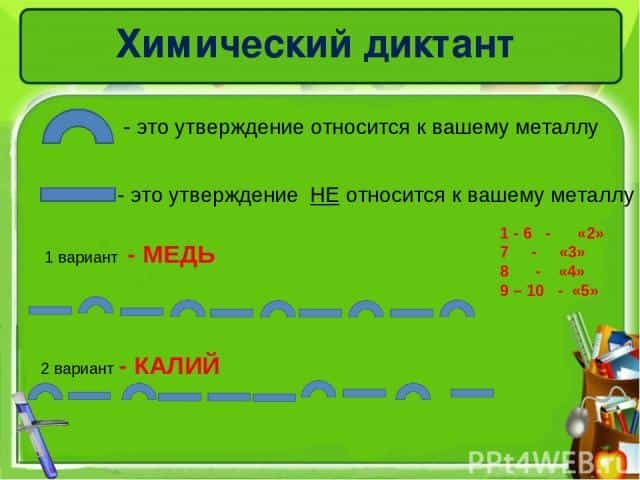
Химический диктант — это утверждение относится к вашему металлу — это утверждение НЕ относится к вашему металлу 1 вариант — МЕДЬ 2 вариант — КАЛИЙ 1 — 6 — «2» — «3» — «4» 9 – 10 — «5»
№ слайда 6
Описание слайда:
В ряду левее водорода Среди металлов нет урода: Все растворимы в кислоте, А те, что с краю, и в воде. Зато на правом фланге “знать” Кислот в упор не хочет знать…
№ слайда 7
Описание слайда:
Допишите уравнения возможных реакций Zn + H2O = Fe + HCl = Zn + H3PO4 = Cu + H2O = Al + HCl = Pb + H2SO4(разб.) = Ag + HCl = FeCl2 + H2 Zn3(PO4)2 + H2 AlCl3 + H2 PbSO4+ Н2 2 3 2 3 2 3 2 6
№ слайда 8
Описание слайда:
3 2 4 5 6 7 8
№ слайда 9
Описание слайда:
Варианты ответов: Вариант 1: Вариант 3: Вариант 2: Вариант 4: Вариант 5: в а б г в в а б г в в а б г в в а б г в в а б г в
№ слайда 10
Описание слайда:
ДОМАШНЕЕ ЗАДАНИЕ: 1. Написать уравнения раекций: а) Fe – FeO — FeSO4 – Fe б) Ba — BaO → Ba(OH)2 →BaCl2 2. Решить задачу Сколько литров углекислого газа выделится при взаимодействии соляной кислоты с 4г. карбоната кальция, если выход составит 90% от теоретически возможного
Скачать эту презентацию
Скачивание материала начнется через 60 сек. А пока Вы ожидаете, предлагаем ознакомиться с курсами видеолекций для учителей от центра дополнительного образования «Профессионал-Р» (Лицензия на осуществление образовательной деятельности
№3715 от 13.11.2013).
Обобщающий урок химии по теме «Металлы» 9 класс

- Обобщающий урок химии по теме «Металлы» 9 класс
- Разработала: учитель высшей категории МОУ «С(к)ОШ № 24»
- г. Магнитогорска
- Павлова
- Галина Григорьевна

Цели
- Образовательная. Обобщение и углубление знаний о физических и химических свойствах металлов и сплавов.
- Коррекционно-развивающая. Развитие мышления путем формирования умения осуществлять следующие операции: анализ, синтез, сравнение, выделение главного. Развитие речи, концентрации и переключения внимания. Расширение объема внимания и памяти.
- Воспитательная. Развитие познавательных интересов, умения применять знания по химии, развитие коммуникативных качеств личности, повышение мотивации к учебной деятельности
Задача
Создание условий для формирования положительной мотивации обучения

Оборудование
- Образцы металлов, коллекция «Металлы и сплавы»
- Железные гвозди
- Медная и алюминиевые проволоки
- Раствор сульфата меди ( II )
- Химические стаканы
- Таблица «Электрохимический ряд напряжений металлов»
- Дидактический и раздаточный материал

Содержание
- Организационный момент
- Домашнее задание
- «Черный ящик»
- Работа с форзацем учебника
- Физические свойства металлов ( твердость , плотность , плавкость , электропроводность , ковкость и пластичность , металлический блеск )
- Словарная работа
- Сплавы
- Металлы
- Химические свойства металлов

Ход урока

- I. Организационный момент
- Объявление темы урока, задач урока, правила работы на уроке, на столах у учащихся жетоны
- Содержание

II. Домашнее задание
- Личностно-ориентированный подход
- Личностно-ориентированный подход
- Дать ответ на вопрос на стр. 62 № 2: «На каких физических и химических свойствах основано применение алюминия и его сплавов?» (письменно). Для Стаханова И., Максимчука И., Милостного С.: упр. № 1, стр. 62 . «Почему в алюминиевой посуде нельзя хранить щелочные или кислые растворы?» (письменно)
- Дать ответ на вопрос на стр. 62 № 2: «На каких физических и химических свойствах основано применение алюминия и его сплавов?» (письменно). Для Стаханова И., Максимчука И., Милостного С.: упр. № 1, стр. 62 . «Почему в алюминиевой посуде нельзя хранить щелочные или кислые растворы?» (письменно)
- Дать ответ на вопрос на стр. 62 № 2: «На каких физических и химических свойствах основано применение алюминия и его сплавов?» (письменно).
- Для Стаханова И., Максимчука И., Милостного С.: упр. № 1, стр. 62 . «Почему в алюминиевой посуде нельзя хранить щелочные или кислые растворы?» (письменно)
Содержание

- III. «Черный ящик»
- Спрятан в ящике предмет –
- Без него не съесть обед.
- Вещь незаменимая,
- Вещь необходимая.
- Если мы садимся кушать,
- Тот предмет нам очень нужен.
- Из чего же сей предмет?
- Серебристо-белый цвет
- Вам позволит дать ответ.
- (Алюминиевая ложка, вилка)
- Содержание

IV. Работа с форзацем учебника
- Что видим на форзаце?
- Каким цветом и почему обозначены химические знаки?
- Назовите и найдите элементы под № 12, 30, 26, 11, 19, 76, 74 (написано на доске).
- Работа по карточкам «Назвать химические элементы»
- K, Na,Ca, Fe, Zn, Cu, Al, Cr, Os, Ag, Au, Sn, Pb, Li, Pt, W
- K, Na,Ca, Fe, Zn, Cu, Al, Cr, Os, Ag, Au, Sn, Pb, Li, Pt, W
- Среди образцов химических веществ выбрать образцы металлов:
- CuO , Fe 2 O 3 , Cu , Al , Zn , Mg , ZnO , MgO , Al 2 O 3 .
- CuO , Fe 2 O 3 , Cu , Al , Zn , Mg , ZnO , MgO , Al 2 O 3 .
Содержание

Выводы
- Все элементы делятся на 2 группы:
металлы и неметаллы
черные и цветные
Офтальмопауза
- Звучит спокойная музыка
- Закрыли глаза, настроили мысль на хорошее, открыли глаза, посмотрели вверх (2-3 сек), посмотрели вниз (2-3 сек), посмотрели вдаль (2-3 сек).
- Повторить 2 раза
- V. Физические свойства металлов
- Работа учащихся с карточками
- Умение классифицировать по определенному признаку
- Твердость (все твердые, за исключением ртути – жидкая)
- Мягкие
- Твердые
- Na
- K
- Cr
- можно
- резать
- ножом
- самый
- твердый,
- царапает
- стекло
- Содержание
- 13
- Плотность
- Легкие
- плотность
- до
- 5 г/см 3
- Mg
- Ba
- Al
- Ca
- K
- Na
- Li
- Тяжелые
- плотность
- больше
- 5 г/см3
- Sn
- Pb
- Ag
- Au
- Cr
- Fe
- Os
- Zn
- Cu
- Содержание
- 14
- Плавкость
- Cs
- 28,5 о С
- Fe
- 1539 о С
- Pt
- 1769 о С
- Os
- 1875 о С
- Туго-
- плавкие
- Легко-
- плавкие
- Na
- 97,8 о С
- K
- 63,6 о С
- W
- 3380 о С
- Содержание
- 15
- Электропроводность
- Al Au Cu Ag
- Содержание
- 15
Ковкость и пластичность
- Наиболее пластичны золото, серебро и медь
- «Золотая фольга» толщиной 0,003 мм используется для золочения изделий
Содержание
15
Металлический блеск
- Самые блестящие – ртуть, серебро
- В порошке все металлы теряют блеск и имеют черный или темно-серый цвет, кроме Al и Mg
Содержание
15
- Выводы
- Физические свойства металлов – это ковкость (пластичность), твердость, мягкость, металлический блеск, электропроводность, теплопроводность, легкие, тяжелые, легкоплавкие, тугоплавкие.
- 15
Словарная работа
- электропроводность
- теплопроводность
- дюралюминий
- произносим хором и по отдельности (3-4 ученика)
Содержание
15
Физкультминутка (на 16 минуте урока)
Упражнения на развитие ловкости, силы, координации движений. Они хорошо снимают усталость, возвращают бодрость, работоспособность. Упражнения интересны детям
15
- Проделать несколько одновременных круговых движений руками. Причем движение правой руки направлено вперед, а левой – назад, затем поменять наоборот.
15
- Сгибая руки в локтевых суставах постараться за спиной соединить пальцы левой и правой рук. Затем, поменяв положение рук, вновь проделать это упражнение.
15
- Встать и соединить ноги вместе, руки в стороны. На счет 1 прыжком поставить ноги в положение врозь, а руки вверх или вниз. На счет 2 вернуть в исходное положение.
15
VI. Сплавы
- Система, полученная сплавлением каких-либо веществ.
- Сплавы обладают более полезными свойствами, чем составляющие их металлы (чистые).
- У бронзы прочность выше, чем у составляющих ее меди и олова.
- Сталь и чугун прочнее технически чистого железа.
- Многие сплавы обладают большей коррозионной стойкостью и твердостью, лучшими литейными свойствами, чем чистые металлы.
Содержание
15
- ПРИМЕНЕНИЕ СПЛАВОВ
- ДЮР-
- АЛЮМИНИЙ
- ЛАТУНЬ
- ЧУГУН
- СТАЛЬ
- 15
- Чугун
- Из чугуна изготовляют литые детали (шестерни, колеса, трубы); переработка в сталь
- СПЛАВЫ
- Состав
- 15
- Дюралюминий
- Он применяется в самолетостроении и машиностроении. Легкий и очень прочный сплав
- СПЛАВЫ
- Состав
- 15
- Латунь
- Из нее делают предметы домашнего обихода.
- Применяется в моторостроении.
- Состав
- СПЛАВЫ
- 15
- Сталь
- Применяется в изготовлении деталей машин, труб, болтов, гвоздей, различных инструментов, двигателей.
- СПЛАВЫ
- Состав
- 15
- Состав
- Сплав
- Основа
- Чугун
- Состав
- Железо
- Сталь
- от 2 до 4,5%
- C , Mn , Si , P , S
- Железо
- Бронза
- Латунь
- Медь
- менее 2% C , Mn , Si , P , S
- до 20% олова
- Медь
- Дюралюминий
- 10-50% Zn
- Алюминий
- Cu , Mg , Mn , Ni
- СПЛАВЫ
- Назад
VII. Металлы – Al, Fe, Cu
- Обобщение в тетради, взаимопомощь, взаимоконтроль
- Умение работать по алгоритму
Инструкция алгоритма
- Химический знак Относительная атомная масса Группа Подгруппа Степень окисления
- Химический знак
- Относительная атомная масса
- Группа
- Подгруппа
- Степень окисления
- VIII. Химические свойства металлов
- Записи на доске двух учеников
- Развитие зрительного и слухового восприятия
- Железо, цинк, медь энергично окисляется кислородом только при нагревании
2 Zn 0 + O 2 0 = 2 Zn +2 O -2
2 Cu 0 + O 2 0 = 2 Cu +2 O -2
- Демонстрация опыта (взаимодействие металлов с растворами солей)
Fe 0 + Cu +2 SO 4 = Fe +2 SO 4 + Cu 0
( красная медь )
- Два ученика пишут уравнения химических реакций на доске, а один демонстрирует опыт и объясняет происходящее.
Содержание
Вывод
Металлы вступают в реакции с кислородом, окисляются, легко отдают электроны, проявляют восстановительные свойства. Более сильные металлы вытесняют слабые металлы из растворов их солей
IX. Итог урока
Из 109 известных химических элементов – 87 металлы и только
22 – неметаллы. Металлы электропроводны, теплопроводны, твердые и мягкие, легкие и тяжелые, легкоплавкие и тугоплавкие, ковкие и пластичные. Широко используются сплавы: чугун, сталь, бронза, латунь, дюралюминий.
- X . Закрепление
- ИТОГОВЫЙ ТЕСТ
- «Что лишнее?»
- 1. ZnO
- 2 . Ca
- Al 2 O 3
- HCl
- FeO
- Fe 2 O 3
- Mg
- S
- Al
- Na
Тесты повышенной трудности
Список литературы
- Габриелян О.С. ХИМИЯ. 9 кл., М.: «Дрофа», 2007 г.
- Гузей Л.С. ХИМИЯ. 9 КЛ., М.: «Дрофа», 2004 г.
- Габриелян О.С., Смирнова М.И. ИЗУЧАЕМ ХИМИЮ. 9 кл., «Дрофа», 2002 г.
Презентация Металлы

Девиз урока
- «Уважение к минувшему – вот черта, отличающая образованность от дикости».
- А.С.Пушкин

Тема урока: Повторительно-обобщающий урок по теме «Металлы». Роль металлов в ВОВ.
- Цель урока:
- обобщить
- знания по теме « Металлы»;
- дополнить
- их новыми знаниями;
- расширить
- кругозор ;
- подготовиться
- к контрольной работе и экзамену по химии.

« Война потребовала грандиозных количеств стратегического сырья…. бесконечное разнообразие различных химических веществ, начиная со сплавов и кончая сложными продуктами переработки – все это сейчас требуется в громадных количествах… только шесть химических элементов не нашли себе применения в военной технике» А.Е.Ферсман

Физические свойства металлов
- Я видел лица, блеск военной стали,
- На гимнастерках звонкие медали,
- На темных касках пуль тяжелый след,
- Литого солнца золотую россыпь,
- И этот шаг торжественную поступь…
- М.Дудин

Википедия (свободная энциклопедия)
- Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов , в виде простых веществ , обладающих характерными металлическими свойствами , такими, как высокие тепло- и электропроводность , высокая пластичность , ковкость и металлический блеск.

Железо
- «В бою железо дороже золота»
«При рати железо дороже золота. Железом и золото добуду».


Fe 3 O 4 Fe 2 O 3
- Оцените содержание железа в каждом соединении
- Сделайте вывод о рациональном выборе сырья
- Определите степени окисления железа в соединениях
- Подберите восстановители к гематиту
- Запишите уравнения реакций восстановления железа ( до 4)
- Какой способ и почему используется в промышленности?

Задача
- Определите массу железа, полученного из 150 кг Fe 2 O 3 ( на три), содержащего 10% примесей (на четыре, пять) .
- Определите массу железа, полученного из 150 кг Fe 2 O 3 ( на три), содержащего 10% примесей (на четыре, пять) .

Свинец – «смертоносный металл»
Никель
Алюминий -«крылатый»
Закончите УХР, укажите окислитель и восстановитель
Инструктаж по технике безопасности
- Будьте внимательны и осторожны;
- Следите, чтобы вещества не попадали на кожу лица и рук ,
- Никакие вещества нельзя пробовать на вкус!
- Работа выполняется только с разрешения учителя,
- При любой возникшей непредвиденной ситуации необходимо обратиться к учителю.
Лабораторный опыт.
- Выполните цепочку превращений оксид магния—хлорид магния—гидроксид магния—сульфат мания
- Составьте уравнения соответствующих реакций.
- Реакцию по выбору запишите также в ионной форме.
Олово – металл «консервной банки»
Бронза – сплав олова, цинка, меди
Золото
В чистом виде золото и серебро — мягкие металлы. Для повышения механической прочности их сплавляют с медью. Число частей золота или серебра, приходящееся на 1000 частей сплава, называют пробой. Рассчитайте массу золота в сплаве 750-й пробы массой 860 г
- Металлов много есть, но дело не в количестве: В команде работящей металлической Такие мастера, такие личности! Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов.
«Военная академия радиационной, химической и биологической защиты имени Маршала Советского Союза С.К.Тимошенко (г. Кострома )
Синквейк
- Металлы
- Какие (2 прилагательных)?
- Что делают (3 глагола)?
- Ваше отношение к металлам (1предложение)
- Синоним к слову металлы.
Д/З
- Повторить тему «Металлы»,
подготовиться к контрольной работе
- Решить задачу 3 стр 176,
- Подготовить презентацию «Получение магния из морской воды»
Спасибо за урок.
- Отметьте, пожалуйста, все ошибки и исправьте их.
- Отметьте, пожалуйста, все ошибки. Я их исправлю сам.
- Отметьте, пожалуйста, количество ошибок. Я их сам найду и исправлю.
- Я сегодня на уроке ничего не сделал, так как у меня была уважительная причина. Я обязательно сдам эту тему.
Спасибо за урок!
Обобщение по теме "Металлы" 9 класс — презентация, доклад, проект скачать
Слайд 1 Описание слайда:
Описание слайда:
Обобщение
по теме «Металлы»
учитель:
Лысоконь И.А
Слайд 2 Описание слайда:
Описание слайда:
Эпиграф «Металлов много есть, но дело не в количестве
В команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов.»
Слайд 3 Описание слайда:
Описание слайда:
N, Hg, O, H, W, S, Li, Сr, F, Ag
Слайд 4 Описание слайда:
Описание слайда:
Игра “Чудо – дерево”
Слайд 5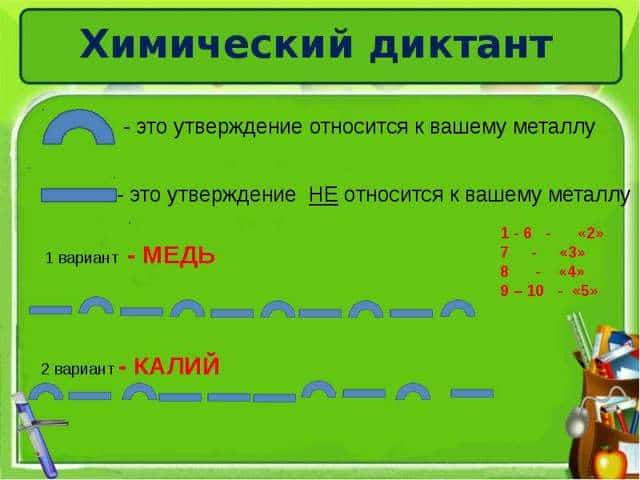 Описание слайда:
Описание слайда:
Химический диктант
Слайд 6 Слайд 7
Слайд 7 Описание слайда:
Описание слайда:
Допишите уравнения возможных реакций
Слайд 8 Слайд 9
Слайд 9 Описание слайда:
Описание слайда:
Варианты ответов:
Слайд 10 Описание слайда:
Описание слайда:
ДОМАШНЕЕ ЗАДАНИЕ:
Конспект урока химии с презентацией, 9 класс. Повторение по теме: Металлы
Химия — 9 класс. Конспект урока с презентацией
Предмет: химия Класс: 9 Тип урока: комбинированный Тема: «Повторение темы «Металлы»». Цель: повторение строения и свойств металлов, коррекция знаний. Задачи • Образовательные: 1). Обеспечить в ходе урока усвоение следующих основных химических понятий: особенности строения атомов металлов, свойства металлов, коррозия, амфотерность, качественные реакции на катионы 2). Продолжить формирование умений и навыков работы с учебником, таблицами Менделеева и растворимости. 3). Продолжить формирование специальных умений по предмету химии.
- Развивающие:
- Воспитательные:
- Предполагаемые результаты.
1). Развивать у учащихся умения анализировать, сравнивать, систематизировать, грамотно излагать свои мысли. 2). Развивать самостоятельность учащихся 3). Развивать познавательный интерес, мотивы и потребности учащихся. 4). Развивать практические умения и навыки при работе с химическими веществами и при работе на компьютере. Содействовать в ходе урока формированию: * добрых отношений со сверстниками, уважительного отношения к учителю. * аккуратного обращения с химическими реактивами и лабораторной посудой Предметные: • Знать: особенности строения атомов металлов, физические и химические свойства металлов, коррозию, качественные реакции на катионы металлов. • Уметь: пользоваться таблицами Менделеева, растворимости, стандартных электродных потенциалов, электрохимическим рядом напряжения металлов, учебником. Составлять уравнения химических реакций в молекулярном и ионном виде, писать уравнения окислительно – восстановительных реакций, составлять электронный баланс, определять окислитель, восстановитель, процессы окисления, восстановления. Проводить химические опыты, соблюдая все правила техники безопасности.
- Личностные:
- Метапредметные:
- Основные понятия: строение атома, атомный радиус, заряд иона, катион, анион, основный, амфотерный характер, коррозия, качественные реакции.
• Формирование целостного мировоззрения, соответствующего современному уровню развития науки. • Формирование уважительного отношения к одноклассникам и учителю. • Освоение социальных норм, правил поведения. • Умение определять понятия, устанавливать причинно-следственные связи, логически рассуждать, обобщать. • Умение применять знаки и символы для решения учебных задач. • Смысловое чтение; • Умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками. Межпредметные связи: физика, география. Ресурсы. 1). Кузнецова Н.Е., Титова И.М., Гара Н.Н. Серия Линия УМК Н. Е. Кузнецовой. Химия (8-9) Класс 9-М.: ВЕНТАНА-ГРАФ, 2012. 2). Периодическая система химических элементов Д.И. Менделеева, 3). Таблица растворимости оснований, кислот, солей в воде. 4). Таблица стандартных электродных потенциалов 5). Электрохимический ряд напряжения металлов 5). Презентация
Натуральные объекты.
1). Химические реактивы: цинк, железо, медь, разбавленная соляная кислота, сульфаты железа, алюминия, щелочь калийная, ампулы с литием и кальцием без этикеток.
Оборудование: нетбуки 5 штук, компьютер, проектор, экран.
Формы урока: групповая, фронтальная Технология: урок коррекции знаний, умений и навыков.
- Ход урока
- Организационный момент.
- Основной этап.
- Задания.
Перед уроком учащиеся рассаживаются группами по 4 человека. У каждой группы ноутбук с флешкой, на которой презентация урока. Приветствие. Деятельность учителя. Сообщает тему и план урока Деятельность учащихся. Слушают, смотрят на экран монитора. Группы учащихся получают задание. На его выполнение даётся 20 минут. При подготовке разрешается пользоваться учебником, справочными таблицами, конспектами уроков. Группа 1. /Слайд 2/ Найдите в таблице Менделеева элементы металлы: кальций, натрий, хром, алюминий. Изобразите строение атома каждого элемента – металла. 1). Разделите их на группы s-, p-, d- элементы. 2). Расположите символы элементов – металлов в порядке увеличения их активности. 3). Расположите символы элементов – металлов в порядке уменьшения их атомного радиуса. 4). Расположите символы элементов – металлов в порядке увеличения числа неспаренных электронов в атоме. Объясните выполнение каждого задания. Группа 2. /Слайд 3/ Даны металлы: цинк, железо, медь. Проведите опыты по взаимодействию этих металлов с разбавленной соляной кислотой. Объясните наблюдаемые явления, напишите уравнения соответствующих реакций в молекулярном и ионном виде. Группа 3. /Слайд 4/ С целью защиты от коррозии цинковое изделие покрыли оловом. Какое это покрытие: анодное или катодное? Напишите уравнение атмосферной коррозии данного изделия при нарушении целостности покрытия. Группа 4. /Слайд 5/ Перед вами ампулы с веществами. Что это за вещества? Опишите их физические свойства. Какая жидкость находится внутри ампул? Какова ее роль? Что произойдет в случае повреждения ампулы? Какие меры предпринять в данном случае? Напишите уравнение реакции взаимодействия этого вещества с водой. Определите окислитель, восстановитель. Составьте электронный баланс. Группа 5. /Слайд 6/ Разгадайте кроссворд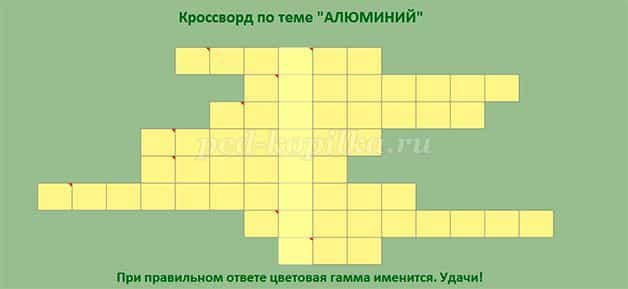 20 минут учащиеся готовятся. Используют справочные материалы, химические реактивы. Свои ответы записывают на компьютере в презентацию. По истечению времени все флэшки передаются учителю на центральный компьютер. Деятельность учителя. Демонстрирует ответы на экране, слушает, корректирует знания, оценивает деятельность учащихся. Деятельность учащихся. Отвечают на поставленные вопросы, аргументируют каждый ответ, корректируют свои знания Ответы.
20 минут учащиеся готовятся. Используют справочные материалы, химические реактивы. Свои ответы записывают на компьютере в презентацию. По истечению времени все флэшки передаются учителю на центральный компьютер. Деятельность учителя. Демонстрирует ответы на экране, слушает, корректирует знания, оценивает деятельность учащихся. Деятельность учащихся. Отвечают на поставленные вопросы, аргументируют каждый ответ, корректируют свои знания Ответы.
- Группа 1
- Группа 2.
- Группа 3
- Группа 5.
- Группа 5.
- Запись домашнего задания.
- Рефлексия.
Ca №20, 1V большой период, 2А группа Na №11 ,111; малый период, 1А группа Cr №24 1V большой период, 6Б группа Al №13 , 111; малый период, 3А группа 1). Na, Ca — s, Al — p, Cr — d элементы. 2). Уменьшение активности: Na, Ca , Al , Cr. 3). Уменьшение атомного радиуса: Ca, Cr, Na , Al 4). Увеличения числа неспаренных электронов в стационарном состоянии атома. Ca Na Cr Al Zn + 2HCl = ZnCl2 + H2 поверхность металла покрылась пузырьками газа, с течением времени скорость реакции увеличивается Zn 0 + 2H+ = Zn2+ + H2 Fe + 2HCl = FeCl2 + H2↑ вся поверхность металла в мелких пузырьках газа. Fe 0 + 2H+ = Fe2+ + H2О Cu + HCl – нет признаков реакции Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный), чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием. В таблице электродных потенциалов найдем: EZn2+/Zn = — 0,763 В ESn2+/Sn = — 0,136 В Олово будет выполнять роль катода и покрытие из него – катодное. При нарушении целостности покрытия, корродировать будет цинк, как более активный металл. При атмосферной коррозии протекают следующие уравнения реакций: К: O2 + 2H2O + 4e— = 4OH— А: Zn — 2e— = Zn2+ 2Zn + O2 + 2H2O = 2Zn2++ 4OH— 2Zn + O2 + 2H2O = 2Zn(OH)2 Группа 4. В ампулах щелочные металлы. Они твердые при нормальных условиях, как все металлы имеют металлический блеск, ковкие, тепло- и электропроводные. Внутри ампул находится керосин, он защищает металлы от воды. При повреждении ампулы металл надо взять пинцетом, переложить в другую ёмкость с керосином. Me0 + 2H2+O = 2Me+OH + H20 Me восстановитель за счёт Me0 H2O окислитель за счёт H+ Me0 — 1e- = Me+ процесс окисления 2H+ + 1e- * 2 = H2 0 процесс восстановления FeSO4 + 2KOH =Fe(OH) + FeSO4 Fe 2++ 2OH- =Fe(OH)2 Наблюдаем темно-зеленый осадок, который через время буреет. Fe2(SO4)3 + 6KOH = 2Fe(OH)3 +3K2SO4 2Fe3+ + 6OH- = 2Fe(OH)3. Наблюдаем бурый осадок. Al2(SO4)3 + 6KOH = 2Al(OH)3 +3K2SO4 2Al3+ + 6OH- = 2Al(OH)3;. Al(OH)3 + KOH = K[Al(OH)4] Наблюдаем белый аморфный осадок, который растворяется в избытке щелочи. Ответы Горизонталь: дюраль, глинозем, алюминат, силумин, боксит, пиротехника, гидроксид, йод. Вертикаль, алюминий Контроль. «Лишний символ» Учитель демонстрирует слайд с заданиями. /Слайд 7/. Проводит фронтальную беседу с классом, корректирует знания учащихся Деятельность учащихся. Осмысленно читают задания. Пользуясь справочными материалами, выбирают правильный ответ. Задания. В каждом ряду представлены символы элементов – металлов, вычеркните лишний символ, объясните своё решение. 1). Li Na Al K Положение в таблице Менделеева 2). Fe Ca Na K Строение атома: s-, d — элементы 3). Sr Ca Be Ba Не относится к семейству щелочноземельных 4. Al Mg Be Zn Характер металла 5. Ag Cu Zn Au Активность металла Учащиеся проверяют, корректируют свои знания. Учитель проговаривает домашнее задание, его текст на экране. / Слайд 8/ Деятельность учащихся. Записывают домашнее задание в дневники. Деятельность учителя. Говорит часть предложения, проецируя его на экран. /Слайд 9/ -Литий, натрий, калий, цезий – это семейство… — Характер цинка, бериллия, алюминия… — Разрушение металлов под действием окружающей среды называется… — Качественной реакцией на ионы железа является реакция… — Свойства металлов зависят от… Деятельность учащихся. Слушают, смотрят на экран, проговаривают окончание предложения. -…семейство щелочных металлов -…амфотерный -…коррозией -…со щелочью -…строения В ходе работы учащиеся корректируют свои знания.
В ходе урока презентация пополняется ответами на вопросы. В результате появляется информация, которую надо выучить к следующему уроку.
Скачать Конспект урока по химии Повторение темы «Металлы»
Презентация Повторение темы «Металлы»
Урок-обобщение по теме "Металлы" с применением ИКТ. 9-й класс
Класс: 9
- На уроке применяются формы организации
познавательной деятельности учащихся:
групповая, индивидуальная работа, лабораторные
опыты, демонстрационные опыты, загадки,
презентация. - Прогнозируемые результаты.
- Учащиеся должны:
- повторить и обобщить материал о металлах;
- расширить свои знания о металлах;
- совершенствовать навыки по проведению лабораторных опытов и составление уравнений реакций.
- Цель урока: учащиеся повторят,
систематизируют материал по теме «Металлы”; (слайд) - Задачи урока:
- в занимательной форме повторить, обобщить знания по теме: “Металлы”
- систематизировать и обобщить материал о металлах;
- совершенствовать умения составлять уравнения химических реакций в молекулярном, ионном и ОВ видах, проводить эксперимент, решать задачи;
- развивать интеллектуальные умения: выделять главное, анализировать, сравнивать, делать выводы, использовать ранее накопленные знания;
- формировать научное мировоззрение, интерес к предмету, воспитывать коммуникативные навыки.
Оборудование:
карточки с формулами
химических веществ для цепочек генетических
превращений, реактивы: химическая посуда, CaCl2,
Na2CO3, AgNO3, FeCl3 (III), KSCN, AlCl3,
BaCI2, FeSO4, NaOH, фенолфталеин, проволока,
номерные пробирки с растворами (№1 и №2),
презентация, магнитики.
План урока
1. Организационный момент. Мотивация учебной
деятельности.
2. Активизация мыслительной деятельности
учащихся.
3. Организация учебной деятельности учащихся
4. Итог урока. Выставление оценок.
5. Домашнее задание.
1. Ориентировано-мотивационный этап
(инициация урока, объявление темы, цели, задачи,
формирование групп)
Учитель:
Организационный момент. Приветствие
учащихся.
2. Актуализация субъективного опыта учащихся. О
чем пойдет речь?
Одновременно с рассказом
слайды.
3. Мотивация и целеполагание
Учитель: “На улицах ужас разрушения: ни
рельсов, ни вагонов, ни автомобилей, камни
мостовой превращаются в труху, растения начинают
чахнуть. Впрочем, человек бы этого не заметил,
т.к., лишившись 3 г этого металла, он бы
моментально умер» — Отсутствие какого металла
так описал академик А.Е.Ферсман? (железо)
Учитель: К какой группе веществ относится
железо?
Постановка целей
Ученики:
Металлы
Учитель:
Что такое металлы? (Металлы — хим.
элементы, образующие в свободном состоянии
простые вещества с металлической связью).
Оглянитесь вокруг, где бы вы ни были: дома, в
школе, на улице, транспорте — вы видите множество
металлов вокруг нас. Через века и тысячелетия
человек пронёс уважение к металлу и мастерам,
добывающим и обрабатывающим его.
Ребята, поразмыслите — все металлы исчезли.
Опишите её последствия для человечества.
- Учитель: Что Вы будете делать?
- Ученики: Получать, добывать металлы.
- Учитель: Из чего?
- Ученики: Из минералов.
- Учитель: Что нужно для этого знать?
- Ученики: Способы получения металлов и
свойства металлов. - Сформулируйте цель урока
- Ученики: (формулируют цель)
- Учитель: Да сегодня на уроке мы обобщим и
систематизируем знания по теме “Металлы”. - Учитель: Какие способы получения
металлов существуют? Интерактив
4. Повторительно-обобщающий этап.
Металлы имеют огромное значение для живых
организмов.
В течение 10 уроков мы с вами рассмотрели тему
металлов? Какие группы металлов мы с вами
изучили.
Перед вами карточки (эл. формулы,
распределитесь так, чтобы у вас образовались
группы).
Деление класса на четыре группы.
(Приложение
1)
- Команда 1 группы металлов
- Команда 2 группы металлов
- Команда 3 алюминия
- Команда 4 железа
Наш класс превращается в научную лабораторию,
где будут работать четыре группы. Итогом работы
каждой группы будут знания, которые вы отразите в
практической и контрольной работе.
- Мы говорим, что металлы важны для нас, а все ли
мы о них знаем? - Вопросы:
- Какие металлы использовались в древние и
средние века? (Fe, Cu, Sn, Pb, Hg, Au, Ag) - Какие металлы называют черными, какие цветными?
Черные — железо и его сплавы, цветные – (Al, Cu, Pb, Zn,
Sn, Ag)
- Самый легкий металл? (Литий)
- Самый тугоплавкий металл. (Вольфрам)
- Металл входящий в состав мела. (Кальций)?
- Какой металл придает нашей крови красный цвет? (Железо)
- В какой металл упаковывают еду для космонавтов и конфеты для ребят? (Алюминий)
- Металл- жидкость. (Ртуть)
- Самый используемый металл в мире. (Железо)
- Рубин, сапфир, корунд, глинозем. (Алюминий)?
- Какой металл называют металлом солдатиков? (Олово)
- Из 1г какого металла можно вытянуть нить длинною 3,5 км (золото)?
- Какой самый распространенный на Земле металл? (Алюминий)
- Чего больше всего боится — железо? (Коррозии)
- Какой металл убивает бактерий? (Серебро).
- А теперь познакомимся с группами ближе. Перед
вами таблица (учащимся раздаются бланки для
записи) - Слайд 5, 6-9 проверка ответов команд
- Общие свойства металлов и их строение
- Приложение 2
| Щ.М | ШЗ.М | Аl | Fe |
| Положение в П.С. | |||
| Число е на внешнем электроном слое | |||
| Физические свойства | |||
| Формула высшего оксида и летучего водородного соединения | |||
| Характер оксидов и гидроксидов |
Цепочка превращений. Слайд
Приложение
3
На ваших столах лежат конверты: Задание, вы
должны из различных карточек с формулами
химических веществ, лежащих на столе в
беспорядке, выбрать те, с помощью которых может
быть составлена генетическая цепочка
превращений указанного элемента. Объяснения
ребят и проверка на доске.(уравнения реакций, ОВР,
ионно-молекулярное уравнение)
Слайд: Проверка
Слайд.
Эпиграф — высказывание М.В. Ломоносова:
“Химии никоим образом научиться невозможно, не
видав самой практики и не принимаясь за
химические операции”. А сейчас на некоторое
время вы станете химиками-аналитиками! В нашей
лаборатории перепутались склянки с реактивами, и
ваша задача распознать вещества и объяснить, как
вы это сделали. (На столах у учащихся 2 пробирки с
веществами под номерами, набор склянок с
реактивами и карточка с заданием). (Приложение
4)
Инструктаж по правилам техники безопасности.
Первичное закрепление знаний
Тест: 6 вариантов (взаимопроверка и сверка на
доске)
Приложение 5
Слайд: Ответы
Слайд: Игровой момент “Тёмный ящик”
На столе стоит коробочка, в которой лежит
металлический предмет – его необходимо отгадать
по свойствам:
слайд (анимация)
1. Наполеон III – племянник великого
дяди, любил пофорсить. На одном из банкетов гости
ели разными столовыми принадлежностями и
обиделись те, кому достались золотые, а не из
этого металла.
слайд (анимация)
2. Этот металл более 30 лет украшал
пальцы, шеи и уши великосветских модниц. Так как
первоначально килограмм этого металла стоил на 80
рублей дороже равного веса золота.
слайд (анимация)
3. Металл, из которого сделана эта вещь,
входит в состав сапфира и рубина.
4. Сырьём для получения этого металла
служит боксит.
5. Его называют “крылатым металлом”
Слайд (анимация)
В коробочке – алюминиевая
ложка.
Вопрос:
В каком городе поставлен памятник
алюминиевой ложке?
5. Подведение итогов урока.
6. Домашнее задание: Повторить главу
“Металлы”.
13.02.2016






