- Какие вещества вступают в реакцию с соляной кислотой
- Признак взаимодействия с цинком, железом и другими металлами
- Как составить уравнение реакции
- Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
- Техника безопасности
- Получение
- Это любопытно
- Применение
- Описание соляной кислоты: формула, свойства и применение
- Физические свойства
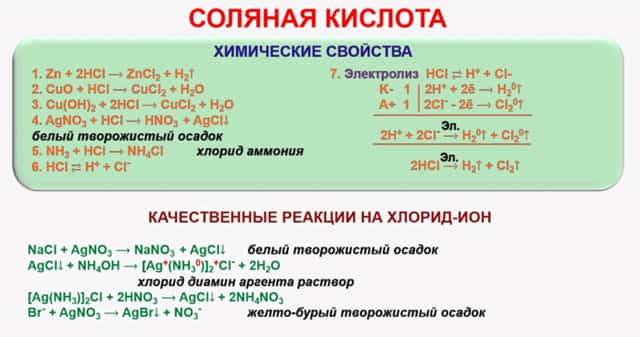
- Химические свойства
- Получение соляной кислоты
- Области применения
- В химической промышленности
- В металлургии
- В пищевой промышленности
- В быту
- В сельском хозяйстве
- В медицине
- В строительстве
- Интересные факты
- Соляная кислота
- Физические свойства
- Химические свойства
- Применение
- Промышленность
- Медицина
- ПОИСК
- Соляная кислота | это… Что такое Соляная кислота?
Известно доказанный факт, что соляная кислота взаимодействует с активными металлами. При этом часть веществ способна реагировать на такое соединение, другая часть остается нетронутой.
Неактивные металлы не могут реагировать на вещество: к ним относят золото, серебро, ртуть.
Соляная кислота представляет собой соединение хлора и водорода. Путем растворения в воде газообразного вещества под названием хлороводород получается данное соединение.
Ионы водорода при таком уравнении исполняют роль окислителя, что вызывает реакцию у активных металлов.
Какие вещества вступают в реакцию с соляной кислотой
- На вступительных экзаменах по химии часто можно встретить задание на определение веществ, которые способны реагировать на соляную кислоту.
- Кроме того, задание «составьте уравнение» нередко вызывает страх в глазах выпускников.
- Чтобы не путаться с химическими задачами, рекомендуется подробнее изучить информацию о взаимодействии с данным соединением.
- Все существующие вещества можно поделить на металлы, вытесняющие водород из соединения, не вытесняющие водород, а также активные и неактивные металлы.
В реакцию с соляной кислотой вступают такие вещества:
- Химические основания. Соляная кислота способна нейтрализовать основания. Как известно, они состоят из атома металла, на который и воздействует кислота.
К ним относят гидроксид натрия, бария, алюминия. Реакция нейтрализации дает образования соли и воды.
- Металлы. Если обратиться к электрохимическому ряду, можно увидеть, что соляная кислота реагирует со всеми элементами, стоящими до водорода в этом ряду.
Сюда относят натрий, магний, алюминий, литий, барий, кальций, цинк, железо и другие элементы. При взаимодействии они образуют хлориды и выделяют газообразный водород.
- Основные и атмосферные оксиды. Во время реакции происходит образование растворимых солей и воды. HCl взаимодействует с оксидом алюминия, меди, цинка, натрия.
- Карбонаты. При взаимодействии с карбонатами кальция получится следующее уравнение: CaCO₃ + 2HCl→ CaCl₂ + CO₂↑ + H₂O.
Из него следует, что выделяется углекислый газ, а также образуется вода и угольная кислота.
- Сильные окислители. Если вещество взаимодействует с перманганатом калия или диоксидом марганца, на выходе получается выделение газообразного хлора.
- Аммиак. Такое взаимодействие ознаменовано выделением сильного дыма, поэтому в момент проведения опытов рекомендуется открыть все окна. Тогда выделяется хлорид аммония.
Кроме перечисленных веществ и соединений, HCl также способна реагировать на нитрат серебра – при таком взаимодействии образуется осадок белого цвета творожистого типа.
Признак взаимодействия с цинком, железом и другими металлами
- Если курс школьной химии был успешно забыт, можно вспомнить о том, какие бывают признаки взаимодействия металлов, вступающих в реакцию с соляной кислотой.
- Чтобы экспериментальные опыты не вызвали несчастного случая, рекомендуется заранее открыть все окна, вооружиться защитной одеждой, чтобы кожа рук была закрыта.
- Также рекомендуется использовать перчатки и повязку на лицо.
Обратите внимание! Ниже будет рассказано о том, какие признаки говорят о вступлении в реакцию элементов с соединением.
Чтобы не проводить наглядные опыты, можно воспользоваться теоретической информацией.

Рассмотрим, что происходит, если добавить немного кислоты на определенный вид металла:
| Металл | Признак взаимодействия |
| Цинк | Если опустить этот металл серебристого цвета в пробирку с указанным веществом, можно постепенно наблюдать выделение небольшого количества пузырьков и водорода. В результате возникает хлорид цинка ZnCl₂ |
| Железо | Во время такого взаимодействия образуется хлористое железо. Реакция происходит медленно, однако, если пробирку подогреть, то процесс пойдет быстрее |
| Литий | При реакции образуется хлорид лития 2LiCl, выделяется водород. На поверхности этого металла, относящегося к щелочной группе, можно увидеть маленькие пузыри |
| Кремний | В результате такого соединения возникает сложный компонент под названием хлорсилан. Также выделяется газообразный водород. Такая реакция происходит при условии нагревания до 350 градусов, а в качестве катализатора выступает медь |
| Магний | При таком взаимодействии наблюдает выделение теплоты, металл начинает плавиться |
Как составить уравнение реакции
Одно из самых распространенных заданий на экзаменах и в контрольных работах – составить уравнение на реакцию HCl, в данном случае – соляной, с другими веществами или соединениями.

Чтобы не запутаться в решении, предлагаем несколько советов и шпаргалок для легкого запоминания:
- Запомните буквенное обозначение данного вещества – соляная кислота в химии обозначается как HCl: если вещество разбавленное, это указывается в скобках рядом.
- Как уже было сказано выше, вещество способно реагировать с активными металлами, стоящими до водорода в электрохимическом ряду; кроме того, она реагирует на основания, оксиды, гидроксиды и карбонаты.
- Химические основания обозначаются как OH, оксиды – O, гидроксиды – OH2, карбонаты – CO3.
- Уравнение реакции всегда будет иметь знак +, потому как в процессе взаимодействия происходит соединение нескольких компонентов.
- HCl может идти первым или вторым слагаемым, после прибавления металла, вещества идет знак =, после этого описывается реакция, где указаны продукты распада.
- Например, при реакции кислоты серы с сульфатом магния получается такое уравнение: Mg+H2SO4 = MgSO4+H2.
- Соляная кислота и гидроксид бария дают такое уравнение: 2HCl + Ba(OH)2 = BaCl2 + 2H2O.
- При реакции соединения водорода, хлора и мела образуется хлорид кальция: СаСО3 + 2HCl = CaCl2 + СО2 + Н2О.
- Раствор карбоната натрия с кислотой выглядит так: HCl+Na2CO3=2NaCl+H2O+CO2.
Составить уравнение несложно, важно изначально правильно обозначить буквенные символы каждого элемента или вещества.
Важно! Необходимо правильно определить коэффициенты атомов в уравнении – их количество до знака = должно быть таким же, как и после знака =.
Для правильного уравновешивания формулы пользуются правилами школьного курса химии, основанными на математическом принципе расстановки коэффициентов.
Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
- Кислота в чистом виде представляет собой жидкость без цвета и запаха. Техническая кислота обычно содержит примеси, которые придают ей слегка желтоватый оттенок. Соляную кислоту часто называют «дымящей», так как она выделяет пары хлороводорода, вступающие в реакцию с влагой воздуха и образующие кислотный туман. Очень хорошо растворяется в воде. При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.Хлористоводородная кислота активно вступает в реакции с металлами, оксидами, гидроксидами, образуя соли — хлориды. HCl взаимодействует с солями более слабых кислот; с сильными окислителями и аммиаком.Для определения соляной кислоты или хлоридов используют реакцию с нитратом серебра AgNO3, в результате которой выпадает белый творожистый осадок.
Техника безопасности
Вещество очень едкое, разъедает кожу, органические материалы, металлы и их окислы. На воздухе выделяет пары хлороводорода, которые вызывают удушье, ожоги кожи, слизистой глаз и носа, повреждают органы дыхания, разрушают зубы. Соляная кислота относится к веществам 2 степени опасности (высокоопасным), ПДК реактива в воздухе составляет 0,005 мг/л. Работать с хлористым водородом можно только в фильтрующих противогазах и защитной одежде, включая резиновые перчатки, фартук, спецобувь.При разливе кислоты ее смывают большим количеством воды или нейтрализуют щелочным растворами. Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.Перевозить и хранить хим реактив допускается в стеклянной, пластиковой таре, а также в металлической таре, покрытой изнутри резиновым слоем. Тара должна герметично закрываться.
Получение
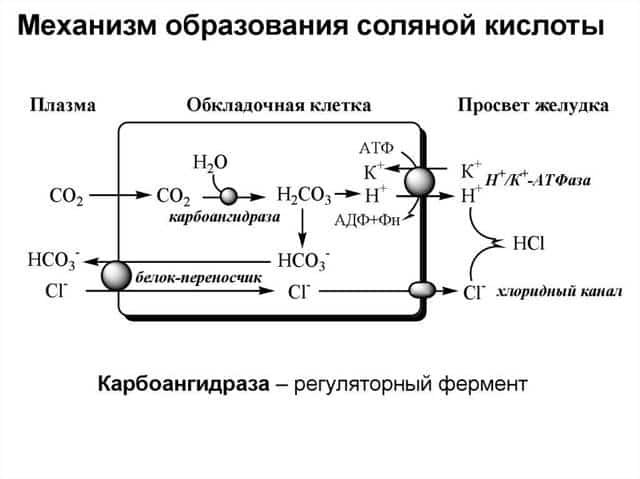
В промышленных масштабах соляную кислоту получают из газообразного хлороводорода (HCl). Сам хлороводород производится двумя основными способами:— экзотермической реакцией хлора и водорода — таким образом получают реактив высокой чистоты, например, для пищевой промышленности и фармацевтики;— из сопутствующих промышленных газов — кислота на основе такого HCl называется абгазной.
Это любопытно
Именно соляной кислоте природа «поручила» процесс расщепления пищи в организме. Концентрация кислоты в желудке составляет всего 0,4%, но этого оказывается достаточно, чтобы за неделю переварить бритвенное лезвие!
Кислота вырабатывается клетками самого желудка, который защищен от этой агрессивной субстанции слизистой оболочкой. Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Применение
— В медицине и фармацевтике — для восстановления кислотности желудочного сока при его недостаточности; при анемии для улучшения всасываемости железосодержащих лекарств.— В пищепроме это пищевая добавка, регулятор кислотности Е507, а также ингредиент сельтерской (содовой) воды. Используется при изготовлении фруктозы, желатина, лимонной кислоты.
— Больше всего производимой в мире хлористоводородной кислоты расходуется в металлургии для очистки заготовок от окислов. Для этих целей применяется ингибированная техническая кислота, в состав которой введены специальные ингибиторы (замедлители) реакции, благодаря чему реактив растворяет окислы, но не сам металл. Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.— Обрабатывают кожу перед дублением.— В добывающей отрасли востребована для очистки буровых скважин от отложений, для обработки руд и горных пластов.— В лабораторной практике хлористоводородная кислота используется как популярный реактив для аналитических исследований, для очистки сосудов от трудноудаляемых загрязнений.
— Применяется в каучуковой, целлюлозно-бумажной индустрии, в черной металлургии; для очистки котлов, труб, оборудования от сложных отложений, накипи, ржавчины; для очистки керамических и металлических изделий.
Описание соляной кислоты: формула, свойства и применение
Время на чтение: 11 минут
В состав соляной кислоты входят два химических элемента: хлор и водород. Данная кислота состоит из двух атомов и имеет формулу: HCl. Стоит отметить, что соляная кислота – это тривиальное название (т.е. название, применяемое в обиходной речи химиков, не отражающее состава). По международной номенклатуре ИЮПАК вещество с формулой HCl принято называть хлороводородной кислотой. Иногда HCl называют хлористоводородной кислотой или хлористым водородом, также приемлемо название – хлорид водорода.
Физические свойства
Физические свойства HCl коррелируют с концентрацией данного соединения в растворе. Для того, чтобы не перегружаться цифрами, рассмотрим физические свойства хлористого водорода на примере его концентрированной формы (около 36%):
- низкая температура кипения (t=48 градусов по Цельсию);
- высокая температура плавления (t=30 градусов по Цельсию);
- плотность составляет 1,18 г/см3;
- хлорид водорода обладает способностью к ионизации в водных растворах.
- при низкой температуре приобретает гидратную оболочку: HCL*H20 или HCl*2H2O;
- растворы хлороводородной кислоты бесцветные;
- в чистом виде находится в газообразном агрегатном состояние (а в растворах в жидкой форме);
- во влажном воздухе концентрированные растворы HCl могут сильно дымиться;
- соляная кислота – вещество, обладающее резким запахом.
Химические свойства
Химические свойства хлорида водорода можно подразделить на общие (характерные для всех соединений, основным свойство которых является отдача протона) и специфические (характерные только для HCl). Общие свойства:
- Изменение окраски индикаторов за счет присутствия в растворе H+.
- Взаимодействует с металлами, стоящими до водорода в электрохимическом ряду напряжения металлов, с образованием газообразного водорода: Mg + 2HCL = MgCl2 + H2(газ).
- Взаимодействует с растворами щелочей – реакция нейтрализации (образование соли и воды посредством взаимодействия кислоты и основания): 2NaOH + 2HCl = H2O + 2NaCl.
- Реагирует с основными оксидами с образование соли и воды: MgO + 2HCL = H2O + MgCl.
- Реагирует с растворами солей (реакция обмена): 2HCL + Na2SO4 = H2SO4 + 2NaCl.
- Взаимодействует с большинством органических соединений (спирты, алкены, алкины, галогенпроизводные и так далее): CH2=CH2 + HCl = CH3-CH2-Cl.
Специфические свойства соляной кислоты:
- Реагирует нитратом серебра (качественная реакция): AgNO3: AgNO3 + HCl = AgCl (осадок белого цвета) + HNO3;
- Вступает в реакцию с сильными окислителями (оксид марганца, перманганат калия и другие): MnO2+4HCl=4Cl2+MnCl2+2H2O. Данная реакция протекает в условия нагревания.
Получение соляной кислоты
Промышленный способ получения хлористого водорода заключается в горении водорода в хлоре и последующим растворением образовавшегося вещества в воде. Существует и другой способ получения хлороводородной кислоты, применяемый в лабораторных условиях.
Суть способа заключается в реакции поваренной соли(NaCl) с концентрированно серной кислотой при нагревании.
В результате получаются следующие соединения: гидросульфат натрия и хлорид водорода, если провести химическое взаимодействие между образовавшимися продуктами, то образуется сульфат натрия и 2 молекулы хлористого водорода. Приведем общее уравнение реакции: 2NaCl + H2SO4 = Na2SO4 + 2HCl.
Области применения
Хлорид водорода является ключевым реагентом в химической промышленности, однако данное соединение нашло себе применение во многих отраслях человеческого деятельности.
В химической промышленности
В химической промышленности хлористый водород применяют для синтез хлорорганических соединений, а хлорсодержащих солей различных металлов.
В металлургии
В металлургии HCl используется с целью очистки металла после лужения (процесса нанесения олова с целью защиты металла от коррозии).
В пищевой промышленности
33% раствор HCl активно применяют в пищевом производстве в качестве регулятора pH, предназначенного для очистки воды.
В быту
В домохозяйстве HCl используют в составе моющих, хлорсодержащих средств.
В сельском хозяйстве
В сельскохозяйственной деятельности HCl применяется в составе хлорорганических веществ, которые используются в качестве органических ядохимикатов.
В медицине
В медицинской практике применяют слабые растворы хлористого водорода с целью улучшения пищеварения.
В строительстве
В строительстве HCl используют для очистки красного кирпича от грязи. Также использование растворов HCl повышает морозостойкость и влагостойкость бетонных конструкций, что способствует постройке более долгоживущих зданий.
Интересные факты
Приведем ряд фактов о хлороводородной кислоте, которые удивят обывателя:
- Хлористый водород способен полностью исправиться. Дело в том, что при высоких температурах соединение переходит в свое основное агрегатное состояние – газообразное и насыщает атмосферу молекулами хлора и водорода.
- Соляная кислота вырабатывается париетальными клетками желудка человеческого организма в небольшой концентрации (0,3%). Она создает необходимую кислотность среды, в которой наиболее активно протекают ферментативные процессы расщепления питательных веществ.
- При пониженной кислотности желудка, в нем развиваются лактобактерии. Данный факт указывает на еще одно свойство HCl – способность уничтожать бактерии. Данное свойство выражает в еще одной её функции в организме человека – бактерицидной.
Соляная кислота
Соляная кислота (также хлороводородная, хлористоводородная кислота, хлористый водород) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота.
Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около ω = 0,5 % присутствует в желудке человека, что соответствует pH = pω − lg ( ρH2O / μHCl ) ≅ 0,86.
Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Соли соляной кислоты называются хлоридами.
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес),кг HCl/кг | Конц. (г/л),кг HCl/м³ | Плотность,кг/л | МолярностьM | Водородный показатель (pH) | Вязкость,мПа·с | Удельная теплоемкость,кДж/(кг·К) | Давление пара,Па | Температура кипения,°C | Температура плавления,°C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
2Na + 2HCl ⟶ 2NaCl + H2 ↑Mg + 2HCl ⟶ MgCl2 + H2 ↑2Al + 6HCl ⟶ 2AlCl3 + 3H2 ↑
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
Na2O + 2HCl ⟶ 2NaCl + H2O MgO + 2HCl ⟶ MgCl2 + H2OAl2O3 + 6HCl ⟶ 2AlCl3 + 3H2O
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
NaOH + HCl ⟶ NaCl + H2O Ba(OH)2 + 2HCl ⟶ BaCl2 + 2H2OAl(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2 ↑
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
2KMnO4 + 16HCl ⟶ 5Cl2 ↑ + 2MnCl2 + 2KCl + 8H2O
- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
NH3 + HCl ⟶ NH4Cl
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
HCl + AgNO3 → AgCl ↓ + HNO3
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
NaCl + H2SO4 →150oC NaHSO4 + HCl
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
2NaCl + H2SO4 →550oC Na2SO4 + 2HCl
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
MgCl2 ⋅ 6H2O →t,oC MgO + 2HCl + 5H2OAlCl3 ⋅ 6H2O →t,oC Al(OH)3 + 3HCl + 3H2O
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
MgCl2 + H2O → Mg2OCl2 + HCl
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
Перевозка соляной кислоты железнодорожным транспортом осуществляется в специализированных вагонах-цистернах
Промышленность
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина
Основная статья: Кислотность желудочного сока
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
- При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
- Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
- В РФ оборот соляной кислоты концентрации 15 % и более — ограничен.
ПОИСК
Опыт 2. Соляная кислота взаимодействует с активными металлами. В пробирки полол ить в одну кусочек цинка, в другую магния, в третью ж елезный гвоздик и налить разбавленной соляной кислоты (1 1).
Отметить выделение водорода и написать уравнения соответствующих реакций. [c.152]
Пользуясь рядом стандартных электродных потенциалов, определите, с какими из перечисленных в скобках металлов (Zn, F , Al, Си.
Со, Pi, d ) будет взаимодействовать соляная кислота. [c.171]
Почему соляная кислота взаимодействует с цинком и многими другими металлами (как ), а безводный сжиженный хлористый водород не вступает с ними в реакции [c.67]
Взаимодействие с разбавленной серной кислотой. Взаимодействие металлов с разбавленной серной кислотой осуществляется так же, как и с соляной кислотой [c.331]
Эквивалент металла равен 8,99. Какой объем водорода (при —3°С и 106,6 кПа) получится при взаимодействии 0,4495 г металла с соляной кислотой [c.14]
При взаимодействии 2,25 г некоторого металла, принадлежащего к элементам второй группы Периодической системы, с соляной кислотой выделяется 5,6 л (при н у.) водорода. Какой это металл [c.15]
Укажите, какие хлориды цинка, меди, железа и алюминия могут быть получены при непосредственном взаимодействии простых вешеств, и какие — при действии хлороводорода (или соляной кислоты) на металл. [c.146]
Решение. Из двух металлов с раствором соляной кислоты взаимодействует только магний [c.24]
Важной особенностью таких растворов является то, что химические свойства электролита в них как бы складываются из свойств соответствующих ионов в таких растворах. Логически это понятно, так как если недиссоциированных молекул в растворе практически нет, то и на свойства раствора они не влияют.
Это приводит, например, к появлению у электролитов групповых химических свойств, присущих всем электролитам, содержащим ион данного вида. Так, все хлориды и соляная кислота содержат ион хлора, и поэтому им свойственна реакция-образования осадка А С1 при взаимодействии с AgNOз. Подобные групповые реакции широко используются в аналитической химии.
Напрнмер, действием иона водорода обусловлены все кислотные свойства способность изменять цвет лакмуса или метилоранжа в красный цвет или соответственно изменять окраску других индикаторов, растворять некоторые металлы с выделенцем водорода и образованием соли, нейтрализовать основания и т. д.
Можно убедиться, что во всех указанных процессах кислота действует не своим анионом и не недиссоциированной молекулой, а именно водородным ионом. Чем больше концентрация водородных ионов, тем более резко проявляются все кислотные свойства раствора. Подобным же образом все свойства, общие для оснований, осуществляются действием гидроксильных ионов.
Чем выше концентрация гидроксильных ионов, тем сильнее все основные свойства раствора. К групповым свойствам принадлежит также окраска раствора, вызываемая присутствием какого-нибудь иона (синий цвет гидратированных ионов Си +, зеленый — N 2- ). [c.397]
Важнейшее химическое свойство оснований — способность образовывать соли с кислотами. Наиример, при взаимодействии перечисленных оснований с соляной кислотой получаются хлористые соли соответствующих металлов —. хлориды натрия или меди [c.41]
Как известно, взаимодействие металлов с серной кислотой происходит различно в зависимости от концентрации кислоты и природы металла.
Разбавленная серная кислота действует на металлы подобно разбавленной соляной кислоте растворяет металлы, стоящие в ряду напряжений до олова включительно. Приэтом водородные ионы разведенной НзЗО. окисляют атомы металла, отдающие электроны.
Так, например, окисление атомов двухналентного металла (Ме) может быть представлено схемой [c.95]
Слейте соляную кислоту с металла, снова промойте его водой и прилейте 5—10 капель концентрированной азотной кислоты.
Осторожно нагрейте пробирку на маленьком пламени горелки и отметьте взаимодействие алюминия с азотной кислотой при нагревании.
Какой газ выделяется Напишите уравнение реакции взаимодействия алюминия с концентрированной азотной кислотой при нагревании. [c.174]
В конце IX в. арабский алхимик Гебер открыл способность смеси азотной и соляной кислот взаимодействовать с золотом. Смесь получила название царской водки за уникальную способность, не свойственную водкам , т. е. кислотам, растворять золото — царя всех металлов.
Природа этого растворения имеет комплексный характер. Известно, что золото очень устойчиво к окислителям. Но эта устойчивость ослабляется в присутствии лигандов вследствие комплексообразования. В царской водке такими лигандами являются хлорид-ионы [c.
20]
В воде FeS нерастворим поэтому, накапливаясь на поверхности металла, сернистое железо играет до некоторой степени роль защитной пленки, предотвращающей дальнейшую коррозию. При взаимодействии FeS с соляной кислотой пленка превращается в хлорное железо, легко растворимое в воде. Наличие соляной кислоты способствует обнажению чистого металла, и его коррозия возрастает. Поэтому содержание солей в нефтях, выделяющих при переработке H2S, особенно опасно. Следовательно, сернистые нефти необходимо предварительно полностью обессоливать. Хлориды способствуют увеличению образования сероводорода при перегонке примерно в 2—3 раза. Сероводород (HgS) крайне ядовитый газ, вызывающий отравление обслуживающего персонала и загрязнение атмосферного воздуха. [c.10]
Рассматриваемые металлы расположены в ряду напряжений до водорода. Галлий и индий растворяются в разбавленных кислотах. В соответствии с устойчивой степенью окисления Т1 при взаимодействии с кислотами образует производные Т1 (I). Галлий в соляной кислоте пассивируется за счет образования нерастворимого в воде Т1С1. [c.463]
Взаимодействие марганца с кислотами. Небольшие кусочки металла, полученного в предыдущем опыте (королек разбейте в стальной ступке), поместите в три пробирки.
В одну пробирку добавьте 1—2 мл разбавленной соляной кислоты, во вторую — разбавленной серной, в третью — раствора щелочи. Наблюдайте растворение марганца в кислотах и отсутствие растворения в щелочи.
Изучите взаимодействие марганца с разбавленной и концентрированной азотной кислотой. Запишите наблюдения и уравнения реакций. [c.120]
Хлористоводородные растворы представляют все свойства виергической кислоты. Они не только превращают синие растительные цвета в красные, вытесняют из углекислых солей углекислый газ и т. п., но и насыщают вполне основания, даже такие энергические, как, напр., кали, известь и т. п.
В сухом состоянии газа, хлористый водород, однако, не изменяет растительных цветов и не производит многих двойных разложений, какие легко совершаются в присутствии воды. Это объясняется тем, что упруго-газообразное состояние хлористого водорода препятствует ему вступать во взаимодействие.
Однако, накаленное железо, цинк, натрий и т. п. действуют на газообразный хлористый водород, вытесняя водород, и именно, оставляя половину объема водорода против одного объема взятого хлористого водорода, что может служить и для определения состава хлористого водорода.
Хлористый водород с водою действует, как кислота, во многом очень сходная с азотною кислотою, но последняя, содержа легко выделяемый кислород, очень часто действует, как окислитель, способности к чему вовсе нет у соляной кислоты. Большинство металлов (даже не вытесняющих Н из H SO , а разлагающих ее до SO , напр.
, медь) вытесняет водород из хлористого водорода. Так, при действии на цинк, даже на медь и. олово, выделяется водород [297]. Немногие только металлы сопротивляются его действию, напр., золото, платина.
Свинец оттого только действует слабо в сплошной массе, что образующийся хлористый свинец — нерастворим и препятствует дальнейшему действию хлористого водорода на металл. То же самое должно заметить относительно слабого действия хлористого водорода [c.319]
Осадок растворяют в соляной кислоте при этом образуются хлорид металла и свободный оксихинолин. К раствору прибавляют бромистый калий и титруют его из бюретки раствором КВгО, известной концентрации.
При взаимодействии КЕгО, и КВг в кислой среде выделяется бром, реагирующий с оксихинолином.
После превращения всего оксихинолина в бромпроизводное в растворе появляется избыток брома, который легко обнаружить по обесцвечиванию им красителей. [c.104]
Хлорное железо легко растворяется в воде, а выделяющийся сероводород вновь вступает во взаимодействие с металлом и т. д. Следовательно, комбинированное действие двух таких корродирующих агентов, как сероводород и соляная кислота, приводит к весьма активному разъеданию аппаратуры. [c.135]
Соли МДЭСи (красного цвета) образуются при взаимодействии соединений Рс1 (II) и Р1 (II) в соляной кислоте с соответствующими солями щелочных металлов. Наиболее важны растворимые [c.653]
Вычислите массовую долю (%) металла в смеси с его оксидом, зная объем водорода, выделившегося при взаимодействии смеси с соляной кислотой. [c.150]
Взаимодействие с кислотами. 1. К 1—2 кусочкам цинка в отдельных пробирках добавьте по 8—10 капель разбавленной и концентрированной соляной кислоты. Отметьте интенсивность взаимодействия металла с кислотой в каждом случае. Аналогичные опыты проделайте с разбавленными и концентрированными Н2804 и НЫОз (опыт проводите в вытяжном шкафу). [c.256]
Причини, по которым данное соединение является хорошим ингибитором для железа и плохим для цинка или наоборот, могут быть связаны также со специфическим электронным взаимодействием полярных групп с металлом (хемосорбцией). Последний фактор в определенных случаях более важен, чем стерический, определяющий возможности для плотнейшей упаковки адсорбированных молекул.
Это можно проиллюстрировать очень значительным ингибирующим действием оксида углерода СО, растворенного в соляной кислоте, на коррозию в ней нержавеющей стали [36] (степень защиты 99,8%, в 6,3 М растворе НС1 при 25 °С). Об этом же свидетельствует защита железа, обеспечиваемая малым количеством иодида в разбавленных растворах Н2504 [35, 37, 38].
Как СО, так и иодид хемосорбируются на поверхности металла, препятствуя в основном протеканию анодной реакции [39]. Кеше [40] показал, что 10″ т К1 значительно лучше ингибирует железо в 0,5 т растворе N32804 с pH = 1 (степень защиты 89 %), чем в растворе с pH = 2,5 (степень защиты 17 %).
Это показывает, что адсорбция иодида в этом интервале pH зависит от значения pH [c.270]
Хроматы щелочно-земельных металлов. В три пробирки налейте небольшое количество растворов солей кальция, стронция, бария и добавьте к ним раствор хромата калия. Хроматы каких металлов выпадают в осадок Отметьте цвет полученных веществ и проверьте их взаимодействие с раствором уксусной и соляной кислот. [c.251]
Результат опыта. Из всех металлов только цинк бурно реагирует с раствором соляной кислоты. С поверхности цинковой пластинки интенсивно выделяются многочисленные пузырьки газа. Поверхность пластинок из меди и серебра остается неизменной — пузырьков газа не образуется, что свидетельствует об отсутствии реакции взаимодействия этих металлов с кислотой. [c.129]
Смесь, состоящая из 1 объема азотной и 3—4 обт>емов концен трнрованной соляной кислоты, называется царской водкой. Цар ская водка растворяет некоторые металлы, пе взаимодействующие с азотной кпслотой, в то.
ч числе и царя металлов — золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием. клороксида азо-rai ni), пл[1 хлорида нитрозила, NO I [c.
414]
Термохимическое воздействие иа ПЗП — процесс подачи на забой скважины соляной кислоты, нагретой в результате взаимодействия с металлом. В качестве реагирующего с НС1 металла обычно используют магний или его сплавы (МЛ-1, МА-1 и др.), кмторые в специальном наконечнике устанавливают в обрабатываемом интервале. [c.17]
Взаимодействие хрома с соляной и разбавленной серной кислотами. В две пробирки поместите по 0,1 г порошка хрома и прибавьте в первую пробирку концентрированную соляную, а во вторую — разбавленную серную кислоту.
Содержимое пробирки слегка подогрейте и наблюдайте интенсивное взаимодействие металла с кислотами. Каков цвет )астворов и соответствует ли он окраске солей хрома (II) 2сли нет, то почему [c.
148]
Подобные процессы происходят и прп реакциях, в ходе которых малорастворимое вещество превращаегся в растворимый, по слабо диссоциирующий продукт. К таким реакциям относится, например, растворение сульфидов некоторых металлов в соляной кислоте. Так, взаимодействие сульфида марганца с соляной кислотой выражается уравнением [c.256]
Проведен термодинамический анализ взаимодействия ксяшояен-тов флюса на основе хлористого цинка с окисной пленкой. Рассчитаны величины изобарного потенциала для взаимодействия 2% раствора соляной кислоты с металлами и их окислами.
Показано, что флюсующее действие 1-2% раствора соляной кислоты при низкотемпературной пайке связано с процессом диспергирования окисной пленки в результате протекания реакции между соляной кислотой и паяемым металлом. [c.
129]
Нет ни одного катализатора, который в условиях реакции не вступал б ы во взаимодействие с фенолом или альдегидом.
Так, напрНмер, соляная кислота взаимодействует с формальдегидом с образованием монохлбрметилового спирта и оксихлорметило-вого эфира, щелочи с фенолами дают феноляты.
Фенолы можно рассматривать как слабые кислоты, а феноляты щелочных и щелочноземельных металлов как соли сильных оснований с слабыми кислотами. Феноляты в присутствии избытка фенила, [c.27]
Соли MgiB lJ (красного цвета) образуются при взаимодействии -оединений Pd (II) и Pt (II) в соляной кислоте с соответствующими олями щелочных металлов. Наиболее важны растворимые в воде KolPt lJ и NaJPt lJ (рис. 243), являющиеся исходными вещест- [c.614]
В ряду напряжений все три элемента располагаются правее водорода, причем медь стоит почти рядом с ним, а золото — дальше всех остальных металлов. Поэтому в растворах таких кислот, как НС1, H2SO4 и т. п., при отсутствии окислителей не растворяется даже медь.
В кислотах, одновременно являющихся окислителями (HNO3 и т. п.), медь и серебро растворяются легко, а золото лишь в том случае, когда окислительные свойства кислоты выражены особенно сильно.
Лучшим растворителем для него является насыщенная хлором соляная кислота, взаимодействую- [c.388]
Используя значения стандартных электродных потенциалов, объясните, какой из металлов (железо или олово), будет энергичнее взаимодействовать с разбавленной соляной кислотой. Определите АСгэв соответствующих процессов. [c.104]
В растворах же состав может меняться непрерывно без существенного изменения химических свойств.
Так, количество H l в растворе соляной кислоты может доходить до 37%, причем все растворы соляной кислоты будут обладать химическими свойствами, характерными для данной кислоты (взаимодействие со и елочами, с металлами и пр.
), при этом однородность растворов кислоты не изменится. Это свойство понятно из приведенного здесь в виде обратимой реакщ и механизма образования раствора.
Уравнение обратимой реакции показывает, что в растворе все время находятся в равновесии сольваты разного состава, поэтому изменение количества растворителя в растворе приведет лишь к изменению соотношения между этими сольватами, но не нарушит однородности и не изменит в некоторых пределах химических свойств раствора. [c.29]
Соляная кислота | это… Что такое Соляная кислота?
- СОЛЯНАЯ КИСЛОТА — (НСl), водный раствор хлороводорода, бесцветного газа с резким запахом. Получают действием серной кислоты на поваренную соль, как побочный продукт хлорирования углеводородов, или реакцией водорода и хлора. Соляная кислота используется, для… … Научно-технический энциклопедический словарь
- Соляная кислота — – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов
- СОЛЯНАЯ КИСЛОТА — (хлористоводородная кислота) раствор хлористого водорода в воде; сильная кислота. Бесцветная, дымящая на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20 .С) 38% по массе,… … Большой Энциклопедический словарь
- СОЛЯНАЯ КИСЛОТА — (Acidum muriaticum, Acid, hydrochloricum), раствор хлористого водорода (НС1) в воде. В природе встречается в воде нек рых источников вулканического происхождения, а также находится в желудочном соке (до 0,5%). Хлористый водород может быть получен … Большая медицинская энциклопедия
- СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда
- СОЛЯНАЯ КИСЛОТА — (хлористоводородная кислота) НСl водный раствор хлористого водорода, сильная одноосновная кислота, летучая, с резким запахом; примеси железа, хлора окрашивают её в желтоватый цвет. Поступающая в продажи концентрированная С. к. содержит 37 %… … Большая политехническая энциклопедия
- соляная кислота — сущ., кол во синонимов: 1 • кислота (171) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
- СОЛЯНАЯ КИСЛОТА — СОЛЯНАЯ КИСЛОТА, водный раствор хлористого водорода HCl; дымящая на воздухе жидкость с резким запахом. Применяют соляную кислоту для получения различных хлоридов, травления металлов, обработки руд, в производстве хлора, соды, каучуков и др.… … Современная энциклопедия
- Соляная кислота — СОЛЯНАЯ КИСЛОТА, водный раствор хлористого водорода HCl; дымящая на воздухе жидкость с резким запахом. Применяют соляную кислоту для получения различных хлоридов, травления металлов, обработки руд, в производстве хлора, соды, каучуков и др.… … Иллюстрированный энциклопедический словарь
- соляная кислота — (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь