- Общая характеристика
- Природные соединения
- Получение
- Химические свойства
- Оксиды щелочноземельных металлов
- Получение
- Химические свойства
- Гидроксиды щелочноземельных металлов
- Получение
- Химические свойства
- Жесткость воды
- Оксиды — что это такое? Химические свойства и классификация
- Виды оксидов
- Номенклатура оксидов
- Названия некоторых оксидов: таблица
- 2. Взаимодействие с кислотными оксидами и кислотами
- Химические свойства кислотных оксидов
- 1. Взаимодействие с водой
- 3. Взаимодействие с амфотерными оксидами и гидроксидами
- 2. Окисление простых веществ — неметаллов
- 3. Разложение гидроксидов
- 4. Окисление сложных веществ
- Оксиды и пероксиды металлов IIA группы
- Получение
- Свойства
- Гидроксиды
- Получение
- Свойства
- Гдз химия 9 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, §17 общая характеристика элементов iiа группы
- Таблица оксидов
- Таблица оксидов (1 часть):
- Таблица оксидов (2 часть):
- Таблица оксидов (3 часть):
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
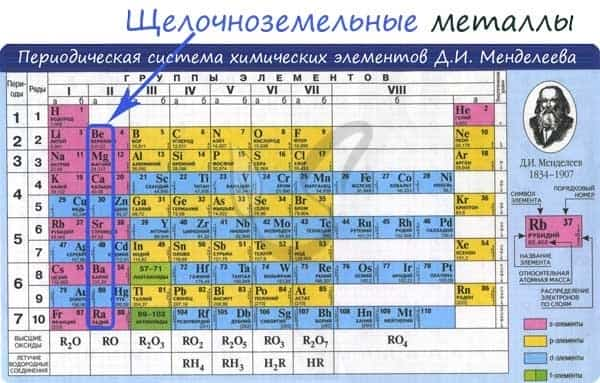
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2:
- Be — 2s2
- Mg — 3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be — BeO*Al2O3*6SiO2 — берилл
- Mg — MgCO3 — магнезит, MgO*Al2O3 — шпинель, 2MgO*SiO2 — оливин
- Ca — CaCO3 — мел, мрамор, известняк, кальцит, CaSO4*2H2O — гипс, CaF2 — флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
- MgCl2 → (t) Mg + Cl2 (электролиз расплава)
- CaO + Al → Al2O3 + Ca (алюминотермия — способ получения металлов путем восстановления их оксидов алюминием)
- MgBr2 + Ca → CaBr2 + Mg

Химические свойства
- Реакции с водой
- Реакции с кислотами
- Реакции с неметаллами
- Mg + O2 → MgO (оксид магния)
- Ca + I2 → CaI2 (йодид кальция)
- При нагревании реагируют с серой, азотом, водородом и углеродом.
- Mg + S → (t) MgS (сульфид магния)
- Ca + N2 → (t) Ca3N2 (нитрид кальция)
- Ca + H2 → (t) CaH2 (гидрид кальция)
- Ba + C → (t) BaC2 (карбид бария)
- С оксидами других металлов
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании. Ca + H2O → Ca(OH)2 + H2↑ 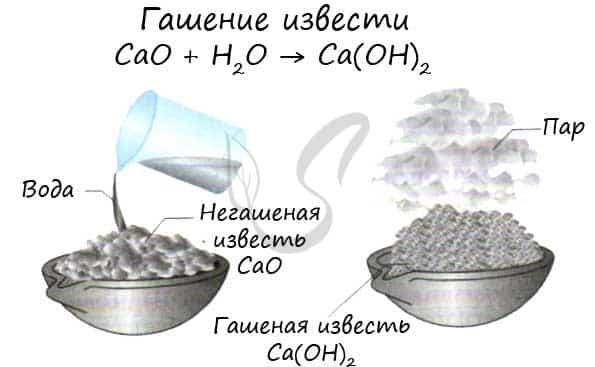
Щелочноземельные металлы — активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот: Ba + HCl → BaCl2 + H2
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
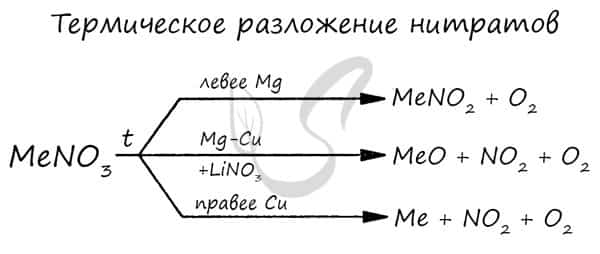
- Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
- MgCO3 → (t) MgO + CO2
- Ca(NO3)2 → (t < 560°C) Ca(NO2)2 + O2
- Ca(NO3)2 → (t > 560°C) CaO + O2 + NO2
- Рекомендую взять на вооружение общую схему разложения нитратов:
Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO — амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
- BaO + HCl → BaCl2 + H2O
- CaO + H2SO4 → CaSO4 + H2O
- MgO + SO3 → MgSO4
- CaO + CO2 → CaCO3
- CaO + SiO2 → CaSiO3
- Реакция с водой
- В нее вступают все, кроме оксида бериллия.
- CaO + H2O → Ca(OH)2
- MgO + H2O → Mg(OH)2
- Амфотерный оксид бериллия
- BeO + HCl → BeCl2 + H2O
- BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
- Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
- BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
- BeO + Na2O → Na2BeO2
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия — амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
CaO + H2O → Ca(OH)2
Химические свойства
- Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
- Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
- Ca(OH)2 + 2CO2 → Ca(HCO3)2
- Ca(HCO3)2 + Ca(OH)2 → CaCO3 + H2O + CO2
- Ca(OH)2 + CO2 → CaCO3↓ + H2O

- Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
- Ba(OH)2 + Na2SO4 → BaSO4↓ + NaOH
- Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
- Be(OH)2 + HCl → BeCl2 + H2O
- Be(OH)2 + NaOH → Na2[Be(OH)4]
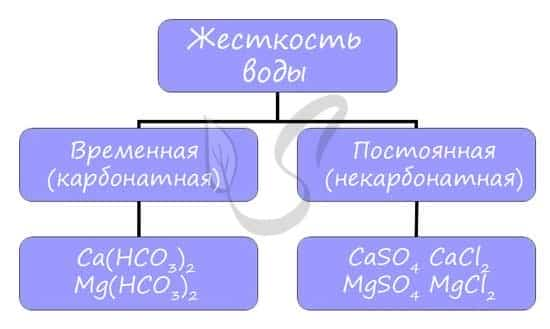
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
- Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить — каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках — CaCO3 — бесспорное доказательство устранения жесткости:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
- Также временную жесткость можно устранить, добавив Na2CO3 в воду:
- Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
- С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
- CaCl2 + Na2CO3 → CaCO3↓ + NaCl
- MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Оксиды — что это такое? Химические свойства и классификация
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
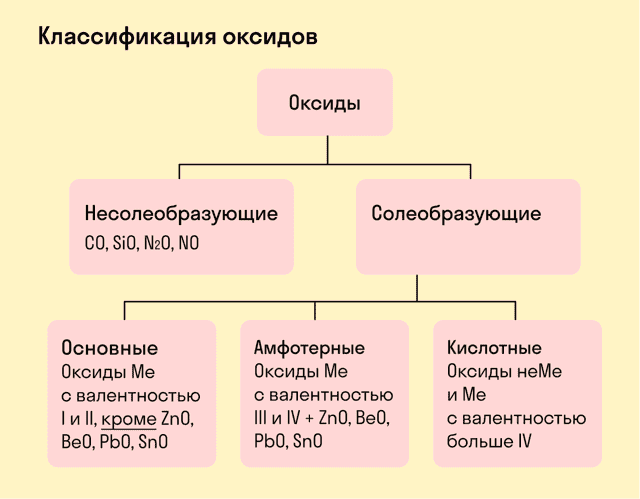
Виды оксидов
- Все оксиды делятся на солеобразующие и несолеобразующие.
- Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
- К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
- Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
- Солеобразующие оксиды делятся на три группы:
-
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
-
- Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
- К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
- Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
- Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
-
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
- CrO (оксид хрома (II)) — проявляет основные свойства;
- Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
- CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «оксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
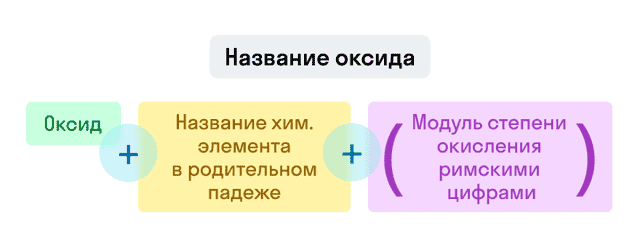
Примеры названий оксидов:
- Fe2O3 — оксид железа (III). Читается: феррум два о три.
- Na2O — оксид натрия. Читается: натрия два о.
- SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Не взаимодействуют с кислородом: платина, золото и палладий.
- Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
- 4Cr + 3O2 = 2Cr2O3
- При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
- При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
- 4P + 5O2 (избыток) = 2P2O5
- При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
- 4P + 3O2 (недостаток) = 2P2O3
- Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
- S + O2 = SO2
- Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
- N2 + O2 = 2NO
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
- Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
- Гидроксид (кислота) = оксид + вода
- Например:
- H2SO3 = SO2↑ + H2O
- H2CO3 = CO2↑ + H2O
- Ag(OH) = Ag2O + H2O
- NH4OH = NH3↑ + H2O
- Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
- Например:
4. Окисление сложных веществ
- Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
- Например:
- 2H2S + 3O2 = 2SO2 + 2H2O
- 4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Летняя перезагрузка
Бесплатный телеграм-марафон для мам и пап. Узнайте, как провести семейное лето с пользой, и подготовьтесь к нему уже сейчас!

Оксиды и пероксиды металлов IIA группы
Атомы металлов IIA группы в соединениях двухвалентны. Поэтому общая формула оксидов — MeO и пероксидов — MeO2 (ВеО2 — не получен).
Получение
- Оксиды получают при нагревании:
- 2Me + O2 = 2 MeO,Me(OH)2 MeO + H2O (Me = Be, Mg)MeCO3 MeO + CO2- (Me = Be, Mg, Ca, Sr)2Me(NO3)2 2MeO + 4NO2- + O2-
- Пероксиды получают по реакции нейтрализации Н2О2:
- Me(OH)2 + H2O2 = MeO2 + 2H2O (кроме BaO2),2BaO + O2 2BaO2.
Свойства
- Оксиды металлов IIA группы являются основными оксидами, а ВеО проявляет амфотерные свойства.
Оксиды реагируют с водой:
- МеO + H2O = Ме(OH)2 (кроме ВеО),
- легко растворяются в кислотах:
- MeO + 2HCl = MeCl2 + H2O,
- а ВеО взаимодействует и со щелочами:
- BeO + 2NaOH Na2BeO2 + H2O,BeO + 2NaOH + H2O = Na2[Be(OH)4],BeO + Na2CO3 = Na2BeO2 + CO2-.
- Пероксиды подвергаются сильному гидролизу:
- MeO2 + 2H2O = Me(OH)2 + H2O2,BaO2 + H2SO4 = BaSO4Ї + H2O2 (в лаборатории),
- легко разлагаются кислотами, даже очень слабыми:
- MeO2 + H2CO3 = MeCO3 + H2O2.
- Пероксиды являются сильными окислителями:
- MeO2 + 2NaI + 2H2O ® Me(OH)2 + 2NaOH + I2Ї,
- но могут и сами окисляться.
- Они реагируют с кислотными оксидами и кислотами:
- MeO + SO3 = MeSO4,MeO + 2HNO3 = Me(NO3)2 + H2O.
Гидроксиды
Гидроксиды имеют общую формулу Ме(ОН)2.
Получение
- Их получают взаимодействием оксидов Ca, Sr, Ba (Ме) с водой:
- MeO + H2O = Me(OH)2.
- Be(OH)2 и Mg(OH)2 получают с помощью обменных реакций:
- BeГ2 + 2NaOH = 2NaГ + Be(OH)2Ї.
Свойства
- Гидроксиды щелочноземельных металлов в воде полностью диссоциируют на ионы.
Они энергично взаимодействуют с кислотными и амфотерными оксидами и гидроксидами, с многоосновными кислотами могут давать кислые соли:
- Cl2 + Ca(OH)2 = Ca(ClO)Cl + H2O(хлорная известь),
- Me(OH)2 + 2HCl = MeCl2 + 2H2O,
2NH4Cl + Me(OH)2 = MeCl2 + 2NH3- + 2H2O,CuCl2 + Me(OH)2 = Cu(OH)2Ї + MeCl2,Ca(HCO3)2 + Ca(OH)2 = 2CaCO3Ї + 2H2O,Ca(OH)2 + CO2 = CaCO3¨ + H2O,Ba(OH)2 + H2SO4 = BaSO4¨ + 2 H2O.
Все содинения бериллия и растворимые соли бария весьма токсичны.
Известняк и известь применяют в сельском хозяйстве для известкования почв с целью понижения ее кислотности и улучшения структуры. Гипс (CaSO4·2H2O) при нагревании превращается в алебастр (CaSO4·0.5H2O). Они широко используются в строительном деле:.
- CaSO4·0,5H2O + 1,5H2O = CaSO4·2H2O.
- Катионы кальция и магния обуславливают жесткость воды. При кипячении воды бикарбонаты разлагаются:
- Ca(HCO3)2 CaCO3Ї + H2O + CO2-
и образуется накипь, что приводит к взрыву паровых катлов. Для борьбы с карбонатной жесткостью воду подвергают предварительному кипячению либо обрабатывают гашеной известью. Некарбонатная жесткость воды устраняется с помощью соды.
Ca2+ + CO32- = CaCO3Ї , Mg2+ + CO32- = MgCO3Ї.
Наиболее эффективным способом борьбы с жесткостью воды является применение ионнообменных смол. Важнейший строительный материал — цемент — это силикат и алюмосиликат кальция.
Гдз химия 9 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, §17 общая характеристика элементов iiа группы
Гдз химия 9 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, §17 общая характеристика элементов iiа группы
Другие задания смотри здесь…
|
ПРОВЕРЬТЕ СВОИ ЗНАНИЯУпражнение 1. Сравните общие характеристики щелочных и щёлочноземельных металлов. Укажите тип связи и тип кристаллической решётки в простых веществах, образованных этими металлами.На внешнем энергетическом уровне атомы всех щелочных металлов имеют по одному электрону, а атомы щелочно-земельных металлов ― по два электрона. Для щелочных и щёлочноземельных металлов характерна металлическая связь и металлическая кристаллическая решетка, а отсюда и все типичные для металлов свойства: металлический блеск, пластичность, тепло- и электропроводность. Металлические свойства щелочных металлов возрастают от лития к цезию, а щёлочноземельных ― от кальция к барию. Максимальная степень окисления щелочных металлов равна +1, а щёлочноземельных ― +2. Формула высших оксидов щелочных металлов Me2O, а щёлочноземельных ― MeO. Все они являются основными оксидами, следовательно, взаимодействует с водой, кислотами и кислотными оксидами. Гидроксиды щелочных металлов имеют формулу MeOH, а щёлочноземельные ― Me(OH)2. Данные гидроксиды являются растворимыми основаниями – щёлочами, следовательно, взаимодействует с кислотами, кислотными оксидами и солями.
Упражнение 2. Перечислите общие химические свойства щёлочноземельных металлов. Подчеркните особенности взаимодействия этих металлов с водой.
Щелочные и щёлочноземельные металлы взаимодействуют с неметаллами, водой, кислотами, оксидами менее активных металлов. В результате реакции щелочных и щёлочноземельных металлов с водой образуются щелочь и водород. Реакция в общем виде взаимодействия щелочных металлов с водой:
2Me + 2H2O = 2MeOH + H2↑
Реакция в общем виде взаимодействия щёлочноземельных металлов с водой:
Me + 2H2О = Me(OH)2 + H2↑
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1. С помощью какой химической реакции можно доказать, что в состав минералов кальция — известняка, мрамора, кальцита — входит карбонат этого металла? Взаимодействием с сильной кислотой, вследствие чего выделяется углекислый газ, то есть раствор «вскипает». Напишите уравнение реакции в молекулярной и ионной формах.
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O CaCO3 + 2H+ + 2Cl- → Ca2+ + 2Cl+ + CO2↑ + H2O
CaCO3 + 2H+ → Ca2+ + CO2↑ + H2OУпражнение 2. Охарактеризуйте свойства оксида кальция как основного оксида. Ответ подтвердите уравнениями химических реакций в молекулярной и ионной формах.Взаимодействует с водой: CaO + H2O = Ca(OH)2Взаимодействует с кислотными оксидами:
CaO + CO2 = CaCO3
Взаимодействует с кислотами:
CaO + 2HСl = CaCl2 + H2O
CaO + 2H+ + 2Cl- ⟶ Ca2+ + 2Cl- + H2O CaO + 2H+ → Ca2+ + H2O
Упражнение 3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, для реакций обмена запишите ионные уравнения:
а) Ca → CaCl2 → CaCO3 → CaO → Ca(OH)2 → Ca(NO3)2 → CaF2;Ca + 2HCl = CaCl2 + H2↑CaCl2 + Na2CO3 = 2NaCl + CaCO3↓Ca2+ + 2Cl- + 2Na+ + CO32- → 2Na+ + 2Cl- + CaCO3↓Ca2+ + CO32- → CaCO3↓ CaCO3↓ = CaO + CO2↑ CaO + H2O = Ca(OH)2Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2OCa2+ + 2OH- + 2H+ + 2NO3- → Ca2+ + 2NO3- + 2H2OH+ + OH- → H2O Ca(NO3)2 + 2KF = 2KNO3 + CaF2↓Ca2+ + 2NO3- + 2К+ + 2F- → 2К+ + 2NO3- + CaF2↓ Ca2+ + 2F- → CaF2↓
б) BaCO3 → BaO → Ba(OH)2 → BaCl2 → Ba3(PO4)2.
BaCO3 = BaO + CO2↑ (при t0)BaO + H2O = Ba(OH)2Ba(OH)2 + 2HCl = BaCl2 + 2H2OBa2+ + 2OH- + 2H+ + 2Cl- → Ba2+ + 2Cl- + 2H2OH+ + OH- → H2O
3BaCl2 + 2Na3PO4 = 6NaCl + Ba3(PO4)2↓
3Ba2+ + 6Cl- + 6Na+ + 2PO43- → 6Na+ + 6Cl- + Ba3(PO4)2↓3Ba2+ + 2PO43- → Ba3(PO4)2↓Упражнение 4. При обработке 9,8 г смеси карбоната, гидроксида и сульфата кальция выделилось 0,896 л газа (н.у.) и осталось 2,1 г твёрдого остатка. Вычислите массовую долю компонентов в смеси.Дано: V(CO2)=0,896 л, m(смеси)=9,8 г, m(тв. остатка)=2,1 гНайти: ω(СaCO3)-?, ω(Сa(OH)2)-?, ω(СaSO4)-?Решение1. Количество вещества углекислого газа объемом 0,896 л рассчитываем по формуле: ʋ=V/VM, где VM=22,4 л/моль.ʋ(Н2О)=V(CO2)/VM=0,896 л : 22,4 л/моль=0,04 моль2. Составим химические уравнения:CaCO3 + HCl = CaCl2 + CO2↑ + 2H2OCa(OH)2 + 2HCl = CaCl2 + 2H2OCaSO4 + HCl ≠ По уравнению реакции 1 моль карбоната кальция реагирует с выделением 1 моль углекислого газа, количество вещества одинаковое, поэтому:ʋ(СаСО3)=ʋ(СО2)=0,04 мольПоскольку СаСl2 растворимая соль, поэтому твердый остаток ― это соль CaSO4, то есть m(СаSО4)=2,1 г 3. Массу карбоната кальция количеством вещества 0,04 моль рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.M(СаСО3)=100 г/мольm(СаСО3)=ʋ(СаСО3)•M(СаСО3)=0,04 моль • 100 г/моль=4 г4. Рассчитываем массу гидроксида кальция:m(Ca(OH)2)=m(смеси)-m(CaCO3)-m(CaSO4)=9,8 г — 4 г — 2,1 г=3,7 г5. Рассчитываем массовую долю компонентов смеси.ω(СаСО3)=(m(СаСО3):m(смеси))•100%=(4 г : 9,8 г)•100%=40,8%ω(Са(ОН)2)=(m(Са(ОН)2):m(смеси))•100%=(3,7 г : 9,8 г)•100%=37,6%ω(СаSО4)=(m(СаSО4):m(смеси))•100%=(2,1 г : 9,8 г)•100%=21,4%Ответ: 40,8% CaCO3, 37,6% Ca(OH)2, 21,4% CaSO4
Упражнение 5. Какую массу соды (безводный карбонат натрия Na2CO3) необходимо добавить к 100 л жёсткой воды, содержащей 610 мг/л гидрокарбонат-ионов, для её полного умягчения?
Дано: V(H2O)=100 л, ρ(HCO3-)=610 мг/л=0,61 г/лНайти: m(Na2CO3)-?Решение1. Рассчитываем массу гидрокарбонат-ионов:m(HCO3-)=ρ(HCO3-)•V(Н2О)=0,61 г/л • 100 л=61 г2. Количество вещества гидрокарбонат-ионов рассчитываем по формуле: ʋ=m/M, где M=Mr г/моль.
M(HCO3-)=61 г/мольʋ(HCO3-)=m(HCO3-)/M(HCO3-)=61 г : 61 г/моль=1 моль3.
Составим химическoе уравнениe в общем виде:Na2CO3 + Ме2+ + 2HCO3−=2NaHCO3 + MeCO3↓По уравнению реакции с 1 моль карбоната натрия реагирует 2 моль гидрокарбонат-ионов, то есть количество вещества карбоната натрия в 2 раза меньше количества вещества гидрокарбонат-ионов, поэтому: ʋ(Na2СО3)=ʋ(HCO3-):2=1 моль:2=0,5 моль4. Массу карбоната натрия количеством вещества 0,5 моль рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.M(Nа2СО3)=106 г/мольm(Nа2СО3)=ʋ(Nа2СО3)•M(Na2СО3)=0,5 моль • 106 г/моль=53 гОтвет: 53 г
Используйте дополнительную информацию и выразите мнение
Вопрос 1. Щелочные металлы получают электролизом расплавов их гидроксидов — щелочей. Для получения щёлочноземельных металлов используют электролиз расплавов их солей. Как вы думаете, почему для этих целей не годятся гидроксиды щёлочноземельных металлов? Поскольку при расплавлении (нагрев от пропускания электрического тока) гидроксиды шёлочноземельных металлов разлагаются с образованием соответствующих оксидов металла, а не простого вещества металла. Напишите уравнение электролиза расплава хлорида кальция: CaCl2(распл.) ⟶ Ca + Cl2↑ (над ⟶ напишите электролиз)Другие задания смотри здесь…
Таблица оксидов
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ),
|
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ),
|
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния), SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора),
|
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы), SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты),
|
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)), Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия),
|
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома),
|
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца),
|
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа),
|
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта),
|
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит), Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт), CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия), Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия), GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка), As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит), SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
|
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
|
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)), Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения), RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия), Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия), Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)), Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)), CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия), InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись), SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид), Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
|
| 53 | Йод | I | I+12O (монооксид дийода),
|
| 54 | Ксенон | Xe | |
| 55 | Цезий | Cs | |
| 56 | Барий | Ba | |
| 57 | Лантан | La | |
| 58 | Церий | Ce | |
| 59 | Празеодим | Pr | |
| 60 | Неодим | Nd | |
| 61 | Прометий | Pm | |
| 62 | Самарий | Sm | |
| 63 | Европий | Eu | |
| 64 | Гадолиний | Gd | |
| 65 | Тербий | Tb | |
| 66 | Диспрозий | Dy | |
| 67 | Гольмий | Ho | |
| 68 | Эрбий | Er | |
| 69 | Тулий | Tm | |
| 70 | Иттербий | Yb |






