- История открытия сплавов железа с углеродом
- Структурные составляющие сплавов железо-углерод
- Диаграмма сплава железо-углерод
- Как читать диаграмму сплава железа с углеродом
- Применение стали из железоуглеродистых сплавов
- Разновидности чугуна из сплава железа с углеродом
- Полиморфные превращения в сплавах железо-углерод
- Соединения углерода — формулы, свойства и применение
- Нахождение в природе
- Основные свойства
- Углеродные соединения
- Монооксид или угарный газ
- Диоксид углерода или CO2
- Углерод и его соединения в химии — формулы и определения с примерами решения задач
- Углерод и его соединения
- Химические свойства углерода
- Оксиды углерода
18.02.2022 VT-METALL 
Из этого материала вы узнаете:
- История открытия сплавов железа с углеродом
- Структурные составляющие сплавов железо-углерод
- Диаграмма сплава железо-углерод
- Как читать диаграмму сплава железа с углеродом
- Применение стали из железоуглеродистых сплавов
- Разновидности чугуна из сплава железа с углеродом
- Полиморфные превращения в сплавах железо-углерод
Открытие сплава железа с углеродом явилось одним из самых важных событий в истории развития металлургии. Именно эти два элемента подарили миру наиболее востребованные марки стали и чугуна. Это те сплавы, из которых производится большая часть промышленного оборудования, металлических конструкций, инструмента, изделий бытового назначения.
В зависимости от процентного содержания углерода в железе, а также способа литья эти сплавы приобретают разные свойства: стойкость к коррозии, необычайную прочность, эластичность и т. д. О том, какие сплавы железа и углерода используются сегодня и как их получают, вы узнаете из нашего материала.
История открытия сплавов железа с углеродом
Выдающийся изобретатель Дмитрий Чернов прославился диаграммой «железо-углерод» и открытием, связанным с полиморфными превращениями. Именно он стал первооткрывателем особых точек в таких сплавах, как чугун и сталь. По мнению ученого, на расположение точек на диаграмме влияет процентная доля углерода.
Открытие стало настолько значимым, что положило начало новой науке – металлографии.
Сама диаграмма сплава железа с углеродом – это масштабный проект, разработанный несколькими учеными из разных уголков мира. Именно поэтому обозначения фаз и основных точек являются международными.
Структурные составляющие сплавов железо-углерод
Основа чугуна и стали – сплав железа с углеродом. Оба черных сплава являются незаменимыми при создании конструкционных деталей для техники. Их качества и структура определяются свойствами базовых компонентов и примесей. Также важно учитывать характер взаимодействия элементов.
Чистое железо – это серебристо-белый металл, который имеет температуру плавления +1 539 °С. Металл является тугоплавким и может обладать одной из полиморфных модификаций – a либо g.
VT-metall предлагает услуги:
Порошковая покраска металла
Низкотемпературный режим (ниже +910 °С) приводит к первой модификации. В этом случае для железа характерна объемно-центрированная кубическая решетка. Его называют а-феррумом. Железо является магнитным при температуре до +760 °С (до точки Кюри).
Нагрев железа приводит к превращению решетки из объемно-центрированной в гранецентрированную. Для создания g-железа необходим высокотемпературный режим – от +910 °С до +1 392 °С.
Углерод представляет собой неметаллический элемент. Его температура плавления составляет +3 500 °С. В природе элемент способен существовать в виде алмаза или графита. Первая полиморфная модификация в сплавах не встречается.
Если говорить об углеродистой структуре в сплаве железо-углерод, то она слоистая. В связи с этим неметаллический элемент в свободном виде имеет форму графита, особенность которого заключается в низких показателях пластичности и прочности.
Углерод растворим в железе и в жидком, и в твердом состоянии. Он способен создать химическое соединение под названием цементит, где углерод в свободном виде также будет иметь форму графита.
Возможные составляющие сплавов железа с углеродом перечислены ниже:
- Аустенит (А). Это твердый раствор элементов в g-железе. Он может существовать только при высокотемпературном режиме (выше +727 °С). С минимальной из возможных температур растворимость составит 0,8 %, а при +1 147 °С – 2,14 %. Главная особенность аустенита – его высокая пластичность.
- Графит. Он представляет собой аллотропическую модификация углерода, обладающую низкой прочностью и высокой мягкостью. Может присутствовать в графитизированной стали и в чугуне. Там он будет существовать в виде вкраплений различной конфигурации. Именно форма окажет непосредственное влияние на технологические и механические свойства сплава.
- Ледебурит. Это механическая смесь из цементита и аустенита, в которой доля углерода составляет 4,3 %. Для получения ледебурита необходимо эвтектическое превращение при температуре +1 147 °С. Если температура составит +727 °С, то аустенит превратится в перлит, и ледебурит станет смесью цементита и перлита. Основные характеристики ледебурита – хрупкость и твердость. Компонент можно встретить во всех белых чугунах.
- Перлит (П). Еще один элемент сплава железа с углеродом. В нем доля углерода составляет 0,8 %. Сам перлит представляет собой механическую смесь цементита и феррита. Его можно получить путем эвтектоидного распада (перекристаллизации) аустенита при температуре +727 °С. В честь распада перлит называется эвтекоидом. Для него характерен высокий уровень прочности и твердости. Также перлит способен повысить механические свойства сплава.
- Феррит (Ф). Это твердый раствор внедрения элементов в a-железе. Существует при низкотемпературном режиме и обладает объемно-центрированной кубической решеткой. Растворимость углерода в феррите крайне низкая. В нормальных условиях она составит не более 0,005 %, а достигнет пика (0,02 %) только при температуре +727 °С. Феррит менее тверд в сравнении с аустенитом, а также более пластичен. В связи с этим он хорошо обрабатывается давлением в холодном состоянии.
- Цементит (Ц). Компонент представляет собой соединения углерода и железа, а именно карбид железа с формулой Fe3C. Процентная доля углерода в веществе составляет 6,67. Цементит обладает сложной кристаллической решеткой и плавится при температуре около +1 600 °С. В сплаве железа с углеродом он является одновременно самой хрупкой и самой твердой составляющей. Следовательно, чем больше компонента содержится в сплаве, тем выше его твердость. Также цементит обладает неустойчивостью, поэтому при определенных условиях он распадается и образует графит. Происходит реакция: Fe3C > 3Fe + С.
Диаграмма сплава железо-углерод
На диаграмме сплава можно выделить следующие границы:
- Линия ледебуритного превращения (линия ECF). Если содержание углерода в сплаве выше 2,14 %, то при его охлаждении жидкая фаза под линией становится ледебуритом.
- Линия ликвидус (линия ACD). Ее особенность заключается в том, что при снижении температуры под ней запускается кристаллизация сплавов.
- Линия перлитного превращения (линия PSK). При снижении температуры сплав под ней из аустенита превращается в перлит.
- Линия солидус (линия AECF). При снижении температуры сплав под ней становится твердым.
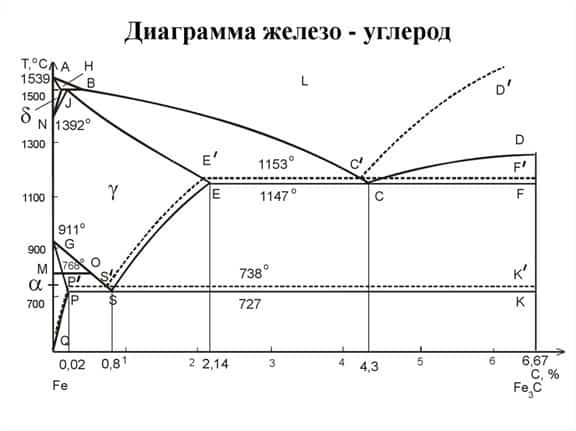
Также на диаграмме присутствует несколько важных точек:
- C. Вещество становится ледебуритом, концентрация углерода не меняется и остается на уровне 2,14 %. Температура превращения жидкости составляет +1 147 °С.
- E. В этой точке аустенит содержит максимальное количество углерода – 2,14 % от общего количества сплава. Такое состояние достигается при температуре +1 147 °С.
- P. При температуре +727 °С у феррита наступает стадия максимального насыщения углеродом (0,025 %).
- S. Аустенит превращается в перлит. Средняя концентрация углерода остается той же и составляет 0,8 %.
Обычно температурный режим, при котором достигается необходимое состояние сплава, обозначается буквой А.
Из-за того, что фазы в сплавах железа с углеродом имеют разные температуры при нагреве и охлаждении, приходится вводить дополнительные обозначения.
Как читать диаграмму сплава железа с углеродом
Сплавы системы железо-углерод имеют свойство меняться при охлаждении или нагреве, повышении или снижении давления. Графически такие процессы обозначены на диаграмме состояния. Благодаря ей можно понять, как происходит то или иное превращение сплава.
Состав сплава с первоначальной долей углерода при заданной температуре можно увидеть, если двигаться по вертикальной прямой, которая соответствует содержанию в сплаве углерода.
Правило легче понять на примере, поэтому рассмотрим на диаграмме зону AEC. Возле нее находятся области жидкой фазы и аустенита (AESG). Следовательно, соединение в данной области состоит из образующегося твердого аустенита и жидкой фазы.
Определим для него концентрация углерода, двигаясь по разным фазам. Для этого нужно знать изначальную концентрацию углерода и заданную температуру. В примере это 2,5 % и +1 250 °С.
Теперь из точки графика нужно провести горизонтальную линию. Ее пересечение с АЕ, которая граничит с зоной аустенита, покажет содержание углерода в аустените при температуре +1 250 °С.
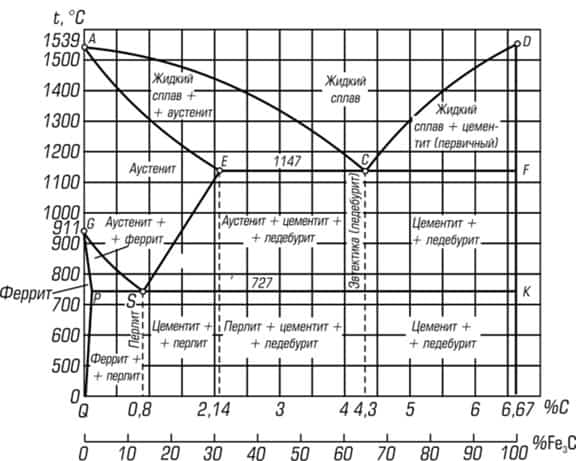
Если же прямая будет пересекаться с АС, которая граничит с зоной жидкой фазы, то можно узнать концентрацию углерода уже в жидкой фазе.
При сохранении температуры по данному методу определимо процентное содержание углерода в фазах абсолютно любого сплава:
- в области AEC в аустените и в жидкой фазе;
- в области CDF в жидкой фазе (процентное содержание углерода в цементите при этом неизменно – 6,67 %);
- в области GPS в аустените и в феррите;
- в области QPKL в феррите;
- в области SEFK в аустените.
Когда содержание углерода становится выше, чем 2,14 %, охлаждаемый сплав получает насыщение углеродом ближе к 4,3 % (по линиям DC и AC) по мере приближения к температуре +1 147 °С (на уровне ECF). Затем жидкость превращается в эвтектику (ледебурит). Среднее содержание углерода остается неизменным.
При движении в сторону температуры +727 °С, что соответствует уровню PSK, содержание углерода в аустените приближается к 0,8 % (линии GS и ES). Затем аустенит превращается в эвектоид, т. е. в перлит. Как известно по предыдущим примерам, средняя концентрация углерода постоянна. В данном случае она составляет 0,8 %.
Применение стали из железоуглеродистых сплавов
Сталь, как и чугун, представляет собой сплав железа с углеродом. Металлы имеют широкое распространение, особенно часто их задействуют в машиностроении.
В стали концентрация углерода составляет не более 2 %.
Примеры металла:
- инструментальная сталь;
- конструкционная сталь;
- техническое железо.
Если в стали содержание углерода было строго меньше 2 %, то в чугуне – больше. В среднем, концентрация вещества составляет от 2,5 до 3,5 %.
Помимо железа и углерода в металлах содержатся такие добавки:
- марганец и кремний, содержание которых исчисляется в десятых долях процента (от 0,15 до 0,6 %);
- фосфор и сера, концентрация которых составляет сотые доли процента (от 0,05 до 0,03 %).

Сталь, в которой концентрация углерода составляет не более 0,7 %, часто используется для создания:
- листов;
- проволоки;
- ленты;
- фасонного профиля разных видов;
- уголкового железа;
- таврового железа;
- различных деталей, используемых в машиностроении (например, осей, шестерен, болтов, кувалд, молотков и др.).
Сталь, в которой концентрация углерода составляет более 0,7 %, используется при изготовлении режущих инструментов:
- бородок;
- резцов;
- зубил;
- сверл;
- метчиков.
Свойства данного сплава железа с углеродом зависят от концентрации неметаллического компонента. Так, чем больше будет углерода, тем прочнее и тверже получится сталь.
Разновидности чугуна из сплава железа с углеродом
Выделяют два основных вида чугуна – литейный и предельный. Первый вид принято использовать в производстве и промышленной сфере. Второй находит применение в создании стали кислородно-конвертерным путем. В получившемся соединении доля марганца и кремния крайне мала.

Литейный чугун также имеет несколько разновидностей:
- Половинчатая. Такой чугун имеет специальные свойства, так как часть углерода из состава имеет форму цементита, а другая часть – форму графита.
- Белая. Здесь углерод находится в виде карбида железа. Название произошло от белого оттенка разлома. Белый чугун не находит применения в чистом виде, но активно используется при создании ковкого чугуна.
- Серая. Отлив на изломе серебристый, поэтому такой чугун называют серым. Сфера использования материала достаточно широкая, в том числе и потому, что чугун легко обрабатывать резцами.
- Высокопрочная. Данная разновидность способна увеличить прочность любого материала, куда она будет добавлена. Материал получают из серого чугуна и небольшого количества магния.
- Ковкая. Как и в случае высокопрочной разновидности, в основе находится серый чугун. Повысить пластичность помогает процесс отжига.
Полиморфные превращения в сплавах железо-углерод
Полиморфные превращения в сплавах железа с углеродом происходят при соблюдении температурного режима.
Если температура составляет меньше +911 °С, то состояние железа называется α-феррумом. Кристаллическая решетка железа – ОЦК, что расшифровывается как объемный гранецентрированный куб. Особенность решетки состоит в большом расстоянии между атомами.

При температуре от +911 до +1392 °С у железа наблюдается модификация гамма. Кристаличесская решетка γ-феррума – ГЦК, т. е. гранецентрированный куб. Расстояние между атомами меньше, чем в случае объемного гранецентрированного куба.
Когда железо переходит из модификации альфа в гамму, его объем уменьшается. Причина кроется в виде кристаллической решетки. В ОЦК атомы не настолько упорядочены, как в ГЦК.
Правило работает и в обратном направлении. При переходе из гамма-стадии в альфа-стадию объем сплава железа с углеродом возрастает.
Если температура находится в диапазоне от +1 392 до +1 539 °С (последняя – температура плавления железа), то α-феррум переходит в свою другую разновидность – δ-феррум. Стоит помнить, что структура δ-феррума неустойчива, поэтому стремится перейти в более устойчивое состояние.
В результате удалось выяснить, что сталь и чугун – сплавы железа с углеродом с разным содержанием углерода и примесей. Это напрямую влияет на механические и химические свойства стали, а они – на сферу применения конечного материала.
Мы с уважением относимся ко всем клиентам и одинаково скрупулезно выполняем задания любого объема.
Наши производственные мощности позволяют обрабатывать различные материалы:
- цветные металлы;
- чугун;
- нержавеющую сталь.
При выполнении заказа наши специалисты применяют все известные способы механической обработки металла. Современное оборудование последнего поколения дает возможность добиваться максимального соответствия изначальным чертежам.
Для того чтобы приблизить заготовку к предъявленному заказчиком эскизу, наши специалисты используют универсальное оборудование, предназначенное для ювелирной заточки инструмента для особо сложных операций. В наших производственных цехах металл становится пластичным материалом, из которого можно выполнить любую заготовку.
Преимуществом обращения к нашим специалистам является соблюдение ими ГОСТа и всех технологических нормативов. На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
Благодаря опыту наших мастеров на выходе получается образцовое изделие, отвечающее самым взыскательным требованиям. При этом мы отталкиваемся от мощной материальной базы и ориентируемся на инновационные технологические наработки.
Мы работаем с заказчиками со всех регионов России. Если вы хотите сделать заказ на металлообработку, наши менеджеры готовы выслушать все условия. В случае необходимости клиенту предоставляется бесплатная профильная консультация.

Соединения углерода — формулы, свойства и применение
Время на чтение: 17 минут 
Нахождение в природе
В природе углерод встречается как в чистом виде, так и в форме соединений. В свободном кристаллическом состоянии он находится в виде двух аллотропных видоизменений:

- Алмаз — чрезвычайно твердое вещество, плохо проводящее тепло и электричество. По внешнему виду — бесцветные кристаллы, сильно преломляющие свет. Если их соответствующим образом огранить — получатся бриллианты, их масса измеряется в каратах: 1 карат = 0,205 г. Самым крупным камням присваиваются имена: например, Куллинан (более 3 тыс. карат), Звезда Якутии (232 карата), и прочие. Тусклые алмазы (борт) используются в промышленности. При нагревании без доступа воздуха алмаз превращается в графит. В настоящее время из графита создаются искусственные алмазы (длительный нагрев при t=3000°С, и давлении 70−100 тыс. атмосфер). Синтетические продукты широко используются в технике.
- Графит — образует мощные залежи. По внешнему виду это серо-черная, жирная на ощупь масса. Имеет слоистую структуру. Хорошо проводит тепло и электричество, тугоплавкий. Используется в промышленности при производстве электродов и грифелей карандашей.
Есть еще одна модификация — аморфный углерод. Это пористое вещество черного цвета. Его «известные представители» — кокс, сажа, древесный и костяной уголь. В чистом виде не встречается, всегда содержит примеси.
В связанном состоянии углерод встречается в карбонатах (кальцит, известняк, мел, мрамор, железный шпат FeCO3, марганцевый шпат MnCO3, цинковый шпат ZnCO3, магнезит, доломит, малахит, и прочие). Кроме того, углерод — основная составная часть каменных и других углей, нефти, горючих природных газов, всех живых организмов.
Основные свойства
Углерод инертен по отношению ко всем обычным растворителям. Исключение — некоторые расплавленные металлы. Однако после остывания он снова кристаллизуется в графит.
При нормальных условиях более химически активный только черный углерод. Он может соединяться со фтором, а при повышении температуры — с водородом, кремнием, серой, бором и некоторыми другими металлами. В результате реакции образуются карбиды:
- 4Al + 3C → Al4C3.
- Ca + 2C → CaC2.
При взаимодействии карбидов с водой или кислотой образуется метан или ацетилен:
- Al4C3 + 12HCl → 4AlCl3 + 3CH4 (метан).
- CaC2 + 2H2O → C2H2 (ацетилен) + Ca (OH)2 (гидроксид кальция).
Ряд карбидов имеет состав, который не подчиняется «общепринятому» представлению о валентности. К таким относится, например, Fe3C.
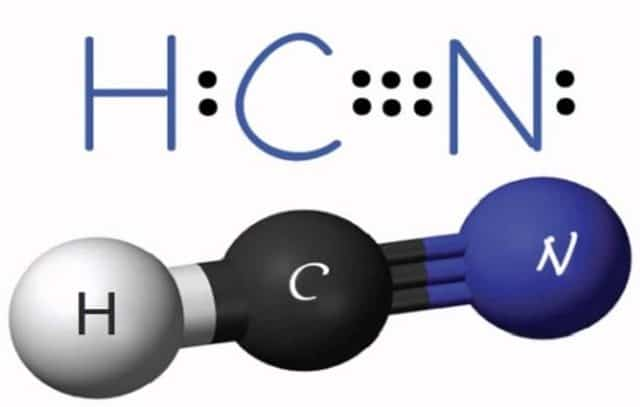
С азотом углерод не соединяется, но в присутствии водорода образует циановодород (формула вещества HCN). В реакциях с кислородом он образует монооксид и диоксид, при этом выделяется большое количество тепла:
- C + O2 → CO2.
- монооксид чаще всего выделяется при пропускании диоксида над раскаленным углем: CO2 + C → 2CO.
Углерод — один из наиболее сильных восстановителей, известных в химии. При взаимодействии с оксидами металлов он «отнимает» у них кислород, восстанавливая при этом вещества до свободного состояния:
- ZnO + C → Zn + CO.
- SiO2 +2C → Si + 2CO.
При взаимодействии избытка углерода с диоксидом кремния (кварцем, песком), кроме чистого Si, образуется карборунд (окись кремния) — очень твердое вещество: SiO2 + 3C → SiC + 2CO.
С галогенами «чистый» углерод не взаимодействует. Соединения с ними образуются из других веществ (например, углеводородов).
Углеродные соединения
В начале XIX века вещества были разделены на неорганические и органические. Ко второй группе относятся углеводороды (метановый, этиленовый и ацетиленовый ряды), белки, углеводы, жиры. Изучением этих веществ занимается органическая химия.
Неорганическая химия изучает другие соединения углерода: галогениды, цианиды, карбиды, оксиды. Наиболее значимыми являются кислородсодержащие вещества — CO, CO2. Есть еще C2O (окись диуглерода) и C3O2 (недооксид), но это пока не слишком изученные вещества.
Монооксид или угарный газ
Оксид углерода 2 (другое название монооксида) — образуется при неполном сгорании C, или продуктов, его содержащих. Его основные свойства:

- Сжижается при температуре — 192 °C.
- Затвердевает при t=-205°С.
- Молекулярная масса — 28,01 г/моль.
- Строение молекулы — линейное (в рамках теории валентных связей ее можно записать как «:C==O:»).
- В воде практически нерастворим.
Монооксид — ядовитый газ, не имеющий цвета и запаха. Его отравляющее действие состоит в том, что он необратимо взаимодействует с гемоглобином крови, в результате чего полностью утрачивается способность переносить кислород от легких к тканям.
В промышленности монооксид получают в процессе газификации твердого топлива. В лаборатории синтезировать соединение можно путем воздействия концентрированной серной кислоты на щавелевую (C2H2O4) или муравьиную (HCOOH). Реакция протекает при нагревании:
- HCOOH → CO + H2O.
- C2H2O4 → CO + CO2 + H2O.
По химическим свойствам двухвалентный оксид — хороший восстановитель. Он отлично горит, выделяя при этом большое количество тепла: 2CO + O2 → 2CO2. Другие характерные признаки:

- Способность «изымать» кислород из его соединений с металлами: FeO + CO → Fe + CO2.
- В присутствии активированного угля, выступающего в роли катализатора, окись углерода со степенью окисления +2, способна присоединять хлор (Cl), образуя при этом фосген (COCL2) — боевое отравляющее вещество. Представляет собой бесцветный, высокотоксичный газ с запахом прелого сена. Уравнение реакции получения: CO + Cl2 → COCl2.
- При высоких температурах (выше 400°C) и повышенном давлении (300 атм) реагирует с водородом. В результате процесса образуется метиловый спирт (метанол): CO + 2H2 → CH3OH.
- При повышенных температурах взаимодействует со щелочами, образуя при этом соли муравьиной кислоты (HCOOH): CO + NaOH → HCOONa.
- При взаимодействии с аммиаком образуется синильная кислота — очень ядовитое вещество: CO + NH3 → HCN + H2O.
Угарный газ находит широкое практическое применение. Он входит в состав искусственного газообразного топлива. Кроме того, незаменим при процессах органического синтеза.
Диоксид углерода или CO2
Это газ, не имеющий цвета, обладающий слабым кисловатым запахом и вкусом. Молярная масса равна 44.01 г/моль.
Примечание: оксид углерода 4 в полтора раза тяжелее воздуха, поэтому его можно «переливать» из пробирки в пробирку.
Углекислый газ (еще одно название диоксида углерода) не поддерживает горения. Кроме того, он делает невозможным дыхание: в комнате, где концентрация вещества будет высокой, человек задохнется. Какие свойства присущи соединению:

- В углекислом газе могут гореть некоторые вещества, образующие с кислородом более прочную связь, нежели углерод (например, магний): 2Mg + CO2 → 2MgO + C.
- Реакция горения с раскаленным углем: CO2 + C → 2CO.
- Взаимодействие с водой: CO2 + H2O → H2CO3 (угольная кислота).
- Образует кислотные оксиды при взаимодействии с основными оксидами: Na2O + CO2 → Na2CO3 (карбонат натрия).
- При недостатке щелочи образует гидрокарбонаты: CO2 + NaOH → NaHCO3.
В промышленности диоксид углерода синтезируют путем термического разложения известняка или мела (иногда доломита, магнезита): CaCO3 → CaO + CO2.
Также это вещество можно выделить из коксового газа, при сжигании угля, торфа, нефтепродуктов, древесины.
Кроме того, он содержится и в природных источниках: например, «появляется» в результате вулканической деятельности, при распаде органических веществ.
В лабораторных условиях его получают при взаимодействии CaCO3 и соляной кислоты: CaCO3 + 2HCl → CaCL2 + CO2 + H2O (реакция проводится в аппарате Киппа). Другой способ — прокаливание гидрокарбоната натрия: NaHCO3 → Na2CO3 + CO2 + H2O.
Углекислый газ имеет промышленное значение: он необходим в содовом производстве, в пищевой промышленности (изготовление газированных напитков), для синтеза органических кислот.
Сухой лед (твердый диоксид) используется в качестве хладагента — углекислая среда предотвращает продукты питания от разложения. Кроме того, CO2 применяется и в медицине (углекислотные ванны для активизации метаболических функций).
Незаменим он и для сельского хозяйства — оксид углерода IV участвует в фотосинтезе, поэтому его недостаток негативно сказывается на растениях.
Углерод и его соединения в химии — формулы и определения с примерами решения задач
Содержание:
- Углерод и его соединения
- Химические свойства углерода
- Оксиды углерода
Соединения углерода весьма распространены: все живые организмы, каменный уголь, торф, нефть и др. содержат углерод.
Углерод входит в состав многих неорганических веществ (известняк, мел, мрамор и др). ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА.
Углерод — малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Углерод и его соединения
Охарактеризуйте углерод по его месту в Периодической системе. Назовите соединения углерода и валентность углерода в этих соединениях.
Углерод в виде угля, копоти, сажи известен человечеству с незапамятных времен. Элементарная природа углерода была установлена А. Лавуазье в конце 1780-х годов. Свое название элемент получил в 1824 г., в переводе с латинского оно означает «уголь».
Положение в периодической системе. Углерод – элемент 2-го периода главной подгруппы IV группы (IVА), атомный номер 6, относительная атомная масса 12, в ядре атома содержится 6 протонов и 6 нейтронов общее число электронов также 6.
Строение атома. Электронная конфигурация атома углерода: Углерод – неметалл, p-элемент.
Валентные электроны (II, IV) размещены по орбиталям:
При возбуждении один электрон переходит с 2s-подуровня на 2p-подуровень. Поэтому в основном состоянии атом углерода двухвалентен (CО), а в возбужденном состоянии – четырехвалентен
Нахождение в природе. Углерод входит в состав всех живых организмов. В свободном состоянии углерод встречается в виде алмаза, графита и карбина (аллотропные видоизменения, рис. 69). Природные соединения углерода – доломит мрамор магнезит Нефть, каменный уголь и природный газ содержат углерод в связанном состоянии.
В свободном виде углерод не токсичен, а вот многие его соединения обладают значительной токсичностью.
Аллотропные видоизменения углерода характеризуются различным строением кристаллических решеток. Этим и объясняется резкое различие их физических свойств.
Физические свойства. Алмаз – самое твердое природное соединение на Земле. Это прозрачное, бесцветное, кристаллическое вещество, имеет тетраэдрическое строение, не электропроводен.
Графит – мягкий, непрозрачный, серого цвета, маслянистый и блестящий (рис. 68). Графит при температуре 2000оС и низком давлении превращается в карбин.
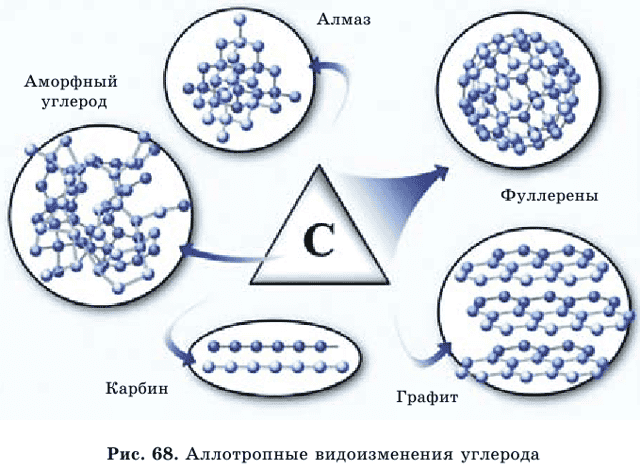
В последние годы открыли еще одну форму – фуллерен. У него структура‚ как у футбольного мяча.
К этим разновидностям можно прибавить аморфный углерод, простейшим представителем которого является древесный уголь. При сухой перегонке древесины образуется древесный уголь, у которого сильно выражена способность к адсорбции (поглощение на поверхности) газов, паров и растворенных веществ.
Получение. Сажа – аморфный углерод, продукт неполного сгорания углеводорода. Кокс – твердое искусственное топливо, продукт термической обработки каменного угля.
Запомни! Площадь поверхности активированного угля массой 1 г составляет 800 м2, поэтому он обладает повышенной адсорбционной способностью.
Адсорбент — это вещество, способное поглощать на своей поверхности газы и жидкости.
Таблетки активированного угля применяют для подготовки желудочно-кишечного тракта к рентгеновскому обследованию и УЗИ; для очистки спирта. Активированный уголь не поглощает угарный газ (СО).
Аллотропные видоизменения углерода.
Химические свойства углерода
Углерод может вступать в реакцию со многими простыми и сложными веществами (схема 9).
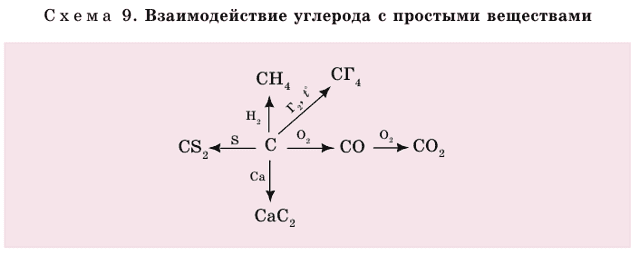
- Далее приводятся некоторые уравнения реакций с простыми веществами:
- 1) а) при неполном сгорании углерода:
- б) при полном сгорании углерода в избытке кислорода:
- 2) углерод при освещении соединяется с хлором:
- 3) с металлами образуются карбиды:
- 4) с серой образуется сероуглерод:
- Сероуглерод применяется для получения вискозного волокна и как растворитель;
- 5) с водородом образуется метан:
- Метан – газообразное топливо (основа природного газа).
- Углерод также взаимодействует со сложными веществами:
1) с водой образуется водяной газ, который является ценным топливом. Именно поэтому уголь смачивают водой, когда топят печь.
- 2) Углерод с углекислым газом образует оксид углерода (II).
- 3) С оксидами железа (этот процесс происходит в доменной печи). Углерод выделяет железо в свободном состоянии:
Применение. Алмаз используют для резки стекла, изготовления наконечников буровых установок. Из ограненного алмаза делают великолепные
Графит применяют для изготовления электродов, а также грифелей карандашей. Кокс (С) получают при сухой перегонке (нагревание без доступа воздуха). Используется в производстве металлов как восстановитель. Адсорбционная способность активированного угля находит применение в медицине, а также в противогазах (рис. 69).
- Фуллерены – это наночастицы, имеющие очень ценные особенности.
- Каждая молекула содержит 60 атомов углерода, упорядоченных в виде пяти и шестиугольников и позволяет изготавливать кристаллы, которые применяются в электронике, в компьютерах.
- Практическая работа №6 Физические и химические свойства углерода
- Цель: Знать условия образования диоксида и монооксида углерода при сжигании углерода.
- Ход работы
Опыт 1. изучение древесного угля 1. В коническую колбу налейте водный раствор какой-нибудь краски. 2. Всыпьте в раствор 0,3–0,5 г мелко истолченного древесного угля, взболтайте содержимое в течение 2–3 минут.
3. Отфильтруйте, наблюдайте исчезновение окраски.
Опыт 2. Восстановительные свойства угля. 1. Примерно одинаковые по массе порции оксида меди (II) и измельченного древесного угля перемешать на листе бумаги. 2.
Смесь пересыпьте в сухую пробирку, укрепите горизонтально в штативе. 3. Закройте пробирку пробкой с газоотводной трубкой, изогнутой под прямым углом. 4. Конец трубки опустите в раствор известковой воды. 5.
Пробирку сильно нагрейте до прекращения выделения газа.
6. Дайте пробирке остыть, отметьте цвет содержимого.
Вопросы и задания 1. Как изменился цвет раствора красителя? Дайте объяснения. 2. Напишите уравнения реакций опыта №2.
3. Каким химическим свойством обладает углерод?
Оксиды углерода
Какие оксиды углерода вы знаете? К каким оксидам они относятся? Какой из оксидов углерода (II, IV) тяжелее воздуха?
- Углерод образует два оксида: угарный газ СО и углекислый газ (диоксид углерода), которые соответствуют двух- и четырехвалентному состоянию атома углерода.
- Оксид углерода (II) – угарный газ СО.
- Впервые он был получен французским химиком Жаком де Лассаном в 1776 году при нагревании оксида цинка с углем.
Нахождение в природе. В естественных условиях, на поверхности Земли, СО образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, например, при лесных и степных пожарах.
В атмосфере СО является продуктом ряда реакций с участием метана и других углеводородов. Основным антропогенным источником СО служат выхлопные газы двигателей внутреннего сгорания.
Получение:
Физические свойства.
Оксид углерода (II) – бесцветный, плохо растворимый в воде ядовитый газ, чуть легче воздуха Он называется угарным газом, потому что связывает ион железа в молекуле гемоглобина крови, вызывая тем самым удушье, его предельно допустимая концентрация (ПДК) = 2%. В выхлопных газах двигателей внутреннего сгорания обнаружено CO (рис. 70). Признаки отравления угарным газом: кровь становится алой, головокружение, иногда потеря сознания. В первую очередь человека необходимо вывести на свежий воздух.
Химические свойства. Угарный газ СО – несолеобразующий оксид. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами. При нагревании он восстанавливает металлы из их оксидов:
- Оксид углерода (II) на воздухе горит голубоватым пламенем:
Оксид углерода (IV) – углекислый газ Он бесцветный, без запаха, тяжелее воздуха (D (возд.) = 1,52).
Оксид углерода не поддерживает горения. Он используется при огнетушении. Выделяется при дыхании животных и человека.
Из-за того что углекислый газ тяжелее воздуха, он накапливается в подвалах, шахтах, колодцах. Углекислый газ легко переходит в жидкое (при давлении 50 атм.
), а затем в твердое состояние («сухой лед»). Углекислый газ, растворенный в воде, придает воде кислый привкус (рис. 71).
Графическая формула: O = C = OКонцентрация углекислого газа в атмосфере Земли составляет 0,039%. При большой концентрации оксида углерода (IV) люди и животные задыхаются. При его концентрации до 3% у человека наблюдается учащенное дыхание, более 10% – потеря сознания и даже смерть.
Повышение концентрации углекислого газа в атмосфере вызывает «парниковый эффект», что приводит к повышению температуры и таянию ледников. Концентрация углекислого газа в атмосфере растет из-за автомобильного транспорта, количество которого увеличивается из года в год.
- Получение: 1) при сгорании углерода:
- 2) при разложении карбонатов:
- 3) из карбонатов под действием сильных кислот (рис. 73):
- Это лабораторный способ получения 4) при разложении основных солей:
- 5) при горении органических веществ:
Химические свойства. – кислотный оксид, ему соответствует угольная кислота которая существует только в растворе . Вступает в следующие реакции:
- 1) с основными оксидами образует соли:
- 2) с растворимыми основаниями образуются соль и вода:
Гидроксид кальция (известковая вода) является реагентом на углекислый газ (выделяется белый осадок). Помутнение известковой воды – качественная реакция на .
- 3) при избытке углекислого газа карбонат превращается в растворимую кислую соль:
- 4) с водой образуется слабая, неустойчивая угольная кислота:
Применение. Углекислый газ применяется при тушении пожаров, в производстве прохладительных напитков, в холодильных установках и других областях.
- Угарный, углекислый газы; ПДК угарного газа, метан, физические и химические свойства оксидов углерода, качественная реакция на
- Практическая работа №7 Получение углекислого газа и изучение его свойств
- Цель: получить углекислый газ, доказать его наличие и изучить свойства.
- Ход работы
1. В пробирку с газоотводной трубкой положите кусочки мрамора и налейте раствор соляной кислоты, наблюдайте выделение газа (рис. 73).
2. Наполните два сухих стакана углекислым газом. Каким способом его можно собирать? Наполненность проверьте горящей лучиной и затем закройте стеклянными пластинками.
3. В сухой стакан бросьте кусочек ваты, смоченной спиртом, и подожгите его горящей лучинкой.
4. Затем возьмите стакан с углекислым газом и осторожно перелейте в стакан, где горит вата? Что происходит?
5. В стакан, наполненный углекислым газом, поместите подожженную магниевую ленту, держа ее шипцами. Наблюдайте за горением магния.
6. Продукты реакции залейте разбавленным раствором соляной кислоты. Что остается на дне стакана?
Вопросы и задания 1. Напишите все уравнения реакций, определите типы реакций. 2. К каким оксидам относится углекислый газ? 3. Можно ли собирать углекислый газ методом вытеснения воды? Ответ мотивируйте.
4. Углекислый газ тяжелее или легче воздуха? На каких этапах работы вы это наблюдали?
ДЕЛЛЕМ ВЫВОДЫ
- 1. Углерод встречается в четырех аллотропных видоизменениях (алмаз, графит, карбин). Фуллерен — это искусственная модификация углерода, не существующая в природе.
- 2. В соединениях углерод проявляет валентность II, IV (СН4, СО, со2).
- 3. СО — угарный (ядовитый) газ, несолеобразующий оксид. СО., -кислотный оксид.
- 4. Углекислому газу соответствует угольная кислота Н„СО3. Она непрочная, разлагается. Соли этой кислоты называются карбонатами.
- 5. Активированный уголь — хороший адсорбент.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
- Лекции по химии:
- Лекции по неорганической химии:
- Лекции по органической химии:






