- Большая Рнциклопедия Нефти Рё Газа
- Физические свойства металлов
- ПОИСК
- Металл: что это такое, его физические свойства, из чего состоит
- Что это такое – металл
- Физические свойства
- Основные химические свойства металлов
- Признаки
- Классификация и виды металлов
- Черные
- Что относится к цветным металлам
- Медь и ее сплавы являются популярными металлами
- К металлам относятся алюминий и сплавы
- Все о металлах магний, титан и их сплавах
- Антифрикционные сплавы
- Мягкие
- Что значит твердый металл
- Металлические материалы в энергетике
- Особенности черных вторичных металлов
- Щелочноземельные сплавы
- Понятие щелочной металл
- Общая характеристика материалов из d- и f-семейств
- Из чего состоят побочные подгруппы металлов системы Менделеева
- Сплавы
- Сравнение свойств
В данной статье ознакомимся с основными физическими свойствами металлов. Вашему вниманию будут представлены пластичность, электропроводность, теплопроводность, металлический блеск, твёрдость, плотность, температура плавления.
Начнём с пластичности.
Пластичность — это свойство вещества изменять форму под внешним воздействием, не разрушаясь, и сохранять принятую форму после прекращения этого воздействия.
Почему у металлов так выходит? Это происходит из-за их строения, виновной выступает кристаллическая решётка. Она состоит из узлов и свободных электронов, которые бегают между углами, никому не принадлежа.
В узлах могут быть атомы, молекулы или ионы. Электроны то присоединяются к ним, то уходят.
Именно взаимосвязью между бегающими по всему веществу электронами и узлами объяснятся свойство пластичности: слои смещаются друг с другом без разрыва.
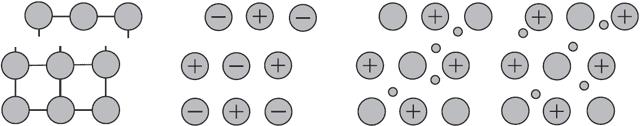
Как же определить и сравнить пластичность разных металлов? Она определяется при испытании на растяжение. Под действием нагрузки образцы разных металлов в различной степени удлиняются, а их поперечное сечение уменьшается. Чем больше способен образец удлиняться, а его поперечное сечение сужаться, тем пластичнее образец.
Существуют две единицы измерения: относительное удлинение и относительное сужение при разрыв.
- По степени пластичности металлы принято подразделять следующим образом:
- -высокопластичные (относительное удлинение превосходит 40 %) — металлы, составляющие основу большинства конструкционных сплавов (алюминий, медь, железо, титан, свинец) и «легкие» металлы (натрий, калий, рубидий и др.);
- -пластичные (относительное удлинение лежит в диапазоне между 40 и 3%) — магний, цинк, молибден, вольфрам, висмут и др. (наиболее обширная группа);
- -хрупкие (относительное удлинение меньше 3%) — хром, марганец, кобальт, сурьма.
- Электропроводность — свойство проводить электрический ток.
Электрическим током зовём упорядоченное движение частиц. В нашем случае под действие некого поля начинают двигаться в одном направлении все свободные электроны в образце.
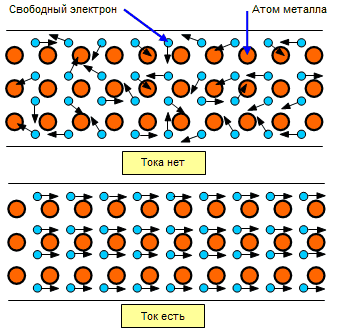
Электропроводность металлов обусловлена концентрацией электронов и их подвижностью. Чем сильнее металл нагрет, тем сильнее прыгающие узлы будут мешать электронам свободно передвигаться в выбранном направлении. Чем больше столкновений, тем сильнее нагревается металл. Данный эффект применяется в нагревательных приборах и в лампах накаливания.
Теплопроводность — свойство металлов переносить энергию от одной части тела к другой.
Оно связано с высокой подвижностью электронов: сталкиваясь с колеблющимися в узлах решётки ионами, атомами, электроны обмениваются с ними энергией. Как видим, данное свойство связано с предыдущим.
Металлический блеск — способность металлов отражать световые лучи.
Данное свойство обуславливается несколькими причинами. Во-первых, от гладкости поверхности, т.е. падающая электромагнитная волна (свет) не застревала в неровностях, а могла отразиться обратно.
Во-вторых, свет попадает на металл, поглощается электронами и через некое малое время излучается обратно, при этом количество энергии, которое может уйти на нагревание, небольшое. Отражённую волну воспринимает наш глаз, цвет волны определяется из величины «длина волны».
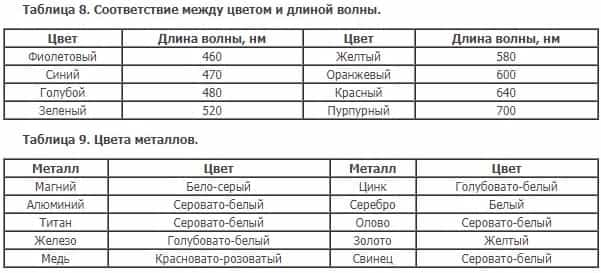
Твёрдость — свойство твёрдого тела сопротивляться проникновению в него другого тела.
Если хотите много теории по данному свойству, то прошу сюда:
- https://libmetal.ru/prop/tverd.htm
Оценка металла по шкале Мооса берёт за основу то, насколько легко образец может быть поцарапан другими металлами.
Например, коэффициент твердости золота — 2,5-3, что значительно ниже коэффициента твердости большинства других материалов.
В то время как графит и некоторые виды пластика стоят на одном конце шкалы, имея значение 1, то на другой её конец ставится алмаз, одно из самых твердых веществ на Земле. Он оценивается в 10 баллов.
Олово: 1.5
Цинк: 2.5
Золото: 2.5-3
Серебро: 2.5-3
Алюминий: 2.5-3
Медь: 3
Медь: 3
Бронза: 3
Никель: 4
Платина: 4-4.5
Сталь: 4-4.5
Железо: 4.5
Палладий: 4.75
Родий: 6
Титан: 6
Укрепленная сталь: 7-8
Вольфрам: 7.5
- Карбид вольфрама: 8.5-9
- Плотность — это отношение массы на объём.
Тяжело расшифровать определение, но я попробую. Оно значит, что при равном объёме разные металлы будут проявлять разную инерцию. Конечно, если и стало понятнее, то на чуток.
- -лёгкие (плотность не более 5 г/см3) — магний, алюминий, титан и др.:
- -тяжёлые — (плотность от 5 до 10 г/см3) — железо, никель, медь, цинк, олово и др. (это наиболее обширная группа);
- -очень тяжёлые (плотность более 10 г/см3) — молибден, вольфрам, золото, свинец и др.
- Таблицы с плотностями:
- Температура плавления — температура, при которой осуществляется процесс перехода вещества из твёрдого состояния в жидкое.
При увеличении внутренней энергии начинают сильнее колебаться узлы, решётка теряет свою структуру, нарушаются связи. Примерно такой процесс можно назвать переходом в жидкое состоянии.
- Делят металлы на несколько групп:
- -легкоплавкие (температура плавления не превышает 600 oС) — цинк, олово, свинец, висмут и др.;
- -среднеплавкие (от 600 oС до 1600 oС) — к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото;
- -тугоплавкие ( более 1600 oС) — вольфрам, молибден, титан, хром и др.
- Больше про плавление написано здесь:
Дополнительная общая ссылка:
- https://examer.ru/ege_po_himii/teoriya/svojstva_prostyx_veshhestv
Большое спасибо за внимание!
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Металлический блеск проявляют лишь компактные массы металла.
Так, при восстановлении водородом окиси меди медь получается в виде порошка, лишенного металлического блеска, но достаточно утрамбовать этот порошок и отшлифовать его, чтобы метал лический блеск появился. [1]
Металлический блеск, сильное поглощение света, возрастающее с переходом в инфракрасную область спектра, является естественным следствием наличия в металлах большой концентрации свободных электронов. [2]
Металлический блеск металлы проявляют в компактной своей массе.
Так, пластинка платины имеет серебристо-белый цвет и металлический блеск, тогда как в мелкораздробленном состоянии этот металл черного цвета и без металлического блеска.
Металлы, отражающие примерно в одинаковой степени все лучи видимого спектра, имеют серебристо-белый цвет. [3]
Металлический блеск, появляющийся РЅР° некоторых пленках красок, РЅРµ содержащих металлических пигментов, Рё маскирующий обычный цвет покрытия РїСЂРё наблюдении его вблизи Рє углам возникновения блеска68, называется бронзированием, так как отраженный свет РїСЂРё этом окрашен обычно РІ желтоватый цвет. Рто, РїРѕ-РІРёРґРёРјРѕРјСѓ, обусловлено очень высоким показателем преломления пигмента РїРѕ отношению Рє СѓР·РєРѕРјСѓ диапазону длин волн падающего света33, вследствие чего для этих длин волн пигмент более непрозрачен, чем для РґСЂСѓРіРёС…. [5]
Металлический блеск — сильный блеск, свойственный металлам.
�м обладают непрозрачные минералы, дающие в большинстве случаев черную черту на фарфоровой пластинке.
Таким блеском обладают самородные металлы ( золото, серебро, платина), многие сульфиды и окислы железа. [6]
Металлический блеск имеют, например, галенит пирит. Все минералы с металлическим блеском непрозрачные, цвет их черты черный или темноокрашенный. [7]
Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов. [8]
Металлический блеск, сильное поглощение света, возрастающее с переходом в инфракрасную область спектра, является естественным следствием наличия в металлах большой концентрации свободных электронов. [9]
Металлический блеск наблюдается обычно только в том случае, когда металл образует компактную массу.
Только магний и алюминий в виде порошков имеют металлический блеск.
Блеск металлов обусловлен отражением падающего на металл света от электронов в его поверхностном слое. [11]
Металлический блеск проявляют лишь компактные массы металла.
Так, РїСЂРё восстановлении РІРѕРґРѕСЂРѕРґРѕРј РѕРєРёСЃРё меди медь получается РІ РІРёРґРµ порошка, лишенного металлического блеска, РЅРѕ достаточно утрамбовать-этот порошок Рё отшлифовать его, чтобы металлический блеск — появился. Лишь РґРІР° металла сохраняют металлический блеск Рё РІ порошкообразном состоянии: магний Рё алюминий. Поэтому алюминиевая пыль применяется РІ качестве серебряной краски. [13]
- Металлическим блеском различной степени интенсивности обладают некоторые минералы, например графит, пирротин, пирит, никелин, арсенопирит. [14]
- Кроме металлического блеска и пластичности, все металлы обладают выср-кой электропроводностью и теплопроводностью. [15]
- Страницы: 1 2 3 4
Физические свойства металлов
9. Физические свойства металлов
Металлическая связь и особенности кристаллического строения обуславливают особые физические свойства металлов.
Металлическая связь основана на обобществлении электронов, входящих в состав атомов металла. Все электроны на внешних энергетических уровнях атомов металлов обобществленные, т.е. принадлежат всем атомам вещества.
И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов.
Постоянно перемещаясь по кристаллической решетке, электроны компенсируют силы электростатического отталкивания между положительно заряженными ионами и тем самым связывают их в устойчивую металлическую решетку.
Металлическая связь – это связь в металлах и сплавах между атом-ионами посредством обобществленных электронов.
Разобраться в том, какой электрон принадлежал какому атому, просто невозможно, так как все оторвавшиеся электроны становятся общими, соединяясь с ионами. Эти электроны временно образуют атомы, потом снова отрываются и соединяются с другим ионом. Этот процесс продолжается бесконечно. Таким образом, в металлических соединениях атомы непрерывно превращаются в ионы и наоборот.
Именно строением металлической связи обусловлены физические свойства металлов.
К физическим свойствам металлов относятся:
-
Металлический блеск.
-
Электропроводность и теплопроводность.
-
Пластичность.
-
Твердость.
-
Высокая плотность и температура плавления.
Рассмотрим каждое из свойств более подробно.
Металлический блеск.
Металлический блеск обусловлен металлической связью между атомами, для которой свойственны обобществленные электроны. Они как раз и испускают под воздействием света свои, вторичные волны излучения, которые мы воспринимаем как металлический блеск.
- В порошкообразном состоянии большинство металлов теряют металлический блеск и приобретают серую или черную окраску.
- Металлический блеск в порошкообразном состоянии сохраняют алюминий и магний.
- Прекрасно отражают свет палладий Pd, ртутьHg, сереброAg, медьCu.
- Из алюминия, серебра и палладия, основываясь на их отражательной способности, изготавливают зеркала, в том числе и применяемые в прожекторах.
- Электропроводность и теплопроводность.
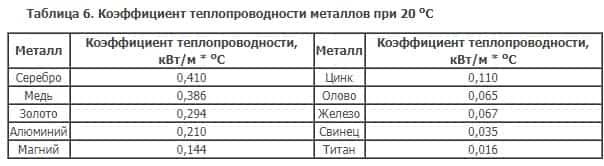
Все металлы хорошо проводят электрический ток и имеют высокую теплопроводность, также благодаря наличию металлической связи. При нагревании металла, увеличивается скорость движения электронов. Быстро движущиеся по кристаллической решетке электроны выравнивают температуру по всей поверхности металла, проводя тепло. Высокая теплопроводность металлов используется для изготовления из нихпосуды.
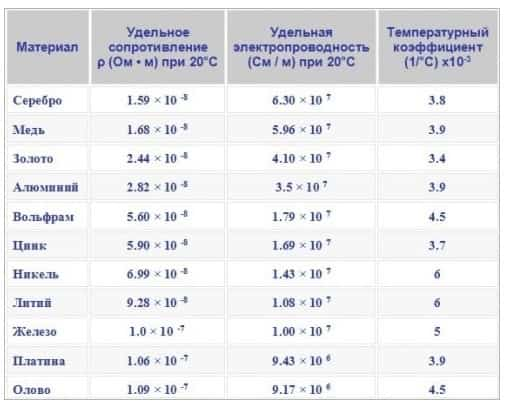
Высокая электропроводность металлов обусловлена направленным движением электронов в кристаллической решетке при воздействии электрического тока. СереброAg, медьCu, золотоAu и алюминий Al обладают наибольшей электропроводностью, поэтому медьCu и алюминийAl используют в качестве материала для изготовления электрических проводов.
- Наименьшей электропроводностью обладают марганец Mn, свинец Pb, ртуть Hgи вольфрам W.
- Пластичность.
- Пластичность – это физической свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
- Большинство металлов пластично, так как слои атом-ионов металлов легко смещаются относительно друг друга и между ними не происходит разрыва связи.
Наиболее пластичные металлы – золотоAu, сереброAg, медьCu. Из золотаAu можно изготовить тонкую фольгу толщиной 0,003 мм, которую используют для золочения изделий.
Именно на пластичности металлов основано кузнечное дело и возможность изготавливать различные предметы с помощью механического воздействия на металл.
Твердость.
Все металлы (кроме ртути) при нормальных условиях представляют собой твердые вещества. Твердость металлов различна. Наиболее твердыми являются металлы побочной подгруппы шестой группы Периодической системы Д.И. Менделеева. Наименее твердыми являются щелочные металлы.
Плотность.
По плотности металлы классифицируют на легкие (их плотность от 0,53 до 5 г/см3) и тяжелые (плотность этих металлов от 5 до 22,6 г/см3). Самым легким металлом является литий Li, плотность которого 0,53 г/см3. Самыми тяжелыми металлами в настоящее время считают осмий Os и иридий Ir (плотность около 22,6 г/см3).
Температура плавления.
Температура плавления металлов находится в диапазоне от 39 (ртутьHg) до 3410оС (вольфрам W). Температура плавления большинства металлов высока, однако некоторые металлы, например, олово Sn и свинец Pl, можно расплавить на электрической плите.
- Физические свойства металлов и в настоящее время широко используются в промышленности и электронике.
- В технике все металлы делятся на черные, к ним относятся железо и его сплавы, и цветные.
- Изделия из различных видов металлов используются повсеместно благодаря их пластичности, но чаще всего в сплавах.
- К драгоценным металлам относят золото, серебро, платину и некоторые другие редко встречающиеся металлы.
ПОИСК
Металлы обладают металлическим блеском, если они находятся в крупнокристаллическом состоянии. Порошкообразные металлы блеска не имеют. Исключение составляют лишь магний и алюминий, которые и в мелкораздробленном состоянии сохраняют свой блеск. [c.
235]
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — один из видов химической связи — связь ионов металла со свободными обобществленными внешними электронами. М. с.
обусловливает характерные свойства металлов блеск, пластичность, высокие электро- и теплопроводность, положительный температурный коэффициент электросопротивления, термоэлектронную эмиссию и др. [c.159]
Если необходимо показать некоторые физические свойства металлов (блеск, цвет), можно продемонстрировать образцы (по возможности, крупные) различных металлов Ре, А1, Мд, 2п, Сг, Т1, Си, 8п, РЬ и др. Для сравнения можно показать и образцы неметаллов. [c.165]
Алюминий — серебристо-белый легкий металл, р = 2,699 г/см , 660,24 С, i .,j,= 2500 С. Он очень пластичен, легко прокатывается в фольгу к протягивается в проволоку.
Прекрасный проводник электрического тока — его электрическая проводимость сравнима с электрической проводимостью меди. Поверхность металла всегда покрыта очень тонкой и очень плотной пленкой оксида АЬОз.
Эта пленка оптически прозрачна и сохраняет отражающую способность металла (блеск). [c.150]
Иод I 2 AI = 253,81 фиол.-черн. ромб, с металл, блеском р = 4,940 [c.65]
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны. [c.29]
Соблюдение этих условий дало возможность получить светлое качественное покрытие с максимальной толщиной 10—12 мк на медной основе, с содержанием таллия 12,5—22,4 вес. %.
Покрытие имеет хорошее сцепление с поверхностью основного металла. Блеск покрытия достигается небольшим полированием. Это покрытие обладает устойчивыми сверхпроводящими свойствами при низких температурах.
[c.127]
Применяют для придания металлу блеска при никелирований. [c.1001]
Следует подчеркнуть, что положение этой граничной диагонали и само деление элементов на металлы и неметаллы весьма условны. Целый ряд элементов, обладая характерными физическими свойствами металлов — блеском, высокой электропроводностью, пластичностью, проявляет химические свойства двойственной природы — [c.109]
Сложных веществ насчитывается в природе сотни тысяч, простых около двухсот, а элементов, из которых образуются все вещества, известно 92.
Большее количество известных простых веществ в сравнении с количеством элементов объясняется свойством последних образовать несколько простых веществ.
Например, общеизвестные вещества — уголь, графит и алмаз, резко различающиеся по своим свойствам, являются видоизменениями одного и того же химического элемента — углерода. Хи.мические элементы подразделяются на металлы и металлоиды.
В группу металлов входит 71 элемент, а в группу металлоидов 21 элемент. Металлы обладают характерным блеском, хорошо проводят тепло и электричество,- обладают ковкостью и т. д. Металлоиды не имеют характерного для металлов блеска и плохо или совсем не проводят тепло и электрический ток. [c.8]
Класс 3. Карбиды промежуточного типа представляют собой огнеупорные материалы с некоторыми характерными свойствами металлов (блеск, металлическая проводимость) и, кроме того, отличаются необычной твердостью и тугоплавкостью.
Атомы металла в них плотно упакованы, а атомы С занимают октаэдрические пустоты, но следует отметить, что упорядочение атомов металла в карбиде не всегда такое, как в самом металле.
В таких случаях карбид МС нельзя рассматривать как предельный твердый раствор углерода в структуре металла наоборот, присутствие атомов С влияет на упорядочение [c.50]
Иод I2 Ai = 253,81 фиол.-черн. ромб, с металл, блеском р= 4,9402 3,960 (ж.) п = 3,34 = 113,6 = 185,5 = 553 С° = 54,43 [c.65]
В свободном металле атомы плотно заполняют пространство, а их наружные энергетические уровни, весьма слабо заполненные электронами, перекрывают друг друга. Благодаря этому наружные электроны легко переходят от атома к атому, так что принадлежат не отдельному атому, а как бы обобществлены.
Таким образом ионы металла (ядра с внутренними энергетическими уровнями) крепко связываются в одно целое суммой свободно блуждающих между ними электронов. Эти свободные электроны обусловливают и физические свойства металлов (блеск, тепло- и электропроводность и пр.). [c.
75]
В связи с большим разнообразием вопросов, решаемых при изучении электроосаждения металлов, методы, применяемые в этой области, также очень разнообразны и охватывают не только электрохимические, но и физические, механические и другие способы исследования.
Это связано с тем, что при электроосаждении металлов изучают как кинетику электродных процессов, так и физико-механические свойства металлов, блеск, пористость, сцепляемость и другие свойства электролитических осадков.
Для разрешения каждого из перечисленных вопросов требуются свои специфические методы исследования применительно к процессу электрокристаллизации металла на катоде. [c.4]
Роспись фаянсовых и фарфоровых изделий проводят с использованием окислов и солей металлов, которые при обжиге переходят в силикаты, обладающие различной окраской окись кобальта дает синюю окраску, окись хрома — зеленую, закись урана — черную и т. д. Из солей легко восстанавливающихся металлов (золота и платины) при обх[c.121]
Алкидные покрытия обладают хорошей адгезией к металлу, блеском, прочностью на изгиб, стойкостью при эксплуатации на воздухе, внутри и вне помещения, преимущественно в условиях умеренного климата. [c.12]
Алкидные покрытия обладают хорошей адгезией к металлу, блеском, эластичностью. С повышением жирности алкидной смолы улучшается эластичность покрытий, но уменьшаются твердость, стойкость к растворителям и маслам, стабильность блеска и цвета при горячей сушке и действии света. [c.47]
Иод 1 2 М = 253,81 фиол.-черн. ромб, с металл, блеском р = 4,9402 [c.65]
ТЕЛЛУР Те Л = 127,60 серебр.-сер. с металл, блеском, триг. р — = 6,25 = 449,8 = 990 Ср = 0,202 С° = 25,77 S° = 49,50 ДЯ = 0 Д0° = 0 ДЯпл = 17,5 ДЯ сп = 51,0 р = 0,1 2. [c.103]
Алкидные ЛКП имеют высокую адгезию к металлу, блеск, стойкость на изгиб. [c.10]
Металлические и неметаллические элементы различаются по своим физическим и химическим свойствам. Неметаллические элементы не имеют характерных для металлов блеска, ковкости и пластичности, а также хорошей электро- и теплопроводности.
В структуре твердых неметаллических элементов атомы окружены сравнительно небольшим числом ближайших соседей и связаны друг с другом ковалентными связями.
Неметаллические элементы характеризуются более высокими энергиями ионизации и электроотрицательностями, чем металлические элементы.
Растворимые оксиды неметаллических элементов обычно образуют водные растворы, обладающие кислотными свойствами по этой причине неметаллические оксиды называю 1О1СЛ0ТИЫМИ ангидридами. В отличие от них растворимые оксиды металлов образуют основные растворы, и поэтому называются основными ангидридами. [c.329]
Теллур Те >1=127,60 серебр.-сер. с металл, блеском, триг. р = 6,252 44g g. ggg. 25,77 s = 49,50 [c.104]
Мышьяк обладает свойством придавать металлам блеск олову при- дает твердость и зво Н и делает его более плотным медь Т же.
юзо отбеливает, а соедипенный с неблагородными металлами сплавлезшем при болео длительной обработке облагораживает часть их Поэтому весьма вероятно, чтч з в состав блеска металлов входит некоторая мышьяковистая часть (особенно металлов, кото рые добываются из ншл чаще в соединении с мышьяком, чем с серою) и что благодаря ей они От других отличаются блеском и крепостью. Это можно с достаточным основанием утверждать П1режде Всего об олове. [c.53]
Теллур Те Л = 127,60 серебр.-сер. с металл, блеском, триг. р = 6,25 5 = 449.8 / ип = 90 Ср = 0,20225 С° = 25,77 S° = 49,50 ДЯ = 0 Д0° = 0 ДЯт=17,5 ДЯисп = 51,0 р=0,01 в 0,1 2 sn. 10632. 1001792. н р S2 реаг. H2SO4, HNO3, Ц. в. медл, реаг. [c.104]
Смотреть страницы где упоминается термин Металлы блеск: [c.81] [c.104] [c.107] [c.81] [c.107] [c.43] [c.50] [c.81] [c.107] [c.65] [c.81] [c.105]
Химический тренажер. Ч.1 (1986) — [ c.6 , c.21 ]
- Блески
- Изучение блеска в процессе электрополировки металлов
- Переходные металлы металлический блеск
© 2022 chem21.info Реклама на сайте
Металл: что это такое, его физические свойства, из чего состоит
05Дек
Содержание статьи
Обнаружение общих физических и химических свойств металлов и сплавов привело к повсеместному использованию материала. Со временем ученые начали подробно изучать его характеристики, а также создавать различные методы металлообработки, которые увеличивают прочность, улучшают кристаллическую решетку.
На настоящий момент есть такие составы, которые используются при кораблестроении. Все больше сфер жизни не может обойтись без металлических элементов – от бытовой ложки или авторучки до сложных механических узлов и микросхем. Но обыватели часто не понимают, что за вещество мы используем, и какие особенности дают ему такую распространенность.
В статье мы подробно поговорим про это.
Что это такое – металл
Древнегреческое слово metallion как раз обозначает «выкапывать из земли» – добытое из горной руды. На настоящий момент известно 96 значений в чистом виде и неограниченное количество сплавов.
Все они отличаются от неметаллов повышенными прочностными качествами и проводимостью, поэтому из них делают провода.
На первый взгляд отличить металлический образец от каменного или иного можно по специфическому блеску.
Физические свойства
В условиях комнатной температуры и без применения давления все вещества обладают твердым состоянием. Но есть галлий, он уже при 30 градусах тепла начинает деформироваться, тает в руках. Можно отметить характеристики:
- Высокая пластичность. Хрупкие только марганец, олово и цинк.
- Могут быть легкие и тяжелые. Сравни алюминий с осмием.
- Температура плавления очень большая. Есть и исключения, например, ртуть, именно по этой причине ее используют в классических термометрах.
- Цвет – серый, серебристый, голубоватый. Редкими являются цветные изделия, например, желтые или красные.
- Увеличенная проводимость тепла и электричества, особенно у меди, поэтому имеют популярность медные провода.
Основные химические свойства металлов
В данной категории нет общих правил, так как все они разделяются на множество подгрупп по уровню активности – щелочные, актиноиды, полуметаллы и другие.
Многие взаимодействуют с водой, почти все – с кислородом (кроме золота и платины),происходит окисление. Процесс проходит в нормальных условиях, если в составе много щелчки, только при нагреве – если нет.
Также почти все элементы вступают в реакцию с серой и хлором.
Признаки
Перечислим черты, по которым обыватель может отличить вещества этой категории от неметаллов:
- Блеск.
- Хорошая проводимость тепла и электричества.
- Прочность.
- Подвергаются ковке и свариванию.
- Кристаллическое строение тела.
- Высокая температура плавления и кристаллизации.
Классификация и виды металлов
Есть чистые, однокомпонентные структуры и сплавы. Самым классическим примером можно назвать различные виды стали. Они различаются по ГОСТу в соответствии с добавлением легирующих добавок. Чем больше содержание углерода, тем крепче материал. Также есть общепринятое разграничение, ниже представим подтипы.
Черные
Их добывают из металлической руды. В производстве они занимают 90% от всего сырья. Обычно это чугуны и стали.
Для изменения характеристик добавляют большее или меньшее количество углерода и легирующие добавки: медь, кремний, хром, никель.
Одним из очень популярных подвидов является нержавейка, которая отличается своим блеском поверхности и уникальными свойствами – легкостью, высокой прочностью и устойчивостью к влажности, температурным перепадам.
Что относится к цветным металлам
Второе название – нежелезные, то есть сплавы не содержат в себе железа, а состоят из более дорогостоящих материалов. Вещества имеют различный цвет, отличаются уникальными качествами:
- долговечность;
- длительное сохранение свойств;
- образование оксидной пленки, которая препятствует коррозии.
Благодаря этому, определенные разновидности можно использовать в медицине, ювелирном деле, химической промышленности, при изготовлении электрических проводов. К цветмету относится алюминий, цинк, олово, свинец, никель, хром, серебро, золото и другие.
Медь и ее сплавы являются популярными металлами
Медная руда была обработана человеком одна из первой, потому что она подвергается холодному методу ковки и штамповки. Податливость привела к востребованности повсеместно. Кислород в составе приводит к красному отливу.
Но уменьшение валентности в различных соединениях приведет к желтому, зеленому, синему цвету. Привлекательным качеством считается отличная теплопроводность – на втором месте после серебра, поэтому она применяется для проводов.
Соединения могут быть:
- твердыми – в сочетании с железом, мышьяком, цинком, фосфором;
- с плохой растворимостью с висмутом, свинцом;
- хрупкими – с серой или кислородом.
К металлам относятся алюминий и сплавы
Al открыт в 1825 году и отличается легкостью и простотой в металлообработке. Производится из бокситов, при этом запасы этой горной породы практически неиссякаемы. Далее элемент соединяют в различных пропорциях с медью, марганцем, магнием, цинком, кремнием. Реже с титаном, литием, бериллием. Особенности в зависимости от добавок:
- хорошая свариваемость;
- устойчивость к коррозии;
- высокая усталостная прочность;
- пластичность.
Его применяют для изготовления ювелирных изделий, столовых приборов, а также для стекловарения, в пищевой и военной промышленности, для создания ракет и для производства водорода и тепла в алюмоэнергетике.
Все о металлах магний, титан и их сплавах
Mg – самое легкое вещество из этой группы. Не обладает прочностью, но есть достоинства, например, пластичность, химическая активность. Благодаря высокой конструкционной способности его добавляют в составы, чтобы увеличивать свариваемость, простоту металлообработки режущим ножом. Необходимо учитывать, что магний очень восприимчив к ржавлению.
Титан имеет похожие качества – легкость, пластичность, серебристый цвет. Но антикоррозийная пленка появляется при первом соприкосновении с кислородом. Отличительные особенности – низкая теплопроводность, электропроводность, отсутствие магнитизма.
Металл, содержащий титан, – это вещество, используемое для авиационной, химической, судостроительной промышленности.
Антифрикционные сплавы
Характерная особенность этой группы – удобство применения при механических воздействиях. Они практически не создают трения, а также снижают его у других композитов. Очень часто они выступают в качестве твердой смазки для узлов, например, для подшипников. В составе обычно бывает фторопласт, латунь, бронза, железографит и баббит.
Мягкие
Это те, у которых ослаблены металлические связи. По этой причине они имеют более низкую температуру плавления и кипения, просто деформируются.
Иногда можно одним нажатием пальца сделать вмятину, ногтем оставить царапину К ним относятся: медь, серебро, золото, бронза, свинец, алюминий, цезий, натрий, калий, рубидий и другие.
Одним из наиболее мягких является ртуть, она находится в природе в жидком состоянии.
Что значит твердый металл
В природе такая руда встречается крайне редко. Порода находится у упавших метеоритов. Один из наиболее популярных – хром. Он тугоплавкий и легко поддается металлообработке. Еще один элемент – вольфрам. Он очень плохо плавится, но при правильной обработке используется в осветительных приборах благодаря устойчивости к теплу и гибкости.
Металлические материалы в энергетике
Мы бы не имели такую развитую электросеть и массу приборов, потребляющих электричество, если бы ряд веществ не отличались наличием свободных электронов, положительных ионов и высокой проводимостью. Провода делают из свинца, меди и алюминия. Отлично бы подошло серебро, но его редкость влияет на стоимость, поэтому редко используется.
Особенности черных вторичных металлов
Это отходы, которые образуются в результате одного из этапа металлообработки – ковки, резки. Это могут быть обрезки или стружки. Они отправляются в сталеплавильные печи, но перед этим должны пройти проверки по ГОСТу. Лом называют чермет, его различают на стальной и чугунный по цене. Его использование очень востребовано вместо обработки руды.
Щелочноземельные сплавы
Это твердые вещества, которые имеют высокую химическую активность. В чистом виде встречаются очень редко, зато применяются в соединениях. Их значение нельзя переоценить с точки зрения анатомии человека и животного. Магний и кальций – необходимые микроэлементы.
Понятие щелочной металл
Они способны растворяться в воде, образуя щелочь. Из-за своей повышенной химической активности (вступление в реакцию происходит с бурным действием, воспламенением, выделением газа, дыма) в природе почти не встречается. Ведь на внешнем уровне всего один электрон, который легко отдается любому веществу. Гидроксиды очень важны в промышленности.
Общая характеристика материалов из d- и f-семейств
Это переходные элементы, которые могут являться как окислителями, так и восстановителями. Свойства зависят от среды, в которой они находятся. Но есть и общие:
- на внешнем уровне много электронов;
- несколько степеней окисления;
- увеличенная валентность;
- прочность;
- тягучесть;
- ковкость.
Из чего состоят побочные подгруппы металлов системы Менделеева
По сути это разновидности предыдущей категории – переходные элементы. Это линейка от скандия до цинка. Они часто выплавляются и обладают фактически такими же характеристиками, как и вышеперечисленные материалы из d- и f-семейств.
Сплавы
Чистые слитки, добываемые из руды, используются максимально редко. Это обусловлено как дороговизной, так и недостаточно хорошими качествами (чтобы исправить, добавляют углерод, легирующие добавки). Иногда в природе встречаются соединения, и нужно только подкорректировать состав. Самые известные:
- латунь;
- бронза;
- сталь;
- чугун.
Сравнение свойств
Вторая часть элементов в периодической системой отличается многообразием характеристик, поэтому почти невозможно привести полную сводную таблицу. Мы предлагаем таблицу, на которой представлено 4 отличительные черты:
| Признаки | Металлы | Неметаллы |
| Положение в П. С. | Под диагональю бор-астат | Над ней |
| Строение атома | Большой атомный радиус, чисто электронов на последнем слое — от 1 до 3 | Маленький, от 4 до 7 — соответственно |
| Физические св-ва | Электропроводность, теплопроводность, блеск, ковкость, пластичность, по агрегатному состоянию, в основном, твёрдые | Диэлектрики, неблестящие, хрупкие, газы, жидкости и летучие твёрдые вещества |
| Кристаллические решетки | Металлическая | Молекулярная, атомная |
| Химические св-ва | Восстановители | Окислительные (иногда восстанов-ли) |
Мы рассказали про металл, что это за материал, как он используется. Если вам нужны станки по металлообработке, закажите их в компании «Роста».
У нас в наличии и на заказ имеются ручные и полуавтоматические ленточнопильные станки, а также маятниковые, вертикальные и двухстоечные агрегаты. Цена на товары снижена в 1.5 — 2 раза по сравнению с зарубежными аналогами.
Чтобы уточнить интересующую вас информацию, свяжитесь с менеджерами, мы с радостью поможем в выборе оборудования.






