- Общие химические свойства металлов
- 1. Реакции металлов с неметаллами
- 2. Реакции металлов с кислотами
- 3. Взаимодействие металлов с водой
- 4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Коррозия металлов
- Rimoyt.com
- Общие химические свойства металлов — урок. Химия, 9 класс
- Материаловедение
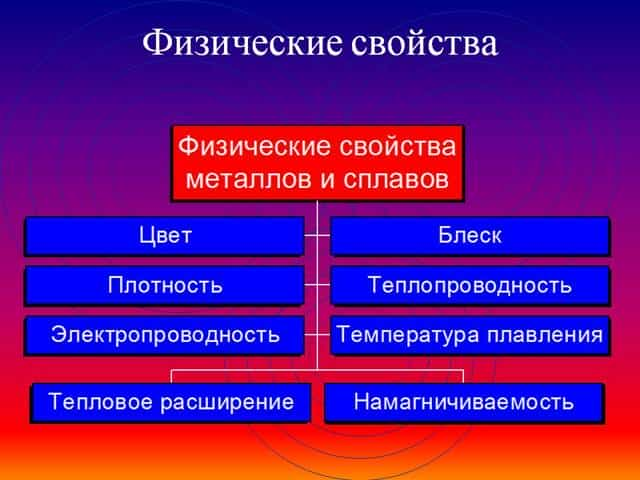
- Физические и химические свойства металлов и сплавов
- Механические и технологические свойства металлов и сплавов
- Введение
- Свойства металлов и сплавов
Чтобы поделиться, нажимайте
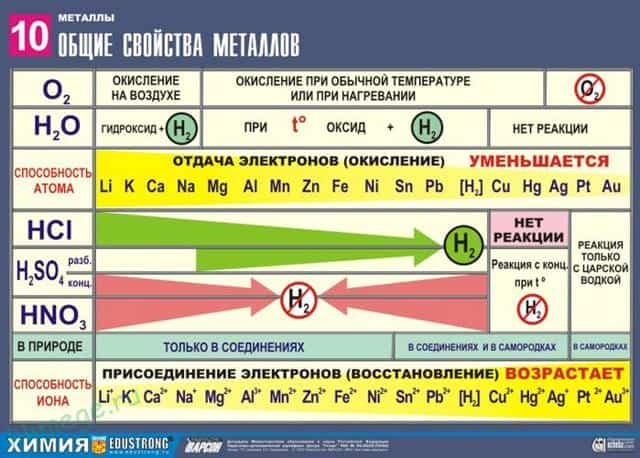
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
- 1) С кислородом:
2Mg + O2 → 2MgO - 2) С серой:
Hg + S → HgS - 3) С галогенами:
Ni + Cl2 –t°→ NiCl2 - 4) С азотом:
3Ca + N2 –t°→ Ca3N2 - 5) С фосфором:
3Ca + 2P –t°→ Ca3P2 - 6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH - Ca + H2 → CaH2
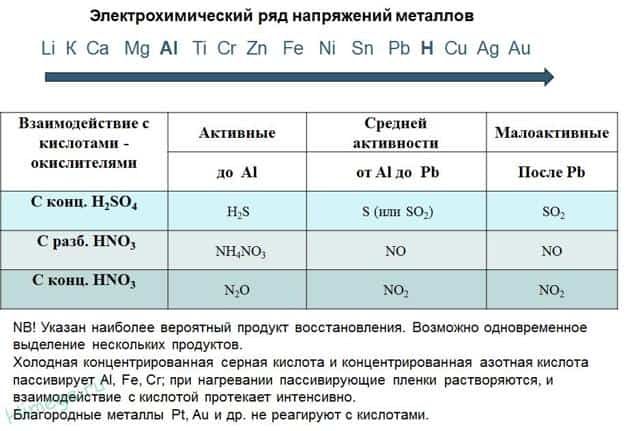
2. Реакции металлов с кислотами
- 1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
- Mg + 2HCl → MgCl2 + H2
- 2Al+ 6HCl → 2AlCl3 + 3H2
- 6Na + 2H3PO4 → 2Na3PO4 + 3H2
- 2) С кислотами-окислителями:
- При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
- Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
- 4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
- 3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
- 2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
- 10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
- 4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. Взаимодействие металлов с водой
- 1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
- 2Na + 2H2O → 2NaOH + H2
- Ca+ 2H2O → Ca(OH)2 + H2
- 2) Металлы средней активности окисляются водой при нагревании до оксида:
- Zn + H2O –t°→ ZnO + H2
- 3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Cu + HgCl2 → Hg+ CuCl2
- Fe+ CuSO4 → Cu+ FeSO4
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание.
Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается.
Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия).
Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара.
Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Rimoyt.com
Свойства металлов и сплавов: механические, физические, химические
- Механические свойства
- К основным механическим свойства относят: — прочность — пластичность
- — твердость
Прочность – способность материала сопротивляться разрушению под действием нагрузок. Пластичность – способность материала изменять свою форму и размеры по действием внешних сил. Твердость – способность материала сопротивляться проникновению в него другого тела.
- Физические свойства
- К физическим свойства относят: — цвет — плотность — температуру плавления — теплопроводность — электропроводность
- — магнитные свойства
Цвет – способность металлов отражать излучение с определенной длиной волны. Например, медь имеет розовато-красный цвет, алюминий – серебристо-белый.
Плотность металла определяется отношением массы к единице объема. По плотности металлы делят на легкие (менее 4500 кг/м3) и тяжелые.
Температура плавления – температура, при которой металл переходит из твердого состояния в жидкое. По температуре плавления различают тугоплавкие (вольфрам – 3416 оС, тантал – 2950 оС и др.) и легкоплавкие (олово – 232 оС, свинец – 327 оС). В единицах СИ температуру плавления выражают в градусах Кельвина (К).
Теплопроводность – способность металлов передавать тепло от более нагретых участков тела к менее нагретым. Большой теплопроводностью обладают серебро, медь, алюминий. В единицах СИ теплопроводность имеет размерность Вт/(м·К).
Способность металлов проводить электрический ток оценивают двумя противоположными характеристиками – электрической проводимостью и электрическим сопротивлением. Электропроводность оценивается в системе СИ в сименсах (См). Электросопротивление выражают в омах (Ом).
Хорошая электропроводность необходима, например, для токонесущих проводов (их изготавливают из меди, алюминия). При изготовлении электронагревательных приборов и печей необходимы сплавы с высоким электросопротивлением (из нихрома, константана, манганина).
С повышением температуры металла его электропроводность уменьшается, а с понижением – увеличивается. Магнитные свойства выражаются в способности металлов намагничиваться. Высокими магнитными свойствами обладают железо, никель, кобальт и их сплавы, которые называют ферромагнитными.
Материалы с магнитными свойствами применяют в электротехнической аппаратуре и для изготовления магнитов.
- Химические свойства
- Химические свойства характеризуют способность металлов и сплавов сопротивляться окислению или вступать в соединение с различными веществами: кислородом воздуха, растворами кислот, растворами щелочей и др.
- К химическим свойствам относят: — коррозионную стойкость
- — жаростойкость
- Коррозионная стойкость – способность металлов сопротивляться химическому разрушению под действием на их поверхность внешней агрессивной среды (коррозия происходит при вступлении в химическое взаимодействие с другими элементами).
- Жаростойкость – способность металлов сопротивляться окислению при высоких температурах
- — приборы и инструменты в химической промышленности
Химические свойства учитывают в первую очередь для изделий или деталей, работающих в химически агрессивных средах: — емкости для перевозки химических реактивов — трубопроводы химических веществ
Общие химические свойства металлов — урок. Химия, 9 класс
Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества, обладающие металлическими свойствами, в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются свойства восстановителя).
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
1. В ряду активности восстановительные свойства металлов снижаются. Самые сильные восстановительные свойства у первых металлов ряда.2. Более активный металл может вытеснить из растворов солей металлы, расположенные в ряду активности после него.3. Металлы, расположенные в ряду активности до водорода, вытесняют его из растворов кислот.
4. Щелочные и щелочноземельные металлы в водных растворах сначала вступают в реакцию с водой.
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется оксид магния:
2Mg0+O02→2Mg+2O−2.
Видеофрагмент:
| Горение магния в воздухе |
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия:
2Na0+Cl02→2Na+1Cl−1.
3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
Zn0+S0→Zn+2S−2.
Видеофрагмент:
| Взаимодействие цинка с серой |
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
- Например, при взаимодействии лития с азотом образуется нитрид лития:
- 6Li0+N02→2Li+13N−3.
- При взаимодействии кальция с фосфором образуется фосфид кальция:
- 3Ca0+2P0→Ca+23P−32.
- Взаимодействие со сложными веществами
1. Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных условиях, образуя растворимое в воде основание (щёлочь) и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и водород:
2Na0+2H+12O−2→2Na+1O−2H+1+H02.
Видеофрагмент:
| Взаимодействие натрия с водой |
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe3O4 и водород:
3Fe0+4H+12O−2→Fe+2O−2⋅Fe+32O−23+4H02.
2. Mеталлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной кислотой образуются сульфат алюминия и водород:
2Al0+3H+12S+6O−24→Al+32(S+6O−24)3+3H02.
Видеофрагмент:
| Реакция алюминия с серной кислотой |
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди((II)) образуются сульфат железа((II)) и медь:
Fe0+Cu+2S+6O−24→Fe+2S+6O−24+Cu0.
Видеофрагмент:
| Взаимодействие железа с сульфатом меди |
Материаловедение
При постройке современных судов и судовых механизмов применяют самые разнообразные материалы. Перечень их особенно расширился в последнее время в связи с внедрением в технике легких сплавов и различных синтетических материалов. Все судостроительные материалы разделяются на три группы:
- — черные металлы;
- — цветные металлы и их сплавы;
- — неметаллические материалы.
Физические и химические свойства металлов и сплавов
К физическим свойствам металлов и сплавов относятся: плотность, температура плавления, теплопроводность, тепловое расширение, удельная теплоемкость, электропроводность и способность намагничиваться.
Плотность — это количество вещества, содержащееся в единице объема. Численное значение плотности совпадает с удельным весом, т.е. весом единицы объема данного вещества Единица измерения -Г /см3
- Зная удельный вес d металла и его объем, можно определить вес любого изделия по формуле:
- Р= d V
- Температура плавления — это температура, при которой металл полностью переходит из твердого состояния в жидкое, каждый металл имеет свою определенную температуру плавления:
- — олово — 2320С;
- — медь — 6510С;
- — железо — 15390С;
- — вольфрам — 33770С.
Теплопроводность — это способность тел передавать с той или иной скоростью тепло при нагревании и охлаждении. Чем лучше металл проводит тепло, тем быстрее и равномернее он нагревается и отдает тепло при охлаждении.
Тепловое расширение
Как известно из физики, вещество при нагреве расширяется, а при охлаждении сжимается. Изменение размера тела называется линейным расширением, а объема — объемным расширением. Изменение длины стального стержня при изменении температуры на 10С называется коэффициентом линейного расширения.
- Удельная теплоемкость — это количество тепла, которое необходимо для повышения температуры 1г вещества на 10С.
- Электропроводность — это способность металлов проводить электрический ток.
- Магнитные свойства — это способность металла создавать собственное магнитное поле либо самостоятельно, либо под действием внешнего магнитного поля.
- Химические свойства — это свойства металлов и сплавов , определяющие отношение к химическим воздействием различных активных сред.
Механические и технологические свойства металлов и сплавов
К механическим свойствам относятся: прочность, пластичность, ударная вязкость, твердость, усталость.
Прочность — свойство металла сопротивляться разрушению под действием внешних сил (нагрузок). В зависимости от характера действия этих сил различают прочность на растяжение, сжатие, изгиб, кручение, усталость и ползучесть.
Для испытания на растяжение из металла или сплава изготавливают образцы определенной формы. Испытание на растяжение проводят на разрывных машинах, в которых образец растягивают до разрыва.
Пластичность — способность металла, не разрушаясь, изменять форму под действием нагрузки и сохранять измененную форму после того, как нагрузка будет снята. Пластичность определяют также при испытании на растяжение.
Под действием нагрузки образцы разных металлов удлиняются, а их поперечное сечение становиться меньше. По величине удлинения образца и величине уменьшения его поперечного сечения судят о пластичности. Чем больше удлиняется образец, тем более пластичнее металл.
Пластичные металлы и сплавы хорошо поддаются обработке давлением.
Ударная вязкость — способность металлов и сплавов оказывать сопротивление действию ударных нагрузок. Вязкость — свойство противоположное хрупкости.
Ударная вязкость — важнейшая характеристика деталей. Которые в процессе работы испытывают ударные нагрузки (коленчатый вал, клапана, оси колес и др.
) испытание на ударную вязкость проводят на машинах, называемых маятниковыми копрами.
- Твердость — свойство металла оказывать сопротивление проникновению в него другого, более твердого тела, не получающего остаточных деформаций. Имеется несколько методов определения твердости, особенно широкое распространение получили следующие:
- — вдавливание шарика из твердой стали (метод Бринелля);
- — вдавливание вершины алмазного конуса (метод Роквелла);
- -вдавливание вершины алмазной пирамиды (метод Виккерса)
- Для измерения твердости применяют стационарные и переносные приборы.
Усталость — явление разрушения металла при его многократном нагружении. Повторение нагрузок значительно уменьшает прочность металла или сплава.
Поэтому в технике для характеристики усталости металлов принято понятие выносливости.
Под пределом выносливости подразумевается то наибольшее напряжение, которое выдерживает металл, не разрушаясь после заданного числа нагрузок (циклов).
К технологическим свойствам относятся: обрабатываемость, свариваемость, ковкость, прокаливаемость, жидкотекучесть, усадка.
Обрабатываемость — комплексное свойство материала, в частности металла, характеризующее способность его подвергаться обработке резанием. Обычно обрабатываемость определяется по скорости резания, по усилию резания и по чистоте обработки
Свариваемость — свойство металла давать доброкачественное соединение при сварке, характеризующееся отсутствием трещин и других пороков металла в швах и прилегающих к шву зонах. Хорошей свариваемостью обладает низкоуглеродистая сталь, значительно худшей обладают чугун, медные и алюминиевые сплавы.
Ковкость — способность металлов и сплавов без разрушения менять свою форму при обработке давлением.
Прокаливаемость — способность стали воспринимать закалку на определенную глубину от поверхности.
Жидкотекучесть — способность металла в расплавленном состоянии заполнять литейную форму. Для повышения жидкотекучести в металлы и сплавы добавляют компоненты, улучшающие жидкотекучесть, например фосфор — к чугуну и медным сплавам, кремний — к алюминию.
Усадка — уменьшение объема или линейных размеров расплавленного металла или сплава.
Введение
Метериаловедение
— это прикладная наука, изучающая связи
между строением (или структурой), составом
и свойствами материалов. Кратко в
математической форме это можно выразить
следующим образом:
Свойства
= f
(химический состав, структура)
Структура
материала весьма чутко реагирует на
внешние механические, термические и
физические воздействия. Поэтому
закономерности влияния этих факторов
на структуру и, в конечном счете, свойства
материалов также является предметом
изучения материаловедения.
Курс
«Материаловедение» состоит из двух
разделов: первый- теоретические основы
материаловедения.
В этом разделе
изучаются свойства материалов, а также
влияние на эти свойства эксплуатационных
факторов; атомно-кристаллическое
строение
металлов и сплавов; диаграммы состояния;
формирование структуры и свойств при
кристаллизации и пластической деформации;
диаграмма железоуглеродистых сплавов;
теория термической обработки.
-
Во
втором разделе изучаются структура и
свойства конкретных классов материалов
(практическое материаловедение). -
Все
материалы, применяемые в машиностроении,
исходя из их природы, можно разделить
на следующие основные группы: -
1.
Металлические
материалы,
к которым относятся:
- сплавы на основе железа – чистое железо, стали, чугуны;
- стали и сплавы с особыми физическими свойствами (магнитные и немагнитные стали и сплавы, аморфные сплавы, сплавы с высоким электрическим сопротивлением, сплавы с эффектом памяти формы и т.д.);
- цветные металлы и сплавы – алюминий и сплавы на его основе (деформирующиеся и литейные; упрочняемые и не упрочняемые термической обработкой), медь и сплавы на ее основе (латуни, бронзы), титан и сплавы на его основе, подшипниковые сплавы и др.
- композиционные материалы с металлической матрицей;
2.
Неметаллические
материалы:
- полимерные органические материалы – пластмассы (термореактивные и термопластичные), резины;
- композиционные материалы с неметаллической матрицей (стекло-пластики, углепластики, оргпластики и др.);
- неорганические материалы (стекло, ситаллы, керамика);
Кроме
того, возможна классификация конструкционных
материалов по свойствам, определяющим
выбор материала для конкретных деталей
конструкций. Каждая группа материалов
оценивается соответствующими критериями,
обеспечивающими работоспособность в
эксплуатации.
В
соответствии с выбранным принципом
классификации все конструкционные
материалы подразделяют на следующие
группы:
- материалы, обеспечивающие жесткость, статическую и циклическую прочность (стали);
- материалы с особыми технологическими свойствами;
- износостойкие материалы;
- материалы с высокими упругими свойствами;
- материалы с малой плотностью;
- материалы с высокой удельной прочностью;
- материалы, устойчивые к воздействию температуры и рабочей среды.
Свойства металлов и сплавов
При
выборе материала исходят из комплекса
свойств, которые подразделяют на
механические, физические, химические
и технологические.
Физические
свойства
определяют поведение материалов в
тепловых, гравитационных, электромагнитных
и радиационных полях. К физическим
относятся такие свойства материалов
как плотность, теплоемкость, температура
плавления, термическое расширение,
магнитные характеристики, теплопроводность,
электропроводность.
Под
химическими
свойствами
понимают способность материалов вступать
в химическое взаимодействие с другими
веществами, сопротивляемость окислению,
проникновению газов и химически активных
веществ. Характерным примером химического
взаимодействия среды и металла является
коррозия.
Технологические
свойства
металлов и сплавов характеризуют их
способность подвергаться горячей и
холодной обработке. Комплекс этих
свойств включает в себя технологичность
при выплавке, горячем и холодном
деформировании, обработке резанием,
термической обработке и, особенно,
сварке.
При
конструировании изделий в первую очередь
руководствуются механическими свойствами
материалов.
Механические
свойства
материалов характеризуют их способность
сопротивляться деформированию и
разрушению под действием различного
рода нагрузок. Механические нагрузки
могут быть статическими, динамическими
и циклическими.
Кроме того, материалы
могут подвергаться деформации и
разрушению как при разных температурных
условиях, так и в различных, в том числе
агрессивных средах. Для того, чтобы
обеспечить надежную работу конкретных
машин и приборов, необходимо учитывать
условия эксплуатации, т.е.
к материалу
предъявляют эксплуатационные требования.
К
основным механическим свойствам относят
прочность, упругость, ударную вязкость,
пластичность, твердость.
Для
определения механических свойств
материалов разработаны различные методы
испытаний. При статических методах
материал подвергают воздействию
постоянной силы, возрастающей весьма
медленно. При динамических испытаниях материал подвергают воздействию удара
или силы быстро возрастающей.
Определение
прочности, пластичности, упругости
Прочность
– способность материала сопротивляться
разрушению под действием внешних сил.
Пластичность
– способность материала к пластической
деформации, т.е. к получению остаточного
изменения формы и размеров без разрушения.
Упругость
– свойство материала восстанавливать
свои размеры и форму после прекращения
действия нагрузки.
Прочность,
пластичность и упругость материала
определяют при статических испытаниях
на растяжение.
Рис.
3.1. Статические испытания на растяжение:
а
– схема испытания; б – диаграмма
растяжения
Испытания
производятся на цилиндрических (или
плоских) образцах с определенным
соотношением между длиной l0
и диаметром d0.
Образец растягивается под действием
приложенной силы P
(рис. 1.1.) до разрушения. Внешняя нагрузка
вызывает в образце напряжение и
деформацию. Напряжение
σ – это
отношение силы P
к площади поперечного сечения F,
МПа:
-
=
, -
Деформация
характеризует
изменение размеров образца под действием
нагрузки, % -
=
100,
где
l
– длина растянутого образца. Деформация
может быть упругой (исчезающей после
снятия нагрузки) и пластической
(остающейся после снятия нагрузки).
При
испытаниях строится диаграмма растяжения,
представляющая собой зависимость
напряжения от деформации (рис.3.1.).
После
проведения испытаний определяются
следующие характеристики механических
свойств:
Предел
упругости σу
– это
максимальное напряжение, при котором
в образце не возникают пластические
деформации.
Предел
текучести –
это напряжение, соответствующее площадке
текучести на диаграмме растяжения (рис.
1.1, б).
Если на диаграмме нет площадки
текучести (что наблюдается для хрупких
материалов), то определяют условный
предел текучести
png»>– напряжение, вызывающее пластическую
деформацию, равную 0,2%.
-
Относительное
удлинение после разрыва – отношение приращения длины образца
при растяжении к начальной длинеl,
%: -
=
·
100, -
где
lk
– длина образца после разрыва.
=
·
100,
где
Fk– площадь
поперечного сечения образца в месте
разрыва. Относительное удлинение и
относительное сужение являются
характеристиками пластичности.
-
Определение
твердости -
Твердость
– способность материала сопротивляться
проникновению в него другого тела. -
Твердость
материала испытывается при статическом
характере вдавливания
в него шарика, конуса или пирамиды.
Наиболее
широкое применение нашли методы
определения твердости по Бринеллю,
Роквеллу и Виккерсу (рис. 3.2.).
Твердость
по Бринеллю (НВ) определяется вдавливанием
в испытываемую поверхность под нагрузкой
Р стального шарика диаметром Д (рис.3.2,
а).
После
снятия нагрузки на поверхности образца
остается отпечаток (лунка).
Твердость
определяется по формуле
где
F
– площадь поверхности отпечатка.
Рис.
3.2. Схемы определения твердости:
- а
– по Бринеллю; б – по Роквеллу; в – по
Виккерсу -
Практически
величину твердости определяют не по
формуле, а по прилагаемой к прибору
таблице в зависимости от диаметра
отпечатка. -
Между
твердостью по Бринеллю и пределом
прочности металла существует приближенная
зависимость
Твердость
по Роквеллу определяют по глубине
отпечатка. Метод основан по вдавливании
в испытуемый образец закаленного
стального шарика диаметром 1,588 мм (шкала
В) или алмазного конуса с углом при
вершине 1200
(шкалы А и С).
Вдавливание производится
под действием двух нагрузок –
предварительной Р0,
равной 100 Н и окончательной Р, равной
600, 1000, 1500 Н для шкал А, В и С соответственно.
Число твердости по Роквеллу HRA,
HRB
и HRC
определяется по разности глубин
вдавливания в условных единицах.
Твердость
по Виккерсу определяют вдавливанием в
испытываемую поверхность (шлифованную
или даже полированную) четырехгранной
алмазной пирамиды с углом при вершине
1360.
Метод используют для определения
твердости деталей малой толщины и тонких
поверхностных слоев, имеющих высокую
твердость.
Число твердости по Виккерсу
HV
определяется отношением приложенной
нагрузки к площади поверхности отпечатка.
Практически
величину твердости определяют не по
формуле, а по прилагаемым к прибору
таблицам по измеренной величине d
(диагональность отпечатка) рис. 3.2, в.
Определение
ударной вязкости
Для
оценки вязкости материалов и установления
их склонности к переходу из вязкого в
хрупкое состояние проводят испытания
при динамических нагрузках.
Метод
основан на разрушении образца с надрезом
(рис. 3.3., а) посередине одним ударом
маятникового копра (рис. 3.3, б).
Рис.
3.3. Схема испытания образца на маятниковом
копре
КС
= А/F,
Дж/м2,
где А
работа, затраченная на разрушение
образца; F
площадь поперечного сечения образца в
месте надреза, м; КС
ударная вязкость, индексы V,U
(KC
V,
КС U)
характеризуют форму надреза.






