- Основное и возбужденное состояние фосфора
- Природные соединения
- Оксид фосфора V — P2O5
- Фосфорные кислоты
- Ортофосфорная кислота
- Соли фосфорной кислоты
- Уравнение реакций фосфорной кислоты с металлами
- Способы получения
- Химические свойства
- Please wait
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Гдз химия 8 класc габриелян о.с. , остроумов и.г., сладков с.а. 2019 §8 валентность
- Разработка урока по теме "Соли фосфора"
- Соли фосфорной кислоты H3PO4: фосфаты, гидрофосфаты, дигидрофосфаты
- Гидролиз фосфата натрия Na3PO4
- Гидролиз гидрофосфата натрия Na2HPO4
- Гидролиз дигидрофосфата натрия NaH2PO4
- Применение фосфатов
- Фосфат натрия: описание, реакции, вред, применение
- Что такое фосфат натрия
- Виды тринатрийфосфата
- Na3PO4
- NaH2PO4
- Na2HPO4
- Формула и свойства фосфата натрия
- Химические реакции, свойства
- Получение и производство фосфата натрия
- Лабораторный способ
- Промышленный
- Сферы применения фосфата натрия
- Фармацевтика
- Слабительные
- Кишечные
- Антацидные
- Внутривенные растворы
- Пищевая индустрия
- Изготовление бытовой химии
- Стекольное производство
- Строительство
- Смягчение воды
- Влияние на здоровье
- Польза
- Вред
- В каких продуктах содержится фосфат натрия
- Тип пищевой добавки
- Класс опасности и токсичности
- Первая помощь
- Хранение и транспортировка
- Где купить, сколько стоит фосфат натрия, расфасовка
- Отзывы
- Заключение
Фосфор (греч. phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество, легко воспламеняющееся и светящееся.

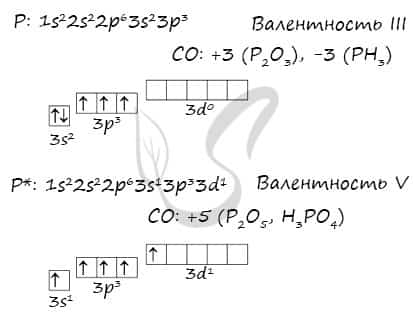
Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*Ca(OH,F)2 — фосфорит
- Ca10(PO4)6(F,Cl,OH)2 — апатит

- Получение
- В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
- Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
- Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до P2.
- Реакции с неметаллами
- 4P + 3O2 → 2P2O3 (недостаток кислорода)
- 4P+ 5O2 → 2P2O5 (избыток кислорода)
- Схожим образом происходит взаимодействие фосфора и хлора.
- 2P + 3Cl2 → 2PCl3 (недостаток хлора)
- 2P + 5Cl2 → 2PCl5 (избыток хлора)
- P + S → P2S3
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое отравляющее вещество. Ca3P2 + H2O → Ca(OH)2 + PH3↑ 
2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество является и окислителем, и восстановителем). P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования. P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 — гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя. KClO3 + P → KCl + P2O5 
Оксид фосфора V — P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
- Получение
- P + O2 → P2O5
- Химические свойства
- Кислотные свойства
- P2O5 + Na2O → Na3PO4
- 6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
- 4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
- 2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)
- Дегидратационные свойства
- Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
- HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 — метафосфорная кислота)
- HNO3 + P2O5 → HPO3 + N2O5
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту. P2O5 + 3H2O = 2H3PO4 P2O5 + H2O = HPO3 (при недостатке воды) Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного оксида/основания и кислотного оксида.

Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (трехосновная кислота, соли — фосфаты PO43-)
- Метафосфорная кислота — HPO3 (одноосновная кислота, соли — метафосфаты PO3-)
- Фосфористая — H3PO3 (двухосновная кислота, соли — фосфиты HPO32-)
- Фосфорноватистая — H3PO2 (одноосновная кислота, соли гипофосфиты — H2PO2- )
- Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
- CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора, взаимодействия оксида фосфора V с водой.
- Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4
- P2O5 + H2O → H3PO4
- PCl5 + H2O → H3PO4 + HCl
- Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
- P + HNO3 + H2O → H3PO4 + NO

Химические свойства
- Кислотные свойства
- 3K2O + H3PO4 = 2K3PO4 + 3H2O
- 3KOH + H3PO4 = K3PO4 + 3H2O
- 2KOH + H3PO4 = K2HPO4 + H2O
- KOH + H3PO4 = KH2PO4 + H2O
- Реакции с солями
- AgNO3 + H3PO4 → Ag3PO4 + HNO3
- В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
- K2CO3 + H3PO4 → K3PO4 + H2O + CO2
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные соли (фосфаты, гидрофосфаты и дигидрофосфаты).
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
- Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
- 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
- Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4

Уравнение реакций фосфорной кислоты с металлами
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
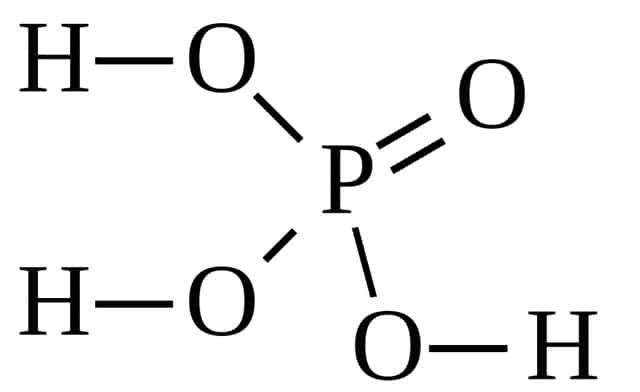
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
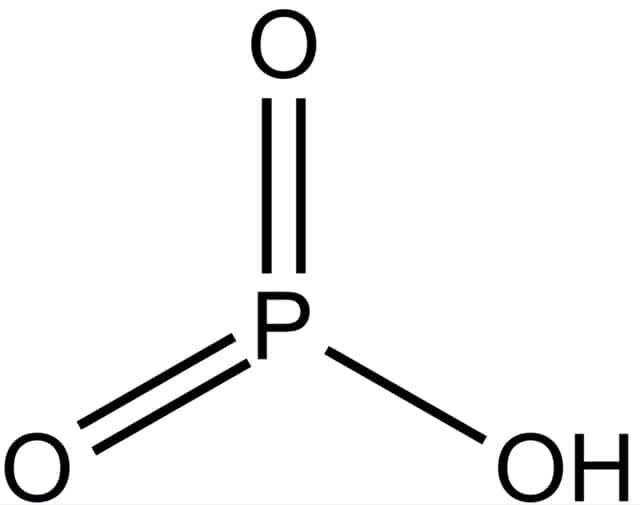
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.) .
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая) .
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , фосфорная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например , фосфорная кислота взаимодействует с гидрокарбонатом натрия:
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , фосфорная кислота реагирует с магнием:
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:

Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Please wait
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
Гдз химия 8 класc габриелян о.с. , остроумов и.г., сладков с.а. 2019 §8 валентность
Гдз химия 8 класc габриелян о.с. , остроумов и.г., сладков с.а. 2019 §8 валентность
Другие задания смотри здесь…
| Красным цветом даются ответы, а фиолетовым ― объяснения. |
Задание 1
Запишите формулы оксидов железа и меди, т.е. бинарных соединений металлов с кислородом. Данные о валентности элементов приведены на схеме 3.
FeO— оксид железа (II)Fe2O3— оксид железа (III)
Cu2O
— оксид меди (I)CuO
— оксид меди (II)Объяснение.
Для оксида железа (II). Записываем химические символы элементов, а над ними валентность элементов: FeIIОII. Наименьшее общее кратное валентностей обоих элементов равно два и делим его на величину валентности каждого из элементов (2:2=1 и 2:2=1) ― это индексы, которые ставим у символа соответствующего химического элемента (на письме 1 не пишем).
Итак, формула FeОДля оксида железа (III). Записываем химические символы элементов, а над ними валентность элементов: FeIIIОII. Наименьшее общее кратное валентностей обоих элементов равно шесть и делим его на величину валентности каждого из элементов (6:3=2 и 6:2=3) ― это индексы, которые ставим у символа соответствующего химического элемента.
Итак, формула Fe2O3Для оксида меди (I). Записываем химические символы элементов, а над ними валентность элементов: СuIОII. Наименьшее общее кратное валентностей обоих элементов равно два и делим его на величину валентности каждого из элементов (2:1=2 и 2:2=1) ― это индексы, которые ставим у символа соответствующего химического элемента.
Итак, формула Сu2ОДля оксида меди (II). Записываем химические символы элементов, а над ними валентность элементов: CuIIОII.
Наименьшее общее кратное валентностей обоих элементов равно два и делим его на величину валентности каждого из элементов (2:2=1 и 2:2=1) ― это индексы, которые ставим у символа соответствующего химического элемента (на письме 1 не пишем). Итак, формула СuО
Задание 2
Сера образует два оксида, формулы которых SO2 и SO3. Назовите эти оксиды. Оксид серы (IV) и оксид серы (VI)
В каком из них содержание серы выше? Ответ подтвердите расчётами.
Дано: оксиды SO2 и SO3Найти: ω1(S) —?, ω2(S) —?Решение.1. Рассчитываем массовую долю cеры в SO2.Mr(SO2)=Ar(S)+2•Ar(O)=32+2•16=64ω1(S)=(Ar(S)/Mr(SO2))•100%=(32:64)•100%=50%2. Рассчитываем массовую долю cеры в SO3.Mr(SO3)=Ar(S)+3•Ar(O)=32+3•16=80ω2(S)=(Ar(S)/Mr(SO3))•100%=(32:80)•100%=40%Ответ: в оксиде SO2 массовая доля серы больше, чем в оксиде SO3.
- Задание 3
- Рассчитайте массовую долю фосфора в оксиде фосфора (III) и оксиде фосфора (V).Mr(P2O3)=2•Ar(P)+3•Ar(O)=2•31+3•16=110w1(P)=(2•Ar(P)/Mr(P2O3))•100%=(2•31:110)•100%=56,4%Mr(P2O5)=2•Ar(P)+5•Ar(O)=2•31+5•16=142w2(P)=(2•Ar(P)/Mr(P2O5))•100%=(2•31:142)•100%=43,7%
- Задание 4
Назовите вещества, формулы которых: FeS —
cульфид железа (II)Al2S3—
cульфид алюминияSCl2—
хлорид серы (II)SCl4—
хлорид серы (IV)CO —
оксид углерода (II)CO2—
оксид углерода (IV)Na3P —
фосфид натрияCa3P2—
фосфид кальция
Задание 5
Запишите формулы хлоридов — бинарных соединений элементов с одновалентным хлором: Углерода (IV) —
CCl4Калия — KClАзота (III) —
NCl3Меди (I) —
CuClМеди (II) —
CuCl2Железа (II) —
FeCl2Железа (III) —
FeCl3Свинца (II) —
PbCl2
Объяснение.
Для CIVCl. Записываем химические символы элементов, а над ними валентность элементов: CIVClI. Наименьшее общее кратное валентностей обоих элементов равно четыре и делим его на величину валентности каждого из элементов (4:4=1 и 4:1=4) ― это индексы, которые ставим у символа соответствующего химического элемента (на письме 1 не пишем).
Итак, формула CCl4Для KICl. Записываем химические символы элементов, а над ними валентность элементов: KIClI.
Наименьшее общее кратное валентностей обоих элементов равно один и делим его на величину валентности каждого из элементов (1:1=1 и 1:1=1) ― это индексы, которые ставим у символа соответствующего химического элемента (на письме 1 не пишем). Итак, формула KClДля NIIICl.
Записываем химические символы элементов, а над ними валентность элементов: NIIIClI. Наименьшее общее кратное валентностей обоих элементов равно три и делим его на величину валентности каждого из элементов (3:3=1 и 3:1=3) ― это индексы, которые ставим у символа соответствующего химического элемента. Итак, формула NCl3Для CuIICl.
Записываем химические символы элементов, а над ними валентность элементов: CuIIClI. Наименьшее общее кратное валентностей обоих элементов равно два и делим его на величину валентности каждого из элементов (2:2=1 и 2:1=2) ― это индексы, которые ставим у символа соответствующего химического элемента (на письме 1 не пишем). Итак, формула CuCl2
Для FeIICl. Записываем химические символы элементов, а над ними валентность элементов: FeIIClI. Наименьшее общее кратное валентностей обоих элементов равно два и делим его на величину валентности каждого из элементов (2:2=1 и 2:1=2) ― это индексы, которые ставим у символа соответствующего химического элемента (на письме 1 не пишем). Итак, формула FeCl2
Для FeIIICl. Записываем химические символы элементов, а над ними валентность элементов: FeIIIClI. Наименьшее общее кратное валентностей обоих элементов равно три и делим его на величину валентности каждого из элементов (3:3=1 и 3:1=3) ― это индексы, которые ставим у символа соответствующего химического элемента (на письме 1 не пишем). Итак, формула FeCl3
Для PbIICl. Записываем химические символы элементов, а над ними валентность элементов: PbIIClI. Наименьшее общее кратное валентностей обоих элементов равно два и делим его на величину валентности каждого из элементов (2:2=1 и 2:1=2) ― это индексы, которые ставим у символа соответствующего химического элемента (на письме 1 не пишем). Итак, формула PbCl2
Задание 6
Запишите формулы фосфатов — соединений металлов (натрия, кальция, алюминия) с группой атомов остатка фосфорной кислоты Н3РО4.Фосфат натрия — Na3PO4Фосфат кальция — Ca3(PO4)2Фосфат алюминия — Al3(PO4)2Задание 7
Запишите формулы гидроксидов металлов — соединений металлов (натрия, кальция, алюминия) с одновалентной группой атомов —ОН (гидроксильной группой).Гидроксид натрия — NaOH
Гидроксид кальция — Ca(OH)2
Гидроксид алюминия — Al(OH)3
Задание 9
Подготовьте сообщение о развитии представлений о валентности.Понятие валентность встречается в науке с конца XV века, но обозначало оно не «связь», а «экстракт». Мысль о возможности между атомами в молекуле числа связей была высказана впервые в конце XVIII века У. Хиггинсом. В 1852 г. английский химик Э.
Франкленд обратил внимание, что разным атомам свойственна разная степень «насыщения» связей, термин валентность в данном контексте не употреблялся. Даже Ф.А.
Кекуле, внесший огромный вклад в развитие теории валентности, в своих работах употреблял термин «основность», подразумевая в первую очередь способность углерода образовывать 4 связи (т.е. быть «четырехосновным»). А.М.
Бутлеров в своей теории называл валентность «сродством», имея в виду, что способность к «сродству» каждого элемента определяет способ организации связей в молекуле. Термин «валентность», в контексте числа связей, образующихся между атомами, стал повсеместно использоваться с 80-х годов XIX века и применяется до сих пор.
Другие задания смотри здесь…
Разработка урока по теме "Соли фосфора"
Тема: Оксид фосфора (V). Фосфорная кислота и ее соли.
Цель: формирование знаний о свойствах оксида фосфора(V), фосфорной кислоты, кислых солях фосфорной кислоты, реакциях неполной нейтрализации; продолжение формирования умений составлять уравнения химических реакций.
Задачи:
- Образовательная: сформировать знания об оксиде фосфора(V), о фосфорной кислоте, ее физических и химических свойствах, получении и применении; обеспечить в ходе урока усвоение знаний о солях фосфорной кислоты, их свойствах, получении и применении.
- Тип урока: комбинированный
- Ход урока
- I.Организационный момент
Сегодня на уроке мы познакомимся с кислородными соединениями фосфора: с оксидом фосфора(V), фосфорной кислотой и ее солями. Изучим свойства оксида фосфора, рассмотрим физические и химические свойства фосфорной кислоты, ее получение и применение, рассмотрим получение и свойства солей фосфорной кислоты. Перед тем как мы перейдем к изучению новой темы сначала проведем опрос по фосфору.
- II.Актуализация опорных знаний
- Опрос учащихся по теме «Фосфор»
- Вопросы:
-
Где расположен фосфор в периодической таблице химических элементов Д. И. Менделеева?
-
Сколько энергетических уровней у атома фосфора?
-
Сколько электронов на внешнем энергетическом уровне находится у атома фосфора?
-
Заряд ядра атома фосфора?
-
Назовите высшую и низшую степени окисления фосфора?
-
В виде каких аллотропных модификаций встречается фосфор?
-
Чем отличается белый фосфор от красного?
-
Какие свойства фосфор проявляет в реакциях?
-
Где применяется фосфор?
Примерные ответы:
-
Фосфор расположен в 3 периоде, 5 группе главной подгруппе периодической таблицы химических элементов Д.И. Менделеева.
-
У атома фосфора 3 энергетических уровня
-
У атома фосфора на внешнем энергетическом уровне находится 5 электронов.
-
Заряд ядра атома фосфора равен + 15
-
Высшая + 5, низшая – 3.
-
Фосфор образует несколько аллотропных модификаций: белый, красный и черный фосфор.
-
Белый фосфор не растворим в воде, хорошо растворим в сероуглероде. Белый фосфор очень ядовит, светится в темноте. Красный фосфор не растворяется ни в воде, ни в сероуглероде. Неядовит и не светится в темноте.
-
Фосфор в реакциях чаще всего бывает восстановителем (с кислородом, галогенами, бертолетовой солью, азотной кислотой), с металлами проявляет окислительные свойства.
-
Фосфор применяют в производстве фосфорной кислоты, лекарственных препаратов, в производстве спичек.
- III.Изучение нового материала
- 1.Оксид фосфора (V)
- Оксид фосфора(V) P2O5 образуется при горении фосфора на воздухе:
- 4Р + 5О2 ® 2Р2О5
- Твердое кристаллическое вещество Р2О5 гигроскопично и используется как водоотнимающее средство.
- P2O5 – типичный кислотный оксид, обладающий всеми свойствами кислотных оксидов. 1) При взаимодействии с водой образует на холоде метафосфорную кислоту НРО3: P2O5 + H2O ® 2HPO3 или при нагревании ортофосфорную кислоту Н3РО4:
- P2O5 + 3H2O ® 2H3PO4
- 2) Как кислотный оксид, вступает в реакции с основными оксидами: P2O5 + 3CaO → Ca3(PO4)2
- 3) Со щелочами:
- 2. Фосфорная кислота — H3PO4
- Получение
- Фосфорную кислоту получают из оксида фосфора (V):
- P2O5 + 3H2O ® 2H3PO4
- и фосфата кальция:
- Ca3(PO4)2 + 3H2SO4 ® 3CaSO4 + 2H3PO4
- Физические свойства Фосфорная кислота – бесцветное твердое кристаллическое вещество (t плавления = 42ºС), хорошо растворимое в воде.
- Химические свойства
- Фосфорная кислота вступает во многие реакции, характерные для кислот:
- 1.С металлами, стоящими в ряду напряжения металлов до водорода:
- 3Mg + 2H3PO4 ® Mg3(PO4)2 + 3H2↑
- 2.С основными оксидами:
- 3CaO + 2H3PO4® Сa3(PO4)2 + 3H2O
- 3.С основаниями и аммиаком:
- H3PO4 + 3NaOH → Na3PO4 + 3H2O
- H3PO4 + 2NH3 → (NH4)2HPO4
- 4.С солями слабых кислот:
- 2H3PO4 + 3Na2CO3 → 2Na3PO4 + 3H2O + 3CO2↑
- 5.При действии раствора нитрата серебра появляется желтый осадок:
- H3PO4 + 3AgNO3 → Ag3PO4 ↓ + 3HNO3
- Это качественная реакция на фосфорную кислоту и её соли – фосфаты.
- Применение
P2O5 +3Ca(OH)2 → Ca3(PO4)2 + 3H2O
- В производстве фосфорных удобрений
- В производстве кормовых добавок для животноводства
- В производстве моющих средств (фосфаты щелочных металлов)
- Для создания защитных покрытий на металлах
- 3.Соли фосфорной кислоты
- Фосфорная кислота может давать три ряда солей: кислые соли — гидрофосфаты и дигидрофосфаты, средние соли – фосфаты.
- Получение
- 1)H3PO4 + 2NaOH → Na2HPO4 + 2H2O гидрофосфат натрия 2)H3PO4 + NaOH → NaH2PO4 + H2O дигидрофосфат натрия Реакции неполной нейтрализации 3)H3PO4 + 3NaOH → Na3PO4 + 3H2O
- фосфат натрия
- Реакция полной нейтрализации
- Физические свойства
- Средние соли, или фосфаты (например, Са3(РО4)2), нерастворимы в воде, кроме фосфатов щелочных металлов;
- Кислые соли – дигидрофосфаты (например, Са(Н2РО4)2), большинство хорошо растворимы в воде;
- Кислые соли — гидрофосфаты (например, СаНРО4), малорастворимы в воде (кроме фосфатов натрия, калия и аммония), т.е. занимают промежуточное положение между фосфатами и дигидрофосфатами по растворимости.
- Химические свойства
- Для средних солей фосфорной кислоты характерны все свойства солей.
- Кислые соли могут взаимодействовать со щелочами и разлагаться при нагревании на среднюю соль и Н3РО4. 1) Со щелочами: Na2НPO4 + NaOH → Na3PO4 + H2O (происходит замещение водорода на натрий) 2) Разложение:
- 3NaH2PO4 → Na3PO4 + 2H3PO4
- IV. Закрепление
- 1) «Проверь себя»
- Закончите высказывания:
-
Оксид фосфора (V) образуется при горении …
-
Формула фосфорной кислоты…
-
Фосфорную кислоту получают из …
-
Фосфорная кислота – это … вещество, …растворимое в воде
-
Качественная реакция на фосфорную кислоту и ее соли – это взаимодействие с … . Признак реакции — …
-
Фосфорная кислота применяется в производстве …
-
Фосфорная кислота может давать три ряда солей: кислые соли — … и … , средние соли – …
- 2) Работа по карточкам с цепочками превращений по вариантам
- I – в
- Р2О5 → Н3РО4 → Na3PO4 → Ca3(PO4)2 → H3PO4 → Zn3(PO4)2
- II – в
- P → Ca3P2 → PH3 → Р2О5 → Na3PO4 → Ag3PO4
- III — в
- Ca3(PO4)2 → P → PCl5 → Н3РО4 → K3PO4 → Fe3(PO4)2
- Решение:
- I – в
- 1) P2O5 + 3H2O ® 2H3PO4
- 2) H3PO4 + 3NaOH → Na3PO4 + 3H2O
- 3) 2Na3PO4 + 3CaCI2 → Ca3(PO4)2 + 6NaCl
- 4) Ca3(PO4)2 + 3H2SO4 ® 3CaSO4 + 2H3PO4
- 5) 2H3PO4 + 3ZnCI2 → Zn3(PO4)2 + 6HCl
- II – в
- 1) 2Р + 3Са → Са3Р2
- 2) Са3Р2 + 6НCI → 3CaCI2 + 2PH3
- 3) 2PH3 + 4O2 → P2O5 + 3H2O
- 4) P2O5 +6NaOH → 2Na3PO4 + 3H2O
- 5) Na3PO4 + 3AgNO3 → Ag3PO4 ↓ + 3NaNO3
- III – в
- 1) Ca3(PO4)2 + 3SiO2 + 5C → 2P + 3CaSiO3 + 5CO
- 2) 2P + 5CI2 → 2PCI5
- 3) PCI5 + 4H2O → H3PO4 + 5HCI
- 4) H3PO4 + 3KOH → K3PO4 + 3H2O
- 5) 2K3PO4 + 3FeCI2 → Fe3(PO4)2 + 6KCI
- V.Подведение итогов урока
Выставление оценок за урок. Сообщение домашнего задания.
Соли фосфорной кислоты H3PO4: фосфаты, гидрофосфаты, дигидрофосфаты
Фосфорная кислота H3PO4 диссоциирует в три ступени:
- H3PO4 ↔ H++H2PO4- (Kдис=7,5·10-3)
- H2PO4- ↔ H++HPO42- (Kдис=6,2·10-8)
- HPO42- ↔ H++PO43-(Kдис=5,0·10-13)
H3PO4 образует три ряда солей:
- средние соли — фосфаты:H3PO4+3NaOH = Na3PO4+3H2O
- кислые соли: гидрофосфаты:H3PO4+2NaOH = Na2HPO4+2H2O
- кислые соли: дигидрофосфаты:H3PO4+NaOH = NaH2PO4+H2O
Как видно из реакций, приведенных выше, та или иная соль получается в зависимости от соотношения молярных масс реагирующих кислот и щелочей.
Средние соли фосфорной кислоты (фосфаты) нерастворимы в воде, за исключением аммония и фосфатов щелочных металлов. Кислые соли, наоборот, хорошо растворяются в воде, лучше всего — дигидрофосфаты.
Отличительной особенностью солей фосфорной кислоты является принципиально разный характер среды, образующейся в водных растворах средних и кислых солей в результате их гидролиза.
- Na3PO4: сильнощелочная среда (pH=12,1)
- Na2HPO4: слабощелочная среда (pH=8,9)
- NaH2PO4: слабокислая среда (pH=6,4)
Гидролиз фосфата натрия Na3PO4
Основная ступень гидролиза фосфата натрия выражается следующей реакцией:
Na3PO43-+H2O ↔ Na2HPO42-+NaOH-
Образующиеся ионы HPO42- очень слабо диссоциируют (см. выше диссоциацию фосфорной кислоты п.3), практически не подкисляя раствор, в таких условиях кислотность раствора определяется только гидроксид-ионами OH-, по этой причине водные растворы средних фосфатов имеют сильно щелочную среду.
Гидролиз гидрофосфата натрия Na2HPO4
Основная ступень гидролиза гидрофосфата натрия выражается следующей реакцией:
Na2HPO42-+H2O ↔ NaH2PO4-+NaOH-
Образующиеся ионы H2PO42- диссоциируют достаточно хорошо (см. выше диссоциацию фосфорной кислоты п.2), нейтрализуя значительную часть гидроксид-ионов OH-, по этой причине водные растворы гидрофосфатов имеют слабощелочную среду.
Гидролиз дигидрофосфата натрия NaH2PO4
В растворах дигидрофосфатов наряду с гидролизом идет процесс диссоциации дигидрофосфат-ионов:
NaH2PO4-+H2O ↔ H3PO4+NaOH-
H2PO4- ↔ H++HPO42-
Примечательно, что второй процесс превалирует над первым, по этой причине, все гидроксид-ионы OH-, являющиеся продуктом гидролиза, полностью нейтрализуются продуктами диссоциации — катионами водорода H+, которых присутствует в растворе в избытке, что и объясняет слабокислый характер среды растворов дигидрофосфатов.
Применение фосфатов
Соли фосфорной кислоты находят широчайшее применение в современной стоматологии и ортопедии, в бытовой химии:
Апатит Ca5(OH)(PO4)3 — важнейший компонент зубов и костей. Зубной кариес является результатом химической реакции фосфата с кислой средой в ротовой полости (кислоты содержатся в пище, а также образуются в результате жизнедеятельности микроорганизмов, находящихся во рту).
- Фтор, входящий в состав зубной пасты, способствует образованию на зубах тонкого слоя фторапатита, более устойчивого к негативному действию кислот:
Ca5(OH)(PO4)3+F → Ca5F(PO4)3+OH- - Современные пломбировочные материалы, применяющиеся в стоматологии, содержат труднорастворимые фосфаты алюминия и цинка (AlPO4, Zn3(PO4)2), которые являются очень устойчивыми к действию кислот.
- В последнее время соли фосфорной кислоты стали использоваться в ортопедии для восстановления сломанных костей — специальная паста, в состав которой входят дигидрофосфат кальция, фосфат натрия, фосфорит вводится в место перелома кости, формируя в течение нескольких минут сломанный участок — по мере сращения кости искусственная кость замещается естественной костной тканью.
- Натриевая соль трифосфорной кислоты нашла применение в моющих средствах, которые используются для смягчения жесткой воды — ионы магния и кальция связываются трифосфорной кислотой, и не взаимодействуют с анионами мыла.
Фосфат натрия: описание, реакции, вред, применение
Фосфат натрия (Е399) широко используется во многих промышленных сферах, как влагоудерживатель, кислотный регулятор, эмульгатор, закрепитель структуры.
Формула вещества изменяется, в зависимости от используемых компонентов и реакций. Отсюда изменена водность, название и тип (замещаемой или незамещаемый).
Рассмотрим: что такое фосфат натрия, формулы, способы получения, свойства, где применяется, как влияет на здоровье.
Что такое фосфат натрия
Фосфат натрия – это синтетическое кристаллизованное вещество белогопрозрачного оттенка, являющееся средней солью щелочного гидроксида натрия и ортофосфорной кислоты (пищевая добавка Е399).
Дополнительные названия:
- ортофосфат натрия;
- натрий фосфорнокислый;
- натриевый ортофосфат;
- тринатрийфосфат;
- триполифосфат натрия;
- пищевая добавка Е399.
Основная сфера использования ортофосфат натрия – продуктовая, фармацевтическая, в качестве противослеживающегося вещества, эмульгатора, щелочного регулятора.
Виды тринатрийфосфата
Фосфат натрия бывает замещенным (зам.)не замещенным, 1-12-ти водным (вод.), образованным под влиянием различных компонентов и факторов
Na3PO4
- Na3PO4 – натриевый 3-зам. ортофосфат, ортофосфатный Na;
- Na3PO4 * 12H2O – 12-ти вод. фосфорнокислый 3-зам. Na, додекагидрат фосфат Na;
- Na3PO4 * H2O – 1-но вод. фосфорнокислый 3-зам. Na, фосфатный моногидрат Na;
- Na3PO4 * 0,5H2O – 0,5-вод. фосфорнокислый 3-зам. Na, полугидрат фосфата натрия.
NaH2PO4
- NaH2PO4 * 2H2O – 2-х вод. 1-но зам. фосфорнокислый Na, натриевый дигидратдигидрофосфат;
- NaH2PO4 * H2O – 1-но водная 1-но замещенная натриевая фосфорная кислота, моногидратдигидрофосфат Na;
- NaH2PO4 – 1-но зам. натриевая кислота, безводный дигидрофосфат Na.
Na2HPO4
- Na3PO4 * 12H2O – 12-ти вод. 2-х зам. натриевая фосфорная кислота, додекагидрат гидрофосфат Na;
- Na2HPO4 – 2-х зам. фосфорнокислая кислота Na, безводная форма гидрофосфата Na;
- Na3PO4 * 7H2O – 7-ми вод., 2-х зам. фосфорнокислый Na, гептагидрат, натриевый гидрофосфат;
- Na3PO4 * 2H2O – 2-х вод., 2-х зам. натриевая фосфорная кислота, дигидрат гидрофосфат Na.
Вещества оказывают полезное воздействие на организм человека при отсутствии противопоказаний к применению.
Формула и свойства фосфата натрия
Формула фосфата натрия:
Na3PO4
- Агрегатное состояние: твердое гранулированное, кристаллизованное.
- Запах: отсутствует.
- Вид: гранулы, кристаллы белогопрозрачного оттенка, измельченный порошок.
- Температура плавления: 1340°С.
- Масса (гмоль): 163,941.
- Энтропия Дж/(моль•К): 224, 7.
- Энергия кДж/моль: 1819.
- Энтальпия кДж/моль: 1922,8.
- Плотность: 2,536 г/см3.
- Растворимость (на 100 гмл): 0°С – 5, при 25°С – 14.
- Гигроскопичность: высокая.
- Способность к гидролизу: создает щелочную среду.
Структурная формула фосфата натрия
Химические реакции, свойства
Натриевый гидроксид (NaOH) + кислота ортофосфорная (H3PO4) взаимодействуют, приводя к реакции, образовывающей фосфат натрия (Na3PO4). Растворение в Н2О активирует анионный гидролиз 3 ступени.
1-я ступень:
- Na3PO4 ↔ 3Na+ + PO43-;
- 3Na+ + PO43- + HOH ↔ HPO42- + 3Na+ + OH—;
- Na3PO4 + HOH ↔ Na2HPO4 + NaOH.
2-я:
- Na2HPO4 ↔ 2Na+ + H2PO4—;
- 2Na+ + H2PO4— + HOH ↔ NaHPO4 + 2Na+ + OH—;
- Na2HPO4 + HOH ↔ NaHPO4 + NaOH.
3-я:
- NaHPO4 ↔ Na+ + PO43-;
- Na+ + PO43- + HOH ↔ H3PO4 + Na+ + OH—;
- NaHPO4 + HOH ↔ H3PO4 + NaOH.
Другие уравнения:
- анионный гидролиз тринатрийфосфата с образованием щелочной реакции в Н2О: Na3PО4 + H2O = Na2HPО4 + NaОH;
- образование кислых солей при контакте с кислотами: Na3PО4 + H2SO4 = NaH2PО4 + Na2SO4 и Na3PО4 + HСl = Na2HPО4 + NaCl;
- обменная реакция, формирующая фосфаты не растворимого типа:2Na3PО4 + 3CaCl2 = 6NaCl + 2Ca3(PО4)2↓; Na3PО4 + AlCl3 = 3NaCl + AlPО4↓; Na3PО4 + 3AgNO3 = 6NaCl + Ag3PО4↓
Качественная реакция:
Na3PО4 + 3AgNO3 = 6NaCl + Ag3PО4↓
При добавлении AgNO3 (серебряного нитрата) осаждается желтый серебряный фосфат (Ag3PО4). Na определяется, путем пожелтения огня.
Получение и производство фосфата натрия
Синтезирование ортофосфата натрия выполняют лабораторно (небольшими партиями) и промышленно (крупными).
Лабораторный способ
- Незначительное количество ортофосфата натрия добывают, путем взаимодействия натриевого карбоната/гидроксида с кислотой (ортофосфорной):
- H3PO4 + 3NaOH = Na3PO4 + 3H2O
- 2H3PO4 + 3Na2CO3 =2Na3PO4 + 3H2O + 3CO2↑
Промышленный
Крупные партии гранулированного тринатрийфосфата добывают в 2 этапа:
- Н3РО4 + Na2CО3 = Na2HPО4 + СО2↑+ Н2О
- Na2HPО4 + NaОH = Na3PО4 + H2О
Растворы охлаждают до 30°С. Вещество преобразуется в Na3PO4 * 12H2O (плавящийся при 70°С), кристаллизуется. Для получения безводной формы, его в течение 120 минут прокалывают при 120°С, затем еще полчаса при 800°С.
Сферы применения фосфата натрия
Медицинская и пищевая отрасли – самые востребованные для применения фосфата натрия. Его также добавляют в бытовую химию, стройматериалы, благодаря свойствам. Рассмотрим подробно:
Фармацевтика
Добавка Е399 в медицинских препаратах используется, как основное вещество для приготовления антацидных и противозапорных медикаментов. В качестве дополнительного – для нормализации щелочного, кислотного, минерального уровня.
Слабительные
Принцип действия основывается на удержании влаги в 12-ти перстной кишке. За счет этого улучшается перистальтика и стимулируется выведение фекалий. Лекарства выпускают, в виде жидкости для разовой клизмы, например: «Энема Клин», «Fleet Enema». Медикаменты изготовлены из одинаковых компонентов в разных пропорциях.
Кишечные
Ортофосфат натрия выпускаются в форме таблеток и растворов для экстренной кишечной чистки накануне хирургической терапии, толстокишечнойаноректальной манометрии, рентгеноскопии, колоноскопии. Например: «Флит фосфо-сода» распространенный в России и зарубежные: «OsmoPrep», «Visicol», «Phosphate Laxative».
Антацидные
Препараты, направленные на нормализацию кишечной флоры. Назначаются при неправильной выработке желудочного сока. Избавляют от изжоги, язвы, гастрита, гастроэзофагеальной рефлюксной болезни, желудочных болей.
Но, специалисты стараются минимизировать использование препаратов данной группы. Воздействуя на пищеварительный тракт, вещество может нанести больше вреда, чем пользы т.к.
передозировка кислотой способна обжечь желудок, кишечник приводя к обострению или формированию заболеваний. Употребляйте только по назначению врача!
Внутривенные растворы
На территории РФ внутривенные растворы с фосфатом натрия местного производства не зарегистрированы. Существуют только зарубежные медикаменты, используемые для нормализации кислотно-щелочного, минерального кровяного баланса. Препараты запрещаются для введения беременнымкормящим грудью женщинам, поскольку транспортируются кровеносной системой, проникают в молоко и вредят плодуребенку.
Пищевая индустрия
В продуктовой индустрии ортофосфат натрия классифицируется, как пищевая добавка Е339, «ГОСТ Р 52823-2007». Условия распространяются только на 1-но, 2-х, 3-х замещаемые монофосфаты.
Используются, как: стабилизатор, влагоудерживатель, кислотный регулятор, текстуратор, комплексообразователь, эмульгатор при изготовлении спиртных напитков, сладких/хлебобулочных, рыбных, мясных, молочных изделий, полуфабрикатов, консерв.
Изготовление бытовой химии
Фосфат натрия широко используется для изготовления бытовых чистящих средств. Хорошо справляется с жирами, налетом, растворяя их кислотным влиянием. Работая с концентратами защищайте руки резиновыми перчатками. Регулярный контакт со средствами вызывает сухость кожи, раздражение. На чувствительной дерме, кислота может оставить ожоги.
Стекольное производство
При помощи фосфата натрия изготавливают оптическое стекло.
Строительство
Технические сорта ортофосфата натрия снижают пористость бетона, улучшая его устойчивость к влаге, прочность.
Смягчение воды
Ортофосфат натрия применяется для смягчения воды. Эффект достигается, путем преобразования жестких солей в нерастворимые фосфаты.
Влияние на здоровье
Пищевая добавка Е399 считается безопасной. Разрешается, даже для изготовления детских молочныхбезмолочных смесей в России, Украине, во всех странах Евросоюза.
Польза
Фосфорные и натриевые соли легко расщепляются организмом, участвуют в растворении жиров и углеводов, помогая пище лучше усваиваться, образовывать необходимое количество энергии, нормализуют стул. Натриевые ионы улучшают минеральный и кислотно-щелочной баланс. При отсутствии передозировки не угрожают, а помогают организму в повседневной деятельности.
Вред
Навредить ортофосфат натрия может при передозировке и заболеваниях ЖКТ (на стадии обострения). Обычно данные состояния сопутствуют друг другу. Для стабилизации тринатривого фосфата в организме, употребляйте кальцийсодержащие продукты.
Они помогут избежать сердечно-сосудистых болезней, спровоцированных передозировкой. Также чрезмерное потребление грозит возникновением остеопороза, повреждением зубной эмали, замедлением роста костной ткани. Особенно опасно проявление у детей т.к.
тормозит физическое развитие.
В некоторых странах натриевый ортофосфат запрещен или ограничен, из-за загрязнения сточных вод, в результате производства бытовой химии.
В каких продуктах содержится фосфат натрия
Натриевый триполифосфат обладает эмульгирующими, разрыхляющими, стабилизирующими свойствами. Содержится в:
- ликероводочных товарах;,
- хлебобулочных изделиях, печенье;
- фабрично подготовленном мясе, рыбе;
- колбасных, копченых продуктах;
- консервах;
- сырах;
- супах, вермишели, пюре быстрого приготовления;
- густых соусах, заправках;
- концентрированном бульоне;
- сливках, промышленном молоке.
Съедобный Е399 может быть измельченным до порошкообразного состояния или гранулированным. Это дает возможность использовать его, в качестве разрыхлителя и соли-плавителя (для приготовления плавленых сырков).
Тип пищевой добавки
Фосфат натрия (пищевая добавка Е339) – разрыхлитель, влагоудерживатель, стабилизатор вкусацвета, эмульгатор, регулятор кислотности, текстурообразователь, усиливающий антиоксидантные свойства других веществ. Используется во многих промышленных сферах, особенно строительной, медицинской и пищевой. Пожаробезопасен, не взрывоопасен.
Класс опасности и токсичности
Фосфат натрия внесен в Регистр Росстандарта 03.02.2016 г. информационно-аналитическим центром «Безопасность веществ и материалов» ФГУП «ВНИИ СМТ». Присвоен 4 класс опасности (малотоксичная по степени воздействия на организм продукция), сигнальное слово: осторожно!
- фосфат натрия вреден при передозировке. Вызывает нарушения пищеварительного тракта, сердечные патологии (в исключительно редких случаях);
- пыль пищевой добавки Е399 раздражает слизистые органов зрения, дыхательных путей, дерму;
- выброс отходов в водосток загрязняет окружающую среду.
Предприятиям минимизировать утилизацию отходов в сточные воды, с целью экологической сохранности. Сотрудникам, контактирующим в тринатрийфосфатом работать в перчатках и респираторах для защиты органов зрения, дыхания, поверхности кожи от мелких частиц кислоты (пыли).
Первая помощь
При возникновении: першения в горле, головных болей, сухости в ротовой полости, кашле, общей слабости (в результате воздействия тринатрийфосфата) тщательно промыть пораженную область, пить много воды, обеспечить покой, принять активированный уголь. По необходимости обратиться за врачебной помощью. При отравлении пероральным путем рвоту не вызывать!
При попадании в глаза, режущих ощущениях, жжении: в течение 15 минут промывать широко раскрытые органы зрения под проточной водой. При контакте с носовой слизистой – тщательно промыть нос водой. С кожей – вымыть поверхность кожи с гигиеническим средством.
Обязательно обратиться к врачу при: рвоте, болях в зоне пищевода, расстройстве кишечника, красноте глаз!
Хранение и транспортировка
Хранить в хорошо вентилируемом сухом помещении при комнатной температуре, не превышающей 25°С, в упаковке производителя. Транспортировать сырье любым удобным способом в упаковке производителя (синтетических или бумажных мешках с внутренним вкладышем, защищающим от влаги).
Где купить, сколько стоит фосфат натрия, расфасовка
Приобрести фосфат натрия можно у завода производителя или дистрибьютора, через интернет, при личной встрече в необходимом количестве. Мелкие дилеры обеспечат доставку мешков Е399, объемом 1, 5, 10, 25 кг удобным и выгодным Вам способом.
Крупным предприятиям можно там же заказать нужный объем сырья и забрать покупку, объемом от 100 кг можно самостоятельно, воспользоваться доставкой от завода, курьером, почтовой службой.
Стоимость технических сортов натриевого фосфата колеблется в пределах 40-80 рубкг. Цена пищевого, используемого в фармацевтике – 200-400 руб, зависимо от ступеней замещения, объема заказа. В качестве бонуса постоянным крупным клиентам, производитель предоставляет сырье по заниженной цене.
Отзывы
Ангелина 38 лет.
Чтобы сэкономить на лекарствах (у меня частые запоры) купила пищевой фосфат натрия. При возникновении проблемы принимаю дозу на кончике ножа. Эффект, практически не отличается от таблеток. Улучшает стул, не влияет на общее самочувствие. Единственный недостаток – нельзя принимать часто, иначе возникает расстройство кишечника.
Владимир 65 лет.
Для собственного хлебного цеха приобрел 100 кг фосфата натрия. Хорошо разрыхляет хлеб, булочки, улучшает вкус, консистенцию.
Диана 28 лет.
Часто мучает изжога. Принимала фосфат натрия вместо таблеток, как «шипучку». В целом довольна. Жаль, что нельзя принимать при беременности.
Заключение
Фосфат натрия не взрывается, не самовоспламеняется. В целом безопасен для человека, но загрязняет окружающую среду, поэтому его использование ограничено. Можно применять для приготовления пищи (в промышленных) масштабах, употреблять медикаменты на основе фосфата натрия, но с осторожностью.
Регулярное потребление влечет передозировку, влияющую на функциональность пищеварительного тракта, сердечную деятельность. Работая на производстве защищайте слизистые глаз, органов дыхания, кожу. То же касается применения концентрированных чистящих средств.
Кислота легко поражает дерму, дыхательные пути, вызывая симптомы от дискомфорта до раздражения, требующего врачебной помощи.
- Нитрит натрия (Е250): что это, свойства, вредно или нет, использование
- Карбонат натрия (кальцинированная сода): свойства, применение, реакции
- Сульфит натрия: описание, вред и польза, формула, получение, реакции
- Альгинат натрия (Е401): свойства, инструкция по применению






