- Общая характеристика
- Природные соединения
- Получение
- Химические свойства
- Оксиды щелочноземельных металлов
- Получение
- Химические свойства
- Гидроксиды щелочноземельных металлов
- Получение
- Химические свойства
- Жесткость воды
- Химия 11 класс: Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
- 2. Щелочные металлы
- 3. Щелочноземельные металлы
- 4. Алюминий
- 5. Смеси, регенерирующие кислород
- Подведение итога
- Щелочные и щелочноземельные металлы
- 11 класс. Химия. Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
- Разница между щелочными металлами и щелочноземельными металлами
- Основное отличие — щелочные металлы от щелочноземельных металлов
- Какие щелочные металлы
- Природа металла
- Точки плавления
- Природа гидроксида металла
- Разложение карбонатов
- Нагрев нитратов
- Стабильность гидроксидов при нагревании
- Природа бикарбонатов при комнатной температуре
- Образование пероксидов при нагревании
- Образование нитридов
- Образование карбидов
- Примеры
- Резюме
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
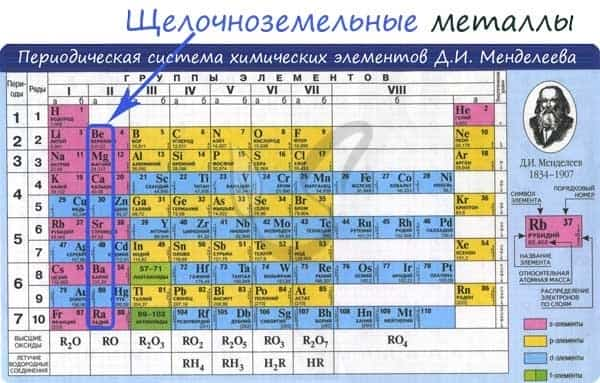
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2:
- Be — 2s2
- Mg — 3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be — BeO*Al2O3*6SiO2 — берилл
- Mg — MgCO3 — магнезит, MgO*Al2O3 — шпинель, 2MgO*SiO2 — оливин
- Ca — CaCO3 — мел, мрамор, известняк, кальцит, CaSO4*2H2O — гипс, CaF2 — флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
- MgCl2 → (t) Mg + Cl2 (электролиз расплава)
- CaO + Al → Al2O3 + Ca (алюминотермия — способ получения металлов путем восстановления их оксидов алюминием)
- MgBr2 + Ca → CaBr2 + Mg

Химические свойства
- Реакции с водой
- Реакции с кислотами
- Реакции с неметаллами
- Mg + O2 → MgO (оксид магния)
- Ca + I2 → CaI2 (йодид кальция)
- При нагревании реагируют с серой, азотом, водородом и углеродом.
- Mg + S → (t) MgS (сульфид магния)
- Ca + N2 → (t) Ca3N2 (нитрид кальция)
- Ca + H2 → (t) CaH2 (гидрид кальция)
- Ba + C → (t) BaC2 (карбид бария)
- С оксидами других металлов
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании. Ca + H2O → Ca(OH)2 + H2↑ 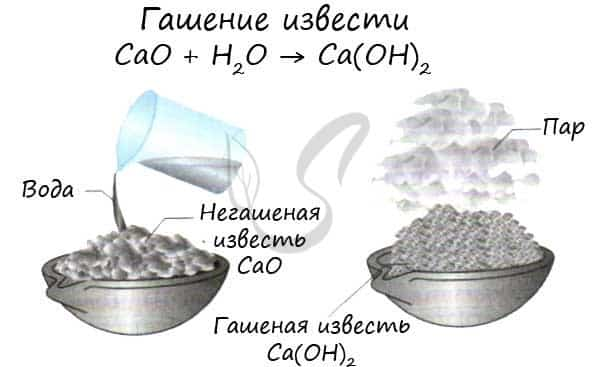
Щелочноземельные металлы — активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот: Ba + HCl → BaCl2 + H2
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
- Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
- MgCO3 → (t) MgO + CO2
- Ca(NO3)2 → (t < 560°C) Ca(NO2)2 + O2
- Ca(NO3)2 → (t > 560°C) CaO + O2 + NO2
- Рекомендую взять на вооружение общую схему разложения нитратов:
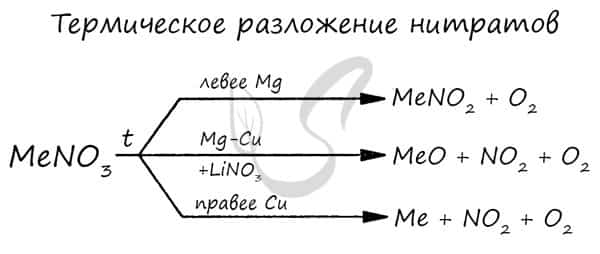
Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO — амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
- BaO + HCl → BaCl2 + H2O
- CaO + H2SO4 → CaSO4 + H2O
- MgO + SO3 → MgSO4
- CaO + CO2 → CaCO3
- CaO + SiO2 → CaSiO3
- Реакция с водой
- В нее вступают все, кроме оксида бериллия.
- CaO + H2O → Ca(OH)2
- MgO + H2O → Mg(OH)2
- Амфотерный оксид бериллия
- BeO + HCl → BeCl2 + H2O
- BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
- Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
- BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
- BeO + Na2O → Na2BeO2
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия — амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
CaO + H2O → Ca(OH)2
Химические свойства
- Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
- Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
- Ca(OH)2 + 2CO2 → Ca(HCO3)2
- Ca(HCO3)2 + Ca(OH)2 → CaCO3 + H2O + CO2
- Ca(OH)2 + CO2 → CaCO3↓ + H2O

- Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
- Ba(OH)2 + Na2SO4 → BaSO4↓ + NaOH
- Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
- Be(OH)2 + HCl → BeCl2 + H2O
- Be(OH)2 + NaOH → Na2[Be(OH)4]
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
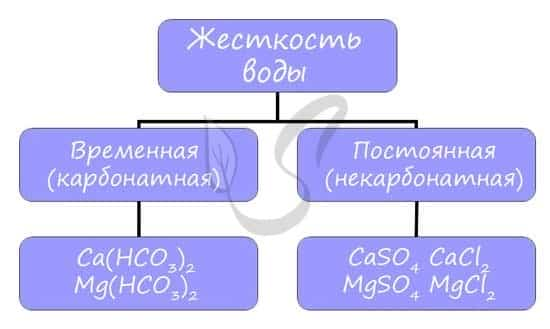
- Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить — каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках — CaCO3 — бесспорное доказательство устранения жесткости:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
- Также временную жесткость можно устранить, добавив Na2CO3 в воду:
- Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
- С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
- CaCl2 + Na2CO3 → CaCO3↓ + NaCl
- MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Химия 11 класс: Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
Главную подгруппу I группы Периодической системы Д.И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И. Менделеева. Это магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочные и щелочноземельные металлы как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов.
Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная.
Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Электронные конфигурации валентного слоя щелочных металлов – ns1 , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов – ns2 (s-элементы).
У алюминия валентные электроны …3s23р1 (p-элемент). Эти элементы образуют соединения с ионным типом связи.
При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях
Ионы металлов легко определить по изменению окраски пламени. Рис. 1.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.
Рис. 1 Определение ионов металлов по изменению окраски пламени
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
2. Щелочные металлы
Свойства металлов
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см3.
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
- 2Na + Cl2→ 2NaCl
- 2Na + S Na2S
- 2Na + H2 2NaH
- 3Na + P Na3P
- Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
- 6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
- Li3N + 3H2O → 3LiOH + NH3↑
- 2. Взаимодействие с кислородом
- Только с литием сразу образуется оксид лития.
- 4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
К + О2 = КО2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
- 2Li + 2H2O → 2LiOH + H2↑
- 4. Взаимодействие с кислотами – сильными окислителями
- 8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
- 8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
- Получение щелочных металлов
- Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности. См. Табл. 1.
| РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ | |
| NaOH | Едкий натр (каустическая сода) |
| NaCl | Поваренная соль |
| NaNO3 | Чилийская селитра |
| Na2SO4∙10H2O | Глауберова соль |
| Na2CO3∙10H2O | Сода кристаллическая |
| KOH | Едкое кали |
| KCl | Хлорид калия (сильвин) |
| KNO3 | Индийская селитра |
| K2CO3 | Поташ |
3. Щелочноземельные металлы
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
- Химические свойства щелочноземельных металлов
- 1. Взаимодействие с неметаллами
- Сa + Cl2→ 2СaCl2
- Сa + S СaS
- Сa + H2 СaH2
- 3Сa + 2P Сa3 P2-
- 2. Взаимодействие с кислородом
- 2Сa + O2 → 2CaO
- 3. Взаимодействие с водой
- Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
- 4. Взаимодействие с кислотами – сильными окислителями
- 4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4H2O
- 4Ca + 10H2SO4 (конц) → 4CaSO4 + H2S↑ + 5H2O
- Получение щелочноземельных металлов
- Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
- CaCl2 Сa + Cl2
- Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
- 3BaO +2Al 3Ba + Al2O3
- РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Самыми известными соединениями щелочноземельным металлов являются: CaО – негашеная известь. Ca(OH)2 – гашеная известь, или известковая вода.
При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция СаСО3.
Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
- Рис. 2 Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий
- СaO + H2O → Ca(OH)2
- Ca(OH)2 + CO2↑ → CaCO3↓+ H2O
- CaCO3↓+ H2O + CO2 → Ca(HCO3)2
Гипс – это CaSO4∙2H2O, алебастр – CaSO4∙0,5H2O. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. Рис. 2.
Карбонат кальция CaCO3 образует множество различных минералов. Рис. 3.

- Рис. 3 Карбонат кальция CaCO3 образует множество различных минералов
- Фосфат кальция Ca3(PO4)2 – фосфорит, фосфорная мука используется как минеральное удобрение.
- Чистый безводный хлорид кальция CaCl2 – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
- Карбид кальция – CaC2. Его можно получить так:
СaO + 2C →CaC2 +CO. Одно из его применений – это получение ацетилена.
CaC2 + 2H2O →Ca(OH)2 + C2H2↑
Сульфат бария BaSO4 – барит. Рис. 4. Используется как эталон белого в некоторых исследованиях.
Рис. 4 Сульфат бария BaSO4 – барит
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Такую жесткость воды можно устранить кипячением.
Ca(HCO3)2 CaCO3↓ + СО2↑ + Н2О
Постоянная жесткость воды обусловлена наличием катионов Ca2+., Mg2+ и анионов H2PO4- ,Cl-, NO3- и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
4. Алюминий
Алюминий и его соединения
Алюминий занимает 4-е место по распространенности в земной коре, уступая кремнию, кислороду и водороду. В природе он присутствует в виде алюмосиликатов, глин и бокситов. Рис. 5.
Рис. 5 Алюминий
По своим химическим свойствам он гораздо менее активен, чем щелочные и щелочноземельные металлы. Во многом это связано с образованием не его поверхности тончайшей пленки оксида, которая препятствует или замедляет многие химические реакции.
- Химические свойства алюминия
- 1. Реакция с галогенами
- 2Al + 3I2 2AlI3
- 2. Сгорает при нагревании с выделением большого количества теплоты
4Al + 3O2 2Al2O3 + Q . При этом может развиваться температура до 35000С.
- 3. Реакция с неметаллами
- 2Al + 3S Al2S3
- 2Al + N2 2AlN
- 4Al + 3С Al4С3
- 4. Взаимодействует с водой
- 2Al + 6H2O → 2Al(OH)3 +3H2↑ Если снять амальгамированием или механически пленку.
- Амальгамирование – это нанесение на поверхность небольшого количества ртути.
- 5. Алюминий активно восстанавливает металлы из их оксидов (алюмотермия)
- Cr2O3 + 2Al → Al2O3 + 2Cr; этот способ используется при получении многих металлов: Mn, Cr, V, W, Ba, Sr и др.
- 6. Взаимодействует с кислотами-неокислителями
- 2Al + 6HCl →2AlCl3 + 3H2↑
- Алюминий не реагирует с концентрированными азотной и серной кислотами из-за пассивации. С разбавленной серной или азотной кислотой взаимодействует
- 8Al + 30HNO3 →8Al(NO3)3 + 3NH4NO3 + 9H2O
7. Взаимодействие со щелочами. Al, Al2O3, Al(OH)3 взаимодействуют со щелочами:
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ (амфотерные свойства).
- Al2O3 + 2NaOH = 2NaAlO2 + H2O
- 8. Реагирует с растворами солей
- 2Al + 3CuCl2 → 2AlCl3 + 3Cu
- Применение алюминия

Рис. 6 Алюминий широко применяется в быту и технике
Алюминий широко применяется в быту и технике, так как он довольно легок, коррозионно-устойчив и нетоксичен. См. Рис. 6. Часто используются сплавы алюминия.
Основной – это дуралюмин (дюралюминий, дюраль). Это сплав алюминия, содержащий медь (массовая доля – 1,4-13%) и небольшие количества магния, марганца и других компонентов.
Используется как конструкционный материал в авиа- и машиностроении.
5. Смеси, регенерирующие кислород
- Оксиды и пероксиды способны реагировать с углекислым газом, образуя карбонат и кислород.
- Na2O2 + CO2 → Na2CO3 + 1/2O2
- KO2 + CO2 → K2CO3 + 3/2O2
- Если сложить эти 2 уравнения реакции, то получится смесь, выделяющая и 2 моль углекислого газа, и 2 моль кислорода.
Na2O2 + 2KO2 + 2 CO2 → Na2CO3 + K2CO3 + 2О2. Суммарный объём газа в левой и правой части уравнения будет одинаков. Постоянство объёма газа очень важно, так как такие смеси применяются для удаления CO2 и превращения его в нужный для дыхания кислород, например, в подводных лодках или космических станциях.
Но там не должно происходить перепада давления.
Подведение итога
Была раскрыта тема «Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий».
Вы узнали общие свойства и закономерности щелочных и щелочноземельных элементов, изучили по отдельности химические свойства щелочных и щелочноземельных металлов и их соединения. С помощью химических уравнений было рассмотрено такое понятие, как жесткость воды.
Познакомились с алюминием, его свойствами и сплавами. Вы узнали, что такое смеси, регенерирующие кислород, озониды, пероксид бария и получение кислорода.
Щелочные и щелочноземельные металлы


Средняя оценка: 4.6
Всего получено оценок: 1355.
Средняя оценка: 4.6
Всего получено оценок: 1355.
Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr);
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
Рис. 1. Щелочные и щелочноземельные металлы в таблице Менделеева.
Электронная конфигурация щелочных металлов – ns1, щелочноземельных металлов – ns2. Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II.
За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях.
Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.
Щелочные металлы имеют серебристо-белый цвет с металлическим блеском. Цезий – серебристо-жёлтый металл. Это наиболее активные и мягкие металлы. Натрий, калий, рубидий, цезий режутся ножом. По мягкости напоминают воск.
 Рис. 2. Разрезание натрия ножом.
Рис. 2. Разрезание натрия ножом.
Щелочноземельные металлы имеют серый цвет. По сравнению со щелочными металлами являются более твёрдыми, плотными веществами. Ножом можно разрезать только стронций. Самый плотный металл – радий (5,5 г/см3).
Наиболее лёгкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Щелочные и щелочноземельные металлы реагируют с простыми веществами и сложными соединениями, образуя соли, оксиды, щёлочи. Основные свойства активных металлов описаны в таблице.
| Взаимодействие | Щелочные металлы | Щелочноземельные металлы |
| С кислородом |
Самовоспламеняются на воздухе. Образуют надпероксиды (RO2), кроме лития и натрия. Литий образует оксид при нагревании выше 200°C. Натрий образует смесь пероксида и оксида.
|
На воздухе быстро образуются защитные оксидные плёнки. При нагревании до 500°С самовоспламеняются.
|
| С неметаллами |
|
|
| С галогенами |
Бурно реагируют с образованием галогенидов: 2Na + Cl2→ 2NaCl |
|
| С водой |
Образуются щёлочи. Чем ниже металл расположен в группе, тем более активно протекает реакция. Литий взаимодействует спокойно, натрий горит жёлтым пламенем, калий – со вспышкой, цезий и рубидий взрываются.
|
|
| С кислотами |
Со слабыми и разбавленными кислотами реагируют с взрывом. С органическими кислотами образуют соли.
|
|
| Со щелочами | – |
Из всех металлов реагирует только бериллий: Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 |
| С оксидами | – |
Вступают в реакцию все металлы, кроме бериллия. Замещают менее активные металлы: 2Mg + ZrO2 → Zr + 2MgO |
 Рис. 3. Реакция калия с водой.
Рис. 3. Реакция калия с водой.
Щелочные и щелочноземельные металлы можно обнаружить с помощью качественной реакции. При горении металлы окрашиваются в определённый цвет. Например, натрий горит жёлтым пламенем, калий – фиолетовым, барий – светло-зелёным, кальций – тёмно-оранжевым.
Щелочные и щелочноземельные – наиболее активные металлы. Это мягкие простые вещества серого или серебристого цвета с небольшой плотностью. Литий, натрий, калий плавают на поверхности воды. Щелочноземельные металлы более твёрдые и плотные, чем щелочные. На воздухе быстро окисляются.
Щелочные металлы образуют надпероксиды и пероксиды, оксид образует только литий. Бурно реагируют с водой при комнатной температуре. С неметаллами реагируют при нагревании. Щелочноземельные металлы вступают в реакцию с оксидами, вытесняя менее активные металлы.
Со щелочами реагирует только бериллий .
Чтобы попасть сюда — пройдите тест.
- Светлана-Анатольевна Мамахай
Средняя оценка: 4.6
Всего получено оценок: 1355.
А какая ваша оценка?
Гость завершил
Тест «Медный всадник»с результатом 10/11
Гость завершил
Тест «Тихое утро»с результатом 9/10
Гость завершил
Тест «Биография Есенина»с результатом 2/14
Гость завершил
Тест «Хамелеон»с результатом 5/10
Гость завершил
Тест «Тарас Бульба»с результатом 11/16
Гость завершил
Тест «Пересолил»с результатом 8/10
Не подошло? Напиши в х, чего не хватает!
11 класс. Химия. Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
1. Общие свойства металлов
Главную подгруппу I группы Периодической системы Д.И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И. Менделеева. Это магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочные и щелочноземельные металлы как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов.
Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная.
Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Электронные конфигурации валентного слоя щелочных металлов – ns1 , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов – ns2 (s-элементы).
У алюминия валентные электроны …3s23р1 (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях
Ионы металлов легко определить по изменению окраски пламени. Рис. 1.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.
Рис. 1
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
2. Щелочные металлы
Свойства металлов
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см3.
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
2Na + Cl2→ 2NaCl
- Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
- 6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
- Li3N + 3H2O → 3LiOH + NH3↑
- 2. Взаимодействие с кислородом
- Только с литием сразу образуется оксид лития.
- 4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
К + О2 = КО2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
- 2Li + 2H2O → 2LiOH + H2↑
- 4. Взаимодействие с кислотами – сильными окислителями
- 8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
- 8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
- Получение щелочных металлов
- Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности. См. Табл. 1.
| РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ | |
| NaOH | Едкий натр (каустическая сода) |
| NaCl | Поваренная соль |
| NaNO3 | Чилийская селитра |
| Na2SO4∙10H2O | Глауберова соль |
| Na2CO3∙10H2O | Сода кристаллическая |
| KOH | Едкое кали |
| KCl | Хлорид калия (сильвин) |
| KNO3 | Индийская селитра |
| K2CO3 | Поташ |
3. Щелочноземельные металлы
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
- Химические свойства щелочноземельных металлов.
- 1. Взаимодействие с неметаллами
- Сa + Cl2→ 2СaCl2
- 2. Взаимодействие с кислородом
- 2Сa + O2 → 2CaO
- 3. Взаимодействие с водой
- Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
- 4. Взаимодействие с кислотами – сильными окислителями
- 4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4H2O
- 4Ca + 10H2SO4 (конц) → 4CaSO4 + H2S↑ + 5H2O
- Получение щелочноземельных металлов
- Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
- CaCl2 Сa + Cl2
- Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Самыми известными соединениями щелочноземельным металлов являются: CaО – негашеная известь. Ca(OH)2 – гашеная известь, или известковая вода.
При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция СаСО3.
Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
- Рис. 2
- СaO + H2O → Ca(OH)2
- Ca(OH)2 + CO2↑ → CaCO3↓+ H2O
- CaCO3↓+ H2O + CO2 → Ca(HCO3)2
Гипс – это CaSO4∙2H2O, алебастр – CaSO4∙0,5H2O. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. Рис. 2.
Карбонат кальция CaCO3 образует множество различных минералов. Рис. 3.
- Рис. 3
- Фосфат кальция Ca3(PO4)2 – фосфорит, фосфорная мука используется как минеральное удобрение.
- Чистый безводный хлорид кальция CaCl2 – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
- Карбид кальция – CaC2. Его можно получить так:
СaO + 2C →CaC2 +CO. Одно из его применений – это получение ацетилена.
CaC2 + 2H2O →Ca(OH)2 + C2H2↑
Сульфат бария BaSO4 – барит. Рис. 4. Используется как эталон белого в некоторых исследованиях.
- Рис. 4
- Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Такую жесткость воды можно устранить кипячением.
Ca(HCO3)2 CaCO3↓ + СО2↑ + Н2О
Постоянная жесткость воды обусловлена наличием катионов Ca2+., Mg2+ и анионов H2PO4- ,Cl-, NO3- и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
- CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
- 4. Алюминий
- Алюминий и его соединения
Алюминий занимает 4-е место по распространенности в земной коре, уступая кремнию, кислороду и водороду. В природе он присутствует в виде алюмосиликатов, глин и бокситов. Рис. 5.
Рис. 5
По своим химическим свойствам он гораздо менее активен, чем щелочные и щелочноземельные металлы. Во многом это связано с образованием не его поверхности тончайшей пленки оксида, которая препятствует или замедляет многие химические реакции.
- Химические свойства алюминия
- 1. Реакция с галогенами
- 2Al + 3I2 2AlI3
- 2. Сгорает при нагревании с выделением большого количества теплоты
4Al + 3O2 2Al2O3 + Q . При этом может развиваться температура до 35000С.
- 3. Реакция с неметаллами
- 2Al + 3S Al2S3
- 2Al + N2 2AlN
- 4Al + 3С Al4С3
- 4. Взаимодействует с водой
- 2Al + 6H2O → 2Al(OH)3 +3H2↑ Если снять амальгамированием или механически пленку.
- Амальгамирование – это нанесение на поверхность небольшого количества ртути.
- 5. Алюминий активно восстанавливает металлы из их оксидов (алюмотермия)
- Cr2O3 + 2Al → Al2O3 + 2Cr; этот способ используется при получении многих металлов: Mn, Cr, V, W, Ba, Sr и др.
- 6. Взаимодействует с кислотами-неокислителями
- 2Al + 6HCl →2AlCl3 + 3H2↑
- Алюминий не реагирует с концентрированными азотной и серной кислотами из-за пассивации. С разбавленной серной или азотной кислотой взаимодействует
- 8Al + 30HNO3 →8Al(NO3)3 + 3NH4NO3 + 9H2O
7. Взаимодействие со щелочами. Al, Al2O3, Al(OH)3 взаимодействуют со щелочами:
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ (амфотерные свойства).
- Al2O3 + 2NaOH = 2NaAlO2 + H2O
- 8. Реагирует с растворами солей
- 2Al + 3CuCl2 → 2AlCl3 + 3Cu
- Применение алюминия
- Рис. 6
Алюминий широко применяется в быту и технике, так как он довольно легок, коррозионно-устойчив и нетоксичен. См. Рис. 6. Часто используются сплавы алюминия.
Основной – это дуралюмин (дюралюминий, дюраль). Это сплав алюминия, содержащий медь (массовая доля – 1,4-13%) и небольшие количества магния, марганца и других компонентов.
Используется как конструкционный материал в авиа- и машиностроении.
- 5. Смеси, регенерирующие кислород
- Оксиды и пероксиды способны реагировать с углекислым газом, образуя карбонат и кислород.
- Na2O2 + CO2 → Na2CO3 + 1/2O2
- KO2 + CO2 → K2CO3 + 3/2O2
- Если сложить эти 2 уравнения реакции, то получится смесь, выделяющая и 2 моль углекислого газа, и 2 моль кислорода.
Na2O2 + 2KO2 + 2 CO2 → Na2CO3 + K2CO3 + 2О2. Суммарный объём газа в левой и правой части уравнения будет одинаков. Постоянство объёма газа очень важно, так как такие смеси применяются для удаления CO2 и превращения его в нужный для дыхания кислород, например, в подводных лодках или космических станциях. Но там не должно происходить перепада давления.
Подведение итога урока
На уроке была раскрыта тема «Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий».
Вы узнали общие свойства и закономерности щелочных и щелочноземельных элементов, изучили по отдельности химические свойства щелочных и щелочноземельных металлов и их соединения. С помощью химических уравнений было рассмотрено такое понятие, как жесткость воды.
Познакомились с алюминием, его свойствами и сплавами. Вы узнали, что такое смеси, регенерирующие кислород, озониды, пероксид бария и получение кислорода.
ИСТОЧНИКИ
источник видео — https://www.youtube.com/watch?v=VMT8vWlJOdM
https://www.youtube.com/watch?v=tvve_WN4DBk
источник презентации — http://ppt4web.ru/khimija/khimicheskie-svojjstva-metallov0.html
источник презентации — http://prezentacii.com/po_himii/1661-schelochnye-metally.html
источник презентации — http://prezentacii.com/po_himii/6431-schelochnozemelnye-metally.html
источник презентации — http://presentaci.ru/download/75082/
Разница между щелочными металлами и щелочноземельными металлами
Основное отличие — щелочные металлы от щелочноземельных металлов
Все элементы на земле можно разделить на металлы, неметаллы, металлоиды и инертные газы. Инертные газы — это элементы с нулевой реакционной способностью из-за наличия стабильного внешнего октета. Металлоиды — это элементы, которые обладают определенными свойствами как металлов, так и неметаллов.
Неметаллы — это элементы, которые не обладают какими-либо свойствами металлов. Металлы — это элементы, обладающие уникальным набором свойств, в том числе отличной электрической и теплопроводностью и блеском. Металлы размещаются на левой стороне и средней части таблицы Менделеева.
Все металлы в периодических таблицах делятся на три группы, а именно; щелочные металлы, щелочноземельные металлы и переходные металлы.
Основное различие между щелочными металлами и щелочноземельными металлами заключается в том, что щелочные металлы имеют один валентный электрон на самой внешней орбите в то время как щелочноземельные металлы имеют два валентных электрона на самой внешней орбите.
В этой статье рассматриваются,
1. Что такое щелочные металлы — определение, характеристики, свойства, примеры 2. Что такое щелочноземельные металлы? — определение, характеристики, свойства, примеры 3. В чем разница между щелочными металлами и щелочноземельными металлами
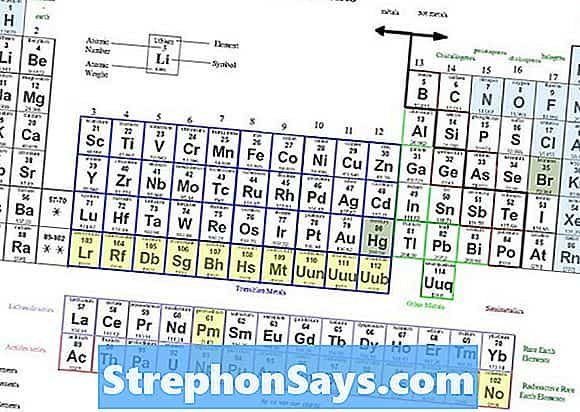
Какие щелочные металлы
Щелочные металлы — это элементы, которые имеют только один валентный электрон в своей внешней оболочке. Эти металлы помещаются в группу IA периодической таблицы. Эти металлы включают литий, натрий, калий, рубидий, цезий и франций.
Пожертвовав один электрон во внешней оболочке атому, принимающему электроны, эти металлы становятся положительно заряженными и получают электронную конфигурацию благородного газа. Все щелочные металлы являются ионными и показывают электровалентность.
Тенденция к донорству электронов возрастает вниз по группе, поскольку положительно заряженное ядро имеет меньше сил притяжения к внешнему электрону из-за присутствия большего количества заполненных электронами внутренних оболочек.
В отличие от большинства других металлов, щелочные металлы мягкие с низкой плотностью и низкой температурой плавления. Эти металлы являются наиболее реакционноспособными из всех металлов периодической таблицы.
Щелочноземельные металлы — это металлы, которые имеют два валентных электрона в своей внешней оболочке. Существует шесть щелочноземельных металлов, в том числе бериллий, магний, кальций, стронций, барий и радий.
Они становятся стабильными, приобретая электронную конфигурацию благородных газов за счет пожертвования их внешних электронов. Когда электроны отдаются электроотрицательному атому, щелочноземельные металлы становятся положительно заряженными.
Щелочноземельные металлы являются высокореактивными металлами и помещаются во второй столбец периодической таблицы. Эти металлы являются строительными блоками для всего в мире. Эти металлы часто встречаются в форме сульфатов в природе.
Примеры включают минералы, такие как гипс; сульфат кальция, эпсомит; сульфат магния и барит; сульфат бария.

Рисунок 1: Периодическая таблица, показывающая щелочные и щелочноземельные металлы
Щелочные металлы: Каждый щелочной металл имеет один электрон.
Щелочноземельные металлы: Каждый щелочноземельный металл имеет два электрона.
Природа металла
Щелочные металлы: Щелочные металлы мягкие.
Щелочноземельные металлы: Щелочноземельные металлы являются твердыми.
Точки плавления
Щелочные металлы: Щелочные металлы имеют низкие температуры плавления.
Щелочноземельные металлы: Щелочные металлы имеют относительно высокие температуры плавления.
Природа гидроксида металла
Щелочные металлы: Гидроксиды щелочных металлов являются сильно основными.
Щелочноземельные металлы: Гидроксиды щелочноземельных металлов являются относительно менее основными.
Разложение карбонатов
Щелочные металлы: Карбонаты щелочных металлов не разлагаются.
Щелочноземельные металлы: Карбонаты щелочноземельных металлов разлагаются с образованием оксида при нагревании до высоких температур.
Нагрев нитратов
Щелочные металлы: Нитраты щелочных металлов дают соответствующие нитраты и кислород в качестве продуктов.
Щелочноземельные металлы: Нитраты щелочноземельных металлов дают соответствующие оксиды, диоксид азота и кислород в качестве продуктов.
Стабильность гидроксидов при нагревании
Щелочные металлы: Гидроксиды щелочных металлов стабильны.
Щелочноземельные металлы: Гидроксиды щелочноземельных металлов образуют оксиды.
Природа бикарбонатов при комнатной температуре
Щелочные металлы: Бикарбонаты щелочных металлов существуют в твердой форме.
Щелочноземельные металлы: Бикарбонаты щелочноземельных металлов существуют в форме раствора.
Образование пероксидов при нагревании
Щелочные металлы: Щелочные металлы образуют пероксиды при нагревании.
Щелочноземельные металлы: Щелочноземельные металлы, кроме бария, не образуют перекисей.
Образование нитридов
Щелочные металлы: Щелочные металлы не образуют нитридов, кроме лития.
Щелочноземельные металлы: Щелочноземельные металлы образуют стабильные нитриды.
Образование карбидов
Щелочные металлы: Щелочные металлы не образуют карбиды, кроме лития.
Щелочноземельные металлы: Щелочноземельные металлы образуют стабильные карбиды.
Примеры
Щелочные металлы: Литий, натрий, калий, рубидий, цезий и франций являются примерами щелочных методов.
Щелочноземельные металлы: Бериллий, магний, кальций, стронций, барий и радий являются примерами щелочноземельных металлов.
Резюме
Щелочные металлы и щелочноземельные металлы являются важными элементами, которые содержат одинарные и двухвалентные электроны соответственно в своей внешней оболочке атома.
Основное различие между щелочными металлами и щелочноземельными металлами заключается в количестве электронов в их внешних оболочках атомов и, следовательно, их положении в периодической таблице.
Щелочные металлы (литий, натрий, калий, рубидий, цезий и франций) размещаются на первой колонне (IA), а щелочноземельные металлы (бериллий, магний, кальций, стронций, барий и радий) размещаются на второй колонке (IIA) периодической таблицы.
Обе металлические группы обладают высокой реакционной способностью. Все эти металлы могут быть идентифицированы с помощью теста на пламя, так как эти металлы имеют уникальный цвет пламени, когда металлы нагревают над пламенем.
Рекомендации: 1. Trefil, J.S. (2001). Энциклопедия науки и техники, Тейлор и Фрэнсис. 2. Бриджит Хеос (2010). Щелочноземельные металлы: бериллий, магний, кальций, стронций, барий, радий, Нью-Йорк: Розен Централ. 3. Рэймонд Фернандес (2008). Живая наука Химия для 10 класса, Ратна Сагар П., ООО
Изображение предоставлено: 1. «Периодическая таблица элементов» Ле Ван Хан Седрик — LeVanHan (GFDL) через






