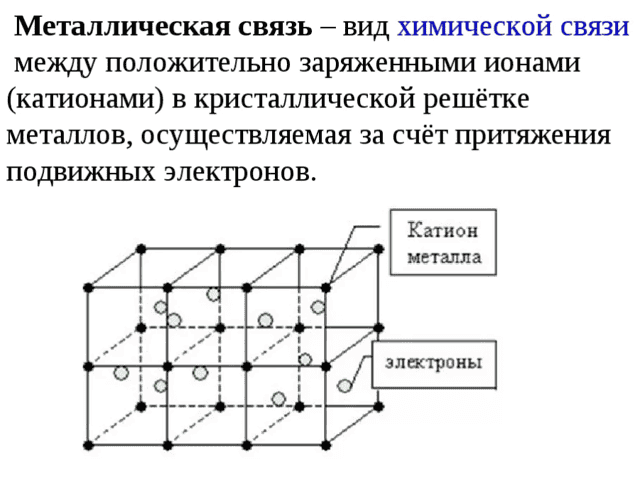
- В металлах существует металлическая связь
- Классификация металлов
- Кристаллическая структура
- Физические свойства
- Металлическая химическая связь — характеристика, способы образования и свойства
- Характерные кристаллические решетки
- Металлическая химическая связь
- Обсуждение: «Металлическая химическая связь»
- Особенности металлов. Металлическая химическая связь
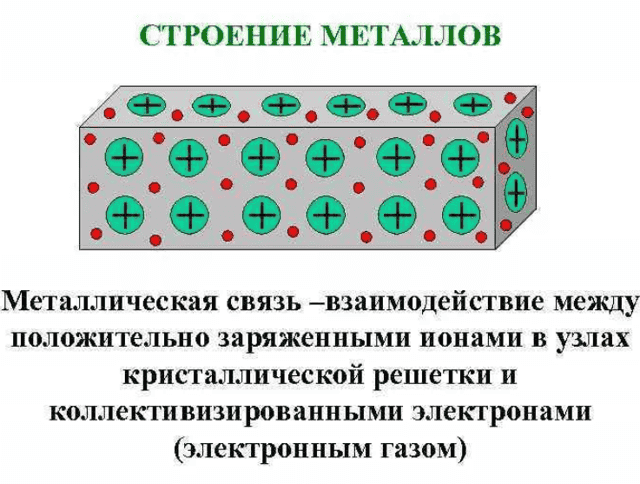
- Металлическая связь. Свойства металлической связи
- Механизм металлической связи
- Характерные кристаллические решётки
- Другие свойства
- Металлическая химическая связь — характеристика, способы образования и свойства — Помощник для школьников Спринт-Олимпик.ру
- Характерные кристаллические решетки
- Металлическая связь | это… Что такое Металлическая связь?
- Механизм металлической связи
- Характерные кристаллические решётки
- Другие свойства
- Примечания
МЕТАЛЛЫ (от греч. Metallon-первоначально шахта, шахта), in-va, обладает свойствами в нормальных условиях, металлами и высокими электрическими свойствами. Проводимость и теплопроводность были отклонены. Температурный коэффициент.
Электропроводность, способность в достаточной степени отражать световые волны (глянец), пластичность. Металлы включают в себя как сам металл (отдельно), его сплавы, так и соединения металлов. Интерметаллическое соединение. Также называется металлом.
Любой остров, который содержит любой металл. По тебе, например, так называемые «синтетические» металлы (см. Интеркаляция), металлоорганические.
Блеск, пластичность, пластичность — «Яркий ковкий предмет» (М.В. Ломоносов) ранее считался металлическим элементом. Но металл. Некоторые неметаллы, такие как йод. Хрупкие металлы известны, но есть много других. Со временем в результате тщательной очистки они были получены в пластиковом виде.
В настоящее время наиболее важные признаки металлов воспринимаются как негативные. Температурный коэффициент.
- Электропроводность, то есть электропроводность, связанная с трехкратным ростом, который снижает электричество. Из 109 элементов, которые являются периодическими. Система 86 классифицируется как металл. Периодические металлические и неметаллические граничные таблицы (длинная версия) рисуются по диагонали от B до At.
Не существует единого мнения по некоторым элементам, например, Ge, Sb, но, тем не менее, правильно считать Ge неметаллическим. Ему принадлежит полупроводник sv-you, физический, но Sb-металл. Святой Антоний — полуметалл.
Олово существует как в металлической (b-Sn), так и в полупроводниковой (a-Sn) модификациях. С другой стороны, Ge, Si, P и другие неметаллы высокого давления выявили модификацию металла. Проводимость.
В металлах существует металлическая связь
При достаточно высоких давлениях можно предположить, что все островки могут приобретать металлические свойства. УО.
Поэтому вопрос о назначении того или иного элемента металлу или неметаллу должен быть четко определен исходя из соображений, а также физических факторов. Санкт-ин-ва, а также его химические вещества. св. Термин «металлоид» иногда используется для элементов на границе между металлом и неметаллом, но этот термин не рекомендуется в химии.
Металлы имеют металлические связи, которые являются кристаллическими.
С другой стороны, валентные электроны делокализованы по всему пространству решетки. Металлы могут быть представлены в виде сложенных скелетов.
Ионы погружены в «электронный газ», который компенсирует силы отталкивания. Ion. Энергия этих делокализованных электронов проводимости соответствует зоне проводимости. Согласно теории зон, металлы не имеют запрещенной зоны между валентной зоной и зоной проводимости.
В металлических кристаллах атомы ионизуются только частично, а некоторые валентные электроны остаются связанными, поэтому между соседними атомами могут возникать некоторые ковалентные связи. Сила сцепления кристальная.
Классификация металлов
Металлическая структура характеризуется энтальпией атомизации, а край колеблется от 61,4 кДж / рт. Моль до 850 кДж / Вт моль. Энтальпия атомизации характерна для металлов серий Nb-Ru и Hf-Ir. Родственные металлы отличаются максимумом. Плавкость меха на прочность.
- Классификация металлов: Все металлы — это s-металл (все s-элементы, кроме H и He), p-металл (элементы группы IIIa, кроме B, и Sn, Рb, Sb, Bi, Po), d -металлы, f-металлы, они объединены под своими именами. «Переходный» (см. Переходные элементы). Первые две группы металлов иногда называют. «Простой».
Некоторые более узкие группы отличаются от этих групп: элементы s-металл-щелочной металл и щелочноземельный металл и d-металл-платина. В группу редкоземельных элементов входят как d, так и f металлы (подгруппы Sc и лантаноиды).
Есть также технологии, которые не являются общепринятыми. Классификация металлов. В определенной степени это отражает геохимическую классификацию элементов. Обычно отмечают след.
Группа: цветные металлы (Fe), тяжелые цветные металлы -Cu, Pb, Zn, Ni и Sn, легкие металлы (плотность менее 5 г / см3) -Al, Mg, Ca и др. Благородные металлы — Au, Ag, платиновые металлы, легированные (или ферросплавные) металлы — Mn, Cr, W, Mo, Nb, V и т. Д. Редкие металлы (см. Редкие элементы) разбиваются на несколько по порядку. Группа; Радиоактивные металлы-U, Th, Pu и др.
Кристаллическая структура: большинство металлов кристаллизуется в одном из трех типов структуры (см. Металлические кристаллы): кубы. И шестиугольники. Плотная упаковка (см. Плотная упаковка) или объемно-ориентированный куб. Бар.
В наиболее плотном пакете каждый атом имеет 12 ближайших соседей на равных расстояниях. Объемно-центрированный куб.
Каждый атом имеет восемь равноотстоящих соседей, а остальные шесть соседей расположены на больших (15%) расстояниях. Так что координируйте. Номер этой структуры считается равным 14 (8 + 6).
Межатомное расстояние кристалла. Металлическая структура характеризуется металлом. Радиус.
Кристаллическая структура
В нормальных условиях щелочные металлы и элементы Ba, Ra, подгруппы V и Cr кристаллизуются в объемно-центрированных кубах. решетка типа a-Fe. Самый плотный куб.
- Упаковка типа C (гранецентрированная кубическая решетка) характерна для Al, Ni, металлов подгруппы Cu, платиновых металлов (исключая Ru и Os). В наиболее плотной упаковке типа Mg кристаллизуются Be, Ca, Sr, Zn, Cd, Co, Ru и Os, а элементы подгруппы Ti и Sc, pl. РЗЭ. Более сложной является структура разложения. Модификация Mn, Ra, U и трансурановых элементов.
Многие металлы претерпевают полиморфные превращения при изменении температуры или давления. Например, низкий t-ra металл образует плотную упаковку. Ca, La и Zr часто имеют объемно-центрированные кубические высокотемпературные модификации. Структура.
При расплавлении металл удерживается электрически, термически и оптически. УО. Вблизи точки плавления жидкого металла наблюдается ближний порядок, почти такой же, как у кристаллического металла. При повышении температуры ближний порядок нарушается до тех пор, пока он не станет полностью беспорядочным.
Физические свойства
Физические свойства св-ва металл варьируется в очень широком диапазоне. Поэтому температура плавления варьируется от -38,87 ° С (Hg) до 3380 ° С (Вт), плотность от -0,531 г / см3 (Li) до 22,5 г / см3 (Os). Сопротивление Beat Electric p при 25 ° C составляет от 1,63 (Ag) до 140 (Mn) мкОм.с. Сопротивление движению электронов (рассеяние электронов) обусловлено нарушением кристалличности.
Решетка и дефекты (вакансии, дислокации, примесные атомы) обусловлены тепловым движением атомов. Мера — это длина свободы. Поток электронов. При комнатной температуре она составляет ~ 10-6 см для металлов нормальной чистоты и ~ 10-2 см для металлов высокой чистоты.
Температурный коэффициент p (диапазон 0-100 ° C) изменяется в диапазоне 1,0,10-3 (Hg) -9,0,10-3 K-1 (Be). В гелиевых m-ts (4,2 К) p практически не зависит от t-pes.
Измерения используются для характеристики чистоты и целостности металлического кристалла. Чем больше соотношение r273 / r4,2, тем чище металл. Для монокристаллов высокой чистоты он достигает 104-105.
Некоторые металлы с низким m-ts становятся сверхпроводниками, что очень важно. 1/100 К чистого металла
Для металлов наблюдается термоэлектронная эмиссия (способность испускать электроны при высоких значениях t-pe). Эмиссия электронов происходит даже под воздействием электромагнита. Излучение в видимой и ультрафиолетовой области спектра (фотоэмиссия).
| Реферат на тему | На заказ | Образец и пример |
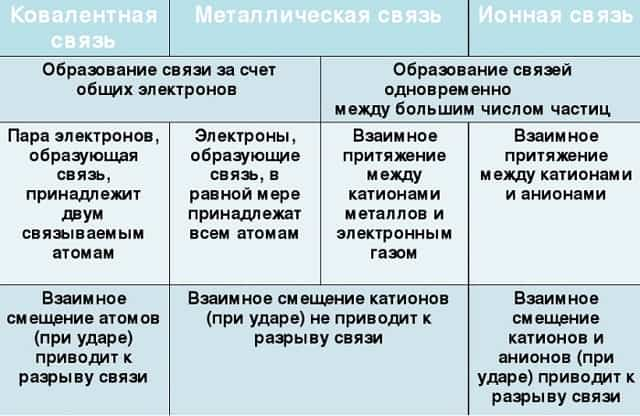
| Металлическая связь и структура металлов | Металлические связи происходят между атомами металла. | Металлические связи ненасыщены из-за небольшого числа электронов на внешних энергетических уровнях, которые слабо удерживаются ядром, и большого количества свободных атомных орбиталей, близких по энергии. |
Поле высокой напряженности (туннелирование или полевая эмиссия) при бомбардировке металлов электронами (вторичная электронная эмиссия) или ионами (ионная эмиссия электронов) в электрических взаимодействиях Поверхность металла с плазмой (взрывная эмиссия электронов). Электричество появляется в металле из-за разницы температур. Ток (тепловая мощность).
Теплопроводность металлов в основном обусловлена движением электронов, т.е. биениями. Коэффициенты теплопроводности () и электропроводности металла взаимосвязаны соотношением / (с • Т) = L = 2,45 • 10 -8 Вт • Ом / К2 (закон Видемана-Франца). Коэффициенты теплопроводности металлов имеют значения теплопроводности от 425 (для Ag) до 8,41 (для Bi) Вт / (мК).
Рефераты по материаловедению
Металлическая химическая связь — характеристика, способы образования и свойства
Время на чтение: 11 минут
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов — металлическую, ионную и водородную, свойственную кристаллам льда.
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
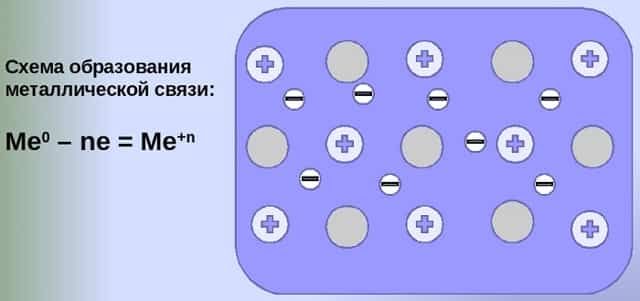
- Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
- Me — ne⁻ ⇆ Me,
- здесь n — число электронов, участвующих в образовании связи, как правило, от 1 до 3.
- В левой части уравнения — атом металла, отдающий электроны, в правой — образовавшийся в результате ион.
- Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
- Схемы формирования связи на примере атомов различной валентности:
- K — e⁻ ⇆ K;
- Cu — 2e⁻ ⇆ Cu;
- Al — 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
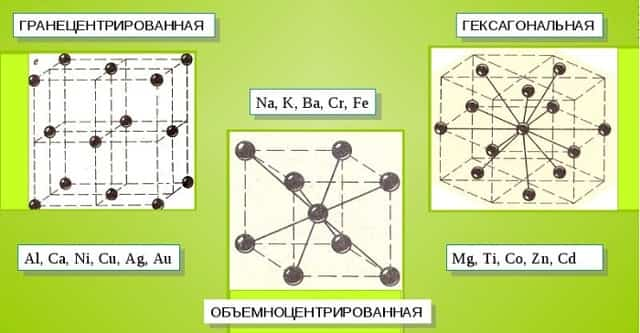
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni — в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
- хорошая электропроводность, благодаря наличию условно свободного электронного облака;
- высокая проводимость тепла;
- низкая реакционная способность или инертность;
- пластичность — большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
- При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
- Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
Их общие черты:
- участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
- металл высвобождает электроны и становится катионом;
- соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью — поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Металлическая химическая связь
Вы когда-нибудь задумывались — существует ли в природе отдельный атом металла?
Металл всегда существует в виде кристалла. Естественно, это обусловлено определенным строением и предполагает определенные физические и химические свойства.
Давайте представим, что у нас есть кусок какого-то металла. Например, нам дано железо (Fe). Из чего состоит этот кусок железа?
Он состоит из атомов железа, которые находятся в строго определенном порядке — в узлах кристаллической решетки.
У атома железа, как у любого металла, на последнем электронном слое небольшое число электронов, плюс к этому, большой радиус атома. На этом последнем слое электроны держатся достаточно слабо.
- Любой металл способен отдавать электроны, превращаясь в положительно заряженный ион.
- На примере железа:
- Fe0 -2e— = Fe2+
Куда направляются отделившиеся отрицательно заряженные частицы — электроны? Минус всегда притягивается к плюсу. Электроны притягиваются к другому иону (положительно заряженному) железа в кристаллической решетке:
- Fe2+ +2e— = Fe0
- Ион становится нейтральным атомом.
- И такой процесс повторяется много раз.
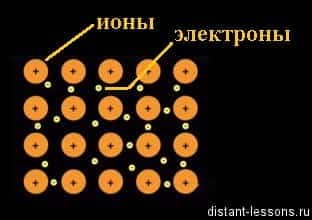
Получается, что свободные электроны железа находятся в постоянном движении по всему объему кристалла, отрываясь и присоединяясь к ионам в узлах решетки. Другое название этого явления — делокализованное электронное облако. Термин «делокализованный» обозначает — свободный, не привязанный.
Это жестко зафиксированные в узлах кристаллической решетки ионы металла и свободно перемещающиеся по всему объему кристалла электроны.
В чем-то металлическая химическая связь похожа на ионную — в ней тоже присутствуют ионы (катионы), однако, существенное отличие в том, что:
- в ионной связи есть катионы (положительно заряженные частицы) и анионы (отрицательно заряженные ионы);
- в металлической химической связи есть катионы и электроны.
Кое в чем металлическая химическая связь похожа и на ковалентную — в ней тоже есть общие электроны, но:
- в ковалентной химической связи электроны принадлежат двум элементам (локализованы между ними);
- в металлической — они принадлежат абсолютно всем ионам.
Металлическая химическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.
- Добиться состояния одной молекулы металла можно только при очень высоких температурах — когда металл перейдет в газообразное состояние.
- Физические свойства металлической химической связи:

- теплопроводность (перенос теплоты частицами — в данном случае — электронами);
- электропроводность;
- все вещества — твердые (кроме некоторых щелочных металлов);
- высокие температуры плавления и кипения;
- характерный металлический блеск — он появляется за счет отражения лучей электронами; если металл растереть до порошкообразного состояния, металлический блеск пропадает — нет кристаллической решетки — нет свободно гуляющих электронов;
- высокая плотность вещества (кроме щелочных металлов);
- пластичность — это смещение слоев кристаллической решетки.
Обсуждение: «Металлическая химическая связь»
(Правила комментирования)
Особенности металлов. Металлическая химическая связь
В одной из предыдущих частей мы уже говорили, что металлы характеризуются металлическими свойствами, то есть способностью отдавать электроны, а чуть позднее, это было вот тут, упомянули о том, что говорить о металлической связи мы можем тогда, когда эта самая связь образуется между атомами химических элементов металлов.Сегодня мы попробуем раскрыть большую часть первоначальных сведений, касающихся металлической связи, что, кстати, позволит понять в том числе и природу физических свойств металлов, поэтому наберитесь терпения, возможно, будет интересно!
Различные металлические воплощенияРазличные металлические воплощения
Начнём мы несколько издалека, а именно с определения химии (неожиданно). Я не удивлю Вас, если скажу, чтоХимия — это наука о веществах, их свойствах и превращениях.Попробуем коротко раскрыть смысл, заложенный в данном определении. Для этого мы должны прийти к единой точки зрения относительно таких понятий, как вещества и их свойства.
Вещество — это то, из чего состоит физическое тело. И вне всяких сомнений металлы непосредственно относятся к веществам, положенным в основу огромного количества физических тел, так железо (Fe) или медь (Cu) являются веществом для таких физических тел, как гвоздь или проволока. Но мы идём дальше.
А как определить, что такое свойства вещества? Давайте размышлять. Например, у меня есть различные свойства. Рост, вес, возраст и т.д. Совокупность всех моих свойств в конечном итоге отличает меня от Вас. Понимаете? Проводя аналогию с веществами, можно сказать, чтоСвойства вещества — это то, что отличает одни вещества от других.
Физические свойства металлов.Физические свойства металлов.
И если физические свойства металлов нам из нашей повседневной практики известны достаточно хорошо, то вопрос о том, чем могут быть обусловлены эти свойства, я думаю, большинству из нас не покажется столь уж простым. Дело в том, что в химии существует понимание: свойства вещества обусловлены, во-первых, составом вещества, во-вторых, его строением.
Свойства любого вещества обусловлены его составом и строениемСвойства любого вещества обусловлены его составом и строением
И состав и строение в каждом конкретном случае по понятным причинам может значительно изменяться, внося свои существенные коррективы в итоговый результат, но наша задача выделить в этом общее, характерное для металлов!Общую составляющую состава мы уже коротко обсудили, она включает в себе систему, состоящую из атомов химических элементов металлов, объединённых химической связью, что коротко может быть описано как Ме — Ме.Чтобы добраться до общего, характеристического для металлов по части строения, нам вновь придётся поразмышлять. Итак, если металлы характеризуются металлическими свойствами, то есть, способностью отдавать электроны, то возникает логичный вопрос: кому они отдают электроны? Представьте, если я хочу отдать электроны, и Вы хотите отдать электроны, как мы можем найти общий язык?Как выяснилось, атомы химических элементов металлов при образовании химической связи между собой отдают электроны в общее пользование, а в некотором роде освобождают эти электроны, и последние заполняют собой межузловое пространство металлической кристаллической решётки.
Схема металлической кристаллической решёткиСхема металлической кристаллической решётки
Таким образом мы вводим новое для нас понятие:
Кристаллическая решётка — совокупность упорядоченно расположенных в пространстве структурных единиц твёрдого вещества.
Структурные единицы, входящие в состав кристаллической решётки называются узлами. Для удобства работы нашего представления узлы кристаллической решётки соединяют воображаемыми линиями.
В узлах же металлической кристаллической решётки находятся так называемые атом-ионы. Почему?Дело в том, что освобождая электроны, или отдавая электроны в общее пользование для всей металлической кристаллической решётки, атом металла (Ме) перестаёт быть атомом и приобретает положительный заряд , то есть, становится ионом (катионом).
Схема металлической химической связиСхема металлической химической связи
Данный процесс обратим. (Стрелочка, направленная как в одну сторону, так и в другую, — символ обратимости). То есть, в действительности происходит беспокойный переход атома металла в состояние иона (катиона) с освобождением электронов и наоборот.
Почему же при отдаче электронов атом металла приобретает положительный заряд? Дело в том, что в случае отдачи электронов совокупный отрицательный заряд электронной оболочки уменьшается, а положительный заряд ядра остаётся неизменным и начинает преобладать над отрицательным зарядом электронной оболочки, что приводит к совокупному положительному заряду всей частицы, то есть к состоянию иона (катиона).
Переход атома кальция (Ca) в состояние иона (катиона) кальцияПереход атома кальция (Ca) в состояние иона (катиона) кальция
Теперь мы наконец-то готовы определить, что же такое металлическая связь:
Металлическая связь — это химическая связь, образованная за счёт обобществлённых (свободных) электронов, между атом-ионами металлов.
Именно наличием в межузловом пространстве металлической кристаллической решётки свободных обобществлённых электронов и объясняются все физические свойства металлов, такие как электропроводность, металлический блеск, ковкость и так далее.Возможно, поподробнее мы об этом когда-нибудь и поговорим. А на этом у меня всё. Спасибо. Пока.
Металлическая связь. Свойства металлической связи
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов.
Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами.
Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали.
Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях.
Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Металлическая химическая связь — характеристика, способы образования и свойства — Помощник для школьников Спринт-Олимпик.ру
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов — металлическую, ионную и водородную, свойственную кристаллам льда.
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
- Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
- Me — ne⁻ ⇆ Me,
- здесь n — число электронов, участвующих в образовании связи, как правило, от 1 до 3.
- В левой части уравнения — атом металла, отдающий электроны, в правой — образовавшийся в результате ион.
- Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
- Схемы формирования связи на примере атомов различной валентности:
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
Металлические кристаллы подразделяются на 3 основных типа:
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni — в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.
Характеристики, отличающие подобные вещества:
- хорошая электропроводность, благодаря наличию условно свободного электронного облака;
- высокая проводимость тепла;
- низкая реакционная способность или инертность;
- пластичность — большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
Их общие черты:
- участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
- металл высвобождает электроны и становится катионом;
- соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
Характерный пример кристалла с ионной связью — поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
ПредыдущаяСледующая
Металлическая связь | это… Что такое Металлическая связь?
Металлическая связь — это одновременное существование положительно заряженных атомов и свободного электронного газа.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отцепившиеся от атомов при образовании ионов.
Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Рис.1.Расположение ионов в кристалле щелочного металла
Рис.2.Связывающее звено кристаллической решётки щелочного металла
Так, щелочные металлы кристаллизуются в кубической объёмно-центрированной решётке, и каждый положительно заряженный ион щелочного металла имеет в кристалле по восемь ближайших соседей – положительно заряженных ионов щелочного металла (рис.1).
Кулоновское отталкивание одноимённо-заряженных частиц (ионов) компенсируется электростатическим притяжением к электронам связывающих звеньев, имеющих форму искажённого сплющенного октаэдра – квадратной бипирамиды, высота которой и рёбра базиса равны величине постоянной трансляционной решётке aw кристалла щелочного металла (рис.2).
Связывающие электроны становятся общими для системы из шести положительных ионов щелочных металлов и удерживают последние от кулоновского отталкивания.
Величина постоянной трансляцонной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
| 3,5021 | 4,2820 | 5,247 | 5,69 | 6,084 |
| 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
Математическое построение, связанное со свойствами свободных электронов в металле, обычно отождествляют с «поверхностью Ферми», которую следует рассматривать как геометрическое место, где пребывают электроны, обеспечивая основное свойство металла – проводить электрический ток[3].
Таким образом, электрический ток в металлах – это движение сорванных с орбитального радиуса электронов в поле положительно заряженных ионов, находящихся в узлах кристаллической решётки металла.
Выход и вход свободных электронов в связывающее звено кристалла осуществляется через точки «0», равноудалённые от положительных ионов атомов (рис.2).
Свободное движение электронов в металле подтверждено в 1916 году опытом Толмена и Стюарта по резкому торможению быстро вращающейся катушки с проводом – свободные электроны продолжали двигаться по инерции, в результате чего гальванометр регистрировал импульс электрического тока. Свободное движение электронов в металле обусловливает высокую теплопроводность металла и склонность металлов к термоэлектронной эмиссии, происходящей при умеренной температуре.
Колебания ионов кристаллической решётки создаёт сопротивление движению электронов по металлу, сопровождающееся разогревом металла.
В настоящее время важнейшим признаком металлов считается отрицательный температурный коэффициент электрической проводимости, то есть понижение проводимости с ростом температуры.
С понижением температуры электросопротивление металлов уменьшается, вследствие уменьшения колебаний ионов в кристаллической решётке. В процессе исследования свойств материи при низких температурах Камерлинг-Оннес открывает явление сверхпроводимости.
В 1911 году ему удаётся обнаружить уменьшение электросопротивления ртути при температуре кипения жидкого гелия (4,2 К) до нуля. В 1913 году Камерлинг-Оннесу присуждается Нобелевская премия по физике со следующей формулировкой: «За исследование свойств веществ при низких температурах, которые привели к производству жидкого гелия.»
Однако теория сверхпроводимости была создана позднее.
В её основе лежит концепция куперовской электронной пары – коррелированного состояния связывающих электронов с противоположными спинамии и импульсами, и, следовательно, сверхпроводимость можно рассматривать как сверхтекучесть электронного газа, состоящего из куперовских пар электронов, через ионную кристаллическую решётку. В 1972 году авторам теории БКШ – Бардину, Куперу и Шрифферу присуждена Нобелевская премия по физике “За создание теории сверхпроводимости, обычно называемой БКШ-теорией».
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Примечания
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 402-513. — 1072 с.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ.. — М.: «Химия», 1987. — С. 132-136. — 320 с.
- ↑ Зиман Дж. Электроны в металлах (введение в теорию поверхностей Ферми). Успехи физических наук.. — 1962. — Т. 78, вып.2. — 291 с.
- Ковалентная связь
- Ионная связь






