- Химические свойства металлов — задачи с решениями и примерами
- Задача 82
- Задача 84
- Задача 85
- Задача 86
- Задача 87
- Задача 88
- Химические свойства металлов
- Взаимодействие с простыми веществами
- Взаимодействие металлов друг с другом
- Взаимодействие металлов с водой
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с солями
- Примеры решения задач
- 2.2.2. Химические свойства металлов IIA группы
- Взаимодействие с простыми веществами
- с кислородом
- с галогенами
- с неметаллами IV–VI групп
- с водородом
- Взаимодействие со сложными веществами
- с водой
- c кислотами-неокислителями
- c кислотами-окислителями
- − разбавленной азотной кислотой
- − концентрированной азотной кислотой
- − концентрированной серной кислотой
- с щелочами
- с оксидами
- Металлы. Особенности строения. Классификация. Свойства
- Химические свойства металлов
- Сегодня мы с вами изучим общие химические свойства металлов.
- В реакциях металлы проявляют восстановительные свойства, то есть они отдают электроны и превращаются в положительные ионы, сами при этом окисляются.
- Сначала разберём реакции металлов с простыми веществами – неметаллами.
- Например, с кислородом взаимодействуют практически все металлы, кроме золота и платины, при этом образуются оксиды.
Щелочные и щелочноземельные металлы при обычной температуре легко окисляются на воздухе, поэтому их обычно хранят в закрытых сосудах или под слоем масла.
Так, в реакции лития с кислородом воздуха образуется оксид лития, при этом литий повышает свою степень окисления с 0 до +1, а кислород понижает свою степень окисления с 0 до -2, литий является восстановителем, а кислород – окислителем, четыре атома лития отдают по одному электрону молекуле кислорода.
В реакции кальция с кислородом, кальций также повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2. Металл кальций выступает в роли восстановителя, а кислород – в роли окислителя, при этом два атома кальция отдают по два электрона молекуле кислорода. В результате реакции образуется оксид кальция.

Такие металлы, как алюминий, цинк, свинец при обычной температуре реагируют с кислородом воздуха, покрываясь тонкой плёнкой оксида, которая защищает их от дальнейшего окисления. Слой оксида, образующегося на поверхности алюминия, настолько тонок, что металл не теряет своего блеска.
Так, в реакции алюминия с кислородом, образуется оксид алюминия, алюминий повышает свою степень окисления с 0 до +3, являясь при этом восстановителем, а кислород, наоборот, понижает свою степень окисления с 0 до -2.
В этой реакции четыре атома алюминия отдают по три электрона молекуле кислорода.
Многие металлы взаимодействуют с кислородом при нагревании: например, медь при нагревании на воздухе чернеет, так как покрывается плёнкой чёрного оксида меди два.
В этой реакции медь выступает в роли восстановителя и повышает свою степень окисления с 0 до +2, а кислород – окислитель, понижает свою степень окисления с 0 до -2. При этом два атома меди отдают по два электрона молекуле кислорода.
При прокаливании железа образуется железная окалина – это смешанный оксид, который состоит из оксида железа два и оксида железа три.
Железо, в данном случае, является восстановителем, оно повышает свою степень окисления с 0 до +2 и +4, значит, железо – это восстановитель, а кислород – окислитель, он понижает свою степень окисления с 0 до -2. В этой реакции три атома железа отдают восемь электронов молекуле кислорода.

А вот магний при поджигании на воздухе сгорает яркой вспышкой, образуя оксид магния.
Магний также является восстановителем, потому что повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2 и является окислителем. В результате реакции образуется оксид магния, а два атома магния отдают по два электрона молекуле кислорода.

- Таким образом, большинство металлов реагируют с кислородом с образованием оксидов, активные металлы вступают во взаимодействие с кислородом при обычных условиях, менее активные при нагревании, а такие, как золото или платина не реагируют с кислородом.
- Металлы в этих реакциях являются восстановителями и, соответственно, повышают свою степень окисления, а кислород является окислителем и понижает свою степень окисления.
- С серой все металлы, кроме золота, способны взаимодействовать при незначительном нагревании, образуя сульфиды:
В реакции натрия с серой образуется сульфид натрия, натрий повышает свою степень окисления с 0 до +2, он является восстановителем, сера является окислителем и понижает свою степень с 0 до -2. В результате взаимодействия два атома натрия отдают по одному электрону молекуле серы.
В реакции кальция с серой образуется сульфид кальция, кальций также повышает свою степень окисления с 0 до +2, являясь при этом восстановителем, а сера понижает свою степень окисления с 0 до -2 и является окислителем, при этом, каждый атом кальция отдаёт по два электрона молекуле серы.
А в реакции железа с серой образуется сульфид железа два. Здесь также железо является восстановителем, повышает свою степень окисления с 0 до +2, а серя, являясь окислителем, понижает свою степень окисления с 0 до -2. Каждый атом железа здесь отдаёт по два электрона молекуле серы.

Если смешать небольшое количество порошка алюминия с порошком серы и нагреть сверху смесь пламенем лучинки, то в результате бурной реакции образуется сульфид алюминия:
Алюминий выступает в роли восстановителя и повышает свою степень окисления с 0 до +3, а сера понижает свою степень окисления с 0 до -2 и является окислителем. В этой реакции два атома алюминия отдают по три электрона молекуле серы.

Таким образом, с серой при определённых условиях реагируют все металлы кроме золота, в результате этого взаимодействия образуются сульфиды, в которых степень окисления серы равна мину двум. В этих реакциях металлы выступают в роли восстановителей, а сера – в роли окислителя.
C фтором, хлором, бромом и йодом – металлы реагируют с образованием галогенидов.
Так, в реакции алюминия с йодом образуется йодид алюминия, а катализатором в этой реакции является вода.
В этой реакции алюминий также повышает свою степень окисления с 0 до +4, являясь при этом восстановителем, а йод является окислителем и понижает свою степень окисления с 0 до -1. При этом два атома алюминия отдают по три электрона молекуле йода.
Таким образом, в реакциях с галогенами, металлы являются восстановителями и повышают свою степень окисления, а сами галогены являются окислителями и понижают свою степень окисления, при этом металлы окисляются, а галогены восстанавливаются. В результате этих реакций образуются галогениды.
Металлы не только реагируют с неметаллами – простыми веществами, но и вступают в реакции со сложными веществами.
Например, с водой эффективно реагируют щелочные и щелочноземельные металлы. Если натрий поместить в ёмкость с водой, в которую добавили несколько капель фенолфталеина, то он будет двигаться по поверхности воды, бурно реагируя с ней. При этом выделяется водород и образуется гидроксид натрия, окрашивающий фенолфталеин в малиновый цвет.
Металлический натрий выступает в качестве восстановителя, он повышает свою степень окисления с 0 до +1, а ионы водорода выступают в качестве окислителя и водород понижает свою степень окисления с +1 до 0. В этой реакции два атома натрия отдают по одному электрону ионам водорода.
Некоторые металлы взаимодействуют с водой при определённых условиях, например, цинк – при нагревании, железо – в раскалённом виде с парами воды. При этом образуются оксиды металлов и выделяется водород.
Так, в реакции с цинком образуется оксид цинка и водород. Цинк при этом, являясь восстановителем, повышает свою степень окисления с 0 до +2 и отдаёт по два электрона ионам водорода.
Катионы водорода выступают в роли окислителя и понижают свою степень окисления с +1 до 0.
В реакции с железом, аналогично, железо является восстановителем, повышает свою степень окисления с 0 до +2 и +3, при этом три атома железа отдают по восемь электронов ионам водорода, а ионы водорода понижают свою степень окисления с +1 до 0 и являются окислителями.
- Если металл стоит в ряду активности после водорода, то он не вытесняет водород из воды ни при каких условиях.
Таким образом, щелочные и щелочноземельные металлы реагируют с водой с образованием щелочей, при этом выделяется водород, некоторые металлы реагируют с водой только при нагревании, при этом образуются оксиды и выделяется водород, а металлы, стоящие в ряду активности после водорода не реагируют с водой. В этих реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли окислителя.
Металлы реагируют и с кислотами. Активность металлов при взаимодействии с растворами кислот зависит от положения металла в ряду активности. Металлы, стоящие в ряду активности до водорода, способны вытеснять водород из разбавленных растворов кислот.
- Следует учитывать и следующее металл реагирует с кислотой:
- · металл должен стоять в ряду активности до водорода
- · если образуется растворимая соль
- · концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами, при этом водород не выделяется
- · на щелочные металлы это правило не распространяется, так как они реагируют активно с водой, а речь в данном случае идёт о растворах кислот
- Например, в реакции магния с раствором серной кислоты, магний выступает в роли восстановителя, а ионы водорода в качестве окислителя.
При этом магний повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Каждый атом магния отдаёт по два электрона ионам водорода.
- Металлы, стоящие в ряду активности после водорода, к такому взаимодействию не способны:
- Например, медь стоит в ряду активности после водорода, поэтому она не реагирует с раствором соляной кислоты.
Если налить в две пробирки растворы кислот: в первую – раствор соляной кислоты, во вторую – раствор серной кислоты, а затем поместить в каждую по грануле цинка, то в результате у нас появляются пузырьки газа и в первой, и во второй пробирке. Значит, цинк стоит в ряду активности металлов до водорода, поэтому он способен вытеснять водород из раствора кислот.
Цинк в обеих реакциях является восстановителем, он повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0, при этом выступая в роли окислителя. В этих двух реакциях атом цинк отдаёт по два электрона ионам водорода.
- Следует помнить, что металлы, стоящие в ряду активности до водорода, реагируют с растворами кислот, но в результате этих реакций должна образоваться растворимая соль, на щелочные металлы эти правила не распространяются, концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами.
- Металлы реагируют с растворами солей, при этом нужно также использовать ряд активности металлов: более активный металл способен вытеснять другой металл из раствора соли, однако при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, потому что они реагируют с водой, а реакции эти протекают в растворе.
Если в две пробирки налить раствора сульфата меди (II) и поместить в первую кусочек железа, а во вторую гранулу цинка, то реакция будет у нас идти в двух пробирках. На кусочке железа и грануле цинка оседает медь и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на жёлтую, во второй – с голубой на более светлую.
В этой реакции железо выступает в роли восстановителя, само при этом окисляясь. Атомы железа превращаются в ионы железа. Ионы меди выступают в роли окислителя, они восстанавливаются, превращаясь в атомы меди. В результате окислительно-восстановительной реакции электроны от атомов железа переходят к ионам меди.
- Во второй реакции, в роли восстановителя выступает цинк, сам он окисляется, атомы цинка превращаются в ионы цинка, ионы меди выступают в роли окислителя, ионы меди восстанавливаются и превращаются в атомы меди, электроны от атомов цинка переходят к ионам меди.
- Следовательно, металлы реагируют и с растворами кислот, но нужно помнить, что каждый металл вытесняет из раствора соли другой металл, стоящий правее него в ряду напряжений металлов, при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, так как они реагируют с водой.
- Сделаем вывод:
- · металлы реагируют с простыми веществами, такими, как:
- · кислород
- · сера
- · галогены
- · со сложными:
- · вода
- · кислоты
- · соли
Химические свойства металлов — задачи с решениями и примерами
Решение:
Щелочные металлы стоят в начале ряда напряжений металлов. Являясь наиболее активными, они легко окисляются кислородом воздуха уже при обычных температурах. Однако для каждого из указанных металлов есть свои особенности. Литий уже при обычных температурах реагирует как с кислородом воздуха, так и со вторым компонентом воздуха — азотом, образуя, соответственно, оксид и нитрид лития:
При высоких температурах вместо оксида лития образуется пероксид лития:
Натрий: а) при обычной температуре —
б) при высоких температурах —
б) при высоких температурах —
Задача 82
Основываясь на знании общих химических свойств металлов, написать уравнения следующих химических реакций:
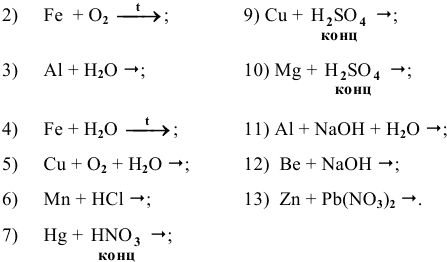
Решение:
5) Электрохимическая коррозия меди с кислородной деполяризацией:
- Задача 83
- С какими из следующих веществ может реагировать ртуть:
- Решение:
Задача 84
- Среди металлов: — найти наиболее и наименее сильный восстановитель:
- а) в водных средах;
- б) в неводных средах.
- Решение:
- В водных средах количественной характеристикой восстановительных свойств металла является величина его электродного потенциала.
Для изучаемых металлов величины стандартных электродных потенциалов следующие:
- Наиболее низкий электродный потенциал у кальция, значит, он наиболее сильный восстановитель в водных средах, а наиболее высокий электродный потенциал у цинка, значит, он наиболее слабый восстановитель среди перечисленных металлов.
- В неводных средах количественной характеристикой восстановительных свойств металла является величина его энергии ионизации.
- Величины энергий ионизации изучаемых металлов находим в справочнике:
Наиболее низкая энергия ионизации (ионизационный потенциал) у натрия — самого сильного восстановителя из перечисленных металлов, наиболее высокая энергия ионизации у цинка — самого слабого восстановителя.
Задача 85
- Составить и уравнять с помощью электронного баланса ОВ реакции.
- Решение:
- Ниже приводятся уравнения уже составленных и уравненных реакций:
Задача 86
- Каким методом может быть получен металлический магний?
- Решение:
- Магний — это очень активный металл, его электродный потенциал
Значит, магний может быть получен не электролизом водных растворов солей магния, а электролизом расплавов его солей, например электролизом расплава :
Магний также может быть получен металлотермией при использовании какого-либо металла, химическое сродство которого к атому, с которым он связан, выше, чем у магния, например:
Докажем возможность использования Na:
Так как , то реакция термодинамически возможна. Металлический натрий может быть использован для получения металлического магния из .
Задача 87
При смешивании расплавленных масс магния и свинца образуется интерметаллическое соединение, содержащее 81% РЬ. Какова его формула?
Решение:
— формула интерметаллического соединения в общем виде. Индексы х и у находим из следующих отношений:
Таким образом, формула интерметаллического соединения — .
Задача 88
Для определения процентного содержания серебра в старой монете растворили 0,3 г этой монеты в концентрированной . Затем из полученного раствора серебра осадили раствором соляной кислоты в виде осадка . Масса осадка равна 0,199 г. Каково содержание серебра в монете?
Решение:
Уравнения химических реакций, происходящих в ходе анализа, следующие:
Согласно уравнениям этих двух реакций, 1 моль образует 1 моль .
Рассчитаем массу серебра, соответствующую 0,199 г :
Вычислим процентное содержание серебра в монете:
- Эти задачи взяты со страницы решения задач по неорганической химии:
- Задачи с решением по неорганической химии
- Возможно эти страницы вам будут полезны:
Химические свойства металлов
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Взаимодействие с простыми веществами
- Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом. В реакцию взаимодействия с кислородом вступают все металлы (исключение составляют Au, Pt), в результате чего возможно образование трех различных продуктов — пероксидов, оксидов и надпероксидов:
- 4Li + O2 = 2Li2O (оксид лития)
- 2Na + O2 =Na2O2 (пероксид натрия)
- K + O2 = KO2 (надпероксид калия)
- Металлы средней активности (начиная с Al) и неактивные металлы реагируют с кислородом только при нагревании:
- 2Al + 3/2 O2 = Al2O3
- 2Cu + O2 = 2CuO
В реакцию взаимодействия с азотом способны вступать только активные металлы, в результате чего образуются азиды, причем при н.у. с азотом реагирует только литий, остальные активные металлы – только при нагревании:
- 6Li + N2 = 2Li3N (азид лития)
- Только активные металлы способны взаимодействовать с углеродом и водородом, причем в случае реакции с водородом – это только щелочные и щелочноземельные металлы:
- 2Li+2C = Li2C2 (карбид лития)
- 2Na + H2 = NaH (гидрид натрия)
- С серой реагируют все металлы кроме Au и Pt:
- 2K +S = K2S (сульфид калия)
- Также металлы способны взаимодействовать с галогенами и фосфором:
- 2Na + Cl2 = 2NaCl (хлорид натрия)
- 3Ca + 2P = Ca3P2 (фосфид кальция)
Все реакции взаимодействия с простыми веществами носят окислительно-восстановительный характер, металлы в них окисляются, проявляя свойства восстановителей, т.е. демонстрируют способность отдавать электроны:
- Fe + S = FeS
- Fe -2e = Fe2+ процесс окисления, железо — восстановитель
- S +2e = S2- процесс восстановления, сера – окислитель
Взаимодействие металлов друг с другом
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
3Cu + Au = Cu3Au
Взаимодействие металлов с водой
- Активные металлы (щелочные и некоторые щелочноземельные металлы — Ca, Sr, Ba) способны взаимодействовать с водой с образованием гидроксидов:
- Ba + 2H2O = Ba(OH)2 + H2↑
- 2Na + 2H2O = 2NaOH + H2↑
- Металлы, характеризующиеся средней активностью (начиная с Al) вступают в реакцию с водой в более жестких условиях (наличие щелочной или кислотной среды и др. условия); при этом образуется соответствующий оксид и выделяется водород:
- Pb + H2O = PbO + H2↑
- Неактивные металлы с водой не реагируют.
- Реакции взаимодействия металлов с водой также относятся к ОВР и металлы в них являются восстановителями.
Взаимодействие металлов с кислотами
- Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
- 2Al + 6HCl = 2AlCl3 + 3 H2↑
- Zn + 2HCl = ZnCl2 + 2H2↑
- Fe + H2SO4 = FeSO4 + H2↑
- Неактивные металлы взаимодействуют с кислотами при особых условиях. Так, концентрированная серная кислота способна растворять медь (1), а при взаимодействии меди с концентрированной азотной кислотой в зависимости от её концентрации (60% или 30%) образуются различные продукты реакции (2, 3):
- Cu + 2H2SO4 = CuSO4 + SO2↑ +2H2O (1)
- Cu + 4HNO3(60%) = Cu(NO3)2 + 2NO2↑ + 2H2O
- 3Cu +8HNO3(30%) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Взаимодействие металлов с солями
Более активные металлы способны взаимодействовать с солями, образованными менее активными металлами, и вытеснять их (металлы) из солей:
3Na + AlCl3 = 3NaCl + Al
Примеры решения задач
2.2.2. Химические свойства металлов IIA группы
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы.
Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием.
В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме0 – 2e— → Ме+2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO.
Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
- Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
- 2Mg + O2 = 2MgO
- 2Ca + O2 = 2CaO
- 2Ba + O2 = 2BaO
- Ba + O2 = BaO2
- Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
- Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
- Мg + I2 = MgI2 – иодид магния
- Са + Br2 = СаBr2 – бромид кальция
- Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл.
Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена.
Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла.
С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода.
Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO.
В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
- Ве + Н2SO4(разб.) = BeSO4 + H2↑
- Mg + 2HBr = MgBr2 + H2↑
- Ca + 2CH3COOH = (CH3COO)2Ca + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
- С разбавленной азотной кислотой реагируют все металлы IIA группы.
При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
- 4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + N2O↑ + 5H2O
- 4Mg + 10HNO3(сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
- Be + 2H2SO4 → BeSO4 + SO2↑+ 2H2O
- Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
- Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
- 4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S↑ + 4H2O
с щелочами
- Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении.
При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
- Be + 2KOH + 2H2O = H2↑ + K2[Be(OH)4] — тетрагидроксобериллат калия
- При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
- Be + 2KOH = H2↑+ K2BeO2 — бериллат калия
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Металлы. Особенности строения. Классификация. Свойства
Цель урока: Систематизировать сведения о строении и свойствах металлов.
Задачи урока:
- Охарактеризовать важнейшие химические свойства металлов;
- На примере реакций, характеризующих химические свойства, повторить типы химических реакций
- Продолжить формирование умения работать с лабораторным оборудованием.
Ход урока
1. Организационный момент
Проверка готовности к уроку. Сообщение темы и цели урока.
2. актуализация знаний
- Актуализация знаний по теме “Физические свойства металлов. Сплавы”.
- Работа по группам. Класс делится на 3 группы (либо по рядам, либо по другому принципу). Задания для групп может быть следующее:
Задание для группы № 1
Варианты вопросов:
- Способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия? (пластичность);
- Тип химической связи в металлах? (металлическая);
- Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов? (электроны);
- Какую плотность имеют легкие металлы (менее 5 г/см3);
- Самый легкий металл? (литий);
- Лучшие проводники электричества среди металлов? (серебро и медь);
- Название известного сплава на основе алюминия (дюралюминий);
- Важнейшие сплавы на основе железа? (чугун и сталь);
- Какой неметалл входит в состав сплавов железа (углерод);
- Укажите не менее трех металлов, которые могут выступать в качестве легирующих добавок? (хром, никель, молибден)
Задание для группы № 2
Решение задачи по теме “Сплавы”:
Вычислите количества вещества меди и никеля, которые нужно взять для производства 25 кг. мельхиора.
Задание для группы № 3.
Группа получает образец металла, который необходимо охарактеризовать по физическим свойствам и примерным областям применения.
На выполнение задания отводится не более 5 минут. После чего происходит проверка результатов.
3. Формирование новых знаний.
Учитель проговаривает основные задачи урока
Мы должны к заключению урока:
- знать общие химические свойства металлов;
- уметь записывать уравнения реакций, характеризующие химические свойства металлов;
- получить навыки проведения химических реакций.
Актуально задать обучающимся вопрос: “А зачем необходимо знать химические свойства металлов?”
Химические свойства металлов
Объяснение нового материала излагается в форме активного диалога с обучающимися, так как часть учебного материала, а именно: принципы написания химических уравнений, свойства кислот и солей, признаки и типы химических реакций, правила ряда напряжения металлов, ОВР процессы им известны. Таким образом, по – ходу изучения нового материала происходит закрепление ряда тем курса химии за 8 класс.
1. Взаимодействуют с неметаллами.
Просматривается видеофрагмент и записывается уравнение реакции. Например: горение магния: 2Mg + O2 = 2MgO. Разбираются процессы окисления — восстановления.
2. Взаимодействие с водой.
- С водой активно реагируют щелочные и щелочноземельные металлы. Реакция разбирается на примере натрия: 2Na + 2H2O = 2NaOH+ H2
- Реакция менее активного металла с водой разбирается на примере железа.
- 3Fe + 4H2O = Fe3O4 + 4H2
- 3. Взаимодействие с кислотами
- с учетом правил по положению металлов в ряду напряжения
- K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Au
- Металл в ряду должен стоять до водорода (не распространяется на щелочные и щелочноземельные металлы);
- Полученная соль должна быть растворимой;
- Азотная и концентрированная серная кислоты реагируют с металлами по – особому.
- Далее просматриваются видеофрагменты взаимодействия алюминия с соляной кислотой и меди с концентрированной азотной кислотой и записываются уравнения данных реакций.
- 2Al + 6HCl = 2AlCl3+3H2
- Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
- 4. Взаимодействие с солями
- с учетом правил по положению металлов в ряду напряжения
- K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Au
- Металл в ряду должен стоять до металла соли (не распространяется на щелочные и щелочноземельные металлы);
- Все соли, участвующие в реакции должны быть растворимы
- Просматривается видеофрагмент взаимодействия цинка с хлоридом меди (II) и учащиеся записывают уравнение реакции:
- Zn + CuCl2 = ZnCl2 + Cu
- Общий вывод по этапу формирование новых знаний:
- Металлы вступают в реакцию:
- (с учетом условий)
- (с учетом правил ряда напряжений металлов)
- (с учетом правил ряда напряжений металлов)
- 4. Закрепление изученного материала
- На этапе закрепления обучающимся предлагается выполнение лабораторных опытов по изучению химических свойств металлов.
- Взаимодействие кальция с кислородом;
- Взаимодействие цинка с соляной кислотой;
- Взаимодействие железа с раствором сульфата меди(II)
Работа выполняется в парах, результаты комментируются и оформляются в тетради.
5. Подведение итогов (рефлексия)
- А) Что я узнал о химических свойствах металлов?
- Б) Для чего необходимо знать химические свойства металлов?
- В) Что бы Вы могли предложить для лучшего усвоения материала по данной теме?
- 6. Домашнее задание с ми
- Изучить гл.7 и 8
- ЗАПОМНИТЬ! Химические свойства металлов
- Выполнить письменно задания: № 1-3
Теория






