- Взаимодействие с оксидами неметаллов
- Взаимодействие с металлами
- Взаимодействие воды с металлами
- Как они взаимодействуют?
- Пример взаимодействие активных металлов с водой
- ПОИСК
- Химические свойства воды. 6 основных типов химических реакций для воды
- Электрохимический ряд напряжений металлов (ЭРН)
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с водой
- Взаимодействие металлов с водными растворами солей
- Процесс термического распада нитратов
- Какие металлы взаимодействуют с водой при обычной температуре
- Взаимодействие с простыми веществами
- с кислородом
- с галогенами
- с неметаллами IV–VI групп
- с водородом
- Взаимодействие со сложными веществами
- с водой
- c кислотами-неокислителями
- c кислотами-окислителями
- − разбавленной азотной кислотой
- − концентрированной азотной кислотой
- − концентрированной серной кислотой
- с щелочами
- с оксидами
Архив уроков › Химия 8 класс
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.

При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).

При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):

Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам.
Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах.
Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
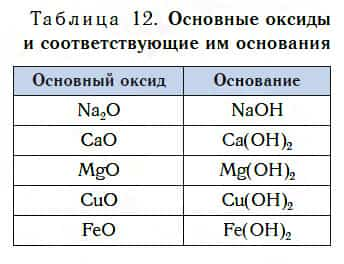
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
- В этих реакциях выделяется водород и образуются растворимые в воде основания.
- Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
- Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Взаимодействие воды с металлами
Вода обладает разнообразными свойствами. Она может замерзать. Превращаться в пар. С водой человек дружит с рождения. Помимо всего этого она так же может вступать во взаимодействие с металлом. Как? Читайте нашу статью, и Вы узнаете об этом! Вступая в контакт с жидкостью, металлы способны давать самые удивительные реакции! Например: чтобы насытить воду железом её настаивают несколько часов на железе, после чего употребляют во внутрь, а если бросить в стакан с водой щелочной металл то произойдет взрыв. Существует множество разнообразных металлов и каждый случай взаимодействия уникален! Проводите опыты, делайте собственные открытия, а посвятить Вас в основы взаимодействия воды с металлами поможет наша статья!
Как они взаимодействуют?
Взаимодействие металла с водой может происходить по разному, в зависимости от металла и воды. Каждый металл обладает своими неповторимыми особенностями.
Так же, может показаться, что формулы очень сложные, однако со временем Вы легко научитесь их читать. Если алюминий, железо вступает в активные реакции с водой, то это значит что в нем присутствуют образующиеся соли. Он окисляется ионами водорода.
Проследить это можно по формуле и записать в виде сокращенной формулировки Me + nH+ → Men+ + H2↑
Вступая в реакцию с водой, в исключительных ситуациях образуются гидроксиды. Очень активно в спокойных условиях вступают в реакцию с влагой щелочные металлы, например Литий (Li), натрий (Na) , Калий (К), Рубидий (Rb) , Цезий (Cs), Франций (FR).
- Щелочные металлы вступают в очень бурную реакцию с водой. Отследить процесс взаимодействия металлов с водой можно по формулам:
- NaH + H2O ® NaOH + H2
- NaH + HCl ® NaCl + H2
 Разные активные реакции металлы выдают так же при различных условиях. Например, в состоянии покоя и при комнатной температуре реакция может быть одна, а в других условиях взаимодействие проявляться по разному: Тихо, спокойно, бурно.
Разные активные реакции металлы выдают так же при различных условиях. Например, в состоянии покоя и при комнатной температуре реакция может быть одна, а в других условиях взаимодействие проявляться по разному: Тихо, спокойно, бурно.
Активные металлы способны вступать во взаимодействие с водой при обычных условиях согласно схеме: 2Me + 2nH2O → 2Me(OH)n + nH2 .Итогом окисления как правило становится гидроксид Me(OH)n (где n-степень окисления металла).
Приведем пример: Ca + 2H2O → Ca(OH)2 + H2↑
Металлы же со средней степенью активности вступают во взаимодействие с водой при нагревании по схеме: 2Me + nH2O Me2On + nH2 . Итогом такой реакции становится появление оксида металла. Его формула — Me2On (где n-степень окисления металла) .
Пример взаимодействие активных металлов с водой
Металлы так же используют при изготовлении кухонной утвари. К примеру алюминиевая сковородка, металлический корпус чайника, лопасти блендера. Тут важна стойкость металла. Самой известной реакцией металла на воду является окисление самой обыкновенной стали на воздухе и в воде.
Железо в таком случае разрушается, ржавеет. Происходящие при этом процессы являются весьма сложными и удивительным природным процессом. Если же окисление происходит в морской воде, то процесс ускоряется, этому способствует определенная концентрация соли находящаяся в составе воды.
Противостоять образованию ржавчины можно при использовании разнообразных лаков, призванных защитить от коррозии металла и перехитрить химические законы! Так же, вода вступая в реакцию с нагретым металлом способна образовывать накипь.
Это явление можно наблюдать на частях чайника сделанных из алюминия или стали, который давно не чистили. Такой чайник достаточно прокипятить с лимонной кислотой и он снова будет как новый!
Иногда образование накипи не связано с активными металлами, а имеет немного другую природу. В частности, накипь может появляться из-за солей жесткости в воде. В таком случае нужно купить качественный фильтр для жесткой воды.
ПОИСК
Металлы, гидроксиды которых растворимы в воде, взаимодействуют с водой. При этом образуется гидроксид металла и водород. [c.148]
Примеси в СОз сернистого газа й сероводорода увеличивают скорость окисления никеля.
Имеются сведении об охрупчивании меди при температуре выше 600 С. Прн высоких температурах молибден, ниобий и некоторые другие металлы энергично взаимодействуют с углекислым газом. Скорость коррозии углеродистых сталей в воде, насыщенной СОа. резко увеличивается.
[c.847]
Наука о коррозии и защите металлов изучает взаимодействие металлов с коррозионной средой, устанавливает механизм этого взаимодействия и его общие закономерности. Своей конечной практической целью учение имеет защиту металлов от коррозионного разрушения при их обработке и эксплуатации металлических конструкций в атмосфере, речной и морской воде, водных растворах кислот, солей и щелочей, грунте, продуктах горения топлива и т. д. [c.10]
Символ Са серебристо-белый, мягкий металл энергично взаимодействует с кислородом, окисляясь на воздухе реагирует с водой энергичнее, чем магний, но медленнее, чем щелочные металлы [c.148]
Оксиды щелочных металлов энергично взаимодействуют с водой, образуя гидроксиды [c.302]
Вода при соприкосновении с ювенильной поверхностью титана вытягивает из него ионы Т1 + стандартный электродный потенциал для этого процесса равен — 1,630 В.
Судя по этому электродному потенциалу, титан является электрохимически довольно активным металлом. Однако поверхность титана обыч ю покрыта оксидной пленкой, поэтому практически при обычной температуре вода на титан не действует.
Кипящая вода взаимодействует с порошкообразным титаном с выделением водорода [c.263]
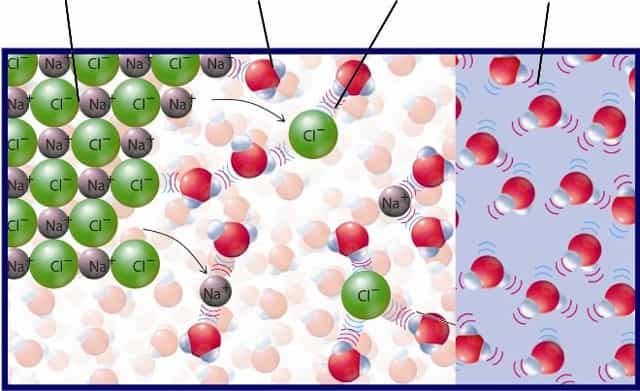
Если в чистую воду погрузить пластинку какого-либо металла,, то согласно гидратной теории Д. И, Менделеева ионы металла будут взаимодействовать с полярными молекулами воды.
Иными словами, поверхностно расположенные катионы этого металла будут гидратироваться молекулами воды и переходить в окружающий раствор, заряжая его положительно, т. е. металл будет как бы растворяться (рис.
54). [c.223]
Взаимодействие с растворами щелочей. Щелочами металлы окисляться не могут, так как щелочные металлы являются одними из наиболее сильных восстановителей. Поэтому их ионы — одни из наиболее слабых окислите.пей и в водных растворах практических свойств окислителя не проявляют.
Однако в присутствии щелочей окисляющее действие воды может проявиться в большей мере, чем в их отсутствие. При окислении металлов водой образуются гидроксиды и водород. Если оксид и гидроксид относятся к амфотерным соединениям, то они будут растворяться в щелочном растворе.
В результате пассивные в чистой воде металлы могут энергично взаимодействовать с растворами щелочей [c.333]
Какие металлы при взаимодействии с водой образуют [c.154]
Многие коррозионные процессы относятся к электрохимическим процессам, складывающимся из двух независимых электродных реакций анодного растворения металла и взаимодействия освобождающихся электронов с ионами водорода, молекулами воды, кислорода и других окислителей. Борьба с коррозией состоит в уменьшении скоростей этих процессов. [c.15]
В атмосфере хлора и фтора щелочные металлы самовоспламеняются. С жидким бромом литий и натрий реагируют замедленно, остальные металлы — бурно, со взрывом. С иодом взаимодействие протекает менее энергично. Литий с водой взаимодействует спокойно, для натрия наблюдается значительный тепловой эф( зект, но выделяющийся водород обычно не воспламеняется. У калия взаимодействие с водой сопровождается самовоспламенением водорода, рубидий и цезий реагируют с водой со взрывом, вытесняют водород из воды (льда) даже при —108 °С. Щелочные металлы взаимодействуют ие только с водой, но и с другими водородсодержащими соединениями, например со спиртами [c.252]
Растворимость одного вещества в другом — свойство, присущее всем веществам. Растворимость может быть неограниченной и крайне малой, что зависит от термодинамических свойств растворяемого вещества и растворителя.
Даже при чрезвычайно малой растворимости одного вещества в другом всегда имеет место переход веществ через поверхность их контакта. Любой металл растворяется в воде, однако растворимость в ряду металлов изменяется в очень широких пределах.
Например, щелочные металлы бурно взаимодействуют с водой, при этом выделяется из воды водород и в растворе образуются гидроксиды металлов. Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается так называемая серебряная вода .
Таким образом, одни металлы активно растворяются в воде, другие — крайне мало. Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает отрасль химической науки — электрохимия. [c.257]
При нагревании все они взаимодействуют с большинством неметаллов, а при сплавлении —с металлами. В обычных условиях только La и Ас разлагают воду, но в нагретом состоянии все четыре металла активно взаимодействуют с водой по уравнению [c.356]
Для основных оксидов характерны ионные или сильно полярные связи в молекуле, что обусловливает прочность их кристаллических решеток и способность быть донорами оксид-ионов.
Эта способность выражается прежде всего в том, что оксиды активных металлов при взаимодействии с водой образуют гидроксиды, являющиеся типичными основаниями.
Оксиды активных металлов способны также нейтрализовать кислоты, являющиеся донорами протонов, посредством связывания последних оксид-ионами в воду. [c.59]
Отношение к воде. Взаимодействие металлов с водой [c.46]
К веществам, вызывающим горение при воздействии на них воды, относятся металлические натрии и калий, карбид кальция, карбиды щелочных металлов, фосфористые кальций и натрий, гидраты щелочных и щелочноземельных элементов и др.
Попадание на такие вещества воды крайне опасно. Например, карбид кальция при действии даже незначительных количеств влаги разлагается с выделением ацетилена.
Реакция экзотермическая и протекает с больтинм выделсипсм тепла (выше 500—700 °С), что вызывает самовоспламсиепие образующегося ацетилена и может привести к взрыву.
Щелочные металлы ири взаимодействии с водой окисляются, выделяя большое количество тепла, что вызывает самовоспламенение образующегося при этом водорода. В мелко раздробленном виде металлические калий и натрий воспламеняются на влажном воздухе. [c.53]
Отношение к воде. Вода при обычной температуре не действует на титан, цирконий и гафний. Кипящая вода взаимодействует с порошкообразными металлами с выделением водорода [c.80]
Гидриды переходных металлов по внешнему виду и некоторым свойствам подобны металлам. Характер химической связи в этих гидридах близок к металлической. Они также обладают восстановительными свойствами, но менее активны, чем ионные гидриды. Большинство из них с водой взаимодействует слабо. [c.256]
Гидроксиды остальных щелочноземельных металлов получаются взаимодействием оксидов с водой, например [c.260]
Соли щелочно-земельных металлов получают взаимодействием оксидов пли гидроксидов с кислотами. Галогениды (т. е. фториды, хлориды, бромиды и иодиды) этих металлов — бесцветные кристаллические вещества, хорошо растворимые в воде (кроме фторидов кальция и магния), сильно диссоциируют в растворах. Фосфаты практически в воде нерастворимы. [c.296]
НЫОз —сильная кислота и сильный окислитель. Поэтому она взаимодействует почти со всеми металлами.
При взаимодействии азотной кислоты с металлами водород, как правило, не выделяется он окисляется, образуя воду.
Кислота же, в зависимости от концентрации и активности металла, может восстанавливаться до N02, N0, N20, N2 или NHэ. Третьим продуктом реакции является соль азотной кислоты. [c.228]
Подобно солеобразным нитридам магния и щелочноземельных металлов, энергично взаимодействует с водой [10] [c.23]
Коррозия — это самопроизвольный процесс разрушения металлов при взаимодействии их с окружающей средой (кислородом, углекислым газом, сернистым газом, водой). [c.278]
Оксиды металлов при взаимодействии с водой образуют гидроксиды металлов. Водные растворы гидроксидов металлов называются щелочами. [c.107]
Символ Ма серебристо-белый, очень мягкий металл, янергично взаимодействует с кислородом, быстро окисляясь на воздухе. Бурно реагирует с водой с выделением водорода и образованием гидроксида натрия [c.144]
К товарным маслам, составлявшимся из этих эфиров и SS-903 или SS-906, нередко добавлялись антиокислитель-ные и антикоррозионные добавки месулфол П и KSE, задачей которых являлось предохранение поршневых колец от пригорания и подшипников из цветных металлов от выкрашивания. Месулфол II готовился следующим образом. Амилксан-тат, растворенный в кетонах, спирте или воде, взаимодействовал с этилендихлоридом при 70° [c.425]
Поскольку ионы металлов несут на себе положительные заряды, они притягивают к себе неподеленные электронные пары молекул воды. Это взаимодействие, называемое гидратацией, как раз и является главной причиной растворения солей металлов в воде, о чем уже говорилось в разд. 12.2, ч. 1.
Сила притяжения возрастает с увеличением заряда на ионе металла и с уменьшением его размеров. Хорошей мерой прочности гидратации служит отношение ионного заряда к ионному радиусу. Для некоторых ионов металлов это отношение указано в табл. 15.7.
В рамках представлений Льюиса процесс гидратации можно рассматривать как взаимодействие кислоты и основания, причем ион металла играет роль льюисовой кислоты, а молекулы воды-роль льюисовых оснований.
Когда молекула воды взаимодействует с положительно заряженным ионом металла, электронная плотность оттягивается от атома килорода, как показано [c.100]
Характерным свойством ионов металлов является их способность вести себя как льюисовы кислоты, или акцепторы электронных пар, по отношению к молекулам воды, которые выступают в роли льюисовых оснований, или доноров электронных пар (см. разд. 15.10). С ионами металлов кроме воды могут взаимодействовать и другие льюисовы основания, особенно ионы переходных металлов.
Такие взаимодействия весьма существенным образом сказываются на растворимости солей металлов. Например, соль Ag l, для которой ПР = l,82 10 °, растворяется в водном растворе аммиака благодаря взаимодействию между ионом Ag и льюисовым основанием NHj.
Этот процесс можно рассматривать как совокупность двух последовательных реакций равновесия растворения Ag l и взаимодействия льюисовой кислоты Ag» [c.130]
Щелочные металлы энергично взаимодействуют с водой, вытесняя из нее водород и образуя соответствующие гидроксиды.
Активность взаимодействия этих металлов с водой возрастает по мере увеличения порядкового номера элемента.
Так, литий реагирует с водой без плавления, иатрий — плавится, калий — самовозгорается, взаимодействие рубидия и цезия протекает еще более энергично. [c.127]
Другая большая группа силикатов имеет слоистую структуру с относительно большим расстоянием между слоями. Эти слои притягиваются к размещающимся между ними катионам металлов.
Это взаимодействие слабее, чем энергия ковалентной полярной связи между атомами кислорода и кремния, находящихся в плоскости. Поэтому слоистые минералы легко расщепляются на чешуйки. К ним относятся слюда, тальк. В минералах глины, находящиеся между с.
гюями катионы металлов, могут присоединять воду, что вызывает увеличение расстояния межд , слоями — глина набухает. [c.613]
Многие металлы медленно взаимодействуют с водной взвесью иода. Реакцию можно ускорить при наличии в воде веществ, иовышающи.х растворимость иода, например спирта. Смесь растертого иода с водой помещают в коническую колбу и добавляют порошок металла. На 1 мае. д. иода необходимо брать 5—6 мае. д.
воды металл берут в небольшом избытке по сравнению с теоретически необходимым количеством. Скорость реакции зависит от степени окисленности металла и от его химической природы. Реакция идет с небольшим разогреванием. Если разогревания раствора не происходит, то к нему прибавляют спирт.
При значительном разогревании, что наблюдается, когда берут мелкодисперсный металл, раствор нужно охлаждать водой. Когда реакция закончится, раствор некоторое время кипятят, чтобы нод полностью прореагировал. Прозрачный раствор отфильтровывают от осадка и оставляют кристаллизоваться.
Этим методом можно получить кристаллогидраты разнообразных иодидов железа, кобальта, никеля, магния, цинка, кадмия и т. д. [c.45]
Существует предположение, что главным исходным материалом для построения живого вещества служили углеводороды, возникавшие за счет взаимодействия воды с карбидами металлов.
Такое взаимодействие становйлось возможным при разрывах твердой земной коры в процессе ее геологического переформирования.
Одновременно с углеводородами, за счет разложения водой нитридов, мог выделяться аммиак, азот которого использовался затем при образовании белковых молекул. [c.570]
Связи в кристаллах основных оксидов (например, NaaO, aO) существенно ионные или, во всяком случае, сильно полярные, что обуславливает их прочность, твердость, упругость, тугоплавкость и способность быть донорами окогд- ионов.
Эта способность выражается в том, что оксиды наиболее активных металлов при взаимодействии с водой образуют гидроксиды— типичные основания. Оксиды активных металлов способны нейтрализовать кислоты, являющиеся донорами протонов, связывая их оксид-ионами в воду.
[c.76]
Li20 с водой реагирует медленно с образованием плохо растворимого в воде LiOH. Остальные оксиды с водой взаимодействуют энергично с образованием щелочей. Гидроксиды щелочны с металлов (кроме LiOH) плавятся без разложения. [c.488]
Свыше 90% всей массы клетки приходится на долю воды. Молекулы воды взаимодействуют с ионами металлов, образуя акваионы. Одна из наиболее характерных особенностей живых систем — это образование макромолекул — биополимеров. Существуют три наиболее важных типа биополимеров полисахариды, белки и нуклеиновые кислоты. [c.563]
В отсутствие пассивирования в мелкодисперсном состоянии марганец при нафевании разлагает воду с выделением водорода. Как ахстивный металл энергично взаимодействует с неокисляюшими разбавленньши кислотами. При этом образуются только производные марганца (U) [c.46]
В гидридах щелочных и щелочноземельных металлов водород находится в степени окисления —1. Гидриды щелочных металлов по внещнему виду и физическим свойствам напоминают галогениды соответствующих металлов. При взаимодействии с водой они обра-зуют водород [c.253]
Химические свойства воды. 6 основных типов химических реакций для воды
Химические свойства воды. 6 основных типов химических реакций для воды. ( хороший обзор Новосибирского Университета)
Давайте вспомним все уже известные нам реакции, в которых участвует вода. Для этого вновь напишем уравнения встречавшихся ранее реакций и систематизируем их. Оказывается, вода – весьма активное в химическом отношении вещество.
- 1) Вода реагирует со многими металлами с выделением водорода:
- 2Na + 2H2O = H2 + 2NaOH(бурно)
- 2K + 2H2O = H2 + 2KOH(бурно)
- 3Fe + 4H2O = 4H2 + Fe3O4(только при нагревании)
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
- Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
- C + H2O = H2 + CO(при сильном нагревании)
- CH4 + 2H2O = 4H2 + CO2(при сильном нагревании)
2) Электролиз. Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
3) Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
| SO2 | + | H2O | = | H2SO3 |
| сернистая кислота |
| SO3 | + | H2O | = | H2SO4 |
| серная кислота |
| CO2 | + | H2O | = | H2CO3 |
| угольная кислота |
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:
| CaO | + | H2O | = | Ca(OH)2 |
| гидроксид кальция (гашеная известь) |
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Мы уже встречались с такими оксидами. Это ZnO, TiO2, Cr2O3, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
| CuSO4 | + | 5 H2O | = | CuSO4.5H2O |
| вещество белого цвета (безводный сульфат меди) | кристаллогидрат (медный купорос),синие кристаллы |
- Приведем другие примеры образования гидратов:
- H2SO4 + H2O = H2SO4.H2O (гидрат серной кислоты)
- NaOH + H2O = NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
6) Фотосинтез . Особая реакция воды– синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
Электрохимический ряд напряжений металлов (ЭРН)
| Li | K | Ba | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | Hg | Ag | Pt | Au |
Ряд напряжений металлов широко используется в неорганической химии. В частности, результаты многих реакций и даже возможность их осуществления зависят от положения некоторого металла в ЭРН. Обсудим этот вопрос подробнее.
Взаимодействие металлов с кислотами
Металлы, находящиеся в ряду напряжений левее водорода, реагируют с кислотами — неокислителями. Металлы, расположенные в ЭРН правее Н, взаимодействуют только с кислотами — окислителями (в частности, с HNO3 и концентрированной H2SO4).
- Пример 1. Цинк расположен в ЭРН левее водорода, следовательно, способен реагировать практически со всеми кислотами:
- Zn + 2HCl = ZnCl2 + H2
- Zn + H2SO4 = ZnSO4 + H2
- Пример 2. Медь находится в ЭРН правее Н; данный металл не реагирует с «обычными» кислотами (HCl, H3PO4, HBr, органические кислоты), однако вступает во взаимодействие с кислотами-окислителями (азотная, концентрированная серная):
- Сu + 2HCl ≠
- Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
- Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
Обращаю внимание на важный момент: при взаимодействии металлов с кислотами-окислителями выделяется не водород, а некоторые другие соединения. Подробнее об этом можно почитать здесь!
Взаимодействие металлов с водой
- Металлы, расположенные в ряду напряжений левее Mg, легко реагируют с водой уже при комнатной температуре с выделением водорода и образованием раствора щелочи.
- Пример 3.
Натрий, калий, кальций легко растворяются в воде с образованием раствора щелочи:
- 2Na + 2H2O = 2NaOH + H2
- 2K + 2H2O = 2KOH + H2
- Ca + 2H2O = Ca(OH)2 + H2
Металлы, расположенные в ряду напряжений от водорода до магния (включительно), в ряде случаев взаимодействуют с водой, но реакции требуют специфических условий. Например, алюминий и магний начинают взаимодействие с Н2О только после удаления оксидной пленки с поверхности металла. Железо не реагирует с водой при комнатной температуре, но взаимодействует с парами воды. Кобальт, никель, олово, свинец практически не взаимодействуют с H2O не только при комнатной температуре, но и при нагревании.
Металлы, расположенные в правой части ЭРН (серебро, золото, платина) не реагируют с водой ни при каких условиях.
Взаимодействие металлов с водными растворами солей
- Речь пойдет о реакциях следующего типа:
- металл (*) + соль металла (**) = металл (**) + соль металла (*)
- Хотелось бы подчеркнуть, что звездочки обозначают в данном случае не степень окисления, не валентность металла, а просто позволяют различить металл № 1 и металл № 2.
- Для осуществления подобной реакции необходимо одновременное выполнение трех условий:
- соли, участвующие в процессе, должны растворяться в воде (это легко проверить, пользуясь таблицей растворимости);
- металл (*) должен находиться в ряду напряжений левее металла (**);
- металл (*) не должен реагировать с водой (что тоже легко проверяется по ЭРН).
- Пример 4. Рассмотрим несколько реакций:
- Zn + CuSO4 = ZnSO4 + Cu
- Fe + CuS ≠
- Pb + FeSO4 ≠
- K + Ni(NO3)2 ≠
- Первая реакция легко осуществима, все перечисленные выше условия выполнены: сульфат меди растворим в воде, цинк находится в ЭРН левее меди, Zn не реагирует с водой.
Вторая реакция невозможна, т. к. не выполнено первое условие (сульфид меди (II) практически не растворяется в воде). Третья реакция неосуществима, поскольку свинец — менее активный металл, нежели железо (находится правее в ЭРН). Наконец, четвертый процесс НЕ приведет к осаждению никеля, поскольку калий реагирует с водой; образовавшийся гидроксид калия может вступить в реакцию с раствором соли, но это уже совершенно другой процесс.
Процесс термического распада нитратов
Напомню, что нитраты — это соли азотной кислоты. Все нитраты разлагаются при нагревании, но вот состав продуктов разложения может быть разным. Состав определяется положением металла в ряду напряжений.
- Нитраты металлов, расположенных в ЭРН левее магния, при нагревании образуют соответствующий нитрит и кислород:
- 2KNO3 = 2KNO2 + O2
- В ходе термического разложения нитратов металлов, расположенных в ряду напряжений от Mg до Cu включительно, образуются оксид металла, NO2 и кислород:
- 2Cu(NO3)2 = 2CuO + 4NO2 + O2
- Наконец, при разложении нитратов наименее активных металлов (расположенных в ЭРН правее меди) образуются металл, диоксид азота и кислород:
- Hg(NO3)2 = Hg + 2NO2 + O2
Какие металлы взаимодействуют с водой при обычной температуре
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы.
Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием.
В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме0 – 2e— → Ме+2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO.
Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
- Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
- 2Mg + O2 = 2MgO
- 2Ca + O2 = 2CaO
- 2Ba + O2 = 2BaO
- Ba + O2 = BaO2
- Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
- Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
- Мg + I2 = MgI2 – иодид магния
- Са + Br2 = СаBr2 – бромид кальция
- Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл.
Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена.
Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла.
С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
При воспалении какая базальная температура
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода.
Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO.
В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
- Ве + Н2SO4(разб.) = BeSO4 + H2↑
- Mg + 2HBr = MgBr2 + H2↑
- Ca + 2CH3COOH = (CH3COO)2Ca + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
- С разбавленной азотной кислотой реагируют все металлы IIA группы.
При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
- 4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + N2O↑ + 5H2O
- 4Mg + 10HNO3(сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
- Be + 2H2SO4 → BeSO4 + SO2↑+ 2H2O
- Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
- Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
- 4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S↑ + 4H2O
с щелочами
- Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении.
При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
- Be + 2KOH + 2H2O = H2↑ + K2[Be(OH)4] — тетрагидроксобериллат калия
- При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
- Be + 2KOH = H2↑+ K2BeO2 — бериллат калия
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.






