- Железо
- Медь
- Соединения меди I
- Соединения меди (II)
- Влияние значения стандартной энергии Гиббса на протекание химической реакции
- Гдз к учебнику химия 8 класс еремина в.в. кузьменко н.е. дроздова а.а. лунина в.в. §23 химические свойства водорода решебник ответы
- Получение металлов из оксидов действием водорода
- Восстанавливаемый оксид должен быть мелкодисперсным; реакция с мелкодисперсными металлами-восстановителями протекают со значительной скоростью
- ПОИСК
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

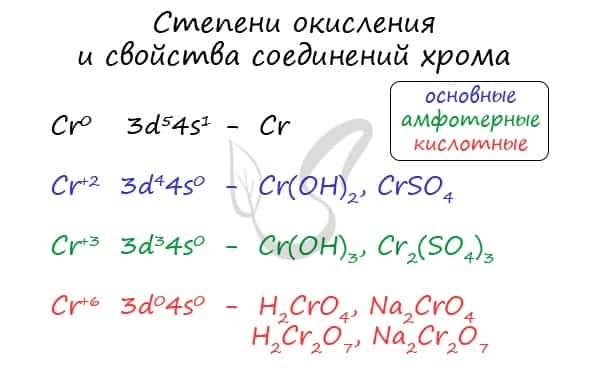
Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.
В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
- Fe(CrO2)2 + C = Fe + Cr + CO
- Cr2O3 + Al = Al2O3 + Cr
- Химические свойства
- Реакции с неметаллами
- Cr + O2 = (t) Cr2O3
- Cr + S = (t) Cr2S3
- Cr + N2 = (t) CrN
- Cr + C = Cr2C3
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.

Протекает в раскаленном состоянии. Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑  Cr + H2SO4(разб.) = CrSO4 + H2↑ С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании. Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Cr + H2SO4(разб.) = CrSO4 + H2↑ С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании. Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него. Cr + CuSO4 = CrSO4 + Cu
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III), реагирует с кислотами, кислотными оксидами.

- CrO + O2 = Cr2O3
- CrO + H2SO4 = CrSO4 + H2O
- CrO + SO3 = CrSO4
- Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

- Cr(OH)2 = (t) CrO + H2O
- Cr(OH)2 + HCl = CrCl2 + H2O
- Cr(OH)2 + SO3 = CrSO4 + H2O
- Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
- H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
- Cr2O3 + Ba(OH)2 → (t°) Ba(CrO2)2 + H2O (прокаливание, хромит бария)
- Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
- Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr+3)

- Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
- Cr2O3 + Al = Al2O3 + Cr
- При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
- K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
- Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
- Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
- Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
- Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
- Na2Cr2O7 + NaOH = Na2CrO4 + H2O
- Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» ?
- (NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит
Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Химические свойства
- Реакции с неметаллами
- Fe + S = FeS (t > 700°C)
- Fe + S = FeS2 (t < 700°C)
- Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов FeO*Fe2O3)
- При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
- Fe + Cl2 = (t) FeCl3
- Fe + P = (t) FeP
- Fe + C = (t) Fe3C
- Fe + Si = (t) FeSi
- Реакции с кислотами
- Железо активнее водорода, способно вытеснить его из кислот.
- Fe + HCl = FeCl2 + H2↑
- На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными серной и азотной кислотами.
- Fe + H2SO4(разб.) = FeSO4 + H2↑
- Реакции с солями
- Восстановительные свойства
- Железо способно восстанавливать соединения железа +3 до +2.
- Fe + Fe2O3 = (t) FeO
- Fe + FeCl3 = (t) FeCl2
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.
Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Соединения железа (II) проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа (II) распадается на соответствующий оксид и воду.
- FeO + H2SO4 = FeSO4 + H2O
- Fe(OH)2 + HCl = FeCl2 + H2O
- Fe(OH)2 = (t) FeO + H2O
При хранении на открытом воздухе соли железа (II) приобретают коричневый цвет из-за окисления до железа +3.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] — гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
- Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
- Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
- При сплавлении комплексные соли не образуются из-за испарения воды.
- Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.
Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
- FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
- Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
- FeCl3 + KCNS = Fe(CNS)3 + KCl
И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
- Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
- Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
- Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O
Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит
- Получение
- Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
- CuFeS2 + O2 = Cu2S + FeS + SO2↑
- Cu2S + O2 = Cu2O + SO2
- Cu2O + Cu2S = Cu + SO2
- Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.
- CuSO4 + Fe = Cu + FeSO4
- Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
- CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
- Химические свойства
- Реакции с неметаллами
- Во влажном воздухе окисляется с образованием основного карбоната меди.
- Cu + CO2 + H2O + O2 = (CuOH)2CO3
- При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
- 4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
- 2Cu + O2 = (t) 2CuO (в избытке кислорода)
- Реакции с кислотами
- Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
- Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
- Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
- С оксидами неметаллов
- Медь способна восстанавливать неметаллы из их оксидов.
- Cu + SO2 = (t) CuO + S
- Cu + NO2 = (t) CuO + N2↑
- Cu + NO = (t) CuO + N2↑
Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
- CuCl2 + Cu = CuCl
- CuO + Cu = Cu2O
- Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
- Cu2O + CO = (t) Cu + CO2
- Cu2O + Al = (t) Cu + Al2O3
- Cu2O + H2 = (t) Cu + H2O
- Оксид меди (I) окисляется кислородом до оксида меди (II).
- Cu2O + O2 = (t) CuO
- Оксид меди (I) вступает в реакции с кислотами.
- Cu2O + HCl = CuCl + H2O
- Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
- CuOH → Cu2O + H2O
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
- Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
- Cu(OH)2 = (t) CuO + H2O
- Cu + O2 = (t) CuO
- Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
- CuO + CO = Cu + CO2
- CuO + C = Cu + CO
- CuO + H2 = Cu + H2O
CuO + H2SO4 = CuSO4 + H2O CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.
CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
- Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди (II) — (CuOH)2CO3)
- Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
- CuSO4 + Na2CO3 + H2O = (CuOH)2CO3 + Na2SO4 + CO2
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду. Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс. Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Влияние значения стандартной энергии Гиббса на протекание химической реакции
- Задача 312. Вычислить значения энергии Гиббса следующих реакций восстановления оксида железа (II):
- Протекание, какой из этих реакций наиболее вероятно? Решение: По табличным данным стандартные значения веществ, участвующих в реакции равны:
- Стандартные значения простых веществ равны нулю. Отсюда, для стандартной энергии Гиббса реакций, находим:
- Так как 1 и 2 > 0, а 3 < 0, то наиболее вероятно протекание реакции (в).
- Ответ: а) 41,7кДж; б) 107,2кДж; в) -13,0кДж.
Задача 313. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: СаО, FеО, СuО, РbО, Fe2O3, Сг2O3? Решение: По табличным данным стандартные значения веществ, участвующих в реакции равны:
- Стандартные значения простых веществ равны нулю. Отсюда, для стандартной энергии Гиббса реакций, находим:
Таким образом, во всех реакциях, кроме реакции (а), значение < 0, т. е. возможно восстановление алюминием всех оксидов, кроме СаО.
Ответ: Все кроме СаО.
Задача 314. Какие из перечисленных оксидов могут быть восстановлены водородом до свободного металла при 298 К: СаО, ZnО, SnО2, NiО, А12O3? Решение: По табличным данным стандартные значения веществ, участвующих в реакции равны
- Стандартные значения простых веществ равны нулю. Отсюда, для стандартной энергии Гиббса реакций, находим:
Таким образом, во всех реакциях. Кроме реакций (в) и (г), значения больше нуля, т е. возможно восстановление водородом только оксидов SnО2 и NiО.
- Ответ: SnО2 и NiО.
- Задача 315. Указать, какие из реакций образования оксидов азота, и при каких температурах (высоких или низких) могут в стандартных условиях протекать самопроизвольно:
Решение: а) Реакция протекает с уменьшением, как общего числа молей веществ, так и газообразных веществ, что приводит переход системы в более высокое состояние упорядоченности ( < 0 ).
Таким образом, в уравнении = Н — Tвеличина будет всегда положительна, так как Н > 0 и при любых температурах член (- T) всегда положителен, поэтому реакция не протекает при любых значениях температуры.
б) В реакции из двух молей простых газообразных веществ образуется два моля сложного вещества, что приводит систему к более низкому состоянию упорядоченности, > 0.
Таким образом, в уравнении = Н — T член (Н ) положителен, а член (- T ) при всех значениях Т будет иметь положительное значение, поэтому член () будет иметь отрицательное значение при достаточно высоких значениях температуры.
Реакция может протекать при достаточно высоких температурах.
в) Реакция протекает с уменьшением, как общего числа молей веществ, так и газообразных веществ, что приводит переход системы в более высокое состояние упорядоченности < 0 ).
Таким образом, в уравнении ( = Н — T) член (- T ) при любых значениях Т будет положителен. Поэтому будет иметь отрицательное значение при Н < 0 только при достаточно низких значениях Т, т.е.
данная реакция при стандартных условиях не протекает.
г) Реакция протекает с уменьшением, как общего числа молей веществ, так и газообразных веществ, что приводит переход системы в более высокое состояние упорядоченности < 0 ).
Таким образом, в уравнении ( = Н — T ) член(- T) при любых значениях Т будет положителен, поэтому при Н < 0 член будет иметь отрицательное значение при достаточно низких температурах, т.е.
данная реакция при стандартных условиях не протекает.
д) Реакция протекает с уменьшением, как общего числа молей веществ, так и газообразных веществ, что приводит переход системы в более высокое состояние упорядоченности < 0 ).
Таким образом, в уравнении ( = Н — T) член (- T) при любых значениях Т всегда будет положителен, поэтому и член , при Н и (- T) положительных, будет всегда иметь положительное значение.
Реакция невозможна при любых температурах.
Так как достижение низких температур нереально, то из рассмотренных реакций в обычных условиях возможна только реакция (б) да и то только при достаточно высоких температурах.
Ответ: б).
Гдз к учебнику химия 8 класс еремина в.в. кузьменко н.е. дроздова а.а. лунина в.в. §23 химические свойства водорода решебник ответы
Гдз к учебнику химия 8 класс еремина в.в. кузьменко н.е. дроздова а.а. лунина в.в. §23 химические свойства водорода решебник ответы
Другие задания смотри здесь…
| Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1К какому типу относятся реакции водорода: а) с кислородом;
- 2H2 + O2 = 2H2O ― реакция соединения
- H2 + S = H2S ― реакция соединения
- PbO + H2 = Pb + H2O ― реакция замещения
- Задание 2
б) с серой;в) с оксидом свинца (II)? Почему нельзя поджигать водород, предварительно не проверив его на чистоту? Водород способен загораться на воздухе, иногда со взрывом. Смесь водорода и кислорода в соотношении 2:1 называют гремучим газом, поэтому необходимо проверить водород на чистоту и убедиться, что мы имеем дело с чистым водородом, а не с гремучим газом.
Задание 3
Можно ли водород использовать в газовых плитах вместо природного газа? Аргументируйте свой ответ. Нельзя, т.к. водород способен загораться на воздухе, иногда со взрывом, что несет собой угрозу жизни и здоровью находящихся рядом людей.
Задание 4
Сравните химические свойства кислорода и водорода.
Кислород ― окислитель, он превращает металлы в оксиды, а водород ― восстановитель, с его помощью можно получить металлы из их оксидов.
2Cu + O2 = 2CuO CuO + H2 = Cu + H2O Водород и кислород реагируют с неметаллами, с образованием соответственно гидридов и оксидов.
H2 + S = H2S
S + O2 = SO2
- Задание 5
- H2 + Cl2 = 2HCl
- Задание 6
При горении водорода в хлоре образуется газ хлороводород HCl. Напишите уравнение реакции. Напишите уравнение реакции образования аммиака NH3 из простых веществ. N2 + 3H2 = 2NH3
Задание 7
Какие из нижеперечисленных оксидов могут быть восстановлены водородом до металла: оксид меди (II), оксид калия, оксид олова (IV), оксид цинка, оксид алюминия, оксид золота (III)? Оксид меди (II), оксид олова (IV), оксид цинка и оксид золота (III), т.к. соответствующие им металлы не стоят в ряду активности металлов левее марганца.Напишите уравнения реакций.
CuO + H2 = Cu + H2O
SnO2 + 2H2 = Sn + 2H2OZnO + H2 = Zn + H2O Au2O3 + 3H2 = 2Au + 3H2O
Задание 8
Оксиды некоторых неметаллов также могут быть восстановлены водородом. Напишите уравнение реакции восстановления оксида азота (IV). 2NO2 + 4H2 = N2 + 4H2O
Задание 9
При неполном восстановлении минерала пиролюзита (оксид марганца (IV)) был получен оксид марганца (II). Напишите уравнение реакции. MnO2 + H2 = MnO + H2O
Задание 10
Оксид ртути (II) при нагревании легко разлагается на простые вещества.
Почему при восстановлении его водородом может произойти взрыв, даже если водород был предварительно проверен на чистоту? Для восстановления оксида ртути (II) с помощью водорода его необходимо нагреть, а при нагревании оксид ртути (II) разлагается на ртуть и кислород. В свою очередь образовавшийся кислород с водородом образуют гремучую смесь, которая при нагревании взрывается.Напишите уравнения реакций.
2HgO = 2Hg + O22H2 + O2 = 2H2O
Задание 11
Как из медной пластинки химическим способом можно получить тонко измельчённый медный порошок? Прокалить медную пластинку, образовавшийся черный налёт нужно соскобить и на него при нагревании подать водород, восстанавливая таким образом медь из ее оксида.2Cu + O2 = 2CuOCuO + H2 = Cu + H2OДругие задания смотри здесь…
Получение металлов из оксидов действием водорода
О способности оксидов восстанавливаться водородом, можно судить в первом приближении по термодинамическим данным (табл. 1).
Термодинамические расчеты и эксперимент подтверждают, что водород наиболее легко восстанавливает металлы из тех оксидов, которые образуются с выделением небольшого количества тепла (оксиды меди, железа, кобальта).
Металлы, оксиды которых имеют большие теплоты образования по абсолютному значению (оксиды алюминия, магния, титана, циркония), с помощью водорода практически не получаются.
Восстановление металлов из оксидов водородом — гетерогенный равновесный процесс, выгодно отличающийся от металлотермических реакций тем, что пары воды можно легко удалить из реакционного пространства, сместив тем самым равновесие в сторону продукта.
Изучение кинетики реакции восстановления металлов из их оксидов показало, что процесс этот заключается в адсорбции водорода на активных центрах оксида с последующей десорбцией паров воды.
Роль этих активных центров могут выполнять следы различных примесей, всегда имеющиеся в исходных оксидах, например, оксиды легко восстанавливаемых металлов или примеси некоторых металлов.
Наличие этих примесей может менять характер восстановления: например, ускорять его, или даже изменять константу равновесия.
При решении вопроса о том, возможно ли восстановление металла из данного оксида, следует учитывать также скорость установления равновесия, особенно при невысоких температурах.Чем медленнее устанавливается равновесие, тем больше времени потребуется затратить для получения металла.
| Таблица 1 – Термодинамические константы оксидов (298 К) | |||
| оксид | DН°обр., кДж/моль | DG°обр., кДж/моль | S°, Дж/(моль×K) |
| CuO | -162 | -129,4 | 42,63 |
| Bi2O3 | -577,8 | -497,3 | |
| CrO3 | -585,76 | -506,26 | 71,96 |
| PbO | -219,3 | -189,1 | 66,2 |
| Pb3O4 | -723,4 | -606,2 | 211,3 |
| PbO2 | -276,6 | -218,3 | 74,89 |
| CoO | -239,3 | -213,4 | 43,9 |
| NiO | -239,7 | -251,6 | 37,99 |
| MnO2 | -521,5 | -466,7 | 53,1 |
| GeO2 | -554,7 | -500,8 | 55,27 |
| Fe2O3 | -822,2 | -740,3 | 87,4 |
| SnO2 | -580,8 | -519,9 | 52,3 |
| SnO | -286 | -256,9 | 56,5 |
| ZnO | -350,6 | -320,7 | 43,64 |
| Cr2O3 | -1140,6 | -1056 | 81,2 |
| TiO2 | -943,9 | -888,6 | 50,33 |
| B2O3 | -1254 | -1193,7 | 80,8 |
| Al2O3 | -1676 | -1582 | 50,92 |
| MoO3 | -745,2 | -668,1 | 77,74 |
| WO3 | -842,7 | -763,9 | 75,94 |
| Li2O | -595,8 | -562,1 | 37,89 |
| Na2O | -416,0 | -377,1 | 75,27 |
| K2O | -363,2 | -322,1 | 94,1 |
Иногда получить металл совсем не удается, хотя с термодинамической точки зрения реакция вполне вероятна. Так, оксиды меди, кобальта, никеля (теплота образования которых не превышают 750 кДж/моль по абсолютному значению), легко восстанавливаются при температуре 350-500°С.
Некоторые оксиды этого ряда (СrО3, МоО3, MnO2, WO3) при этой температуре не восстанавливаются водородом до металла. Объясняется это тем, что восстановление водородом элементов, которые могут существовать в различных степенях окисления, протекает ступенчато.
Сначала из высших оксидов сравнительно легко образуются оксиды в промежуточной степени окисления, а затем при более высоких температурах из них получаются соответствующие металлы. Однако этого не всегда можно добиться.
В частности, при восстановлении марганца из двуокиси можно получить лишь оксид марганца (II), из которого получить металл очень трудно. Как правило, с уменьшением степени окисления металла прочность оксидов возрастает, а их способность к восстановлению уменьшается.
Количество водорода, необходимое для восстановления металла из его оксида, нужно вычислять не по стехиометрическому уравнению, а на основании константы равновесия, которую устанавливают экспериментально и по которой определяют процент использования водорода.
Как правило, при высоких температурах для восстановления металла требуется водорода несколько больше, чем при низких температурах. На практике при низких температурах восстановление не проводят, потому что скорость реакции очень мала.
Применение избыточного количества водорода с целью смещения равновесия дает незначительный эффект и приводит к непроизводительным затратам водорода.
Необходимо также учитывать величину поверхности соприкосновения оксида с водородом. Сильно прокаленные оксиды, имеющие крупнокристаллическую структуру, вступают в реакцию с водородом труднее, чем мелкодисперсные. При малой поверхности соприкосновения водород, для более полного его использования, следует пропускать медленнее.
Большинство металлов, получаемых описанным методом, прочно удерживает следы растворенного кислорода; его остатки удаляются с большим трудом и часто только при сплавлении металла в атмосфере сухого водорода.
Однако после такой переплавки в металле обычно содержится некоторое количество растворенного водорода, удалить который можно только повторной длительной выдержкой расплавленного металла в глубоком вакууме.
Физические свойства и химическая активность получаемых металлов зависят от температуры восстановления. Металлы, получаемые при низких температурах, имеют большую поверхность и очень реакционноспособны.
Некоторые из них получаются пирофорными и на воздухе часто самовозгораются.
Повышение температуры восстановления приводит к укрупнению частичек металла и уменьшение их поверхности; внутренняя структура частичек металла делается упорядоченной, дефектность уменьшается, в результате чего химическая активность металла сильно снижается.
Если температура восстановления близка к температуре плавления, металлы получаются в виде плотной губки. В сплавленном состоянии металлы получаются при более высоких температурах, чем их температуры плавления.
Если температура восстановления выше 600 – 650оС, то реакцию проводят в трубчатых электрических печах. В этом случае оксиды помещают в фарфоровую или кварцевую лодочку, которую вставляют в реактор (фарфоровая или кварцевая трубка).
Концы трубки закрывают резиновыми или хорошими корковыми пробками, в которые вставляют с одного конца трубку, подводящую водород, а с другого – трубку, отводящую пары воды и непрореагировавший водород.
При температуре 550-600оС и ниже реакцию можно вести не в лодочке, а прямо в стеклянной трубке или трубке с перетяжками.
Окончание реакции восстановления оксидов определить довольно трудно. Об этом можно судить по изменению цвета или по уменьшению массы оксида, но только в том случае, если он имеет постоянный и известный состав. Практически водород пропускают в избытке в течение 20 – 30 мин, после чего реакцию считают доведенной до конца.
Когда восстановление проводят в прозрачных трубках и при температуре, несколько превышающей точку плавления металла, об окончании реакции можно судить по образованию металлических корольков (особенно хорошо это видно при получении свинца, висмута, сурьмы).
Если восстанавливаются малостойкие оксиды, то в конце трубки собираются капельки воды, что также можно считать признаком окончания реакции.
Малостойкие оксиды, например платины, могут при нагревании в атмосфере водорода быстро разлагаться, при этом в реакторе образуется гремучая смесь, что иногда приводит к взрыву.
Для измерения температур ниже 500оС можно использовать термометр, для более высоких температур применяют термопару. Так как при восстановлении водородом не требуется очень точного соблюдения температурного режима, термопару можно поместить вне реакционной трубки, с ее наружной стороны, но в непосредственной близости от лодочки.
Собранную установку необходимо обязательно проверить на герметичность. Для этого через установку пропускают ток водорода, а трубку, отводящую водород, погрузить на 3-4 см в воду. Если водород пробулькивает через слой воды, то прибор герметичен.
Другой способ проверки герметичности (лучший в том случае, когда водород получают в аппарате Киппа). Через установку пропускают водород, а затем закрывают выходное отверстие газоотводной трубки. При полной герметичности прибора ток водорода скоро прекращается, об этом можно судить, наблюдая за счетчиком пузырьков.
Восстанавливаемый оксид должен быть мелкодисперсным; реакция с мелкодисперсными металлами-восстановителями протекают со значительной скоростью
Металлы и сплавы, получаемые металлотермическим способом, всегда содержат различные загрязнения (примеси), характер и количество которых определяются многими факторами.
В первую очередь – это непрореагировавший металл-восстановитель, а также примесь из стенок реактора. Таким образом, данный метод непригоден в тех случаях, когда требуется получить чистые металлы.
Показать опыт – получение железа методом алюмотермии.
О способности оксидов металлов восстанавливаться водородом можно судить по теплотам образования оксидов.
Водородом наиболее легко восстанавливаются оксиды, которые образуются с выделением небольшого количества теплоты.
Из оксидов, имеющих большие значения теплоты образования, например, из оксидов алюминия, магния, титана, циркония, металл практически не восстанавливается при действии водородом:
Рассчитайте термодинамические характеристики процесса:
А12О3 + 3Н2 = 3Н2О + 2А1
При решении вопроса о том, возможно ли восстановление металла из оксида, следует учитывать скорость установления равновесия, особенно при невысоких температурах. Чем медленнее устанавливается равновесие реакции, тем больше времени потребуется затратить для получения металла. Иногда получить металл совсем не удается, хотя термодинамически реакция вполне вероятна.
Водород как восстановитель все же выгодно отличается от металлов тем, что реакции с ним являются гетерогенными. И что в этом случае пары воды можно легко удалить из реакционного пространства, сместив тем самым равновесие в сторону получения металла.
Оксиды меди, кобальта, никеля и железа легко восстанавливаются при 350-500оС . Однако некоторые оксиды, например, CrO3, MoO3, MnO2, WO3 при такой температуре не восстанавливаются водородом до металла.
Объясняется это тем, что восстановление водородом элементов, которые могут существовать в различных степенях окисления, протекает ступенчато. Сначала из высших оксидов из них получаются низшие оксиды, а затем при более высоких температурах образуются соответствующие металлы. Этот процесс происходит крайне тяжело.
С уменьшением степени окисления металла в оксидах прочность оксидов увеличивается, а способность к восстановлению уменьшается.
Реакцию восстановления водородом проводят, придерживаясь следующего правила: при высоких температурах пропускают водород над оксидом с большей скоростью, а при низких температурах, когда скорость реакции мала, с очень небольшой скоростью, но в течение длительного времени. МОЖНО ПОКАЗАТЬ ОПЫТ ВОССТАНОВЛЕНИЕ ОКСИДА МЕДИ ВОДОРОДОМ
Оксид меди с сухим водородом начинает реагировать уже при температуре около 150ос с образованием активного мелкодисперсного продукта розового цвета меди. Однако восстановление при этой температуре требует довольно длительного времени. При температуре восстановления около 500оС медь получается в виде спекшийся, но легко измельчаемой массы.
Для получения многих металлов (меди, железа, кобальта, молибдена, никеля и др.) в качестве восстановителей применяют неметаллы – кремний и бор.
Гидрометаллургия охватывает способы получения металлов из растворов их солей. Металл, входящий в состав руды, сначала переводят в раствор с помощью подходящих реагентов, а затем извлекают из этого раствора. Например, медную руду, содержащую CuO, обрабатывают разбавленной серной кислотой:
- CuO + H2SO4 = CuSO4 + H2O,
- затем медь извлекают из раствора либо электролизом, либо вытеснением с помощью порошка железа:
- Fe + CuSO4 = FeSO4 + Cu
Здесь можно показать химический эксперимент «сатурново дерево» и др. При этом, как вы знаете, более активный металл вытесняет менее активный из растворов его солей.
Критерием самопроизвольного протекания реакции является значение ЭДС, рассчитанное как разность стандартных окислительно-восстановительных потенциалов окислителя и восстановителя.
Чем больше разность, тем больше ЭДС и больше величина константы равновесия. Выпишем значение потенциалов для данного процесса:
- Fe0 — 2e = Fe2+ 2 восстановитель Е0 = -0,44 В
- Cu2+ + 2e = Cu0 2 окислитель Е0 = +0,34 В
- ЭДС = +0,34 – (-0,44) = + 0,78 В >0 реакция протекает самопроизвольно в стандартных условиях.
Электрометаллургия охватывает способы получения металлов с помощью электролиза. Электролизом называют совокупность химических процессов, которые протекают под действием электрического тока на электродах, погруженных в раствор или расплав электролита.
Электродами для электролиза могут служить различные электропроводящие материалы. Инертные электроды (платина, графит) в ходе электролиза остаются без изменения, т.е. не окисляются под действием электрического тока. Растворимые электроды (медь, никель и др.
) окисляются под действием электрического тока.
На катоде происходит процесс восстановления, на аноде – окисления. Любой электролиз – процесс несамопроизвольный, т.е. требует затраты энергии в виде электрического тока.
Между катодом и анодом обычно устанавливают полунепроницаемую перегородку, пропускающие ионы, но не пропускающую молекулы, чтобы исключить возможность взаимодействия продуктов электролиза, накапливающихся в приэлектродном пространстве.
ПОИСК
На восстановление 1,80 г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла. [c.9]
При восстановлении водородом 1,34 г оксида металла до металла образовалось 0,324 г Н2О. Вычислить эквивалент металла. [c.6]
Для полного восстановления 1,59 г оксида металла до металла потребовалось 478 мл водорода (при 7°С и 97,3 кПа). Вычислить эквивалент металла. [c.14]
На восстановление оксида металла массой 3,6 г израсходовано водорода объемом 1,77 л (н. у.). Вычислите эквивалентную массу металла. [c.9]
На восстановление оксида металла массой 1,8 г израсходован водород объемом 833 мл (н. у.). Найдите Л (/зкв(Х)Х) металла. Ответ 16,2 г/моль. [c.29]
РАБОТА 38. ВОССТАНОВЛЕНИЕ ОКСИДОВ МЕТАЛЛОВ (ВОЛЬФРАМА, ТИТАНА И АЛЮМИНИЯ) ВОДОРОДОМ [c.140]
РИС. 46. Прибор для восстановления оксидов металлов водородом [c.201]
Каталитическое восстановление оксидов азота. Проводят 13 присутствии в качестве катализаторов сплавов из металлов платиновой группы (палладий, рутений, платина, родий) или составов, содержащих никель, хром, медь, цинк, ванадий, церий и др. Восстановителями служат водород, оксид углерода, метан п другие углеводороды [c.65]
Определение основано на восстановлении оксида металла водородом при нагревании. По разности масс оксида и металла, полученного в результате восстановления, находят содержание кислорода в оксиде отсюда вычисляют эквивалент металла. [c.40]
При восстановлении оксида металла (II) водородом получают металл и воду [c.145]
При восстановлении оксида металла (П) водородом образуется металл. Зная количество оксида металла (П) и массу восстановленного металла, можно определить массу моля металла по уравнению реакции [c.109]
При высокой температуре водород может отнимать кислород от многих соединений, в том числе от большинства оксидов металлов. Напрнмер, если пропускать водород над накаленным оксидом меди, то происходит восстановление меди [c.346]
Если же РнгО = 303,972 кПа, то прямая реакция будет идти до тех пор, пока давление пара воды в реакции не достигнет этого значения. Восстановление оксида металлов водородом — процесс гетерогенный.
Наличие газовой фазы позволяет в каких-то пределах управлять скоростью прямой реакции.
Например, пары воды, которые образовались при восстановлении оксидов, можно удалить из зоны реакции, сместив тем самым равновесие в сторону получения металлов. [c.141]
Вещества, имеющие свой особенный состав, но заимствующие внешний габитус исходных веш еств, являются псевдоморфозами. Они часто встречаются в природе.
Как известно, осторожное окисление металлов, восстановление оксидов металлов приводят к образованию соответствующих псевдоморфоз.
С этим явлением давно связывают активность катализаторов, объясняя это накоплением повыщенного запаса энергии псевдоморфным веществом. Как мы уже отмечали выше, на примере окисления водорода на [c.180]
Задача Н-45. Твердым продуктом реакций полного восстановления оксида металла водородом или оксидом углерода (II) является свободный металл [c.198]
Образцы железа, никеля, кобальта, поверхность которых окислена, активно разлагают перекись водорода, однако под слоем перекиси разложение тотчас же резко замедляется, по-видимому, в связи с протеканием реакции восстановления поверхностного оксида металла [c.54]
Карбиды и нитриды получают непосредственным синтезом из элементов, восстановлением оксидов металлов углем (получение карбидов), взаимодействием металла с аммиаком (получение нитридов) и другими методами.
Перспективным методом получения карбидов и нитридов высокой чистоты является осаждение их из газовой фазы. Первое соединение (2гС) было получено таким способом в атмосфере водорода по схеме [c.
244]
При взаимодействии с влажным воздухом ионные гидриды металлов могут воспламеняться. Они применяются для восстановления оксидов металлов до металла, получения металлических порошков и водорода. [c.256]
Посуда, приборы и реактивы установка для восстановления оксидов металлов водородом, химический стакан, пробирки, центрифуга, никелевые контейнеры, прибор для фильтрования, фильтровальная бумага, электроплитка, вольфрамат натрия, соляная кислота, оксид алюминия, оксид титана. [c.141]
Второй стадией является сама гетерогенная химическая реакция (например, окисление фосфора, растворенного в жидкой стали, продуваемым через нее кислородом, или восстановление оксидов металлов водородом). [c.468]
В результате этой реакции образуются водород, используемый для гидрирования, и азот — для получения нитридов металлов в восстановительной атмосфере. Безводный аммиак пропускают через трубчатый реактор (рис. 2) при температуре около 600 °С.
Обычно процесс ведут при атмосферном давлении или при давлении 25 фунт/дюйм . В качестве катализаторов применяют восстановленные оксиды железа и никеля, а также металлический рутений на активированном угле или а-оксиде алюминия. [c.
152]
Частицы малых размеров могут быть получены либо измельчением вещества, либо объединением очень мелких частиц (атомов, молекул и др.). Как показывает опыт, путем механического измельчения не удается уменьшить средний размер частиц ниже 0,01 мкм.
Более высокодисперсные частицы удается получить методом термического разложения соединения или химического восстановления соединения. В качестве восстановителя используются водород, боргидриды металлов, формальдегид, гидразин и другие. Удельная площадь поверхности частиц, полученных этим методом, колеблется в широких пределах, от 10 до 10 м /г [10].
Более высокую степень дисперсности удается достичь при восстановлении оксидов металлов. [c.31]
Большинство металлов содержится в природе в виде их оксидов или сульфидов. Металлургический процесс извлечения металлов из руд заключается в восстановлении оксидов металлов.
Сульфиды металлов предварительно окисляют, а затем также восстанавливают. В качестве восстановителей используют углерод, водород или металл.
Кроме того, некоторые металлы получают электролизом расплава их солей. [c.67]
Другой тип химического взаимодействия между металлом и его носителем наблюдался для платины на оксиде алюминия при высокотемпературном восстановлении водородом. Часть оксида алюминия образует с платиной твердый раствор.
В настоящее время еще не ясно, насколько распространен или важен этот эффект. Естественно, можно ожидать, что иримесь в носителе, такая, как железо в оксиде алюминия, может сплавиться с нанесенным металлом.
Такое сплавление может существенно влиять на каталитические свойства. [c.14]
В качестве примера диссоциативной хемосорбции можно привести адсорбцию водорода на переходных металлах На2М2МН. При взаимодействии молекулы водорода с поверхностью металла электроны с ВЗМО молекулы водорода переходят на свободные -орбитали переходного металла.
Распад молекулы водорода может протекать по гомолитическому или гетеролитическому механизму (см. 221). На оксидах —полупроводниках типа N10, СГ2О3 и др. — хемосорбция водорода сопровождается восстановлением оксидов с образованием гидроксидов металлов [c.
642]
Как повлияет на глубину процесса восстановления а) повышение общего давления системы б) повышение температуры системы в) вентиляция системы потоком водорода г) увеличение количества оксида металла [c.152]
Для многих металлов формой, подлежащей восстановлению, является оксид. Поэтому сульфидные руды для перевода в оксидную форму подвергают обжигу. Водородным восстановлением оксидов получают такие металлы, как Мо, АУ, Не и т. п. Водород — сравнительно мягкий восстановитель. Карботермическое восстановление используют для получения Ре, РЬ, 5п, Си, 2п, N1, Со, Мп и др.
Более энергичным восстановителем является металлический алюминий. Алюмотермия широко используется для получения таких металлов, как Сг, Мп, Ре (алюмотермическая сварка), щелочно-земельные металлы. Восстановление оксидов металлов алюминием протекает с большим выделением теплоты, что обусловлено высоким сродством алюминия к кислороду.
Еще энергичнее как восстановитель действует магний, который используют для восстановления как оксидов (например, В2О3), так и галогенидов (например, при получении титана и его аналогов). Наконец, самые активные металлы — алюминий, магний, щелочно-земельные и щелочные — получают электролизом расплавов солей (как правило, хлоридов илп фторидов).
Катод электролизера можно рассматривать как наиболее энергичный восстановитель — непосредственный донор электронов. [c.44]
Физ.-хим. методы получеиия металлич. порошков включают восстановление оксидов металлов углеродом, водородом или углеводородсодержащими газами металлотермич. способы-восстановление оксидов, галогенидов или др. соед. металлов др. металлами (см. Металлотермия) разложение карбонилов металлов, металлоорг. соед. электролиз водных р-ров и расплавов солей. Порошки металлоподобных соед. получают теми же методами и, кроме того, синтезом из простых в-в. [c.74]
КН + НОН = КОН + На При взаимодействии с влажным воздухом ионные гидриды металлов могут воспламеняться. Они применяются для восстановления оксидов металлов до металлов, получения металлических порошков и водорода.
В комплексных гидридах ионы Н играют роль лигандов. В качестве примера таких гидридов можно привести алюмогидриды [А1Н4] и борогидриды [ВН4] .
Борогидриды — достаточно устойчивые соединения, в то время как алюмогидриды легко разлагаются водой с выделением водорода [c.387]
Для производства спеченных деталей методом порошковой металлургии выпускают диффузионно-легированные порошки сталей (ОАО Полема ), получаемые восстановлением в водороде смеси оксидов металлов и порошков железа, и распыленные порошки (Опытный завод ЦНИИЧМ) (табл. 3.13). [c.141]
В качестве восстановителя применяют также водород. Восстановление исходного вещества водородом обеспечивает наибольшую чистоту получаемого простого вещества. Восстановление водородом используется, например, для получения вольфрама из УОз, очень чистого железа из его оксидов, ряда благородных металлов [1 е из ЫН4Не04, Оз из (ЫНДа ОзС1б]. [c.242]
Получение. Соли или оксиды Ga, In, TI выделяют в результате сложной переработки отходов производства алюминия и обработки полиметаллических руд. Электролизом подкисленных водных растворов солей или восстановлением оксидов (углем, водородом) получают металлы.
Выделенные металлы очищают зонной плавкой или методами амальгамной металлургии (см. разд. 7.4.3 и 8.9). О легкости их получения путем восстан вления свидетельствуют следующие данные если для АЬОз AGf = — 1582 кДж/мо ль то для GazOa и ПгОз эта величина значительно меньше, она соответственно составляет —998 и —832 кДж/моль.
Производство металлов Ga, In и TI составляет десятки тонн в год. [c.344]






