- Химическая активность металлов
- Реакции металлов с кислородом и водой
- Взаимодействие металлов с кислотами. ряд активности металлов
- Взаимодействие металлов с растворами солей
- Химические свойства металлов
- Ряд активности металлов в химии
- Алюминий
- Кальций
- Железо и его соединения
- Производство чугуна и стали
- Примеры решения задач
- Мир современных материалов — Электрохимический ряд напряжений металлов
- Содержание:
- Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
- Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
- На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химическая активность металлов
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Реакции металлов с кислородом и водой
Что вы знаете о ржавлении железа? Расскажите о разрушении металлов? Как вы думаете, как можно защитить металлы от разрушения? Где применяются металлы? Приведите примеры из жизни.
Металлы мы часто применяем в повседневной жизни. Это алюминий, медь, железо, золото, серебро и т. д. Алюминий и медь применяются для изготовления проводов. Алюминиевой фольгой упаковывают лекарства.
В домашнем обиходе вы часто встречаете алюминиевую посуду и упаковки для напитков. Но больше всего применяется железо для изготовления различных металлоконструкций, трубопроводов, деталей машин и т. д.
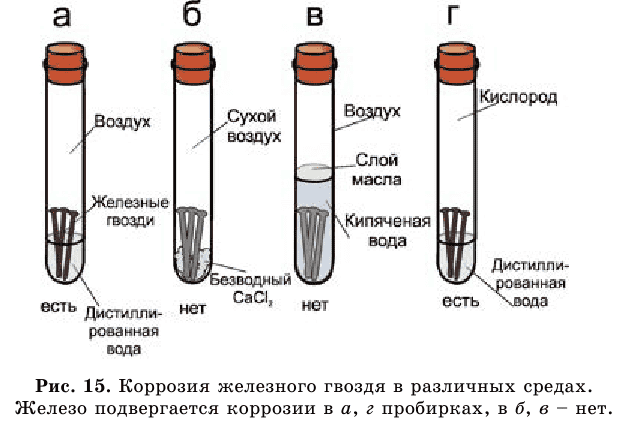
Этот металл от воды и кислорода воздуха приходит в негодность, изменяет цвет и тускнеет.
Железо покрывается ржавчиной красно-бурого цвета. Железо + вода + воздух → ржавчина. Такой химический процесс называется коррозией (от лат. corrodere – разъедать).
- Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- Поверхность алюминия покрывается оксидной пленкой, которая препятствует коррозии:
Химические активные металлы легко окисляются кислородом воздуха (Na, Mg, Ca). Железо и медь окисляются только при нагревании:
А золото и некоторые благородные металлы вообще не окисляются кислородом.
Рассмотрите рисунок 15 и сами сделайте выводы.
Ежегодно четвертая часть всего производимого металла из-за коррозии приходит в негодность (рис. 16).
Знаменитую Эйфелеву башню в Париже красили уже 18 раз, в результате чего ее масса увеличилась на 70 т.
Коррозия вызывает серьезные экологические катастрофы. Из разрушенных трубопроводов может быть утечка газа, нефти, опасных химических продуктов. Это приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
Металлы защищают от коррозии нанесением покрытий на поверхность изделия: окраска металла лаками, красками, эмалями. Но это покрытие недолговечно. Предохраняют металл покрытием другого металла, менее подверженного коррозии.
Это – золото, серебро, хром, никель, олово, цинк и др. В повседневной жизни часто применяют оцинкованные ведра, никелированные кровати. Для консервных банок применяют железо, покрытое оловом. Такое железо называют белой жестью. Белую жесть получают в г.
Темиртау Карагандинской области на металлургическом заводе. Можно уменьшить коррозию железа, добавляя другие металлы: никель, хром, молибден. Таким образом, получают сплав, который называется нержавеющей сталью.
Из этой стали изготавливают столовые приборы, трубы и другие изделия.
Олово — достаточно редкий, но очень полезный металл. Известно, что его начали добывать раньше, чем железо. Олово — это мягкий белый металл, который можно сплавлять с медью, чтобы получить бронзу.
Олово — один из первых освоенных человеком металлов. Оно не подвержено коррозии, поэтому из него делают тару для упаковки. Слой олова, нанесенный на другие металлы, делает их поверхность гладкой и блестящей.
Банки для хранения консервов и напитков также делают из тонкого стального листа, покрытого оловом.
Взаимодействие воды с некоторыми металлами (рис. 17). 1. Взаимодействие воды с активными металлами в обычных условиях идет очень интенсивно.
При этом протекают реакции замещения
При проведении таких опытов необходимо соблюдать меры предосторожности.
2. При взаимодействии металлов средней активности с водой вместо щелочи выделяется оксид металла:
3. Малоактивные металлы (Cu) с водой не реагируют.
Коррозия, ржавчина, защита от коррозии, белая жесть, алюминиевая фольга, сплав
Свинец — тяжелый голубовато-серый металл, который не ржавеет. Он используется в автомобильных аккумуляторах. Свинцовые экраны защищают людей от опасной радиации. Но свинец токсичен и ядовит для человека.
- Демонстрация №2
- Взаимодействие активных металлов с холодной и горячей водой
- Демонстрацию выполняет учитель, учащиеся наблюдают, делают выводы.
- Цель: узнать, как реагируют активные металлы с холодной и горячей водой.

Обрежьте кусочек натрия скальпелем, высушите фильтровальной бумагой. Высушенный кусочек натрия следует бросить в кристаллизатор с холодной, а затем горячей водой. Наблюдать за ходом реакции через стекло вытяжного шкафа. Такую же реакцию проделать и с металлическим кальцием. Испытать полученные растворы двумя индикаторами.
Взаимодействие металлов с кислотами. ряд активности металлов
Что такое кислоты? Какие кислые вещества вы встречали в природе?
В соответствии с определением кислоты должны вступать в реакции с металлами. Все ли металлы взаимодействуют с кислотами? Это можно проверить на опыте.
В четыре пронумерованные пробирки нальем одинаковое количество раствора соляной кислоты и добавим: в первую пробирку – Mg; во вторую – Zn; в третью – Sn; в четвертую – Cu.
Как видим, не все металлы могут взаимодействовать с кислотами и скорости их взаимодействия различны (рис. 18).
На основании интенсивности взаимодействия металлов с кислотами русским ученым Н.Н. Бекетовым был составлен ряд активности металлов:
Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag Au
При использовании ряда химической активности нужно помнить следующие правила:
1) металлы, стоящие в начале этого ряда, химически активны, они могут вытеснить водород из воды. 2) активность металлов в этом ряду снижается слева направо 3) только металлы, стоящие в ряду активности до водорода, вытесняют водород из растворов кислот (рис. 18):
активный металл + кислота —> соль + водород
Протекает реакция замещения. Металлы, стоящие в ряду активности после водорода, не реагируют с разбавленными растворами кислот (табл. 6).
- Лабораторный опыт №3
Взаимодействие металлов с растворами кислот - Цель: исследовать реакции различных металлов с растворами кислот и сделать вывод о существовании химически инертных металлов.
Налейте в четыре пробирки раствор соляной кислоты. В одну из пробирок насыпьте порошка магния, в другую – поместите гранулы цинка, в третью – опилки железа, в четвертую – стружки меди.
Может ли железо не подвергаться коррозии? Да, если оно очень чистое. Например, в Дели (Индия) находится Кутубская колонна высотой 7 м, массой 6,5 т. Она установлена в IX в. до н. э., в ее составе 99,72% Fe. До сих пор эта колонна не подверглась коррозии.
Взаимодействие металлов с растворами солей
Какие соли вы встречали в повседневной жизни?
Химически активные металлы вытесняют менее активные металлы из растворов солей, при этом протекает реакция замещения. Например, из раствора сульфата меди (ІІ) железо вытесняет медь (рис. 19):
Выделение красного налета меди является признаком реакции. Обратная реакция не протекает потому что медь в ряду активности металлов находится после железа, поэтому не вытесняет его.
- Схема реакций замещения выглядит следующим образом:
- соль 4- активный металл = новая соль + новый металл (менее активный)
- Реакции такого типа протекают при следующих условиях: 1) взаимодействующие соли должны быть растворимыми в воде;
- 2) более активный металл вытесняет из соли менее активный металл.
- Демонстрация №3
Вытеснение металлов из растворов солей - Цель: понимать, что более активный металл вытесняет менее активный металл из растворов его солей.
В пробирку поместите гранулы цинка и налейте раствор сульфата меди. В другую пробирку поместите небольшие кусочки железа и налейте раствор сульфата меди. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Практическая работа № 1 Сравнение активности металлов
Цель: Разработать ряд активности металлов. Обобщить результаты и сделать выводы.
Ход работы
В пять пробирок налейте растворы солей по 5 мл, опустите в каждую пробирку стружки меди. Затем такие опыты повторите с другими металлами. Наблюдайте за интенсивностью хода реакций. Заполните таблицу: где идет реакция следует поставить знак “+”, если не идет реакция – знак “–”. По сравнительной интенсивности, т. е. по числу протекающих реакций, составьте ряд активности металлов.
ДЕЛАЕМ ВЫВОДЫ:
- 1. Атомы металлов в реакциях только отдают электроны, образуя положительно заряженные ионы.
- 2. Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- 3. Сравнительную активность металлов можно определить с помощью ряда активности, составленного Н. Н. Бекетовым.
- 4. Металлы IA, НА группы очень легко вступают во взаимодействие с кислородом и водой. Многие металлы образуют оксидную пленку, которая препятствует дальнейшему окислению. Благородные металлы вообще не реагируют с кислородом и водой.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
- Лекции по химии:
- Лекции по неорганической химии:
- Лекции по органической химии:
Химические свойства металлов
- Химические свойства металлов
- Сегодня мы с вами изучим общие химические свойства металлов.
- В реакциях металлы проявляют восстановительные свойства, то есть они отдают электроны и превращаются в положительные ионы, сами при этом окисляются.
- Сначала разберём реакции металлов с простыми веществами – неметаллами.
- Например, с кислородом взаимодействуют практически все металлы, кроме золота и платины, при этом образуются оксиды.
Щелочные и щелочноземельные металлы при обычной температуре легко окисляются на воздухе, поэтому их обычно хранят в закрытых сосудах или под слоем масла.
Так, в реакции лития с кислородом воздуха образуется оксид лития, при этом литий повышает свою степень окисления с 0 до +1, а кислород понижает свою степень окисления с 0 до -2, литий является восстановителем, а кислород – окислителем, четыре атома лития отдают по одному электрону молекуле кислорода.
В реакции кальция с кислородом, кальций также повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2. Металл кальций выступает в роли восстановителя, а кислород – в роли окислителя, при этом два атома кальция отдают по два электрона молекуле кислорода. В результате реакции образуется оксид кальция.

Такие металлы, как алюминий, цинк, свинец при обычной температуре реагируют с кислородом воздуха, покрываясь тонкой плёнкой оксида, которая защищает их от дальнейшего окисления. Слой оксида, образующегося на поверхности алюминия, настолько тонок, что металл не теряет своего блеска.
Так, в реакции алюминия с кислородом, образуется оксид алюминия, алюминий повышает свою степень окисления с 0 до +3, являясь при этом восстановителем, а кислород, наоборот, понижает свою степень окисления с 0 до -2.
В этой реакции четыре атома алюминия отдают по три электрона молекуле кислорода.
Многие металлы взаимодействуют с кислородом при нагревании: например, медь при нагревании на воздухе чернеет, так как покрывается плёнкой чёрного оксида меди два.
В этой реакции медь выступает в роли восстановителя и повышает свою степень окисления с 0 до +2, а кислород – окислитель, понижает свою степень окисления с 0 до -2. При этом два атома меди отдают по два электрона молекуле кислорода.
При прокаливании железа образуется железная окалина – это смешанный оксид, который состоит из оксида железа два и оксида железа три.
Железо, в данном случае, является восстановителем, оно повышает свою степень окисления с 0 до +2 и +4, значит, железо – это восстановитель, а кислород – окислитель, он понижает свою степень окисления с 0 до -2. В этой реакции три атома железа отдают восемь электронов молекуле кислорода.

А вот магний при поджигании на воздухе сгорает яркой вспышкой, образуя оксид магния.
Магний также является восстановителем, потому что повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2 и является окислителем. В результате реакции образуется оксид магния, а два атома магния отдают по два электрона молекуле кислорода.

- Таким образом, большинство металлов реагируют с кислородом с образованием оксидов, активные металлы вступают во взаимодействие с кислородом при обычных условиях, менее активные при нагревании, а такие, как золото или платина не реагируют с кислородом.
- Металлы в этих реакциях являются восстановителями и, соответственно, повышают свою степень окисления, а кислород является окислителем и понижает свою степень окисления.
- С серой все металлы, кроме золота, способны взаимодействовать при незначительном нагревании, образуя сульфиды:
В реакции натрия с серой образуется сульфид натрия, натрий повышает свою степень окисления с 0 до +2, он является восстановителем, сера является окислителем и понижает свою степень с 0 до -2. В результате взаимодействия два атома натрия отдают по одному электрону молекуле серы.
В реакции кальция с серой образуется сульфид кальция, кальций также повышает свою степень окисления с 0 до +2, являясь при этом восстановителем, а сера понижает свою степень окисления с 0 до -2 и является окислителем, при этом, каждый атом кальция отдаёт по два электрона молекуле серы.
А в реакции железа с серой образуется сульфид железа два. Здесь также железо является восстановителем, повышает свою степень окисления с 0 до +2, а серя, являясь окислителем, понижает свою степень окисления с 0 до -2. Каждый атом железа здесь отдаёт по два электрона молекуле серы.

Если смешать небольшое количество порошка алюминия с порошком серы и нагреть сверху смесь пламенем лучинки, то в результате бурной реакции образуется сульфид алюминия:
Алюминий выступает в роли восстановителя и повышает свою степень окисления с 0 до +3, а сера понижает свою степень окисления с 0 до -2 и является окислителем. В этой реакции два атома алюминия отдают по три электрона молекуле серы.

Таким образом, с серой при определённых условиях реагируют все металлы кроме золота, в результате этого взаимодействия образуются сульфиды, в которых степень окисления серы равна мину двум. В этих реакциях металлы выступают в роли восстановителей, а сера – в роли окислителя.
C фтором, хлором, бромом и йодом – металлы реагируют с образованием галогенидов.
Так, в реакции алюминия с йодом образуется йодид алюминия, а катализатором в этой реакции является вода.
В этой реакции алюминий также повышает свою степень окисления с 0 до +4, являясь при этом восстановителем, а йод является окислителем и понижает свою степень окисления с 0 до -1. При этом два атома алюминия отдают по три электрона молекуле йода.
Таким образом, в реакциях с галогенами, металлы являются восстановителями и повышают свою степень окисления, а сами галогены являются окислителями и понижают свою степень окисления, при этом металлы окисляются, а галогены восстанавливаются. В результате этих реакций образуются галогениды.
Металлы не только реагируют с неметаллами – простыми веществами, но и вступают в реакции со сложными веществами.
Например, с водой эффективно реагируют щелочные и щелочноземельные металлы. Если натрий поместить в ёмкость с водой, в которую добавили несколько капель фенолфталеина, то он будет двигаться по поверхности воды, бурно реагируя с ней. При этом выделяется водород и образуется гидроксид натрия, окрашивающий фенолфталеин в малиновый цвет.
Металлический натрий выступает в качестве восстановителя, он повышает свою степень окисления с 0 до +1, а ионы водорода выступают в качестве окислителя и водород понижает свою степень окисления с +1 до 0. В этой реакции два атома натрия отдают по одному электрону ионам водорода.
Некоторые металлы взаимодействуют с водой при определённых условиях, например, цинк – при нагревании, железо – в раскалённом виде с парами воды. При этом образуются оксиды металлов и выделяется водород.
Так, в реакции с цинком образуется оксид цинка и водород. Цинк при этом, являясь восстановителем, повышает свою степень окисления с 0 до +2 и отдаёт по два электрона ионам водорода.
Катионы водорода выступают в роли окислителя и понижают свою степень окисления с +1 до 0.
В реакции с железом, аналогично, железо является восстановителем, повышает свою степень окисления с 0 до +2 и +3, при этом три атома железа отдают по восемь электронов ионам водорода, а ионы водорода понижают свою степень окисления с +1 до 0 и являются окислителями.
- Если металл стоит в ряду активности после водорода, то он не вытесняет водород из воды ни при каких условиях.
Таким образом, щелочные и щелочноземельные металлы реагируют с водой с образованием щелочей, при этом выделяется водород, некоторые металлы реагируют с водой только при нагревании, при этом образуются оксиды и выделяется водород, а металлы, стоящие в ряду активности после водорода не реагируют с водой. В этих реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли окислителя.
Металлы реагируют и с кислотами. Активность металлов при взаимодействии с растворами кислот зависит от положения металла в ряду активности. Металлы, стоящие в ряду активности до водорода, способны вытеснять водород из разбавленных растворов кислот.
- Следует учитывать и следующее металл реагирует с кислотой:
- · металл должен стоять в ряду активности до водорода
- · если образуется растворимая соль
- · концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами, при этом водород не выделяется
- · на щелочные металлы это правило не распространяется, так как они реагируют активно с водой, а речь в данном случае идёт о растворах кислот
- Например, в реакции магния с раствором серной кислоты, магний выступает в роли восстановителя, а ионы водорода в качестве окислителя.
При этом магний повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Каждый атом магния отдаёт по два электрона ионам водорода.
- Металлы, стоящие в ряду активности после водорода, к такому взаимодействию не способны:
- Например, медь стоит в ряду активности после водорода, поэтому она не реагирует с раствором соляной кислоты.
Если налить в две пробирки растворы кислот: в первую – раствор соляной кислоты, во вторую – раствор серной кислоты, а затем поместить в каждую по грануле цинка, то в результате у нас появляются пузырьки газа и в первой, и во второй пробирке. Значит, цинк стоит в ряду активности металлов до водорода, поэтому он способен вытеснять водород из раствора кислот.
Цинк в обеих реакциях является восстановителем, он повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0, при этом выступая в роли окислителя. В этих двух реакциях атом цинк отдаёт по два электрона ионам водорода.
- Следует помнить, что металлы, стоящие в ряду активности до водорода, реагируют с растворами кислот, но в результате этих реакций должна образоваться растворимая соль, на щелочные металлы эти правила не распространяются, концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами.
- Металлы реагируют с растворами солей, при этом нужно также использовать ряд активности металлов: более активный металл способен вытеснять другой металл из раствора соли, однако при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, потому что они реагируют с водой, а реакции эти протекают в растворе.
Если в две пробирки налить раствора сульфата меди (II) и поместить в первую кусочек железа, а во вторую гранулу цинка, то реакция будет у нас идти в двух пробирках. На кусочке железа и грануле цинка оседает медь и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на жёлтую, во второй – с голубой на более светлую.
В этой реакции железо выступает в роли восстановителя, само при этом окисляясь. Атомы железа превращаются в ионы железа. Ионы меди выступают в роли окислителя, они восстанавливаются, превращаясь в атомы меди. В результате окислительно-восстановительной реакции электроны от атомов железа переходят к ионам меди.
- Во второй реакции, в роли восстановителя выступает цинк, сам он окисляется, атомы цинка превращаются в ионы цинка, ионы меди выступают в роли окислителя, ионы меди восстанавливаются и превращаются в атомы меди, электроны от атомов цинка переходят к ионам меди.
- Следовательно, металлы реагируют и с растворами кислот, но нужно помнить, что каждый металл вытесняет из раствора соли другой металл, стоящий правее него в ряду напряжений металлов, при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, так как они реагируют с водой.
- Сделаем вывод:
- · металлы реагируют с простыми веществами, такими, как:
- · кислород
- · сера
- · галогены
- · со сложными:
- · вода
- · кислоты
- · соли
Ряд активности металлов в химии
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s23p1. В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
2Al2O3 = 4Al + 3O2↑
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3[AlF6] и Al2O3. Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
- Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):
- 2Al + 6H2O = 2Al(OH)3 +3H2↑ (1)
- 2Al +3/2O2 = Al2O3 (2)
- 2Al + 3Cl2 = 2AlCl3 (3)
- 2Al + N2 = 2AlN (4)
- 2Al +3S = Al2S3 (5)
- 4Al + 3C = Al4C3 (6)
- 2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑ (7)
- 2Al +2NaOH +3H2O = 2Na[Al(OH)4] + 3H2↑ (8)
Кальций
В свободном виде Ca – серебристо-белый металл. При нахождении на воздухе мгновенно покрывается желтоватой пленкой, которая представляет собой продукты его взаимодействия с составными частями воздуха. Кальций – достаточно твердый металл, имеет кубическую гранецентрированную кристаллическую решетку.
Электронная конфигурация внешнего энергетического уровня – 4s2. В своих соединениях кальций проявляет степень окисления равную «+2».
- Кальций получают электролизом расплавов солей, чаще всего – хлоридов:
- CaCl2 = Ca + Cl2↑
- Кальций способен растворяются в воде с образованием гидроксидов, проявляющих сильные основные свойства (1), реагировать с кислородом (2), образуя оксиды, взаимодействовать с неметаллами (3 -8), растворяться в кислотах (9):
- Ca + H2O = Ca(OH)2 + H2↑ (1)
- 2Ca + O2 = 2CaO (2)
- Ca + Br2 =CaBr2 (3)
- 3Ca + N2 = Ca3N2 (4)
- 2Ca + 2C = Ca2C2 (5)
- Ca +S = CaS (6)
- 2Ca + 2P = Ca3P2 (7)
- Ca + H2 = CaH2 (8)
- Ca + 2HCl = CaCl2 + H2↑ (9)
Железо и его соединения
Железо – металл серого цвета. В чистом виде оно довольно мягкое, ковкое и тягучее. Электронная конфигурация внешнего энергетического уровня – [Ar]3d 64s2. В своих соединениях железо проявляет степени окисления «+2» и «+3».
- Металлическое железо реагирует с водяным паром, образуя смешанный оксид (II, III) Fe3O4:
- 3Fe + 4H2O(v) ↔ Fe3O4 + 4H2↑
- На воздухе железо легко окисляется, особенно в присутствии влаги (ржавеет):
- 3Fe + 3O2 + 6H2O = 4Fe(OH)3
- Как и другие металлы железо вступает в реакции с простыми веществами, например, галогенами (1), растворяется в кислотах (2):
- 2Fe + Br2 = 2FeBr3 (при нагревании) (1)
- Fe + 2HCl = FeCl2 + H2↑ (2)
Железо образует целый спектр соединений, поскольку проявляет несколько степеней окисления: гидроксид железа (II), гидроксид железа (III), соли, оксиды и т.д. Так, гидроксид железа (II) можно получить при действии растворов щелочей на соли железа (II) без доступа воздуха:
- FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
- Гидроксид железа (II) растворим в кислотах и окисляется до гидроксида железа (III) в присутствии кислорода.
- Соли железа (II) проявляют свойства восстановителей и превращаются в соединения железа (III).
- Оксид железа (III) нельзя получить по реакции горения железа в кислороде, для его получения необходимо сжигать сульфиды железа или прокаливать другие соли железа:
- 4FeS2 + 11O2 = 2Fe2O3 +8SO2↑
- 2FeSO4 = Fe2O3 + SO2↑ + 3H2O
- Соединения железа (III) проявляют слабые окислительные свойства и способны вступать в ОВР с сильными восстановителями:
- 2FeCl3 + H2S = Fe(OH)3↓ + 3NaCl
Производство чугуна и стали
Стали и чугуны – сплавы железа с углеродом, причем содержание углерода в стали до 2%, а в чугуне 2-4%. Стали и чугуны содержат легирующие добавки: стали– Cr, V, Ni, а чугун – Si.
Выделяют различные типы сталей, так, по назначению выделяют конструкционные, нержавеющие, инструментальные, жаропрочные и криогенные стали. По химическому составу выделяют углеродистые (низко-, средне- и высокоуглеродистые) и легированные (низко-, средне- и высоколегированные). В зависимости от структуры выделяют аустенитные, ферритные, мартенситные, перлитные и бейнитные стали.
Стали нашли применение во многих отраслях народного хозяйства, таких как строительная, химическая, нефтехимическая, охрана окружающей среды, транспортная энергетическая и другие отрасли промышленности.
В зависимости от формы содержания углерода в чугуне — цементит или графит, а также их количества различают несколько типов чугуна: белый (светлый цвет излома из-за присутствия углерода в форме цементита), серый (серый цвет излома из-за присутствия углерода в форме графита), ковкий и жаропрочный. Чугуны очень хрупкие сплавы.
Области применения чугунов обширны – из чугуна изготавливают художественные украшения (ограды, ворота), корпусные детали, сантехническое оборудование, предметы быта (сковороды), его используют в автомобильной промышленности.
Примеры решения задач
Мир современных материалов — Электрохимический ряд напряжений металлов
В электрохимической ячейке (гальваническом элементе) электроны, остающиеся после образования ионов, удаляются через металлический провод и рекомбинируют с ионами другого вида. Т.е.заряд во внешней цепи переносится электронами, а внутри ячейки, через электролит, в который погружены металлические электроды, ионами. Таким образом получается замкнутая электрическая цепь.
Разность потенциалов, измеряемая в электрохимической ячейке, oбъясняется различием в способности каждого из металлов отдавать электроны. Каждый электрод имеет собственный потенциал, каждая система электрод-электролит представляет собой полуэлемент, а любые два полуэлемента образуют электрохимическую ячейку.
Потенциал одного электрода называют потенциалом полуэлемента, он определят способность электрода отдавать электроны. Очевидно, что потенциал каждого полуэлемента не зависит от наличия другого полуэлемента и его потенциала. Потенциал полуэлемента определяется концентрацией ионов в электролите и температурой.
В качестве «нулевого» полуэлемента был выбран водород, т.е. считается, что для него при добавлении или удалении электрона с образованием иона никакой работы не совершается. «Нулевое» значение потенциала необходимо для понимания относительной способности каждого из двух полуэлементов ячейки отдавать и принимать электроны.
Потенциалы полуэлементов, измеряемые относительно водородного электрода, называются водородной шкалой.
Если термодинамическая склонность отдавать электроны в одной половине электрохимической ячейки выше, чем в другой, то потенциал первою полуэлемента выше, чем потенциал второго.
Под действием разности потенциалов будет происходить переток электронов. При сочетании двух металлов можно выяснить возникающую между ними разность потенциалов и направление потока электронов.
Электроположительный металл обладает более высокой способностью принимать электроны, поэтому он будет катодным или благородным. С другой стороны находятся электроотрицательные металлы, которые способны самопроизвольно отдавать электроны. Эти металлы являются реакционноспособными, а, следовательно, анодными:
- — →0→ +
- Al Mn Zn Fe Sn Pb H2 Cu Ag Au
- Например, Cu отдает электроны легче Ag, но хуже Fe. В присутствии медного электрода ноны серебра начнут соединяться с электронами, приводя к образованию ионов меди и осаждению металлического серебра:
- 2Ag+ + Cu→Cu2+ + 2Ag
- Однако та же самая медь менее реакционноспособна, чем железо. При контакте металлического железа с нонами меди та будет осаждаться, а железо переходить в раствор:
- Fe+ Cu2+→Fe2+ + Cu.
- Можно говорить, что медь является катодным металлом относительно железа и анодным — относительно серебра.
Стандартным электродным потенциалом считается потенциал полуэлемента из полностью отожженого чистого металла в качестве электрода в контакте с ионами при 250С. В этих измерениях водородный электрод выступает в роли электрода сравнения. В случае двухвалентного металла можно записать реакцию, протекающую в соответствующей электро-химической ячейке:
М + 2Н+ → М2+ + Н2.
Если упорядочить металлы по убыванию их стандартных электродных потенциалов, то получается так называемый электрохимический ряд напряжений металлов (табл. 1).
Таблица 1. Электрохимический ряд напряжений металлов
| Равновесие металл-ионы (единичной активности) | Электродный потенциал относительно водородного электрода при 25°С, В (восстановительный потенциал) | |
| Благородные или катодные | Au-Au3+ | + 1,498 |
| Pt-Pt2+ | + 1,2 | |
| Pd-Pd2+ | +0,987 | |
| Ag-Ag+ | +0,799 | |
| Hg-Hg2+ | +0,788 | |
| Cu-Cu2+ | +0,337 | |
| Н2-Н+ | 0 | |
| Pb-Pb2+ | -0,126 | |
| Sn-Sn2+ | -0,140 | |
| Ni-Ni2+ | -0,236 | |
| Co-Co2+ | -0,250 | |
| Cd-Cd2+ | -0,403 | |
| Fe-Fe2+ | -0,444 | |
| Cr-Cr2+ | -0,744 | |
| Zn-Zn2+ | -0,763 | |
| Активные или анодные | Al-Al2+ | -1,662 |
| Mg-Mg2+ | -2,363 | |
| Na-Na+ | -2,714 | |
| K-K+ | -2,925 |
Например, в гальваническом элементе медь-цинк возникает поток электронов от цинка к меди. Медный электрод является в этой схеме положительным полюсом, а цинковый — отрицательным. Более реакционноспособный цинк теряет электроны:
- Zn→Zn2+ + 2е-; E°=+0,763 В.
- Медь же является менее реакционноспособной и принимает электроны от цинка:
- Cu2+ + 2е-→Cu; E°=+0,337 В.
- Напряжение на соединяющем электроды металлическом проводе составит:
- 0,763 В + 0,337 В = 1,1 В.
Таблица 2. Стационарные потенциалы некоторых металлов и сплавов в морской воде по отношению к нормальному водородному электроду (ГОСТ 9.005-72).
| Металл | Стационарный потенциал, В | Металл | Стационарный потенциал, В |
| Магний | -1,45 | Никель (активное coстояние) | -0,12 |
| Магниевый сплав (6 % Аl, 3 % Zn, 0,5 % Mn) | -1,20 | Медные сплавы ЛМцЖ-55 3-1 | -0,12 |
| Цинк | -0,80 | Латунь (30 % Zn) | -0,11 |
| Алюминиевый сплав (10 % Mn) | -0,74 | Бронза (5-10 % Al) | -0,10 |
| Алюминиевый сплав (10 % Zn) | -0,70 | Томпак (5-10 % Zn) | -0,08 |
| Алюминиевый сплав К48-1 | -0,660 | Медь | -0,08 |
| Алюминиевый сплав В48-4 | -0,650 | Купроникель (30 % Ni) | -0,02 |
| Алюминиевый сплав АМг5 | -0,550 | Бронза «Нева» | +0,01 |
| Алюминиевый сплав АМг61 | -0,540 | Бронза Бр. АЖН 9-4-4 | +0,02 |
| Алюминий | -0,53 | Нержавеющая сталь Х13 (пассивное состояние) | +0,03 |
| Кадмий | -0,52 | Никель (пассивное состояние) | +0,05 |
| Дюралюминий и алюминиевый сплав АМг6 | -0,50 | Нержавеющая сталь Х17 (пассивное состояние) | +0,10 |
| Железо | -0,50 | Титан технический | +0,10 |
| Сталь 45Г17Ю3 | -0,47 | Серебро | +0,12 |
| Сталь Ст4С | -0,46 | Нержавеющая сталь 1Х14НД | +0,12 |
| Сталь СХЛ4 | -0,45 | Титан йодистый | +0,15 |
| Сталь типа АК и углеродистая сталь | -0,40 | Нержавеющая сталь Х18Н9 (пассивное состояние) и ОХ17Н7Ю | +0,17 |
| Серый чугун | -0,36 | Монель-металл | +0,17 |
| Нержавеющие стали Х13 и Х17 (активное состояние) | -0,32 | Нержавеющая сталь Х18Н12М3 (пассивное состояние) | +0,20 |
| Никельмедистый чугун (12-15 % Ni, 5-7 % Си) | -0,30 | Нержавеющая сталь Х18Н10Т | +0,25 |
| Свинец | -0,30 | Платина | +0,40 |
| Олово | -0,25 |
Примечание. Указанные числовые значения потенциалов н порядок металлов в ряду могут изменяться в различной степени в зависимости от чистоты металлов, состава морской воды, степени аэрации и состояния поверхности металлов.






