Химические
свойства металлов во многом зависят от строения его внешнего или предвнешнего
электронного слоя. Для металлов, расположенных в одной группе периодической
системы и имеющих одинаковое строение внешней электронной оболочки, следует
ожидать определённые сходства в химических свойствах.
В атоме
металлов на внешнем энергетическом уровне небольшое количество электронов и
очень большой радиус атома, что способствует быстрой отдаче электронов атомами
металлов в результат их взаимодействия с другими соединениями.
Металлы
окисляются, сами при этом выступают в роли восстановителя.
Кроме этого,
положение металла в ряду активности характеризует свойства металла и его
катионов в водных растворах и связано с его химической активностью.
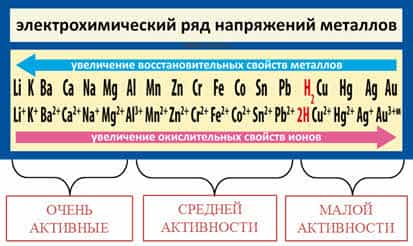
Как известно, самые
активные металлы расположены в начале ряда (слева), а самые
малоактивные – в конце (справа).
На основании
восстановительной способности металлов в ряду напряжений металлы условно можно
разделить на три группы: от лития до алюминия – очень активные
металлы, от алюминия до водорода – металлы средней
активности, от водорода до золота – малоактивные металлы.
Следует отметить,
что высокая электрохимическая активность металла не всегда означает его
химическую активность и наоборот. Обратите внимание на расположение лития и
натрия в ПС и в ряду активности металлов.
На основании положения в ПС натрий
активнее лития, так как радиус у натрия больше, на основании положения их в
ряду активности видно, что литий стоит левее натрия, то есть его восстановительная
способность выше, так как здесь учитывается не только радиус атома, но и
энергия отрыва электрона, энергия разрушения кристалла и энергия гидратации
ионов металла.
Например, с
кислородом активно при комнатной температуре реагируют только щелочные металлы,
при этом образуются оксиды или пероксиды. Так, в реакции лития с кислородом
образуется оксид лития, а в реакции натрия с кислородом – пероксид натрия.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
Металлы средней
активности реагируют с кислородом при нагревании. Например, проведём
эксперимент горения магния в кислороде. В результате данной реакции образуется
оксид магния, магний горит яркой вспышкой. Эта реакция сопровождается
выделением большого количества и света и ранее использовалась фотографами в
качестве вспышки при съёмке.
2Mg + O2 = 2MgO
Алюминий в
порошке также горит ослепительным пламенем с образованием оксида алюминия. Эта
способность используется в фейерверках, салютах, бенгальских огнях.

Такие металлы,
как Au, Pt не
реагируют с кислородом и поэтому на воздухе практически не изменяют своего
блеска.
Большинство
металлов, кроме Au, Pt реагируют при нагревании с серой, при этом образуются
соответствующие сульфиды.
Так, в реакции
цинка с серой образуется сульфид цинка, в реакции серебра с серой образуется
сульфид серебра (I).
Проведём
эксперимент, для этого на асбестовой сетке поместим цинк с серой, подожжём эту
смесь горящим магнием, в результате у нас образуется сульфид цинка.
Практически все
металлы реагируют с галогенами. Условия протекания этих реакций зависит от
активности металла и галогена.
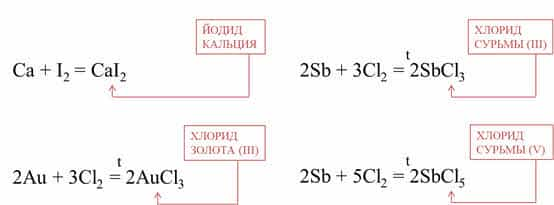
Например, кальций реагирует с йодом при
комнатной температуре, при этом образуется йодид кальция, а золото реагирует с
хлором при сильном нагревании, при это образуется хлорид золота (III).
Очень красиво горит сурьма в хлоре, при этом образуется
смесь хлоридов: хлорид сурьмы (III) и хлорид сурьмы (V).
С металлами
реагируют соединения всех классов – оксиды (в том числе вода), кислоты,
основания и соли.
При нагревании
металлы реагируют и с другими неметаллами. Так, в реакции алюминия с
азотом, образуется нитрид алюминия, в реакции кальция с форфором, образуется
фосфид кальция, в реакции алюминия с углеродом – карбид алюминия, в реакции
магния с кремнием – силицид магния.

С водородом
реагируют только активные металлы. Например, в реакции натрия с водородом
образуется гидрид натрия.
Так, активные
металлы бурно реагируют с водой при комнатной температуре. Например, в реакции
лития с водой образуется гидроксид лития и водород, в реакции бария с водой
образуется гидроксид бария и водород.
Проведём
эксперимент, для этого в воду добавим фенолфталеин и опустим туда кусочек
натрия. Натрий начинает бегать по поверхности из-за выделения водорода, раствор
приобретает малиновую окраску, вследствие образования щёлочи. Таким образом, в реакции
натрия с водой образуется щёлочь – гидроксид натрия и газ – водород.
Поверхность таких
металлов, как магний и алюминий, защищена плотной плёнкой соответствующего
оксида. Это препятствует протеканию реакции с водой.
Но если убрать
эту плёнку, то эти металлы активно будут вступать в реакцию. Например,
порошкообразный магний реагирует с горячей водой, при этом образуется гидроксид
магния и водород.
При повышенной
температуре с водой реагируют и менее активные металлы, но в данном случае
образуется окси д и водород. Например, в реакции цинка с водой образуется оксид
цинка и водород.
Металлы, стоящие
в ряду активности до водорода, реагируют с кислотами (кроме HNO3
любой концентрации и H2SO4
концентрированной) с образованием солей и водорода.
Активные металлы реагируют
с растворами кислот очень быстро.
Например, в реакции кальция с соляной
кислотой образуется соль – хлорид кальция и водород, в реакции алюминия с
разбавленной серной кислотой образуется соль – сульфат алюминия и водород.
Малоактивные
металлы часто практически не растворяются в кислотах. Это обусловлено
образованием на их поверхности плёнки нерастворимой соли. Например, свинец,
стоящий в ряду активности до водорода, практически не растворяется в
разбавленной серной и соляной кислотах вследствие образования на его
поверхности плёнки нерастворимых солей (PbCl2,
PbSO4).
В азотной кислоте
растворяются металлы, стоящие и до, и после водорода. При этом образуются
нитраты, а также различные продукты восстановления азотной кислоты.
Концентрированная
серная кислота также может вступать в реакции с металлами, расположенными в
ряду активности после водорода. Например, в реакции серебра с концентрированной
серной кислотой образуется сульфат серебра (I), сернистый
газ и вода, а в реакции магния с концентрированной серной кислотой образуется
сульфат магния, сероводород и вода.
Al,
Cr, Fe при
комнатной температуре не вступают в реакцию и с концентрированной серной
кислотой из-за образования на их поверхности оксидной плёнки. Это явление
называется пассивацией. Благодаря этому становится возможным транспортировать
концентрированную азотную серную кислоты в стальных цистернах.
- Проведём
эксперимент, поместим в четыре пробирки металлы: в первую – магний, во вторую –
цинк, в третью – железо, а в четвёртую – медь и прильём в каждую пробирку
соляной кислоты. - Интенсивнее всего
выделение наблюдается в первой пробирки, где находится цинк, кроме этого,
реакция сопровождается выделение теплоты, во второй и третье пробирке
интенсивность выделения водорода меньше, а в четвёртой пробирке водород вообще
не выделяется. - Mg + 2HCl = MgCl2
+ H2↑ + Q - Zn + 2HCl = ZnCl2
+ H2↑ - Fe + 2HCl = FeCl2
+ H2↑ - Cu + HCl ≠
Тоже самое
сделаем в другом опыте, но использовать здесь будем уксусную кислоту.
Получается, что при комнатной температуре с уксусной кислотой реагирует
только магний, цинк и железо реагирует с уксусной кислотой только при
нагревании, а медь не вступает во взаимодействие с уксусной кислотой.
- Mg + 2CH3COOH = (CH3COO)2 Mg + H2↑
- Zn + 2CH3COOH = (CH3COO)2 Zn + H2↑
- Fe + 2CH3COOH = (CH3COO)2 Fe + H2↑
- Cu + CH3COOH
≠ - Таким образом, металл
реагирует с раствором кислоты, если он стоит в ряду активности левее водорода,
при этом должна образоваться растворимая соль, концентрированная серная и
азотная кислота иначе реагируют с кислотами, щелочные металлы для данных
реакций лучше не использовать из-за их высокой химической активности. - Некоторые
металлы, такие, как Be, Zn, Al, легко растворяются в водных растворах щелочей с
образованием комплексных соединений. - Например, в
реакции бериллия с раствором гидроксида натрия образуется комплексная соль –
тетрагидроксобериллат натрия, а в реакции цинка с водным раствором гидроксида
калия образуется комплексная соль – тетрагидроксоцинкат калия. - Be + 2H2O + 2NaOH = Na2[Be(OH)4] +
H2↑ - Zn + 2H2O + 2KOH = K2[Zn(OH)4] + H2↑
Металлы, оксиды и
гидроксиды которых амфотерны, взаимодействуют также с расплавами щелочей при
нагревании. Например, в реакции цинка с расплавом гидроксида натрия образуется
соль – цинкат натрия и водород.
Zn + 2NaOH (тв.)
= Na2ZnO2
+ H2↑
Активные
металлы вытесняют малоактивные из растворов их солей. Так, в реакции железа
с хлоридом меди (II) железо замещает медь в его хлориде
и образуется хлорид железа (II) и медь, в реакции меди
с нитратом серебра (I) образуется соль – нитрат меди (II) и серебро.
- Fe + CuCl2 = FeCl2 + Cu↓
- Cu + 2AgNO3 = Cu (NO3)2 +
2Ag↓ - Проведём
эксперимент, опустим железный гвоздь в раствор сульфата меди (II),
через некоторое время на железном гвозде осела медь и раствор стал жёлтого
цвета, если опустить медную платину в раствор сульфата железа (II), то в данной случае признаков реакции не наблюдается,
ведь медь менее активный металл, чем железо. - Fe + CuSO4 = FeSO4 + Cu↓
- Cu + FeSO4 ≠
- В данных реакциях
нужно соблюдать следующие условия: щелочные металлы брать нельзя, так как они
будут взаимодействовать с водой, металл должен находится левее того металла,
который входит в состав соли, в данных реакциях должна образоваться растворимая
соль.
Металлы могут
реагировать и с органическими веществами. Например, в реакции фенола с натрием,
образуется фенолят натрия, в реакции этанола с натрием образуется этилат
натрия.
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Кроме этого,
натрий вступает в реакцию Вюрца с галогеналканами. Так, в реакции хлорметана с
натрием образуется хлорид натрия и этан.
2H3CCl + 2Na C2H6
+ 2NaCl
Соединение Pb(C2H5)4
– тетраэтилсвинец – применяется как антидетонатор в моторном топливе. Это
сильно ядовитое соединение, если бензин содержит тетраэтилсвинец, тогда его
называют «этилированным».
Таким образом, о
химической активности металлов можно примерно судить по их расположению в
электрохимическом ряду напряжений металлов.
Чем левее расположен
металл, тем выше его химическая активность в водном растворе. Активные
металлы размещаются вначале вытеснительного ряда, а малоактивные – в конце.
Металлы
реагируют как с простыми веществами – неметаллами, так и со сложными: оксидами,
кислотами, основаниями и солями.
Общие химические свойства металлов
- Тема: «Металлы».
- Общие химические свойства металлов
- В химических реакциях металлы выступают в роли восстановителейи повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.

В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород. Активность металлов убывает слева направо:
Запомнить! Металлы, стоящие в ЭХ ряду после водорода, называют неактивными металлами.
- Металлы, расположенные в ЭХ ряду до алюминия называют сильноактивными или активными металлами.
- Общие химические свойства металлов
- 1) Многие металлы вступают в реакцию с типичными неметаллами – галогенами, кислородом, серой. При этом образуются соответственно хлориды, оксиды, сульфиды и другие бинарные соединения:
- с азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании;
- с серой металлы образуют сульфиды – соли сероводородной кислоты;
- с водородом самые активные металлы образуют ионные гидриды (бинарные соединения, в которых водород имеет степень окисления -1);
- с кислородом большинство металлов образует оксиды – амфотерные и основные. Основной продукт горения натрия — пероксид Na2O2; а калий и цезий горят с образованием надпероксидов MeO2.
2) Следует обратить внимание на особенности взаимодействие металлов с водой:
- Активные металлы, находящиеся в ряду активности металлов до Mg (включительно), реагируют с водой с образованием щелочей и водорода:Ca+2H2O=Ca(OH)2+H2↑
- Активные металлы (например, натрий и литий), взаимодействуют с водой со взрывом.
- Металлы средней активности окисляются водой при нагревании до оксида:
6Cr+6H2O→t,∘C2Cr2O3+3H2↑
- Неактивные металлы (Au, Ag, Pt) — не реагируют с водой.
- →[Li……Mg]MOH+H2↑ активные металлы (до Al)
- H2O+M→[Al……PbMxOy+H2↑ среднеактивные металлы (от Al до H), только при нагревании
- →[Bi……Au]≠ неактивные металлы (после Н)
- Более подробно взаимодействие металлов с водой рассмотрено в темах, посвященных химии отдельных групп.
- 3) С разбавленными кислотами реагируют металлы, стоящие в ЭХР до водорода: происходит реакция замещения с образованием соли и газообразного водорода. При этом кислота проявляет окислительные свойства за счет наличия катиона водорода:
Mg+2HCl=MgCl2+H2
4) Взаимодействие азотной кислоты (любой концентрации) и концентрированной серной кислоты протекает с образованием других продуктов: кроме соли и водорода в этих реакциях выделяется продукт восстановления серной (или азотной) кислоты. Подробнее см.тему «Взаимодействие азотной кислоты с металлами и неметаллами.
Запомнить! Все металлы, стоящие в ряду левее водорода, вытесняют его из разбавленных кислот, а металлы, расположенные справа от водорода, с растворами кислот не реагируют (азотная кислота – исключение).
5) Активность металлов также влияет на возможность протекания простого вещества металлас оксидом или солью другого металла. Металл вытесняет из солей менее активные металлы, стоящие правее его в ряду напряжений.
Запомнить! Для протекания реакции между металлом и солью другого требуется, чтобы соли, как вступающие в реакцию, так и образующиеся в ходе нее, были растворимы в воде. Металл вытесняет из соли только более слабый металл.
- Например, для вытеснения меди из водного раствора сульфата меди подходит железо,
- CuSO4+Fe=FeSO4+Cu
- но не подходят свинец – так как он образует нерастворимый сульфат. Если опустить кусочек свинца в раствор сульфата меди, то с поверхности металла покроется тонким слоем сульфата, и реакция прекратится
- CuSO4+Pb=PbSO4↓+Cu
- Другой пример: цинк легко вытесняет серебро из раствора нитрата серебра, однако реакция цинка со взвесью сульфида серебра, нерастворимого в воде, практически не протекает.
- Общие химические свойства металлов обобщены в таблице:
| Уравнение реакции | Продукты реакции | Примечания |
| с простыми веществами — неметаллами | ||
| с кислородом | ||
| 4Li+O2=2Li2O | оксиды O−2 | |
| 2Na+O2=Na2O2 | пероксиды (O2)−2 | только натрий |
| K+O2=KO2 | надпероксиды (O2)−2 | надпероксиды при горении образуют K, Rb, Cs |
| с водородом | ||
| Ca+H2=CaH2 | гидриды | щелочные металлы 0 при комнатной температуре; остальные металлы — при нагревании |
| с галогенами | ||
| Fe+Cl2=Fe+3Cl3 | хлориды и др. | при взаимодействии с хлором и бромом (сильные окислители) железо и хром образуют хлориды в степени окисления +3 |
| с серой | ||
| Fe+S=FeS | сульфиды | при взаимодействии с серой и иодом железо приобретает степень окисления +2 |
| с азотом и фосфором | ||
| 3Mg+N2=Mg3N2 | нитриды | * при комнатной температуре с азотом реагируют только литий и магний |
| 3Ca+2P=Ca3P2 | фосфиды | |
| с углеродом | ||
| 4Al+3C=Al4C3 | карбиды | |
| с водой | ||
| 2Na0+2H2O=2NaOH+H2 | Основание + H2 | щелочные металлы |
| Zn0+H2O=ZnO+H2 | Оксид + H2 | среднеактивные металлы, при нагревании |
| Au,Ag,Pt+H2O/ne | не реагируют | неактивные металлы (после Н) |
| с окисдами менее активных металлов | ||
| 2Al+3ZnO=Al2O3+2Zn | др оксид + др.металл | |
| с солями менее активных металлов | ||
| Fe+CuSO4=Cu+FeSO4 | Др. соль + др. металл |
|
| Cu+AlCl3≠ | ||
| с кислотами | ||
| Fe+2HCl=FeCl2+H2 6Na+2H3PO4=2Na3PO4+3H2 | Др. соль +водород | Металлы, стоящие в электрохимическом ряду напряжений до H реагируют с разбавленными кислотами (кроме HNO3) |
Химические свойства металлов
Металлы на внешнем энергетическом уровне имеют небольшое число электронов (от 1 до 3). Как правило, в химических реакциях металлы проявляют только восстановительные свойства, их атомы отдают электроны, образуя в результате положительные ионы.
1. Взаимодействие металлов с неметаллами.
Показываем на примере взаимодействия цинка с серой. Тщательно перемешав порошки серы и цинка (1:1), помещают их в фарфоровую чашечку. Небольшие порции смеси берут и медленно посыпают сверху на пламя спиртовки. Наблюдаются синевато-белые вспышки, сопровождающиеся образованием сульфида цинка. Оставшуюся смесь поджигают тлеющей лучинкой.
Zn0 + S0 = Zn+2S-2
Zn0 – 2 ? ? Zn+2
восстановитель
S0 + 2 ? ? S-2
окислитель
2. Взаимодействие металлов с кислородом.
(Легко взаимодействуют с кислородом щелочные и щелочноземельные металлы, поэтому их хранят под слоем керосина) Mg, Fe, Zn, Cu окисляются кислородом только при нагревании. Покажем это на примере взаимодействия Mg с кислородом. Для этого мы сначала соберем кислород в баночку. Кислород тяжелее воздуха и будет собираться на дне баночки.
t
2KMnO4 ? K2MnO4 + MnO2 + O2 ?
Раскалим магний в пламени спиртовки и внесем в баночку с кислородом. Магний сгорает, образуя яркую вспышку.
2Mg0 + O02 = 2Mg+2O-2
Mg0 – 2 ? ? Mg+2
восстановитель
O0 + 2 ? ? O-2
окислитель
После того, как магний сгорит, в ложечке для сгорания образуется оксид магния MgO белого цвета. Следовательно, продуктами сгорания металлов являются основные оксиды. Золото, серебро, платина при обычных условиях и при нагревании не окисляются кислородом.
3. Взаимодействие металлов с водой.
Это свойство рассмотрим на примере взаимодействия натрия с водой. На демонстрационный стол ставим стакан с водой. Для безопасности наливаем воды не более 4/5 стакана. Бросаем в стакан с водой кусочек натрия величиной с горошину.
Стакан накрываем перевернутой воронкой. Через несколько секунд поджигаем выделяющийся водород у кончика воронки. Когда весь натрий прореагирует, то в воду капают раствор фенолфталеина, чтобы показать образование щелочи.
Делаем вывод: щелочные металлы бурно взаимодействуют с водой с выделением водорода.
2Na0 + 2H2+1O = 2Na+1OH + H20?
Na0 – 1 ? ? Na+1
восстановитель
2H+1 + 2 ? ? H20
окислитель
Менее активные металлы взаимодействуют с водой при нагревании. При этом образуется оксид и выделяется водород.
- Взаимодействие металлов с растворами кислот и солей.
- 1 правило: Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот, а стоящие правее, не вытесняют водород из растворов кислот.
- Взаимодействие цинка с соляной кислотой учащиеся выполняют самостоятельно на рабочих местах, предварительно вспомнив правила техники безопасности.
- Zn0 + 2H+1Cl = Zn+2Cl2 + H20?
Zn0 – 2 ? ? Zn+2
восстановитель
H+1 + 1 ? ? H0
окислитель
На щелочные металлы это правило не распространяется, т.к. они легко взаимодействуют с водой, а мы имеем дело с растворами кислот.
Это правило не относится к концентрированной H2SO4 и к азотной кислоте любой концентрации. При взаимодействии с ними кислород не выделяется.
2 правило: Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений. Взаимодействие железа с раствором сульфата меди. Этот опыт учащиеся выполняют также самостоятельно на рабочих местах.
Fe0 + Cu+2SO4 = Cu0 + Fe+2SO4
Fe0 – 2 ? ? Fe+2
восстановитель
Cu+2 + 2 ? ? Cu0
окислитель
Это правило не распространяется на щелочные металлы.
- Металлотермия (взаимодействие металлов с оксидами металлов).
Показываем на примере взаимодействия кальция с оксидом меди (кальциетермия).
Cu+2O + Ca0 = Cu0 + Ca+2O
Cu+2 + 2 ? ? Cu0
восстановитель
Ca0 – 2 ? ? Ca+2
окислитель
Все реакции учащиеся разбирают на доске и в тетрадях с окислительно-восстановительной точки зрения.
В химических реакциях металлы проявляют только восстановительные свойства. Их атомы отдают электроны, образуя в результате положительные ионы.
Открытый урок химии 9 класс на тему: "Общие химические свойства металлов"
Урок химии по теме: «Общие химические свойства металлов. Ряд активности».
- 9 класс
- Тип урока: урок изучения нового материала
- Вид урока: мультимедийный
- Цель урока: систематизировать сведения о химических свойствах металлов, рассмотренных при изучении материала курса химии 8,9 классов, выявить особенности протекания реакций металлов со сложными веществами, подчеркнуть химическую функцию металлов как восстановителей.
- Оборудование и реактивы:
- на столах учащихся: раствор соляной кислоты (НCl), CuSO4 (раствор), металлы: цинк, медь, железо ( железные гвозди на ниточках), пробирки, штатив для пробирок, емкость для слива, спиртовка, щипцы, спички.
- На столе учителя: предметный столик, спички, спиртовка, вата, шпатель, асбестовая прокладка, порошок магния, натрий, эксикатор с водой, фенол-фталеин.
- Оснащение урока.
Компьютер, мультимедиапроектор, экран, таблицы « Растворимость кислот, солей и оснований в воде», « Периодическая система химических элементов Д.И.Менделеева», «Электрохимический ряд напряжений металлов», рабочие листы учащихся.
Ход урока:
I. Орг. момент (готовность учащихся к уроку) (1 мин.)
II. Проверка опорных знаний (10 мин.).
Контроль ЗУН
а) Решение задач по карточке.
б) Блиц опрос – небольшой мозговой штурм. (3 мин.)
-
На какие группы мы разделили элементы Периодической системы?
Ответ: Металлы и неметаллы.
-
Определите расположение металлов в ПСХЭ
Ответ: Нижний угол относительно диагонали Вор-Астат, и все элементы побочных подгрупп.
-
Какая кристаллическая решетка свойственна для металлов? Ответ: Металлическая кристаллическая решетка
-
Чем она отличается от всех других? Ответ: в узлах металлической кристаллической решетки располагаются атомы и положительные ионы металлов, между которыми находится свободные электроны.
-
Какие общие физические свойства металлов объясняются наличием металлическая кристаллической решети. Ответ: электропроводность, теплопроводность, металл блеск, пластичность, легкость тугоплавкость, легкоплавкость, твердость, мягкие
-
Как называется способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия? (пластичность);
-
Какой металл самый легкий? Ответ: литий (Li)
-
Назовите самый тяжелый металл? Ответ: Осмий (Os)
-
Лучшие проводники электричества среди металлов?
Ответ: серебро и медь;
-
Назовите самый тугоплавкий металл? Ответ: Вольфрам (W)
-
Какой металл самый легкоплавкий? Ответ: Ртуть (Hg)
-
Назовите самый пластичный металл? Ответ: Золото (Au)
-
Какие металлы легко режутся ножом? Ответ: щелочные металлы.
-
Название известного сплава на основе алюминия (дюралюминий);
-
Важнейшие сплавы на основе железа? (чугун и сталь);
-
Какой неметалл входит в состав сплавов железа (углерод);
-
Укажите не менее трех металлов, которые могут выступать в качестве легирующих добавок? (хром, никель, молибден)
-
В детстве мы читали о нем в сказке Андерсена. Его звон слышали заблудившиеся путники и находили дорогу. Он может болеть «чумой» Какой это металл? (2.8.18.18.4)
Ответ: олово.
-
При раскопках этрусских гробниц (1000 лет до н.э) были обнаружены зубные протезы. Вопрос: из какого металла они были сделаны? Ответ: золото.
- Тестовые задания по теме «Химические свойства металлов»
- Задание: выберите один правильный ответ.
- Вариант 1
- 1.При взаимодействии кальция с водой образуются:
- а) оксид кальция и водород;
- б) гидроксид кальция и водород;
- в) гидроксид кальция
- 2. Ртуть из раствора нитрата ртути (II) можно получить с помощью:
- а) серебра; б) натрия; в) меди
- 3. Какой металл взаимодействует с водой с образованием оксида:
- а) барий; б) хром; в) медь
- 4. С раствором серной кислоты с образованием соли и водорода реагирует:
- а) ртуть; б) алюминий; в) золото
- 5. При взаимодействии с кислородом образует пероксид:
- а) медь б) железо в) натрий
- Вариант 2
- 1.При взаимодействии цинка с водой образуются:
- а) оксид цинка и водород;
- б) гидроксид цинка и водород;
- в) гидроксид цинка
- 2. Медь из раствора нитрата меди (II) можно получить с помощью:
- а) серебра; б) натрия; в) железа
- 3. Какой металл взаимодействует с водой с образованием щелочи:
- а) барий; б) хром; в) медь
- 4. С раствором серной кислоты с образованием соли и водорода реагирует:
- а) ртуть; б) свинец; в) золото
- 5. При обычных условиях с азотом взаимодействует:
- а) литий б) железо в) хром
- Проверка теста.
| 1 | 2 | 3 | 4 | 5 | |
| вариант 1 | б | в | б | б | а |
| вариант 2 | а | в | а | б | а |
- Самопроверка :
- 5 правильных ответов – «5»
- 4 правильных ответов – «4»
- 3 правильных ответов – «3»
III. Изучение нового материала. ( 27 мин.- 30 мин.)
Постановка цели урока. Актуальность изучения данной темы.
-
Актуализация знаний (1-2 мин.)
Учитель: «Роберт Вуд, знаменитый американский физик и великий любитель всяческих проделок, направлялся из лаборатории домой на обед. Дорога шла через негритянский квартал.
Была зимняя оттепель, и огромная лужа распростерлась по мостовой между тротуарами, на которых толпились негры, вышедшие погреться на солнышке.
Проходя мимо них, Вуд громко закашлял и на виду у всех плюнул в лужу, незаметно бросив в том же направлении кусок натрия величиной с грецкий орех. Прогремел взрыв, полетели искры, и большое желтое пламя поднялось над поверхностью воды.
Затем раздались вопли, молитвы и один голос громче, чем все остальные вместе взятые, пробасил: «спасайся, кто может, негры! Этот человек плюнул огнем! На вид он молодой, но только сам старый дьявол, сам старый сатана умеет это делать!» О каких свойствах натрия идет речь в этом отрывке?
Ученик: О химических
Учитель: Следовательно, тема нашего урока «Характерные химические свойства металлов»
-
Организация познавательной деятельности (20-25 мин.)
Учитель: Мир вокруг нас – это совокупность физических и химических превращений веществ. Как ведут себя металлы в этом мире, с какими веществами они взаимодействуют и каким должно быть их практическое применение.
От чего зависят химические свойства металлов? ( Химические свойства металлов зависят от их активности)
Как делятся металлы по активности? Приведите примеры (По активности металлы делятся на активные (натрий, кальций) и неактивные (медь, ртуть))
Где и как можно узнать о активности металла? (В электрохимическом ряду активности металлов. Если металл стоит в ряду активности до водорода, то это активный металл. Если после водорода, то это неактивный металл
- Li K Ca Na Mg Al | Zn Cr Fe Ni Pb (H2) Cu Hg Ag Pt Au
- Активные малоактивные неактивные
- Химические свойства металлов делятся на две группы – с простыми веществами и сложными
- Чем обусловлены химические свойства металлов?
- (2) 1 Большим радиусом
- 2 Небольшим числом электронов на внешнем уровне
- Чем, с точки зрения окислительно-восстановительных процессов, являются металлы в реакциях?
(3) Ответ: Металлы являются только восстановителями, т.к их атомы легко отдают электроны, превращаясь при этом в положительно заряженные ионы – катионы.
- М0 – nе- →Мn+. Чем обусловлены
- Для того, чтобы прошла данная реакция необходимо наличие окислителя.
- Вопрос к классу: Вспомните вещества, которые могут выступать в качестве окислителя при взаимодействии с металлами.
- Составить список этих веществ: Кислород, галогены, сера, водород и др., вода, кислоты
(2) Как называются продукты взаимодействия металлов с кислородом, галогенами, серой, азотом ? (учащиеся дают ответы, сверяют их с записью на слайдах).
Эпиграф — высказывание М.В. Ломоносова: “Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции”. А сейчас на некоторое время вы станете химиками-аналитиками!
- Правила техники безопасности.
- Лабораторный опыт №1.
- Прокаливание медной пластинки в пламени спиртовки.
- (признак реакции при прокаливании медной проволоки – изменение цвета, наблюдаем почернение – образование оксида меди (II), уравнение реакции 2Cu + O2 = 2CuO)
- Наблюдения, уравнения реакций записывают в рабочем листе.
- Следующие два опыта мы посмотрим на видеофрагменте:
- Демонстрационный опыт 1 (видеоклип): горение магния в кислороде.
Вопрос: Как вы можете объяснить этот опыт? Где подобный процесс мог применяться?
- ( В прошлом веке использовался фотографами для улучшения освещения)
- Ученик у доски: Составляет уравнение реакции горения магния в кислороде, определяет окислитель и восстановитель.
- Демонстрационный опыт 2 (видеоклип): Взаимодействие сурьмы с хлором.
- Ученик у доски: Составляет уравнение реакции взаимодействия сурьмы с хлором, определяет окислитель и восстановитель.
Закрепление. Допишите уравнения реакций взаимодействия металлов с другими неметаллами.
- Al + I2 →
- Fe + S →
- Na + N2 →
- Ca + P →
- Физкультпауза Выполняются упражнения для глаз
- 2) Взаимодействие металлов с водой.
- Как металлы реагируют с водой?
- Активные металлы(Li – Na) + вода → гидроксид металла(щелочь) + Н2↑
- Металлы средней активности(Mg – Pb) + вода → оксид металла + Н2↑
- Неактивные металлы (Bi – Au) + вода → не реагируют
- Посмотрите маленький фрагмент.
«Как вы думаете ?»… имеет ли смысл фраза, которую мы слышали в сказке: «К морю синему пошли и море синее зажгли?».
Демонстрационный опыт 2 (видеоклип): Взаимодействие калия с водой.
Лабораторный опыт №2: взаимодействие натрия с водой:
Ученик у доски: Составляет уравнения реакции взаимодействия натрия с водой. Фиксирует признаки химической реакции, определяет окислитель и восстановитель. Уравнение реакции:
2Na + 2H2O = 2NaOH + H2
Почему металлы первой группы (А) называют щелочными? (образуется щелочь). Докажите! (капают в раствор фенолфталеин. Раствор окрасился в малиновый цвет, значит среда – щелочная,)
Закрепление. Допишите уравнения возможных реакций взаимодействия металлов водой.
- Al + H2O →
- Zn + H2O →
- Ag + H2O →
- Проблема: почему алюминий при обычных условиях не реагирует с водой? (алюминий прокрыт оксидной пленкой, которая его и защищает)
Это свойство имеет практическое значение, т.к. для изготовления посуды не берут калий, натрий, а именно алюминий, цинк, железо.
3) Взаимодействие металлов с кислотами.
Лабораторный опыт №3. Взаимодействие цинка, железа, меди с соляной кислотой. ТБ
- 1 вариант — Zn + HCl
- 2 вариант — Cu + HCl
- 3 вариант – Fe + HCl
- Учитель: контролирует правила ТБ при выполнении опытов, навыки и умения экспериментальной работы.
- Запись в тетрадях уравнений реакций,
- Zn + HCl → ZnCl2 + H2
- Fe + HCl → FeCl2 + H2
- Cu + HCl → не идёт
- Это свойство используется для получения водорода в лаборатории.
- Объясните результаты опыта.
Вывод. Металлы , стоящие в ряду активности до водорода вытесняют его из растворов кислот, а после водорода — не вытесняют. .
Но для этой реакции есть несколько поправок.
-
Если образуется растворимая соль;
-
Кроме щелочных и щелочно-земельных металлов;
-
Азотной кислота и . концентрированная серная кислота реагируют особенно, при этом никогда не выделяется водород.
-
Взаимодействие металлов с солями.
-
Лабораторный опыт № 4. Взаимодействие железа с сульфатом меди и меди с хлоридом железа (III).
- Учитель: контролирует правила ТБ при выполнении опытов, навыки и умения экспериментальной работы.
- Запись в тетрадях уравнений реакций, наблюдения
- Fe + CuSO4 → FeSO4 + Cu
- FeCl2 + Cu → не идет
- Для этой реакции тоже есть поправки, которые совпадают с первой и второй поправкой для кислот
- Объясните результаты опыта.
Вывод. Более активные металлы вытесняют менее активные из растворов их солей.
Закрепление. Допишите уравнения возможных реакций.
- Ag + CuCl2 →
- Zn + FeCl3 →
- Fe + AgNO3 →
- Задания на определение катионов металлов
Для распознавания веществ используют качественные реакции на катионы и анионы. Мы сейчас говорим о металлах, значит на какие ионы нам нужно обратить внимание? (на катионы)
Лабораторный опыт № 5 :
I. Задание: Определить катионы металлов в трех пробирках при поморщи одного реагента.
Реактивы: MgСl2, AlCl3, CuCl2
Какой ход ваших мыслей для выполнения данного задания?
(Так как нужно определить катионы металлов, мы должны найти что то общее в свойствах катиона Mg2+, Аl3+ и Cu2+. Это можно посмотреть в таблице растворимости.
Все эти катионы образуют нерастворимые или малорастворимые основания. Значит, возможно, образование осадка. Следовательно, общим реагентом для них будет щелочь.
Следовательно, для проведения исследования, используем имеющийся у нас на столах гидроксид натрия)
-
CuCl2 +2NaOH=Cu(OH)2 +2NaCl2 Сu2++2OH- = Cu(OH)2 ↓(голубой осадок)
-
МgСl2+ 2NaOH=Ca(OH)2 +2NaCl2 Mg2++2OH- = Mg(OH)2 (белый осадок)
-
2AlCl3 +3NaOH= 2Al(OH)3 +3NaCl2 2Al3+ +3OH-= 2Al(OH)3 ↓ (белый осадок) Al(OH)3 + NaOH = Na [Al (OH)4] (осадок растворяется) Al(OH)3 + OH- = Na+ + [Al (OH)4]-
(образование голубого осадка говорит о наличии в растворе катионов меди, значит в пробирке № 3 хлорид меди; в двух других пробирках образовался белый осадок. Для распознавания добавим в эти пробирки еще щелочь. В пробирке №2 осадок растворился, значит в этой пробирке хлорид алюминия – он амфотерный и растворяется в избытке щелочи. А тогда в пробирке № 1 хлорид магния.
IV. Закрепление нового материала.
Предлагается ребятам выполнить интерактивное упражнение:
С какими из веществ будут реагировать предложенные металлы при нормальных условиях? Выбрать правильные ответы.
- С какими веществами реагируют металлы?
- Чем являются металлы в реакциях – окислителями или восстановителями?
- Какие поправки вводятся для реакций металлов с водой, кислотами, солями?
- Для чего нужно изучать химические свойства металлов? Где их можно использовать?
- Где применить полученные знания?
Ответ: Металлы широко используются человеком в технике, медицине, различных отраслях промышленности, но при использовании надо учитывать их свойства: взаимодействие с кислородом, водой, различными солями.
V.Итоги урока. «Самооценка». Учащиеся оценивают свою работу на уроке по результатам теста и своим ответам. Учитель корректирует оценки и выставляет их в журнал.
VI. Домашнее задание.
-
Для всех: §8 , упр. 7,8 (письменно)
-
Придумать кроссворд по теме «Металлы»






