- Химические свойства металлов. Электрохимический ряд напряжения металлов. 11-й класс
- Ход урока
- I. Стадия вызов.
- II. Осмысление новой информации.
- III. Рефлексия, размышление.
- Конспект урока по химии в 9 классе по теме: "Химические свойства металлов"
- Технологическая карта урока химии 9 класс "Химические свойства металлов"
- Методическое пособие для учителя Авторский коллектив фгаоу дпо Академия Минпросвещения России
Презентация на тему: Электрохимический ряд напряжений металлов. Общие химические свойства металлов
Скачать эту презентацию
Получить код Наши баннеры 






Скачать эту презентацию
№ слайда 1
Описание слайда:
Электрохимический ряд напряжений металлов. Общие химические свойства металлов
№ слайда 2
Описание слайда:
Цель урока: Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ
№ слайда 3
Описание слайда:
Задачи урока: Повторить общие химические свойства металловОбъяснить зависимость свойств металлов от их положения в ЭХРНМ Выполнить упражнения на написание уравнений химических реакций, характеризующих общие химические свойства металлов Провести диагностику и коррекцию знаний
№ слайда 4
Описание слайда:
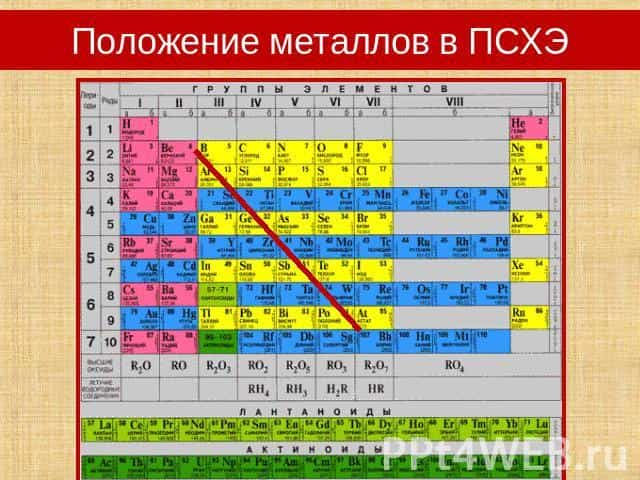
Вспомним! Положение металлов в ПСХЭОсобенности строения атомов металлов (радиус атома, количество электронов на внешнем энергетическом уровне, электроотрицательность)Способность к принятию или отдаче электронов
№ слайда 5
Описание слайда:
Положение металлов в ПСХЭ
№ слайда 6
Описание слайда:
Схема строения атома 11p 12n 2 8 1
№ слайда 7
Описание слайда:
Вывод: Атомы металлов – ……………. электроны с внешнего энергетического уровня, поэтому являются ………………………..
№ слайда 8
Описание слайда:
Атомы металлов – восстановители, а катионы металлов?Катионы металлов принимают электроны, и являются окислителями
№ слайда 9
Описание слайда:
Окислители металловАтомы неметаллов в степени окисления = 0 в составе простых веществ неметаллов Атомы водорода в степени окисления = +1В составе воды, кислот, щелочейКатионы металловВ составе солей
№ слайда 10
Описание слайда:
Металлы взаимодействуют С неметаллами с образованием бинарных соединений (оксидов, гидридов, сульфидов, галогенидов и др.)С водой с образованием щелочей или оксидов и выделением водородаС растворами кислот с образованием солей и выделением водородаС растворами солей с образованием новой соли и нового металла
№ слайда 11
Описание слайда:
Электрохимический ряд напряжений металлов. Стр. 201
№ слайда 12
Описание слайда:
4 правила ЭХРНМ 1. Чем левее стоит металл в ЭХРНМ тем более сильным восстановителем он является 2. Каждый металл способен вытеснять из растворов солей те металлы , которые в ЭХРНМ стоят правее его Опыт 1 3.
Металлы, находящиеся в ряду напряжений левее водорода, вытесняют его из кислот в растворе Опыт 2 4.
Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные ), в водных растворах взаимодействуют прежде всего с водой Опыт 3
№ слайда 13
Описание слайда:
Металлы после водорода… Взаимодействие с концентрированной серной кислотой при нагревании Cu + 2H2SO4 = CuSO4 + 2H2O + SO2↑
№ слайда 14
Описание слайда:
Металлы после водорода… Взаимодействие с концентрированной и разбавленной азотной кислотой. Опыт — 4Cu + 4HNO3 = Cu(NO3)2 + 2H2O + NO2↑ 3Cu + 8HNO3 = 3Cu(NO3)2 + 4H2O + 2NO↑
№ слайда 15
Описание слайда:
Металлы после водорода… 3. Взаимодействие золота с «царской водкой»Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
№ слайда 16
Описание слайда:
Подведем черту… Металл + кислород = оксид металлаМеталл + хлор = хлорид металлаМеталл + сера = сульфид металлаМеталл + вода = щелочь (оксид) + H2Металл + кислота (р) = соль + H2Металл + соль (р) = соль + металл
№ слайда 17
Описание слайда:
Подведем черту… Металл + серная кислота (к) = соль + вода + «Х», где «Х» — SO2, S, H2S в зависимости от положения металла в ЭХРНММеталл + азотная кислота = соль + вода + «У» где «У» — NO2, NO, N2O, N2, NH3 в зависимости от положения металла в ЭХРНМ и концентрации кислоты
№ слайда 18
Описание слайда:
Напишите реакции: калий + вода = гидроксид калия + водородкальций + вода = гидроксид кальция + водородцинк + вода = оксид цинка + водородолово + вода = оксид олова (II) + водородметаллы, стоящие в ЭХРНМ до водорода, взаимодействуют с водой с образованием щелочи и водорода или с образованием оксида и водорода. Это зависит от их активности.
№ слайда 19
Описание слайда:
железо + соляная кислота = хлорид железа (II) + водородникель + серная кислота = сульфат никеля (II) + водородметаллы, стоящие в ЭХРНМ до водорода, взаимодействуют с растворами кислот (кроме азотной) с образованием растворимой соли и водорода.
№ слайда 20
Описание слайда:
железо + сульфат меди (II) = медь + сульфат железа (II)медь + нитрат ртути (II) = ртуть + нитрат меди (II)металлы взаимодействуют с растворами солей. Согласно ЭХРНМ, каждый более активный металл вытесняет менее активный из раствора соли. НЕ БРАТЬ АКТИВНЫЕ МЕТАЛЛЫ!
№ слайда 21
Описание слайда:
Напишите реакции взаимодействия магния с кислородом, хлором, азотом, водой, соляной кислотой, хлоридом меди(II)Напишите реакцию взаимодействия цинка с концентрированной серной кислотой при нагревании.
Определите с какими из перечисленных веществ (H2SO4(p), H2SO4(к), MgCl2, CuSO4) при обычных условиях взаимодействует железо.
Составьте уравнения возможных реакций, укажите в них окислитель и восстановитель, запишите процессы окисления и восстановления.
№ слайда 22
Описание слайда:
Решение диагностики: 1. 2Mg +O2 = 2MgOMg +Cl2 = MgCl23Mg +N2 = Mg3N2Mg +2H2O = Mg(OH)2 +H2Mg +2HCl = MgCl2 +H2Mg +CuCl2 = MgCl2 + Cu 4Zn +5H2SO4(конц) = 4ZnSO4 +4H2O + H2S↑ Fe + H2SO4 = FeSO4 + H2↑ Fe + CuSO4 = FeSO4 + Cu
№ слайда 23
Описание слайда:
Домашнее задание Выполните задания диагностики для следующих металлов:1 задание для лития Li2 задание для ртути Hg и концентрированной азотной кислоты HNO33 задание для цинка Zn
Скачать эту презентацию
Скачивание материала начнется через 60 сек. А пока Вы ожидаете, предлагаем ознакомиться с курсами видеолекций для учителей от центра дополнительного образования «Профессионал-Р» (Лицензия на осуществление образовательной деятельности
№3715 от 13.11.2013).
Химические свойства металлов. Электрохимический ряд напряжения металлов. 11-й класс
Класс: 11
Цели и задачи:
- Обучающая: Рассмотрение химической активности металлов исходя из положения в периодической таблице Д.И. Менделеева и в электрохимическом ряду напряжения металлов.
- Развивающая: Способствовать развитию слуховой памяти, умению сопоставлять информацию, логически мыслить и объяснять происходящие химические реакции.
- Воспитательная: Формируем навык самостоятельной работы, умение аргументировано высказывать свое мнение и выслушивать одноклассников, воспитываем в ребятах чувство патриотизма и гордость за соотечественников.
Оборудование: ПК с медиапроектором, индивидуальные лаборатории с набором химических реактивов, модели кристаллических решеток металлов.
Тип урока: с применением технологии развития критического мышления.
Ход урока
I. Стадия вызов.
Актуализация знаний по теме, пробуждение познавательной активности.
Блеф-игра: «Верите ли Вы, что…». (Слайд 3)
- Металлы занимают верхний левый угол в ПСХЭ.
- В кристаллах атомы металла связаны металлической связью.
- Валентные электроны металлов крепко связаны с ядром.
- У металлов, стоящих в главных подгруппах (А), на внешнем уровне обычно 2 электрона.
- В группе сверху вниз происходит увеличение восстановительных свойств металлов.
- Чтобы оценить реакционную способность металла в растворах кислот и солей, достаточно посмотреть в электрохимический ряд напряжения металлов.
- Чтобы оценить реакционную способность металла в растворах кислот и солей, достаточно посмотреть в периодическую таблицу Д.И. Менделеева
Вопрос классу? Что обозначает запись? Ме0 – ne —> Me+n (Слайд 4)
Ответ: Ме0 – является восстановителем, значит вступает во взаимодействие с окислителями. В качестве окислителей могут выступать:
- Простые вещества (+О2, Сl2, S…)
- Сложные вещества (Н2О, кислоты, растворы солей…)
II. Осмысление новой информации.
В качестве методического приема предлагается составление опорной схемы.
Вопрос классу? От каких факторов зависят восстановительные свойства металлов? (Слайд 5)
Ответ: От положения в периодической таблице Д.И.Менделеева или от положения в электрохимическом ряду напряжения металлов.
Учитель вводит понятия: химическая активность и электрохимическая активность.
Пред началом объяснения ребятам предлагается сравнить активность атомов К и Li поположению в периодической таблице Д.И. Менделеева и активность простых веществ, образованными данными элементами по положению в электрохимическом ряду напряжения металлов. (Слайд 6)
Возникает противоречие: В соответствии с положением щелочных металлов в ПСХЭ и согласно закономерностям изменения свойств элементов в подгруппе активность калия больше, чем лития. По положению в ряду напряжения наиболее активным является литий.
Новый материал.
Учитель объясняет в чем отличие химической от электрохимической активности и объясняет, что электрохимический ряд напряжений отражает способность металла переходить в гидратированный ион, где мерой активности металла является энергия, которая складывается из трех слагаемых (энергии атомизации, энергии ионизации и энергии гидротации). Материал записываем в тетрадь. (Слайды 7-10)
- Вместе записываем в тетрадь вывод: Чем меньше радиус иона, тем большее электрическое поле вокруг него создается, тем больше энергии выделяется при гидротации, следовательно более сильные восстановительные свойства у этого металла в реакциях.
- Историческая справка: выступление ученика о создании Бекетовым вытеснительного ряда металлов. (Слайд 11)
- Действие электрохимического ряда напряжения металлов ограничивается только реакциями металлов с растворами электролитов (кислот, солей).
- Памятка:
- Уменьшаются восстановительные свойства металлов при реакциях в водных растворах в стандартных условиях (250°С, 1 атм.);
- Металл, стоящий левее, вытесняет металл, стоящий правее из их солей в растворе;
- Металлы, стоящие до водорода, вытесняют его из кислот в растворе (искл.: HNO3);
- Ме (до Al) + Н2О —> щелочь + Н2 Другие Ме (до Н2) + Н2О —> оксид + Н2 (жесткие условия) Ме (после Н2) + Н2О —> не реагируют
- (Слайд 12)
- Ребятам раздаются памятки.
- Практическая работа: «Взаимодействие металлов с растворами солей» (Слайд 13)
- Осуществите переход:
- CuSO4 —> FeSO4
- CuSO4 —> ZnSO4
Демонстрация опыта взаимодействия меди и раствора нитрата ртути (II).
III. Рефлексия, размышление.
Повторяем: в каком случае пользуемся таблицей Менделеева, а в каком случае необходим ряд напряжение металлов. (Слайды 14-15).
Возвращаемся к начальным вопросам урока. На экране высвечиваем вопрос 6 и 7. Анализируем какое высказывание не верное. На экране – ключ (проверка задания 1). (Слайд 16).
Подводим итоги урока:
- Что нового узнали?
- В каком случае возможно пользоваться электрохимическим рядом напряжения металлов?
Домашнее задание: (Слайд 17)
- Повторить из курса физики понятие «ПОТЕНЦИАЛ»;
- Закончить уравнение реакции, написать уравнения электронного баланса: Сu + Hg(NO3)2→
- Даны металлы (Fe, Mg, Pb, Cu) – предложите опыты, подтверждающие расположение данных металлов в электрохимическом ряду напряжения.
Оцениваем результаты за блеф-игру, работу у доски, устные ответы, сообщение, практическую работу.
Используемая литература:
- О.С. Габриэлян, Г.Г. Лысова, А.Г. Введенская «Настольная книга для учителя. Химия 11 класс, часть II» Издательство Дрофа.
- Н.Л. Глинка «Общая химия».
19.02.2011
Конспект урока по химии в 9 классе по теме: "Химические свойства металлов"
- План – конспект
- урока химии в 9 классе Тема: Химические свойства металлов
- Цель урока: познакомить учащихся с химическими свойствами металлов.
- Задачи урока:
- образовательные:
- — знать химические свойства металлов;
- — уметь устанавливать причинно-следственные связи между положением металла в периодической таблице и свойствами металлов;
- — уметь прогнозировать свойства металлов по их положению в ряду
- активности;
- развивающие:
- — развивать творческие способности, логическое мышление;
- — развивать общеучебные умения и навыки;
- — развивать коммуникативные и информационные компетенции;
- воспитательные:
- — воспитывать познавательный интерес к предмету;
- — воспитывать дисциплинированность, самостоятельность, ответственность.
- Ход урока
У ч и т е л ь (приветствует учащихся). Сегодня мы с вами предпримем путешествие в море химических реакций по разным островам.
II. Актуализация опорных знаний. 1. 4 человека работают по карточкам по предыдущей теме «Физические свойства металлов» в течение 7 минут.
Карточка №1. Металлическая кристаллическая решетка, особенности строения.
Карточка №2. Фотоэффект, то есть свойство металлов испускать электроны под действием лучей света, характерен для щелочных металлов, например, цезия. Почему? Где это свойство находит применение?
Карточка №3. Какие физические свойства вольфрама лежат в основе его применения?
Карточка №4. Какие физические свойства металлов используют в технике?
2. Остальные работают с учителем.
- Металл – это точность, металл – это прочность.
- Скорость, высота, блеск и красота.
- Не сразу в дом пришёл металл,
- Не сразу вилкой, ложкой стал.
- Не сразу стал он кружкой и заводской игрушкой.
- Он в проводах несёт нам свет,
- Металл – коньки, велосипед,
- Метро, трамвай, будильник,
- Утюг и холодильник.
Какие физические свойства металлов легли в основу их применения? (ответы учащихся).
3. Ответы учащихся по карточкам (оценку ответов дают одноклассники).
III. Постановка цели.
Учитель. У металлов есть только физические свойства? (нет).
Учитель. Какие ещё свойства характерны для металлов? (химические).
Учитель. Как вы считаете, о чём мы сегодня будем говорить? (о химических свойствах металлов).
Учитель. Итак, тема нашего урока – химические свойства металлов.
IV. Объяснение нового материала. В безбрежном море реакций у металлов свои острова. Первый, и самый любимый остров – «Неметаллы» . Из 109 химических элементов 87 являются металлами.
И как у людей есть определённый тип темперамента, так и у металлов есть свой характер. Их можно разделить на три типа.
Первый тип – самые активные – расположены в ряду активности до марганца, второй – от марганца до знака водорода, они более спокойные, и третий тип – очень спокойные, невозмутимые (они располагаются в ряду активности после знака водорода).
1) с кислородом: н.у I тип4Na + O2 → 2Na2O (фронтально) II тип 2Cu + O2 → 2СuO (самостоятельно) III тип Au + O2 → не взаимодействует.
- 2) c водородом: (только первого типа) 2Na + H2 → 2NaH (фронтально).
- 3) с другими неметаллами: 2Fe +3Cl2 → 2FeCl3 (фронтально, следующие четыре реакции учащиеся выполняют самостоятельно с последующей самопроверкой по ключу)
- Al + S →
- Mg + N2 →
- K + C →
- Ca + P →
- Учитель: У кого возникли вопросы?
- Второй остров – «Вода».
- I тип Mg + 2H2O = Mg(OH)2 + H2↑
- Учитель. Проведение опыта весьма опасно, поэтому данный опыт на медиаролике мы предоставим продемонстрировать Коновалову Алексею (учащийся демонстрирует медиаролик «Горение магния в парах воды»)
- II тип Zn + H2O = ZnO + H2↑ (самостоятельно с последующей фронтальной проверкой).
- III тип не реагируют.
- Третий остров – «Кислоты» (не брать HNO3, H2SO4(конц.)
- а) I и II тип: Fe+2HCl = FeCl2 + H2↑ (выполняет опыт Горячкина Анастасия)
- III тип не взаимодействует.
- б) с H2SO4 (конц.): Ag + H2SO4 → Ag2SO4 + H2O + SO2
- в) с НNO3: Fe + HNO3 → Fe(NO3)3 + H2O + NO
Учитель. Эти две реакции вы уравняете дома, применив метод электронного баланса.
- Четвёртый остров – «Соли» (свободный металл должен быть активнее, чем в соли по электрохимическому ряду напряжений)
- Fe + CuSO4 = FeSO4 + Cu (выполнение опыта Гимадеевой Анастасией)
- Пятый остров – «Металлотермия» (металлы первого типа взаимодействуют с оксидами других металлов):
- 8Al + 3Fe3O4 = 4Al2O3 + 9Fe (фронтальное написание уравнения)
- II и III тип не взаимодействуют.
- Общий вывод.
1. Учитель. Чем во всех этих реакциях является металл? (Отдаёт электроны, является восстановителем). Это можно выразить схемой:
- Ме – ne → Me │восстановитель, окисление
- 2. Дописать уравнения практически возможных реакций самостоятельно:
- Na + S →
- K + H2O →
- Li + HCl →
- Ca + Cl2 →
- Cu + H2O → (с последующей взаимопроверкой)
V. Рефлексия. Итак, давайте подведём итог нашего путешествия по островам.
1. На какие острова приплывали металлы разных типов?
2. Чем при этом являются металлы? (восстановителями).
3. Что больше всего заинтересовало вас на уроке?
4. Что нового вы узнали?
VI. Домашнее задание: прочитатьпараграф 8, выполнить письменно упражнение № 2, 5,7, а также две реакции (см. выше) с электронным балансом.
Технологическая карта урока химии 9 класс "Химические свойства металлов"
Технологическая карта урока в 9 классе по теме « Химические свойства металлов».
| Тема | Химические свойства металлов. Ряд активности |
| Цель | -формировать представление об электрохимическом ряде напряжения металлов, актуализировать знания о химических свойствах металлов, формировать умения составлять уравнения химических реакций с участием металлов |
| Задачи |
|
| Планируемый результат | Предметные :научиться использовать при характеристике металлов и их соединений понятия «металлы», «ряд активности металлов», «щелочные металлы», «щелочноземельные металлы», называть соединения металлов и составлять их формулы по названию; характеризовать химические свойства простых веществ-металлов; объяснять зависимость свойств химических элементов-металлов от положения в Периодической системе химических элементов Д. И. Менделеева; составлять молекулярные уравнения реакций, характеризующих химические свойства металлов и их соединений, а также электронные уравнения процессов окисления-восстановления;
Личностные : будут сформированы умения использовать знания в быту. формирование навыков индивидуальной и коллективной исследовательской деятельности. |
| Оборудования и реактивы | раствор соляной кислоты (НCl), раствор серной кислоты (H2SO4), CuSO4 (раствор), металлы: цинк, медь, железо,медная проволока, пробирки, штатив для пробирок. |
| Формы и методы обучения. | Формы:фронтальная, индивидуальная (работа с тестами, ) групповая Методы:словесные,практические,дедуктивные |
| Этапы урока | Деятельность учителя | Деятельность учащихся | УУД на уроке |
| 1. Организационный момент. Проверка готовности учащихся к уроку. Эмоциональный и психологический настрой на урок. | Проверяют свою готовность к уроку. | ||
| 2. Актуализация опорных знаний. Цель этапа : повторить ранее изученный материал (Положение металлов в П.С.,строение атомов металлов, физические свойства ). |
– Какими свойствами (окислительными или восстановительными) обладают металлы? Почему? – Как меняются восстановительные свойства металлов в А группе и периоде? Почему?
|
— Отвечают на вопросы Выполняют тестовую работу в тетрадях, затем взаимопроверка в парах. | Коммуникативные УУД: умение слушать и понимать других, умение строить речевое высказывание в соответствии с поставленными задачами, работать в парах. |
| 3. Формулирование темы, цели урока. Цель этапа: организовать самостоятельное формулирование | Проблемная ситуация. Учитель демонстрирует взаимодействие железа с раствором сульфата меди и меди с раствором сульфата железа (П). (инструктаж по Т.Б.) -Почему во втором случае реакция не протекает?Может быть, медь вообще не реагирует с растворами солей? Затем демонстрируется реакция меди с раствором нитрата ртути (II). — Почему один и тот же металл в одних случаях взаимодействует с солями металлов, а в других нет? Как определить, будет ли взаимодействовать металл с раствором соли, не прибегая к эксперименту?Достаточно ли у нас знаний о металлах — А теперь давайте подумаем, какова цель урока? |
|
|
| 4. Изучение нового материала. Цель этапа (обучающая): организовать поиск решения проблемы | — Для того, чтобы ответить на наши вопросы давайте проведем практическую работу. -Но сначала обратимся к тексту параграфа. Как изменяются свойства металлов , расположенных в электрохимическом ряду напряжения?
Ме + 3……..
|
Слушают, уясняют поставленную задачу. Проводят эксперимент.
Слушают, уясняют поставленную задачу. Проводят эксперимент. -Металлы , стоящие левее вытесняют из солей металл, стоящие правее. 2-3 ученика записывают свой кластер на доске. |
Познавательные УУД: проводить эксперимент, обобщать полученные данные, делать выводы, извлекать информацию из текста. Коммуникативные УУД:устанавливать рабочие отношения, эффективно сотрудничать, с достаточной полнотой выражать свои мысли. Формируем умение оценивать учебные действия в соответствии с поставленной задачей. РегулятивныеУУД: проявлять способность к мобилизации сил и энергии в достижении цели |
| 7. Закрепление и обобщение изученного материала. Цель – определение степени «понимания» материала и «умения» его применения обучающимися |
|
. Определяют свои достижения. Выполняют задания в тетрадях. | Познавательные…УУД: Формируем умения использовать получееные знания для решения упражнений. Регулятивные УУД: оценивать степень достижения цели |
| 8. Итог урока. Рефлексия. Цель этапа: подвести итог урока, оценить работу детей на уроке, прокомментировать ход выполнения домашнего задания | Комментирует домашнее задание. Д/з: п.41,упр 4 (1 группа) упр.2(2 группа),упр 3 ( 3 группа) Побуждает к анализу индивидуальных достижений.. Предлагает составить синквейн. |
|
|
Тестовая работа
| 1 вариант |
1. Атом железа имеет электронную конфигурацию внешнего энергетического уровня: 1) …3d64s2 2) …4s2 3) …4s24p6 4) …3d54s2 2. В каком ряду химические элементы расположены в порядке увеличения металлических свойств?
|
2 вариант
1. Атом кальция имеет электронную конфигурацию внешнего энергетического уровня: 1) …3d64s2 2) …4s2 3) …4s24p6 4) …3d54s2
2. В каком ряду химические элементы расположены в порядке увеличения металлических свойств?
- 1) Sr, Ca, Mg 2) Na, Mg, Al 3) Al Mg Na 4) Ba, Ra Sr
- 3. Самый легкоплавкий металл: 1) Li 2) Cs 3) V 4) W
- 4. К щелочным металлам относится: 1) Са 2) Na 3) Cu 4) Al
- 5. Самый тяжелый металл: 1) Li 2) Mg 3) Os 4) Cs
- 6. Жидкий металл : 1) Hg 2) Li 3) Au 4) W
- Ответы
- 1 вариант 2 вариант
- 1 -1 1-2
- 2-4 2-3
- 3-4 3-1
- 4-2 4-2
- 5-1 5-3
- 6-3 6-1
- Инструктивная карта .
- При выполнении практической работы соблюдайте правила техники безопасности!
Опыт №1.Взаимодействие металлов с кислородом.
Зажгите спиртовку. Внесите медную проволоку в пламя спиртовки. Что наблюдаете? Запишите уравнение химической реакции.
Опыт№2.Взимодействие металлов с кислотами.
В две пробирки налейте раствор соляной кислоты , в первую положите гранулу цинка, во вторую гранулу меди .Что наблюдаете? Запишите уравнение химической реакции.
Опыт№3 Взаимодействие металлов с растворами солей.
В пробирку налейте раствор сульфата меди II, положите гранулу железа. Что наблюдаете? Запишите уравнения реакций.
Методическое пособие для учителя Авторский коллектив фгаоу дпо Академия Минпросвещения России
С этим файлом связано 45 файл(ов). Среди них: Анализ восп работы ШАБЛОН.doc, самоанализ.docx, Практическая работа 5.docx, изменения по обновленным ФГОС.pdf, Практическая работа 4.docx, практическая работа 2.docx, Практическая работа 3.docx, практическая работа 1.doc, результаты интенсива.docx, Доклад.docx, Открытый урок на тему _Ядерный реактор_ (9 класс).doc, Присич Александра.docx, практическая работа 2.docx, КИМ окр мир 4 кл.docx, Итоговая КР ОМ 4 кл.docx, Итоговый тест Лит. чт 3 кл.docx, КТП русский 4 кл.docx, Контр вопросы ОВЗ.docx, Трон.docx, Анкета Уровень воспитанности.docx, Искры талантов.docx, 2020 ОБЖ 10-11 .doc, доклад по наставничеству.docx, Раздел 4.1. Лекция 1. Способы определения.pdf, буклет по пожарам.docx, сценарий.docx, КТП чтение 5 класс.docx, смысловое чтение.docx, КТП Профильный труд.docx, практическая работа 21 по химии.docx, ответы по физике.docx, db842217-d4d6-46ff-b9dd-63938ad0648c.pdf, 43b1474a-4dec-4b8d-946f-7ca9ac3ac86f.pdf, 0ce16d8c-c0b0-4b81-bac0-dd15ed81686a.pdf, 0b57c7ed-dfaf-41cc-b79f-bc523cffdba9.pdf, ответ на тест «Понимание особенностей естественно-научного иссле, обыкновенные дроби.pptx, Урок Все действия с обыкновенными дробями.docx, kontrolnoe_spisyvanie_2.docx, ИНСТРУКЦИЯ ПО ФОРМИРОВАНИЮ И ПОДПИСАНИЮ ДОКУМЕНТА О ПРИЕМКЕ.doc, 1.doc, Титульный лист психология 4.doc, РОСТ 1-4кл ГОТОВ!!!.docx, Титульный лист физ ра.doc, тех оснащение 1.docx и ещё 35 файл(а). Показать все связанные файлыПодборка по базе: Экономика организации (учебное пособие).pdf, Грамм трен для 5 кл. для учителя.docx, Немецкий язык Шаг за шагом. Учебное пособие. Уровень А1. Часть 1, Информация об ответственном за методическое сопровождение сотруд, Электробезопасность учебное пособие .pdf, Учебное пособие Кузнецов Электронные приборные системы.pdf, Реализация требований обновленных ФГОС ООО в работе учителя . Ит, Практическая работа Чек-лист анализа фрагмента учебного занятия., Использование результатов внешней оценки в деятельности учителя., Эссе учителя математики МБОУ.docx Тема «Химические свойства металлов. Ряд активности (электрохимический ряд напряжений) металлов» При изучении данной темы обучающиеся должны уметь пользоваться электрохимическим рядом напряжений металлов, составлять уравнения химических реакций, характеризующих свойства металлов, и объяснять свойства металлов в свете представлений об окислительно- восстановительных процессах; знать состав и строение сплавов, отличие сплавов от металлов; уметь объяснять, почему в технике широко используют сплавы.Задание «Как «болеет» железо» 121 На земном шаре ежегодно «болеет» ржавчиной такое количество железа, которое равняется четверти его годовой добычи. Процесс коррозии можно условно выразить следующей схемой: Fe + O2 + H2O → Fe2O3 · nH2O. Как видно из схемы, ржавчина состоит из гидратированного оксида железа(III) Fe2O3·nH2O и гидроксидов железа (FeO(OH), Fe(OH)3). Для борьбы с ржавчиной применяются различные методы. Например, железо смешивают с другими веществами (добавками) и получают сплавы. Наиболее известные из них – сталь и чугун. По значению для человека железо является металлом № 1. Задание 1 Учитывая распространенность веществ в природе, сформулируйте предположение о том, с какими из химических элементов железо образует соединения в природе. Приведите пример формулы соединения с железом. Особенностью этого задания является формирование / проверка умения обучающихся распознавать предположения (допущения), аргументы и описания в научно-популярных текстах. Известно, что железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-е место среди всех элементов и 2-е место среди металлов. Прочитав в тексте задания фразу «При наличии кислорода, воды и достаточного времени практически любое изделие из железа в конечном счете полностью преобразуется в ржавчину и разрушается (корродирует)», учащиеся должны сделать вывод, что железо довольно активно реагирует с кислородом и водой. Также в задании сказано: «В силу достаточной химической активности железо на Земле встречается преимущественно в виде соединений». Обучающихся необходимо научить выдвигать гипотезу (предположение), на проверку которой направлено данное исследование. Подсказка для формулирования гипотезы может быть такой: «Наличие в природе каменного 122 угля (С) и углекислого газа (СО2), серы (S), сернистого газа (SO2) и воды (Н2О) позволяет сделать предположение о наличии в природе в виде соединений…» Вспомним, что железо образует ряд минералов: магнитный железняк, или магнетит Fe3O4; красный железняк, или гематит Fe2O3; бурый железняк, или лимонит 2 Fe2O3 ∙ 3 H2O; железный колчедан, или пирит FeS2 (используют при производстве серной кислоты); гидрокарбонат железа Fe(HCO3)2 (встречается в природных и некоторых минеральных водах). Возможна обратная задача: при формулировании гипотезы «В природе железо встречается в виде соединений с кислородом или серой, иногда встречается чистое железо, попадающее на Землю с метеоритами», приведите аргументы, подтверждающие этот факт. Возможный ответ Ответ:в природе много соединений железа с кислородом – оксидов: FeO, Fe2O3Существование каменного угля и углекислого газа, серы, сернистого газа и воды позволяет сделать предположение о наличии в природе месторождений сульфидов (FeS, FeS2), сульфатов (FeSO4) и карбонатов (FeCO3) железа Дан верный ответ 1 балл Другие ответы или ответ отсутствует 0 баллов Задание 2 В домашней мастерской всегда много изделий из железа и его сплавов. Предложите два способа, которые смогут замедлить процесс коррозии железных изделий и продлить срок их службы. 123 Данное задание помогает научить школьников интерпретировать данные и делать соответствующие выводы, а также прогнозировать свойства неизученных веществ по аналогии со свойствами изученных на основе знания химических закономерностей. Так как «процесс коррозии можно условно выразить следующей схемой: Fe + O2 + H2O → Fe2O3 · nH2O», то, следовательно, для того, чтобы замедлить процесс коррозии железных изделий, необходимо исключить действие кислорода и воды. Возможный ответ Ответ: предложены два способа защиты: использование осушителей воздуха (поглотителей влаги), покрытие изделий маслом, специальной краской Предложены два способа защиты 1 балл Другие ответы или ответ отсутствует 0 баллов Задание 3 Объясните, почему в промышленности и быту большее применение получили сплавы, а не чистые простые вещества-металлы. При выполнении этого задания школьники должны вычленить из текста ключевую информацию: «Для борьбы с ржавчиной применяются различные методы, например смешивают с другими веществами (добавками) и получают сплавы. Наиболее известные из них – сталь и чугун». Также у обучающихся должно быть сформировано представление о том, чтосплавы – это особые системы, состоящие из двух и более металлов или металлов и неактивных неметаллов (углерод, фосфор, кремний, иногда сера). Свойства сплавов отличаются от свойств каждого из металлов, входящих в его состав. Дело в том, что сплавлением одних металлов с другими можно существенно улучшить свойства многих металлов, например: твердость, пластичность, текучесть, электрические, магнитные и термические свойства, а также антикоррозийную устойчивость. 124 Возможный ответ Ответ: приведено одно из объяснений: сплавы имеют большее многообразие свойств; можно создавать сплавы с заранее заданными свойствами в зависимости от области применения Названа одна из причин 1 балл Другие ответы или ответ отсутствует 0 баллов Тема «Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V). Фосфорная кислота и ее соли. Фосфорные удобрения» Задание «Такой разный фосфор» Фосфор – один из распространённых элементов земной коры, он входит в первую двадцатку. Содержится фосфор и в тканях живых организмов – входит в состав белков и других важнейших органических соединений (АТФ, ДНК). Фосфор называют элементом жизни. История его получения относится ещё к временам алхимии. Разорившийся купец и при этом алхимик – самоучка Бранд – в поисках философского камня получил красное «уринное масло». При его дальнейшей дистилляции алхимик заметил образовавшуюся на дне реторты белую пыль. Алхимик решил, что ему удалось извлечь «элементарный огонь», но не получив желаемого золота, Бранд стал продавать свой секрет по цене, во много раз превосходящей золото, и обогатился на этом. Задание 1 1. В переводе с греческого название фосфора означает «светоносный». Сегодня известно несколько аллотропных модификаций фосфора – белый, красный, чёрный. Какая из этих модификаций стала причиной такого названия химического элемента? 125 Возможный ответ Ответ: белый фосфор обладает способностью светиться Записан верный ответ 1 балла Другой ответ, ответ отсутствует 0 баллов Задание 2 Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, – это горючесть. Горючесть фосфора очень велика и зависит от аллотропной модификации. Фосфор вместе с другими веществами наносится на спичечный коробок и при трении загорается. 1. Какая аллотропная модификация фосфора применяется при производстве спичек? 2. Какое вещество можно увидеть в виде белого дымка в момент зажигания спички? Запишите название и химическую формулу этого вещества. Для этого задания рассмотрим проведение химического эксперимента. Обязательно продемонстрируйте данный химический эксперимент. Необходимо найти ответ на вопрос: по каким признакам химических реакций можно судить, что образовалось новое вещество? После рассмотрения признаков химических реакций следует перейти к условиям 126 их протекания. В химии не ограничиваются простым наблюдением протекающего процесса, а наблюдения сочетают с проведением эксперимента. Эксперимент – это исследование каких-либо явлений путем активного воздействия на них разными способами, соответствующими целям исследования. Провести химический эксперимент – это значит специально создать такие условия, при которых наблюдение исследуемого явления проводить наиболее удобно. Проведение химического эксперимента способствует формированию умений устанавливать связи между реально наблюдаемыми химическими явлениями и процессами, происходящими в микромире, объяснять причины многообразия веществ, зависимость их свойств от состава и строения, а также зависимость применения веществ от их свойств. На большинство вопросов данного комплексного задания о фосфоре после просмотра химического эксперимента можно ответить правильно.Для решения этого задания можно предложить школьникам рассмотреть сущность аллотропного перехода между белым и красным фосфором. Возможный ответ Ответ: 1) красный фосфор используют в производстве спичек; 2) белый дым – это оксид фосфора(V) P2O5Записаны верные ответы на два вопроса 2 балла Записан верный ответ на один вопрос 1 балл Другие ответы или ответ отсутствует 0 баллов 127 Задание 3 Фосфор (в виде фосфатов) – один из трех важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идет на получение фосфорных удобрений: суперфосфата Ca(H2PO4)2, преципитата СаНРО4 · Н2О, аммофоски (NH4)2SO4 + (NH4)2HPO4 + K2SO4 и др. Доля производства удобрений, содержащих в своем составе только один фосфор, падает, и все больше производится комплексных удобрений, содержащих два или три питательных элемента. 1. Какое из приведенных удобрений относится к комплексным? Напишите его название. 2. Какие макроэлементы входят в состав этого удобрения? Напишите их названия. Прежде чем приступать к выбору удобрения, стоит разобраться, что такое полное комплексное удобрение. Выпускаются различные составы для деревьев и растений. Они включают от двух компонентов, каждый из которых имеет свое определенной действие. Перечень выпускаемых смесей достаточно широк. Чаще всего в их состав входят: калий, фосфор, азот. Растения на разных этапах жизни потребляют питательные элементы в разных количествах. Азот растения больше всего поглощают в период активного роста — с момента прорастания семян до формирования первых цветов. Фосфор нужен растениям в период прорастания. В период подготовки растений к зиме — важную роль играет калий Перечень вводимых в комплексное удобрение компонентов постоянно меняется. Уделяется внимание не только вводимым компонентам, но и их процентному соотношению. Это позволяет подобрать препарат 128 в зависимости от возникшей проблемы. При этом очень важно придерживаться инструкции, разработанной производителем. В таком случае культурные растения начинают активно развиваться, лучше сопротивляются внешнему воздействию, активно наращивают зеленую массу. Для выполнения этого задания необходимо школьников научить определять процентное содержание химических элементов в том или ином соединении.Норма азота для разных культур зависит от плодородия и влажности почвы, предшественника, способа внесения удобрения, величины запланированного урожая. Чем ниже плодородие почвы и выше запланированный урожай, тем больше азотных удобрений нужно вносить. Возможный ответ Ответ: 1) аммофоска относится к комплексным удобрениям; 2) аммофоска содержит макроэлементы – азот, калий и фосфор Записаны верные ответы на два вопроса 2 балла Записан верный ответ на один вопрос 1 балл Другие ответы или ответ отсутствует 0 баллов Задание 4 Фосфор присутствует в живых клетках, входит в состав костей человека, зубной эмали. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Усвоение фосфора происходит эффективнее при его приеме вместе с кальцием в соотношении 3:2 (P:Ca). Содержание и соотношение кальция и фосфора представлено в таблице: 129 Ознакомьтесь с информацией в таблице и назовите два продукта, в которых соотношение элементов наиболее соответствует рекомендуемому. Ход рассуждения
В таблице 2:3 дано соотношение кальция и фосфора (Ca:Р). 2:3 = 0,666 Таким образом, в данном заданиипредлагается сформулировать выводы на основе интерпретации данных, представленных в различных формах. Такие задания необходимо включать в содержание урока. Возможный ответ Ответ: яблоки и пшеничный хлеб Записан верный ответ 1 балл Другие ответы, ответ отсутствует 0 баллов 130 Задание 5 При недостатке фосфора в организме развиваются различные заболевания костей. Суточная потребность в фосфоре для взрослых составляет 1,0–2,0 г, для детей и подростков – 1,5–2,5 г. Сколько граммов (килограммов) жареной трески минимально надо употребить подростку, чтобы покрыть суточную потребность в фосфоре? Ответ подтвердите расчетами (округлите до целых). Задание является типично межпредметным: оно основано на понимании основ здорового питания и формировании здорового образа жизни. Для выполнения данного задания необходимо развивать компетенцию «оценивать достоверность научных аргументов и доказательства из различных источников». Необходимо научить использовать вопросы в качестве инструмента познания и в качестве основы для формирования гипотезы по проверке правильности высказываемых суждений.Решение задачи Составляем пропорцию: 0, 274 – это 100 г 1,5 – х 1,5·100 : 0,274= 547 г Правильный ответ: 547 г. Возможный ответ Ответ: 547 г; расчёты: Записан верный ответ 1 балл Другие ответы или ответ отсутствует 0 баллов 131 Заключение Российская система образования рассматривает фундаментальные знания как основу для решения реальных задач, стоящих перед обществом. Формирование естественно-научной грамотности возможно в рамках комплексной подготовки учителей к реализации новых видов педагогической деятельности, которая должна быть направлена на всестороннее развитие личности обучающихся, а также на освоение ими новых видов предметных и метапредметных умений. Учителю, как организатору процесса обучения, необходимо всесторонне рассматривать на урочных и внеурочных занятиях различные аспекты формирования естественно-научной грамотности, учитывая при этом возможность построения индивидуальной траектории обучения и воспитания обучающихся. Это является актуальным как с точки зрения подготовки школьников к международным и национальным исследованиям, так и с точки зрения формирования компетенций, направленных на адаптацию обучающихся к жизни в современном обществе. 132 Список источников Литература 1. Демидова М.Ю. Подходы к разработке заданий по оценке естественно- научной грамотности обучающихся / М.Ю. Демидова, Д.Ю. Добротин, В.С. Рохлов // Педагогические измерения. – 2020. – № 2. – С. 8–19. 2. Разумовский В.Г., Пентин А.Ю. и др. Естественнонаучная грамотность: контрольные материала и экспериментальные умения. / Народное образование, 2017 — №4-5, с. 159-167 3. Колесникова Г. М. Развитие естественно-научной функциональной грамотности // Молодой ученый. — 2017. — № 7.3 (111.3). — С. 13-15. 4. Пентин А. Ю. , Ковалева Г. С. и др. Состояние естественнонаучного образования в российской школе по результатам международных исследований TIMSS и PISA // Вопросы образования. 2018. — № 1, с.79-105 5. Пентин А.Ю., Никифоров Г.Г., Никишова Е.А. Основные подходы к оценке естественнонаучной грамотности // «Отечественная и зарубежная педагогика» — 2019. — № 4 Т.1 (61) 6. Сборник информационных и методических материалов для педагогов (по проблеме формирования функциональной грамотности у школьников). М., Высшая школа экономики, 2020. – 89 с.Интернет-ссылки |






