- Щелочные металлы
- Химические свойства
- Оксиды щелочных металлов
- Гидроксиды щелочных металлов
- Пероксиды щелочных металлов
- Фактчек
- Проверь себя
- Щелочные металлы
- Щелочные металлы
- Общая характеристика
- Природные соединения
- Получение
- Химические свойства
- Оксиды щелочных металлов
- Получение
- Химические свойства
- Гидроксиды щелочных металлов
- Получение
- Химические свойства
- Щелочные металлы
- Щелочные металлы:
- Строение атомов щелочных металлов:
- Щелочные металлы: общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 9 класс
- Урок 6: Щелочные металлы
- Представители щелочных металлов
- Строение атомов щелочных металлов
- Изменение химических свойств щелочных металлов
- Внешний вид и физические свойства щелочных металлов
- Нахождение в природе щелочных металлов
- Обнаружение ионов металлов в соединениях
- Качественные реакции
- Обнаружение катионов лития
- Обнаружение катиона натрия
- Обнаружение катиона калия
- Обнаружение катионов рубидия, цезия
- Обнаружение ионов франция
- Химические свойства щелочных металлов
- Реакция с простыми неметаллами
- Взаимодействие с водой
- Взаимодействие с сильными кислотами
- Специфические химические свойства лития
- Получение щелочных металлов
- Применение соединений щелочных металлов
- Кодовое название — щелочные металлы. Откуда оно произошло?
- Почему щелочные металлы не берут в реакции с кислотами?
- Рассмотрим химические и физические свойства щелочных металлов;
- Как можно распознать катионы щелочных металлов?
Эти металлы — очень активные! Именно их кидают в ванны с водой, в результате чего происходят мощщные взрывы.
Щелочные металлы
IA группа называется главной подгруппой первой группы, в которую входят щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
| Кодовое название — щелочные металлыДанные металлы получили такое название, так как большинство их соединений растворимы в воде («выщелачивать» означает «растворять»). |
Щелочные металлы — серебристо-белые металлы с высокой электро- и теплопроводностью, обладают ковкостью, пластичностью и металлическим блеском.
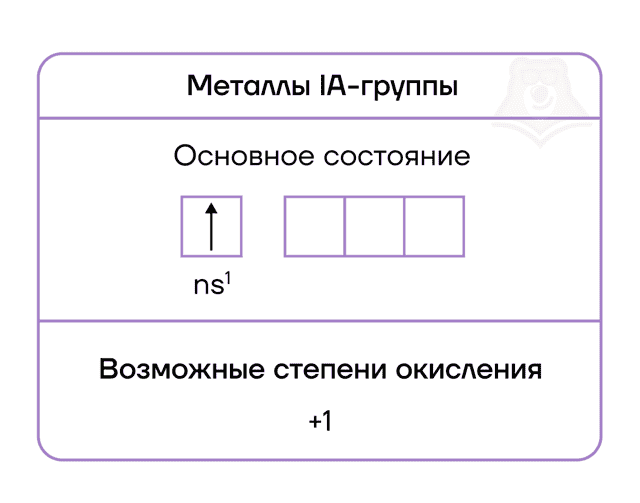
- Главная особенность строения атомов химических элементов IA группы заключается в том, что они содержат один электрон на внешнем энергетическом уровне — их электронная конфигурация ns1.
- Из этого следует, что атомам щелочных металлов энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа, приобретая при этом степень окисления +1.
- Основным способом получения таких металлов является электролиз расплавов солей.
Химические свойства
Их химические свойства крайне логичны:
- как типичные металлы они будут вступать в реакции со своими противоположностями — неметаллами;
- как восстановители — реагировать с окислителями (в том числе восстанавливать металлы и неметаллы из их оксидов);
- как металлы, стоящие в ряду активности до водорода — вступать в реакции вытеснения с водой, кислотами-неокислителями и солями менее активных металлов.
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
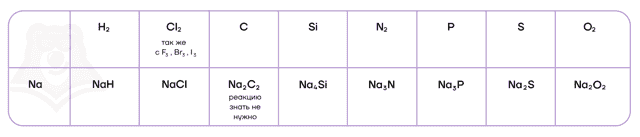
| Гидриды металлов подвергаются необратимому гидролизу |
В реакциях с щелочными металлами кислород образует ряд веществ:
- литий («кандидат от народа»), как и подавляющее большинство металлов, образует оксид;4Li + O2 = 2Li2O
- натрий образует пероксид;2Na + O2 = Na2O2
- калий и все нижестоящие металлы — надпероксиды/супероксиды.K + O2 = KO2
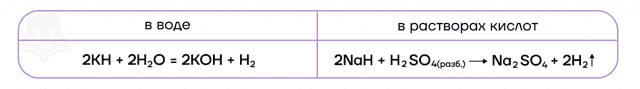
В ряду активности щелочные металлы находятся до водорода, поэтому они способны вытеснять водород из воды:
Можно представить воду как HOH, тогда металл (например, натрий) будет замещать один из атомов водорода с образованием NaOH.
За счет крайне низких значений электроотрицательности металлы очень слабо притягивают к себе электроны, а следовательно, у них «легко их украсть». Делаем вывод: в ОВР щелочные металлы проявляют ярко выраженные восстановительные свойства, повышая в реакциях степени окисления.
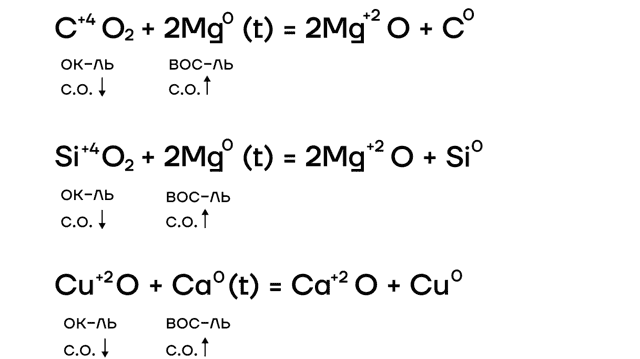
| Почему щелочные металлы не берут в реакции с кислотами?Щелочные металлы из-за своей бешенной активности взаимодействуют сначала с водой, крайне бурно, со взрывом! Поэтому для таких реакций их не берут! |
Оксиды щелочных металлов
По физическим свойствам это — бесцветные кристаллические вещества, хорошо растворимые в воде.
Они являются основными оксидами, поэтому:
- реагируют с водой с образованием оснований:
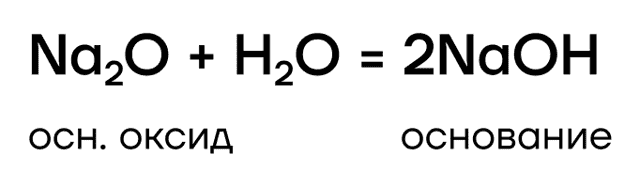
- вступают в основно-кислотные взаимодействия со своими противоположностями, обладающими кислотными свойствами: кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами:
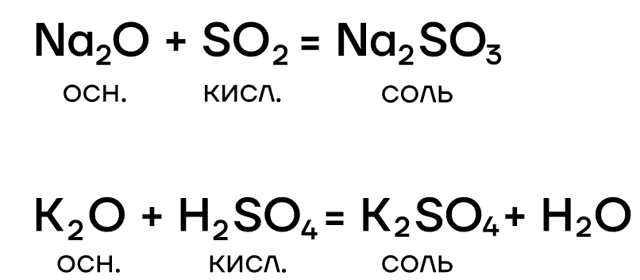
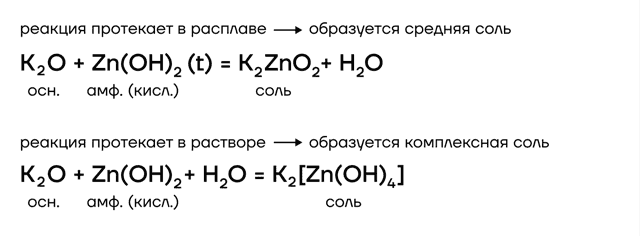
Гидроксиды щелочных металлов
Что же это такое? По-другому их называют щелочами. Они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде.
По химическим свойствам они являются типичными сильными основаниями, то есть:
- диссоциируют в растворах с образованием гидроксид-анионов. создавая в растворах щелочную среду:
- вступают в основно-кислотные взаимодействия со своими противоположностями (кислотами и кислотными оксидами + амфотерные оксиды и гидроксиды), образуя соли;
- вступают в реакции ионного обмена с кислотами и солями:
Какие же специфические свойства щелочей существуют? Рассмотрим некоторые из них:
- Окислительно-восстановительные реакции с металлами
Из металлов со щелочами напрямую взаимодействуют только амфотерные бериллий Be, цинк Zn, алюминий Al.
| Эти металлы можно запомнить по аббревиатуре BeZnAl |
А какие соли тогда будут образовываться? В растворе образуются комплексные соли, а в расплаве (t) — средние. В качестве еще одного продукта реакции выделяется газообразный водород.
- Окислительно-восстановительные реакции с неметаллами
Неметаллы, которые могут реагировать со щелочами, можно запомнить по «крестообразному» расположению в таблице Менделеева:
Пероксиды щелочных металлов
Что же такое пероксиды? Пероксиды — сложные вещества, которые содержат группу —О—О—, где кислород имеет степень окисления −1.
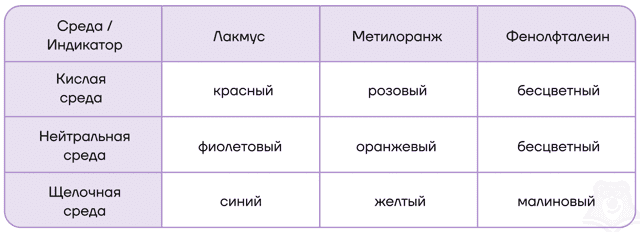
| Как можно распознать катионы щелочных металлов?Как же можно отличить катионы щелочных металлов друг от друга? Самый простой и распространенный метод — по окраске цвета пламени! Соединения этих металлов придают пламени характерные цвета, которые приведены в таблице. Кстати, это используют в пиротехнике при изготовлении смесей для салютов и фейерверков. |
Фактчек
- Металлы IA группы называются щелочными металлами, которые представлены литием, натрием, калием, рубидием, цезием и францием.
- Постоянная валентность щелочных металлов I, постоянная степень окисления — +1.
- Основной способ получения щелочных металлов — электролиз расплавов солей.
- Щелочные металлы — чрезвычайно активные металлы, могут реагировать с большим рядом простых веществ, с водой.
Проверь себя
Задание 1.Какой из щелочных металлов имеет самое большое число электронов?
- Литий;
- Натрий;
- Калий;
- Рубидий;
- Цезий;
- Франций
Задание 2.Щелочные металлы имеют постоянную степень окисления:
Задание 3.Щелочные металлы образуют с серой соединения, называемые:
- Сульфиты;
- Сульфиды;
- Сульфаты;
- Сульфонаты.
Задание 4.При реакции калия с кислородом образуется:
- Оксид калия;
- Пероксид калия;
- Супероксид калия;
- Озонид калия
Задание 5.При внесении солей натрия в пламя оно приобретает окраску:
- Фиолетовую;
- Желтую;
- Небесно-голубую;
- Малиновую
Ответы: 1. — 6; 2. — 1; 3. — 2; 4. — 3; 5. — 2.
Щелочные металлы
Щелочные металлы
Сегодня мы поговорим о строении и свойствах атомов элементов I A группы, о физических и химических свойствах щелочных металлов, об основных соединениях щелочных металлов, истории открытия некоторых щелочных металлов и ещё много чего интересного.
Как вы помните, к щелочным металлам относятся элементы I A группы. Это литий, натрий, калий, рубидий, цэзий, франций. Франций является редким радиоактивным элементом.
Теперь рассмотрим строение и свойства атомов элементов I A группы.
Посмотрев в Периодическую таблицу, мы видим, что на внешнем энергетическом уроне у этих атомов один электрон, потому что все они расположены в I A группе, этот внешний электрон находится далеко от ядра, поэтому он легко отрывается и атом превращается в ион. Для всех элементов этой группы характерна только степень окисления +1.
Все щелочные металлы являются восстановителями из-за способности отдавать электроны. Причём восстановительные свойства сверху вниз в группе увеличиваются, так как увеличиваются радиусы атомов, металлические свойства также усиливаются сверху вниз. Элементы I A группы – типичные металлы.
Строение мы разобрали, а теперь поговорим о физических свойствах щелочных металлов.
Как вы уже знаете, это серебристо-белые мягкие металлы. Наиболее твёрдым является литий, но он также как и все щелочные металлы легко режется ножом.
Посмотрите таблицу, здесь указана температура плавления, температура кипения и плотность щелочных металлов.
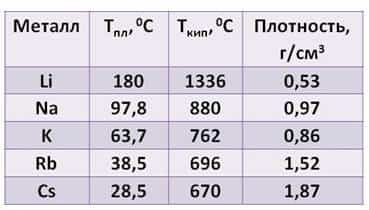
- Из таблицы видно:
- · плотность их увеличивается от лития к цезию
- · температура плавления, в отличие от плотности, уменьшается от лития к цезию
- · температура кипения тоже уменьшается от лития к цезию.
Все щелочные металлы лёгкие. Например, плотность лития примерно в два раза ниже плотности воды. А температура плавления цезия меньше температуры человеческого тела.
С физическими свойствами мы разобрались, теперь можем перейти и к химическим свойствам.
Элементы I A группы обладают очень высокой химической активностью. В лабораториях эти металлы хранят под слоем керосина, с которым они не взаимодействуют.
В реакции с кислородом оксид образует только литий, при этом образуется оксид лития, степень окисления лития +1, а кислорода -2. А натрий в реакции с кислородом образует пероксид натрия, в этом соединении, в отличие от оксида, степень окисления кислорода -1, а натрия степень окисления +1.
В реакцию с азотом при обычной температуре вступает только литий, при этом образуется нитрид лития, в этих бинарных соединениях степень окисления азота -3, а лития +1. Остальные щелочные металлы реагируют с азотом тольлко при нагревании.
В реакции с водородом щелочные металлы образуют гидриды. Так в реакции водорода с натрием образуется гидрид натрия. Степень окисления натрия +1, а водорода -1.
С галогенами щелочные металлы образуют галогениды. Так в реакции калия с бромом образуется бромид калия, где степень окисления калия +1, брома -1, в реакции натрия с хлором образуется хлорид натрия, где степень окисления натрия +1, а хлора -1.

С серой эти щелочные металлы образуют сульфиды. Например в реакции лития с серой образуется сульфид лития, где степень окисления лития +1, а серы -2.
- Как вы помните, все щелочные металлы активно реагируют с водой с образованием щелочей, при этом вода восстанавливается до водорода.
- Например, в результате взаимодействия натрия с водой образуется газ водород, который можно собрать методом вытеснения воздуха.
- Так в реакии натрия с водой образуется щёлочь – гидроксид натрия и выделяется водород.
- Причём скорость взаимодействия металла с водой будет увеличиваться от лития к цэзию, ведь металлические и восстановительные свойства также усиливаются.
Все щелочные металлы легко растворяются в растворах кислот с образованием соответствующих солей и водорода. Однако эти реакции проводят редко из-за того, что идут побочные реакции с водой. Например, в реакции калия с соляной кислотой образуется соль – хлорид калия и газ водород, в реакции натрия с серной кислотой образуется соль – сульфат натрия и газ водород.
Сами щелочные металлы получают путём электролиза расплавленных хлоридов или гидроксидов. Например, твёрдый хлорид натрия под действием электрического тока разлагается на металл натрий и газ – хлор.
- Вы убедились, что щелочные металлы обладают высокой химической активностью, поэтому в свободном виде они не встречаются, а только в виде соединений.
- Познакомимся с некоторыми из них.
Оксиды щелочных металлов – твёрдые вещества, обладают ярко выраженными основными свойствами, они реагируют с водой, кислотами и кислотными оксидами.
Так, в реакции оксида лития с водой образуется гидроксид лития, в реакции оксида натрия с серной кислотой образуется соль – сульфат натрия и вода, в результате взаимодействия оксида калия с оксидом углерода четыре, образуется соль – карбонат калия.
Оксиды натрия и калия получают, прокаливая пероксиды с соответствующими металлами. Это окислительно-восстановительная реакция, при которой кислород меняет свою степень окисления с минус -1 до -2, а натрий повышает свою степень окисления с 0 до +1.
Гидроксиды элементов I A группы – твёрдые белые вещества, хорошо растворимые в воде с образованием щелочей, очень гигроскопичны, поэтому расплываются на воздухе.
Растворы щелочей мыльные на ощупь. При растворении их в воде выделяется большое количество теплоты.
Гидроксиды щелочных металлов – сильные основания, они реагируют с кислотами, кислотными оксидами, солями, амфотэрными оксидами и гидроксидами.
Например, в рекции гидроксида калия с серной кислотой, образуетсся соль – сульфат калия и вода. В реакции гидроксида натрия с кислотным оксидом серы (VI) – образуется соль – сульфит натрия и вода.
В результате взаимодействия гидроксида натрия с солью сульфатом меди (II) , образуется соль – сульфат натрия и нерастворимое основание гидроксид меди (II). В реакции гидроксида калия с амфотэрным оксидом цинка, образуется соль – цинкат калия и вода.
В результате взаимодействия гидроксида калия с амфотэрным гидроксидом цинка в водной среде , образуется комплексная соль – тэтрагидроксоцинкат натрия.
Естественно, что гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов с водой или их оксидов с водой. При зиимодействии натрия с водой образуется гидроксид натрия и водород, в результате реакции оксида натрия с водой также образуется гидроксид натрия.
Рассморим свойства и применения соединений щелочных металлов.
Например, гидроксид натрия – NaOH – в технике известен как едкий натр, каустическая сода, а также каустик, а вот гидроксид калия – KOH называют в технике едкое кали. Оба этих гидроксида разъедают ткани и бумагу, поэтому их называют едкими щелочами.
Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, производства мыла и волокон, а едкое кали – для производства жидкого мыла.
Соли щелочных металлов – твёрдые кристаллические вещества с ионным типом кристаллической решётки. В прошлом из-за соли нередко вспыхивали войны и народные волнения (соляные бунты), а в некоторых странах куски соли служили разменной монетой.
- Рассмотрим наиболее значимые соли.
- Кристаллическую соду – Na2CO3 ∙ 10 H2O – используют при производстве стекла, бумаги, мыла, в быту и стиральных порошках.
- Питьевую соду – NaHCO3используют в быту и пищевой промышленности, а также в медицине.
- Поташ, или карбонат калия – K2CO3используют при производстве жидкого мыла, в качестве удобрения и получения тугоплавкого стекла.
- Кристаллогидрат сульфата натрия, или глауберова соль –
- Na2SO4 ∙ 10 H2O применяется для производства соды и стекла, в качестве слабительного средства.
Поваренная соль, или хлорид натрия – NaCl используется при производстве соляной кислоты, гидроксида натрия, хлора, натрия и соды, для консервирования, как приправа к пище, при производстве мыла. Хлорид натрия – галит содержится в моской воде и при высыхании морей образует мощные пласты каменной соли.
Биологическая роль ионов натрия и калия очень велика. Так, ионы натрия содержатся в крови и лимфе, ионы калия – основной внутриклеточный ион.
Соотношение концентраций этих ионов регулирует давление крови, обеспечивает перемещение растворов солей из корней в листья растений. В организме человека концентрация ионов калия внутри клеток выше, чем ионов натрия.
В межклеточном постранстве, наоборот, концентрация ионов натрия выше, чем ионов калия. Различные концентрации этих ионов внутри и снаружи клеток позволяет регулировать водные потоки через мембраны.
Кроме этого, калий поддерживает работу сердечной мышцы.
Взрослому человеку в сутки необходимо три с половиной грамма калия. Калий содержится в кураге, сое, фасоле, зелёном горошке, черносливе, изюме и других продуктах.
Ребята, решите интересную задачу. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
В условии задачи нам сказано, что в 100 г кураги содержится 2,034 г калия, а в сутки человеку необходимо 3,5 г калия. Найти необходимо массу кураги.
Для решения этой задачи составим выражение: 2 г калия содержится в 100 г кураги, 3,5 г калия содержится в Х граммах кураги, найдём Х. Для этого 3,5 умножим на 100 и разделим на 2,034, получаем 172 г.
Для того, чтобы получить суточную норму калия человеку необходимо съесть 172 г кураги.
Калий нужен и растениям. Он является одним из элементов питания. Ежегодно большое количество калия уходит из почвы. Недостаток калия в почве, понижает интенсивность фотосинтеза. Это приводит:
- · к уменьшению содержания сахаров в корнеплодах свёклы и крахмала в зерне
- · отмиранию листьев растений
- · повышению восприимчивости к грибковых и бактериальным заболеваниям
- · снижению всхожести семян.
- Поэтому для получения высоких урожаев сельскохозяйственных культур необходимо внесение калийных удобрений, таких солей калия, как хлорид, нитрат, карбонат, сульфат калия.
- Соли щелочных металлов окрашивают пламя в различные цвета: литий – в карминово-красный цвет, натрий – в жёлтый, калий, рубидий и цэзий – в фиолетовый.
Для того чтобы это доказать, проведём лабораторный опыт. Возьмём лучинку и закрепим на ней спираль из проволоки. Обмакнём её сначала в соляную кислоту, затем в сухую соль натрия и поднесём к пламени спиртовки. Пламя, окрашивается в жёлтый цвет.
Сейчас возмём лучинку со спиралью из проволоки, обмакнём в кислоту, но теперь поместим в сухую соль калия и поднесём к пламени спиртовки. Пламя окрашивается в фиолетовый цвет.
Открытии щелочных металлов. Так, литий был открыт в 1817 году шведским химиком Арфвэдсоном и назван литием, так как литос от греческого означает камень, потому что он был обнаружен в камне.
Натрий и калий был получен английским химиком Дэви в 1807 году при электролизе едких щелочей. Натрий от арабского натрун означает сода, а калий от арабского алкали – щёлочь.
Сделаем вывод: щелочные металлы – это элементы I А группы, у них один электрон на внешнем энергетическом уровне. Все они – восстановители, проявляют степень окисления равную +1.
Это мягкие металлы и легко режутся ножом, у них сравнительно невысокие температуры плавления, они обладают высокой химической активность, реагируют с простыми и сложными веществами .
Их получают в результате электролиза расплавов, встречаются в природе только в виде соединений, соединения щелочных металлов имеют большое значение в жизни человека и в народном хозяйстве.
Щелочные металлы
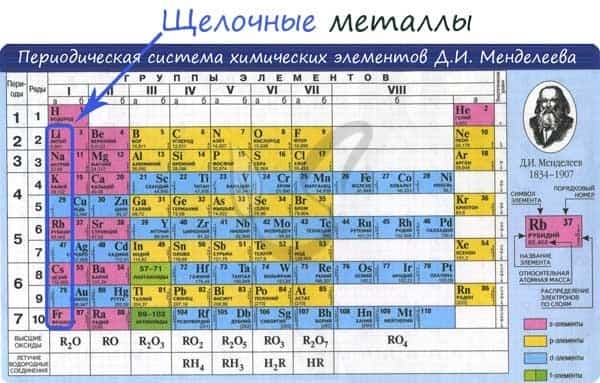
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвин
- NaCl*KCl — сильвинит

Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Li + O2 → Li2O (оксид лития)
- Na + O2 → Na2O2 (пероксид натрия)
- K + O2 → KO2 (супероксид калия)
- Реакции с неметаллами
- Li + H2 → LiH (в гидридах водород -1)
- Na + F2 → NaF (в фторидах фтор -1)
- Na + S → Na2S (в сульфидах сера -2)
- K + N2 → K3N (в нитридах азот -3)
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий — пероксид, калий, рубидий и цезий — супероксиды.
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет». Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный, цезий — синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
- Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
- Li + O2 → Li2O (оксид лития)
- В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
- Na2O2 + Na → Na2O
- KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание — реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание — мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.
Получение
- Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
- KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде — хлор)
- Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
- K + H2O → KOH + H2↑
- Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
- LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке — получается кислая соль)
- 2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке — получается средняя соль)
- KOH + SO2 → KHSO3 (соотношение 1:1 — получается кислая соль)
- 2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 — получается средняя соль)
- NaOH + MgBr2 → NaBr + Mg(OH)2↓
- С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов — смешанных оксидов (при высоких температурах — прокаливании).
- NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
- NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел — смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
- Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
- NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
- NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
- В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
- NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

- NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
- Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам — и азотной, и азотистой.
- LiOH + NO2 → LiNO2 + LiNO3 + H2O
Щелочные металлы
- К щелочным металлам относятся литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
- Щелочные металлы
- Строение атомов щелочных металлов
- Физические свойства щелочных металлов
- Химические свойства щелочных металлов
Щелочные металлы:
Щелочные металлы – это элементы 1-й группы периодической таблицы химических элементов Д.И. Менделеева (по устаревшей классификации – элементы главной подгруппы I группы):
- – литий Li,
- – натрий Na,
- – калий K,
- – рубидий Rb,
- – цезий Cs,
- – франций Fr.
- При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами.
Строение атомов щелочных металлов:
Особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1.
Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства.
Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия – самый низкий) и электроотрицательности. Как следствие, в большинстве соединений щелочные металлы присутствуют в виде однозарядных катионов.
С увеличением порядкового номера у щелочных металлов увеличиваются радиус атома, способность отдавать валентные электроны и восстановительная активность, уменьшается электроотрицательность и энергия ионизации.
Все щелочные металлы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень легкие, мягкие и пластичные, их можно резать скальпелем и ножом.
Щелочные металлы имеют небольшую плотность. Так, литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней. Щелочные металлы обладают высокой тепло- и электропроводностью.
Они имеют низкую температуру плавления и кипения.
С увеличением порядкового номера у щелочных металлов уменьшаются плотность, температура плавления, температура кипения, твердость.
Все щелочные металлы обладают высокой химической активностью. Они проявляют высокую химическую активность при взаимодействии с водой, кислородом, галогенами и другими соединениями.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. В соединениях щелочные металлы проявляют единственную степень окисления +1. Все соединения щелочных металлов носят ионный характер.
Почти все соединения растворимы в воде.
С увеличением порядкового номера у щелочных металлов усиливаются металлические свойства и ослабевают неметаллические свойства, увеличивается восстановительная способность, возрастает химическая активность их щелочей.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
- карта сайта
- Ссылка на источник
Щелочные металлы: общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 9 класс
Щелочными металлами называются химические элементы-металлы (IA) группы Периодической системы Д. И. Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы (IA) характерна степень окисления (+1).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия (NaCl)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 (·) 10H2O,
- сильвин — хлорид калия (KCl),
- сильвинит — двойной хлорид калия-натрия (KCl) (·)(NaCl) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами (IA) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.

Рис. (1). Литий

Рис. (2). Натрий
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2H2O=2NaOH+H2↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности.
Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах.
Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
- В расплаве хлорида натрия присутствуют ионы:
- NaCl⇄Na++Cl−.
- При электролизе
- на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
- катод ((–)): 2Na++2e_=2Na,
- анод ((+)): 2Cl−−2e_=Cl2↑.
- Суммарное уравнение реакции при электролизе расплава хлорида натрия:
- 2NaCl→2Na+Cl2↑.
Источники:
Рис. 1. Литий © ЯКласс
Рис. 2. Натрий © ЯКласс
Урок 6: Щелочные металлы
- План урока:
- Представители щелочных металлов
- Строение атомов щелочных металлов
- Изменение химических свойств щелочных металлов
- Внешний вид и физические свойства щелочных металлов
- Нахождение в природе
- Качественные реакции
- Химические свойства щелочных металлов
- Получение щелочных металлов
- Применение соединений щелочных металлов
Представители щелочных металлов
Щелочные металлы – это группа высокоактивных металлов. Название происходит от продукта взаимодействия этих веществ с водой, в результате которой образуется щелочь (сложное химическое соединение). Найти в природе такие металлы, сделать из них изделие или просто хранить в виде слитка невозможно. Эти металлы сразу окисляются кислородом воздуха.
К щелочным металлам относятся: литий, натрий, калий, рубидий, цезий, франций.
Строение атомов щелочных металлов
В таблице Менделеева щелочные металлы расположены в первой группе. Такое положение не случайно, а отражает строение атома и химические свойства.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра.
Ядро и электроны притягиваются за счет электростатического напряжения. Соответственно, чем меньше у электрона силы сопротивления, тем ближе он будет к ядру. Электроны с большей энергией способны отдаляться на периферию атома.
По мере смены периодом, количество электронов и энергетических уровней будет увеличиваться. Общий параметр атомов всех щелочных металлов является 1 электрон на внешнем энергетическом уровне.
Изменение химических свойств щелочных металлов
По мере продвижения от первого до последнего периода, в атомах щелочных металлов происходит увеличение количества атомов и электронных облаков. Чем дальше атом оказался от ядра, тем меньше притяжение между ними.
За счет этого, отдаленный (последний) электрон проще отсоединить от атома. Легкость отщепления электронов определяет реакционную способность.
Отщепление электрона приводит к окислению собственного атома и восстановлению окислителя.
Таким образом, восстановительные свойства щелочных металлов увеличиваются сверху вниз в группе. Самый активный металл – цезий.
Внешний вид и физические свойства щелочных металлов
Щелочные металлы обладают всеми характерными свойствами: серебристый цвет (исключение: цезий – золотистого цвета) металлический блеск, электро- и теплопроводность, ковкость, пластичность.
Особенным качеством является мягкость и легкость за счет низкой плотности вещества. Эти металлы можно резать ножом, разминать руками (в перчатках) и ломать.
Нахождение в природе щелочных металлов
Из-за высокой реакционной активности, щелочные металлы не встречаются в природе в виде самородков или чистых залежей. Обнаружить их можно в составе солей. Многие природные минералы содержат ион щелочного металла в своей структуре.
Таблица. Минералы, в состав которых входят ионы щелочных металлов
Как видно из таблицы, чем выше активность элемента, тем ниже его встречаемость в природе. Элемент последнего периода первой группы – франций – вообще не встречается в природе даже в составе минералов. Этот элемент является радиоактивным и является промежуточным продуктом распада Урана-235. Его общее содержание в земной коре оценивается в 380 граммов.
Обнаружение ионов металлов в соединениях
Самый простой способ определения иона металла – окраска пламени. Для соли каждого металла характерен свой цвет:
- Литий – красный,
- Калий – фиолетовый,
- Натрий – желтый,
- Рубидий – розовый,
- Цезий – синий.
Соли франция такой проверке не подвергаются.
Для такой проверки важно, чтобы в пламени не было других примесей, меняющий цвет, иначе проверка будет недостоверна.
Качественные реакции
Обнаружение катионов лития
Обнаружить ионы металлов в соли можно с помощью качественной реакции.
- Для обнаружения катионов лития используют фосфорную кислоту. Получившийся белый фосфат лития растворим только в концентрированной азотной кислоте и солях аммония:
- 3Li+ + PO43- = Li 3РО 4↓
- В растворимых солях литий можно обнаружить с помощью фторида аммония. При реакции образуется белый нерастворимый осадок фторида лития:
- Li+ + F- = LiF↓
Обнаружение катиона натрия
Ионы натрия можно обнаружить реакцией с комплексной солью гексагидроксостибатом (V). При низких температурах и в нейтральной среде образуется мелкокристаллическая белая соль натрия:
Na+ + [Sb (OH)6]– = Na[Sb(OH)6] ↓
Эту реакцию проводят на предметном стекле. За образованием и формой кристаллов наблюдают под микроскопом или бинокуляром.
Обнаружение катиона калия
В кислой и нейтральной среде ионы калия образуют двойную комплексную соль с гексанитрокабальтатом натрия (III). Эта соль нерастворима в воде и имеет желтый цвет:
2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6] ↓+ 2Na+
Особенность реакции в ее медленном течении. Реакционную смесь оставляют на несколько часов. Для ускорения реакции можно тереть стеклянной палочкой по стенке пробирки. Это приводит к формированию статического электричества, что усиливает притяжение ионов друг к другу.
Еще одним способом обнаружения катионов калия служит реакция с гидротартратом натрия NaHC4H4O6. В этом случае образуется соль белого цвета. Реакцию можно ускорить потиранием стеклянной палочной о поверхность пробирки:
K+ + NaHC4H406= KHC4H4O6↓ + Na+.
Обнаружение катионов рубидия, цезия
Катионы рубидия и цезия – высокоактивные ионы, поэтому не обнаруживаются качественными реакциями. Все соединения прозрачные и хорошо растворимы в воде. Основными способами их обнаружения в составе соли служит осаждение органическими ароматическими растворами. Способа разделения цезия и рубидия из смеси в настоящее время нет.
Обнаружение ионов франция
Как радиоактивный металл, франций не входит в состав обычных солей. Его обнаружение проводится методом спектрометрии и радиационных приборов.
Химические свойства щелочных металлов
Все металлы являются восстановителями, поэтому они вступают в реакцию с различными окислителями. К таким относятся простые неметаллы и сложные соединения, обладающие окислительными свойствами.
Реакция с простыми неметаллами
Щелочные металлы активно вступают в реакции с галогенами. При этом образуется соответствующий галогенид. С серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов реагируют только при нагревании:
- 2Na + Cl2→ 2NaCl
- 2К + S К2S
- 2Rb + H2 2RbH
- 3Na + P Na3P
- В реакции с кислородом щелочные металлы образуют пероксиды (кроме лития), повторное окисление которых приводит к образованию оксидов:
- 2Na + О2 = Na2О2
- 2 Na2О2 + О2 = 2Na2О
- Специальных условий для окисления металлов кислородом не требуется, поэтому щелочные металлы хранят под слоем парафина, вазелина или масла без доступа кислорода.
Взаимодействие с водой
Реакция щелочных металлов с водой происходит с выделением большого количества тепла. Выделяющийся в ходе реакции водород может воспламеняться, что в некоторых случаях приводит к взрыву.
Взаимодействие с сильными кислотами
- В реакциях щелочных металлов с кислотами образуются соответствующие соли. Особенных проявлений свойств щелочных металлов здесь нет:
- 8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
- 8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
Специфические химические свойства лития
- В некоторых реакциях литий проявляет отличные от остальных щелочных металлов свойства. Например, это единственный металл, реагирующий с азотом без нагревания:
- 6Li + N2 = 2Li3N
- Нитрид лития подвергается необратимому гидролизу.
- Li3N + 3H2O → 3LiOH + NH3↑
- В реакции с лития с кислородом образуется оксид лития:
- 4Li + О2 = 2Li2О
Получение щелочных металлов
Получить щелочные металлы в чистом виде можно только электролизом расплавов их солей:
- NaCl Na+ + Cl–;
- катод (–) (Na+): Na+ + е = Na0,
- анод (–) (Cl–): Cl– – е = Cl0, 2Cl0 = Cl2;
- 2NaCl = 2Na + Cl2 .
- Если использовать раствор соли, катионы металла будут сразу вступать в реакцию с образованием щелочей:
- NaCl Na+ + Cl–,
- H2O Н+ + ОН–;
- катод (–) (Na+; Н+): H+ + е = H0, 2H0 = H2
- (2H2O + 2е = H2 + 2OH–),
- анод (+) (Cl–; OН–): Cl– – е = Cl0, 2Cl0 = Cl2;
- 2NaCl + 2H2O = 2NaOH + Cl2 + H2 .
Применение соединений щелочных металлов
Основные области применения данных солей – медицина, кулинария, строительство, химическая промышленность.
Наиболее используемый щелочной металл – натрий. Он служит катализатором синтеза металлов, служит теплоносителем в атомных реакторах.
Хлорид натрия – соединение, используемое в каждом доме. Это безопасная соль, используемая в кулинарии. Так же, хлорид натрия применяется в медицине для приготовления физиологических растворов.
Литий и его щелочи служат основой изготовления щелочных батареек. Длительное время это был единственный способ создания портативных энергоносителей.
Калий и натрий используются для изготовления мыла в качестве омыляющего компонента.
Соли калия используются в сельском хозяйстве в качестве удобрения.
Калий, рубидий и натрий используются в атомной промышленности и атомной энергетике. Эти металлы служат катализаторами многих реакций.
- Литий добавляется во многие сплавы для улучшения металлических свойств.
- Соединения лития, рубидия и цезия используют при изготовлении цветных стекол.
- Франций пока не имеет практического применения в связи с высокой радиоактивностью.






