- Металлы, их положение в периодической системе химических элементов Д.И. Менделеева, строение атома, химические свойства, применение
- Таблица Менделеева
- Классический вид таблицы Менделеева
- История открытия Периодического закона
- Список химических элементов таблицы Менделеева
- Как расположены металлы в периодической таблице Менделеева какими особенностями строения атомов?
- Как расположены металлы в периодической системе Какими особенностями строения атомов?
- Как расположены неметаллы в периодической таблице Менделеева?
- Какое место занимают металлы в периодической таблице Менделеева?
- Как расположены металлы и неметаллы в периодической системе?
- Где располагаются металлы и неметаллы?
- Где расположены атомы металлов и почему?
- Где находятся щелочные металлы в периодической системе?
- Какие свойства относятся к металлам?
- Где находятся металлы и неметаллы в таблице Менделеева?
- Каким цветом обозначаются металлы и неметаллы в таблице Менделеева?
- Как расположены элементы в таблице Менделеева?
- В каком виде металлы находятся в природе?
- Какое строение имеют металлы?
- Кто на самом деле придумал таблицу Менделеева?
- Положение металлов в периодической системе, строение их атомов
- 1. Металлы: положение этих химических элементов в периодической системе, строение их атомов (на примере атомов натрия, магния, алюминия). Характерные физические свойства металлов. Химические свойства металлов: взаимодействие с кислородом, водой, кислотами
- 2. Опыт. Получение и собирание кислорода. Доказательство наличия кислорода в сосуде
- Металлы, их положение в периодической системе химических элементов Д. И. Менделеева, строение атомов
- Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
- Цель и задачи урока:
- Методы и приёмы:
- Оборудование:
- Ход урока
- II. Постановка и оглашение темы урока, его целей и задач
- III. Изучение нового материала.
- IV. Закрепление изученного материала
- V. Подведение итогов урока
- VI. Домашнее задание
Содержание:
§ 1 Положение металлов в периодической системе химических элементов Д.И. Менделеева
В современной периодической системе Д.И. Менделеева размещено 118 химических элементов. Большая часть из них относится к металлам.
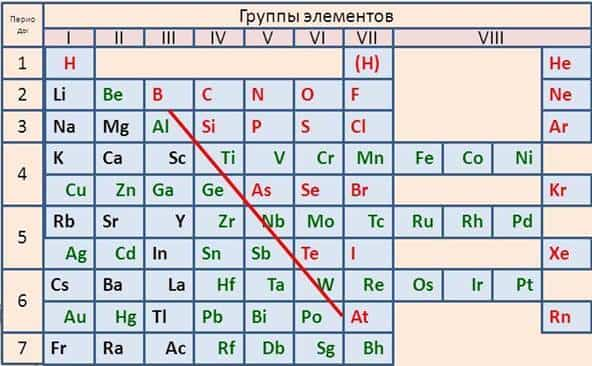
Металлы содержатся во всех группах этой системы, например, в первой группе все элементы, кроме водорода, относятся к металлам. Во второй группе — все металлы, в третьей группе все элементы являются металлами, кроме бора.
В IV, V, VI группах металлы располагаются в побочных подгруппах и внизу главных подгрупп (в IV группе — это германий, олово, свинец, в V группе – сурьма, висмут, в VI группе – полоний).
В VII – VIII группах металлы располагаются только в побочных подгруппах.
Таким образом, условная граница между элементами-металлами и элементами-неметаллами в главных подгруппах проходит по диагонали B (бор) — Si (кремний) – As (мышьяк) — Te (теллур) – At (астат). Все элементы побочных подгрупп относятся к металлам.
§ 2 Названия групп металлов в периодической системе химических элементов Д.И. Менделеева
Металлы I группы главной подгруппы — литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr) — называются щелочными. Их так назвали, потому что их гидроксиды являются растворимыми в воде основаниями – щелочами.
Металлы II группы главной подгруппы – магний (Mg), кальций (Ca), стронций (Sr),
барий (Ba), радий(Ra) — называются щелочноземельными. Их гидроксиды обладают щелочными свойствами, а оксиды сходны по тугоплавкости с оксидами алюминия и железа, которые ранее называли «земли».
- В периодической системе выделяют группу благородных металлов: золото (Au),
- серебро (Ag), платина (Pt) и металлы платиновой группы рутений (Ru), родий (Rh),
- палладий (Pd), осмий (Os), иридий (Ir), их так назвали из-за блеска в изделиях и их способности не окисляться на воздухе.
§ 3 Строение атомов в металлах 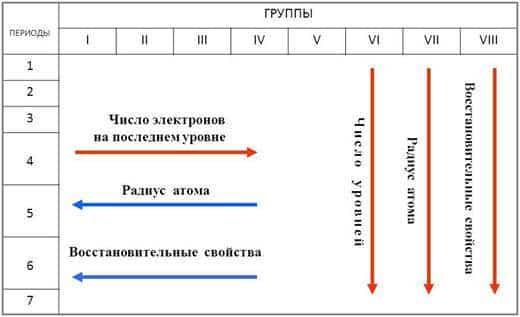
- Из положения металлов в периодической системе химических элементов можно определить и особенности их строения.
- Первой особенностью является небольшое число электронов на внешнем уровне
- (от 1 до 3 электронов) у большинства металлов.
- Ко второй особенности можно отнести сравнительно большой радиус атома.
Атомы металлов в отличие от атомов неметаллов легко отдают наружные электроны и превращаются в положительно заряженные ионы. Свободные электроны перемещаются между ионами металлов.
Положительные ионы металлов удерживаются все вместе за счет притяжения ко всем свободно движущимся в металлах электронам.
Между этими частицами (свободными электронами и ионами металлов) возникает связь, которую называют металлической.
Схематично такую связь можно изобразить так:
; где М-символ элемента металла.
Электроны находятся в постоянном движении, при их столкновении с положительно заряженными ионами металлов ионы превращаются в нейтральные атомы, а затем снова в ионы, и такой процесс происходит непрерывно. Поэтому ввели понятие – ион-атом металла.
Металлическая связь имеется в металлах, находящихся в жидком и твердом состоянии. Твердые металлы – вещества кристаллические. Их кристаллические решетки называются металлическими. В узлах их решеток находятся ион-атомы металлов, а между ними передвигаются относительно свободные электроны. Металлическая связь является очень прочной.
§ 4 Краткие итоги по теме урока
В периодической системе Д.И. Менделеева из 118 химических элементов большая часть относится к металлам. Металлы содержатся во всех группах периодической системы.
Они в основном расположены в левой нижней части системы, условная граница между элементами-металлами и элементами-неметаллами в главных подгруппах проходит по диагонали B (бор) — Si (кремний) – As (мышьяк) — Te (теллур) – At (астат). Все элементы побочных подгрупп относятся к металлам.
Для металлов характерна металлическая химическая связь и металлическая кристаллическая решетка. Металлическая связь очень прочная.
Список использованной литературы:
- Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений/ — М.: Дрофа, 2010.
- Химия. 9 класс: Настольная книга учителя/О.С. Габриелян, И.Г. Остроумов. – М.: Дрофа, 2003.
- Рудзитис Г.Е., Фельдман Ф.Г. Химия: Неорган. химия. Орган. химия: Учеб. для 9 кл. общеобразоват. учреждений. -М.: Просвещение, 1999.
- https://ru.wikipedia.org/wiki/
Использованные изображения:
Металлы, их положение в периодической системе химических элементов Д.И. Менделеева, строение атома, химические свойства, применение
В периодической системе элементов Д.И.Менделеева металлы расположены в левом нижнем углу от диагонали B–At.
Класс металлов образован элементами s-семейства (кроме Н и Не), p-элементы главных подгрупп III (кроме В), IV (Ge, Sn, Pb), V (Sb, Bi) и VI (Po), все d— и f-элементы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge), обладают двойственным характером. Металлов в периодической системе элементов – большинство (Из 109 элементов только 22 неметаллы).
- На наружном электронном уровне находятся 1,2 или 3 электрона, слабо связанных с ядром.
- 11Na +11 ) ) ) 20Ca +20 ) ) ) ) 13Al +13 ) ) )
- 2 8 1 2 8 8 2 2 8 3
- 1s22s22p63s1 1s22s22p63s2 3p64s2 1s22s22p63s3
- В металлах связь металлическая и металлическая кристаллическая решётка чем объясняются физические свойства металлов.
Для главных подгрупп: чем левее и ниже металл, тем большую химическую активность он проявляет. В периодах металлические свойства убывают, а в группах усиливаются (с увеличением порядкового номера), так как изменяется радиус атома.
- Для металлов характерны общие физические свойства:
- 1) твёрдость; 2) электро и теплопровдность; 3) непрозрачность; 4) металлический блеск;
- 5) ковкость или пластичность (объяснение – металлическая кристаллическая решётка).
- Химические свойства: , n=1,2,3. (металлы всегда восстановители)
- I. С простыми веществами:
- 1) с кислородом:
- а) 2Ca + O2 → 2CaO б) 2Mg + O2 2MgO в) Au + O2 ↛
- в-ль ок-ль многие металлы покрыты тонкой плёнкой, которая препятствует дальнейшему окислению.
- 2) с галогенами:
- а) 2Na + Cl2 → 2NaCl б) 2Fe + 3Cl2 FeCl3
- 3) с серой: Fe + S → FeS
- II. Со сложными веществами (ряд активности металлов):
- 1) с водой:
- а) (для щелочных и щелочноземельных металлов) 2Na + 2H2O → 2NaOH + H2↑
- б) металлы средней активности Mg + H2O MgO +H2↑
- в) правее водорода Au + H2O ↛
- 2) с растворами кислот, кроме HNO3
- а) Zn + 2HCl → ZnCl2 + H2 б) Cu + HCl ↛
- 3) с солями: Fe + CuSO4 → FeSO4 + Cu
- Применение:
- 1) в быту – посуда, бытовые приборы; 2) в технике, в промышленности;
3) в самолёто- и ракетостроении; 4) в медицине и т.д.
- Билет №9 (2)
- Фенол, его строение, свойства, получение и применение.
- Фенол – это производное бензола, в котором один атом водорода замещён на группу ОН.
- Взаимное влияние бензольного кольца и ОН-групп:
- 1) Радикал С6Н5 обладает свойством оттягивать на себя электроны атома кислорода ОН—группы, делая связь О–Н более полярной и атом водорода более подвижным.
- 2) ОН—группа придаёт большую подвижность атомам водорода в положениях 2,4,6 – бензольного кольца.
- Этим взаимовлиянием и определяются свойства фенола.
- Фенол – бесцветное, кристаллическое вещество с характерным запахом больницы.
- Температура плавления 40,9℃ , хорошо растворим в горячей воде (карболовая кислота).
- Фенол – ядовит!
- Химические свойства:
- 1) В воде диссоциирует на ионы:
- 2) Проявляет слабые кислотные свойства, реагирует с металлами:
- 2C6H5OH + 2Na → 2C6H5ONa + H2↑
- фенолят натрия
- 3) Реагирует со щёлочью:
- C6H5OH + NaOH → C6H5ONa + H2O (отличие от спиртов)
- 4) Реакции замещения:
- В промышленности фенол получают по схеме:
- 1) 2)
- Фенол применяют для производства:
- 1) полимеров и пластмасс на их основе, красителей;
- 2) медикаментов;
3) взрывчатых веществ. Водородный раствор фенола используется как дезинфицирующее средство.
Билет №10 (1)
Таблица Менделеева
Периодическая система химических элементов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И.
Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Классический вид таблицы Менделеева
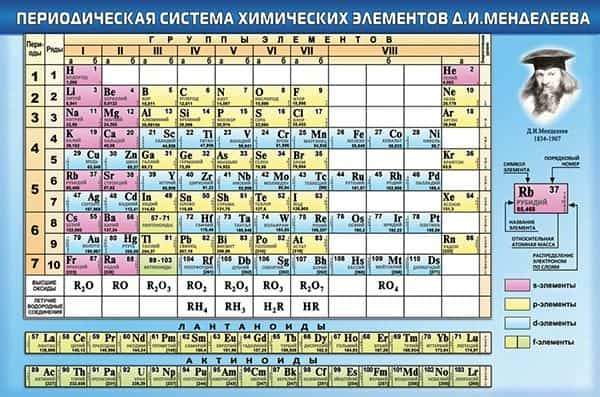
| Таблица Менделеева в картинках |
История открытия Периодического закона
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно.
В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомный вес многих элементов близок к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и йод и др.).
Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию.
В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Д. И. Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов» (в журнале Русского химического общества); ещё ранее (февраль 1869 г.
) научное извещение об открытии было им разослано ведущим химикам мира. По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Написав на карточках основные свойства каждого элемента (их в то время было известно 63, из которых один — дидим Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима), Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим.
Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы («Опыт системы элементов, основанной на их атомном весе и химическом сходстве»), в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов). В 1870 году Менделеев в «Основах химии» публикует второй вариант системы («Естественную систему элементов»), имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы. Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов (например, бериллия, индия, урана, тория, церия, титана, иттрия), несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Научная достоверность Периодического закона получила подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и, с поразительной точностью, целый ряд физических и химических свойств.
Список химических элементов таблицы Менделеева
- 1 H Водород (а.м. 1,00794)
- 2 He Гелий (а.м. 4,002602)
- 3 Li Литий (а.м. 6,9412)
- 4 Be Бериллий (а.м. 9,0122)
- 5 B Бор (а.м. 10,812)
- 6 С Углерод (а.м. 12,011)
- 7 N Азот (а.м. 14,0067)
- 8 О Кислород (а.м. 15,9994)
- 9 F Фтор (а.м. 18,9984)
- 10 Ne Неон (а.м. 20,179)
- 11 Na Натрий (а.м. 22,98977)
- 12 Mg Магний (а.м. 24,305)
- 13 Al Алюминий (а.м. 26,98154)
- 14 Si Кремний (а.м. 28,086)
- 15 P Фосфор (а.м. 30,97376)
- 16 S Сера (а.м. 32,06)
- 17 Cl Хлор (а.м. 35,453)
- 18 Ar Аргон (а.м. 39,948)
- 19 К Калий (а.м. 39,0983)
- 20 Ca Кальций (а.м. 40,08)
- 21 Sc Скандий (а.м. 44,9559)
- 22 Ti Титан (а.м. 47,9)
- 23 V Ванадий (а.м. 50,9415)
- 24 Cr Хром (а.м. 51,996)
- 25 Mn Марганец (а.м. 54,938)
- 26 Fe Железо (а.м. 55,847)
- 27 Со Кобальт (а.м. 58,9332)
- 28 Ni Никель (а.м. 58,7)
- 29 Cu Медь (а.м. 63,546)
- 30 Zn Цинк (а.м. 65,38)
- 31 Ga Галлий (а.м. 69,72)
- 32 Ge Германий (а.м. 72,59)
- 33 As Мышьяк (а.м. 74,9216)
- 34 Se Селен (а.м. 78,96)
- 35 Br Бром (а.м. 79,904)
- 36 Kr Криптон (а.м. 83,8)
- 37 Rb Рубидий (а.м. 85,4678)
- 38 Sr Стронций (а.м. 87,62)
- 39 Y Иттрий (а.м. 88,9059)
- 40 Zr Цирконий (а.м. 91,20)
- 41 Nb Ниобий (а.м. 92,9064)
- 42 Mo Молибден (а.м. 95,94)
- 43 Tc Технеций (а.м. 98,9062)
- 44 Ru Рутений (а.м. 101,07)
- 45 Rh Родий (а.м. 102,9055)
- 46 Pd Палладий (а.м. 106,4)
- 47 Ag Серебро (а.м. 107,868)
- 48 Cd Кадмий (а.м. 112,41)
- 49 In Индий (а.м. 114,82)
- 50 Sn Олово (а.м. 118,69)
- 51 Sb Сурьма (а.м. 121,75)
- 52 Те Теллур (а.м. 127,6)
- 53 I Йод (а.м. 126,9045)
- 54 Xe Ксенон (а.м. 131,3)
- 55 Cs Цезий (а.м. 132,9054)
- 56 Ba Барий (а.м. 137,33)
- 57 La Лантан (а.м. 138,9)
- 58 Ce Церий (а.м. 140,12)
- 59 Pr Празеодим (а.м. 140,9)
- 60 Nd Неодим (а.м. 144,24)
- 61 Pm Прометий (а.м. 145)
- 62 Sm Самарий (а.м. 150,35)
- 63 Eu Европий (а.м. 151,96)
- 64 Gd Гадолиний (а.м. 157,25)
- 65 Tb Тербий (а.м. 158,92)
- 66 Dy Диспрозий (а.м. 162,5)
- 67 Ho Гольмий (а.м. 164,93)
- 68 Er Эрбий (а.м. 167,26)
- 69 Tm Тулий (а.м. 168,93)
- 70 Yb Иттербий (а.м. 173,04)
- 71 Lu Лютеций (а.м. 174,97)
- 72 Hf Гафний (а.м. 178,49)
- 73 Ta Тантал (а.м. 180,9479)
- 74 W Вольфрам (а.м. 183,85)
- 75 Re Рений (а.м. 186,207)
- 76 Os Осмий (а.м. 190,2)
- 77 Ir Иридий (а.м. 192,22)
- 78 Pt Платина (а.м. 195,09)
- 79 Au Золото (а.м. 196,9665)
- 80 Hg Ртуть (а.м. 200,59)
- 81 Tl Таллий (а.м. 204,37)
- 82 Pb Свинец (а.м. 207,2)
- 83 Bi Висмут (а.м. 208,9)
- 84 Po Полоний (а.м. 209)
- 85 At Астат (а.м. 210)
- 86 Rn Радон (а.м. 222)
- 87 Fr Франций (а.м. 223)
- 88 Ra Радий (а.м. 226)
- 89 Ac Актиний (а.м. 227)
- 90 Th Торий (а.м. 232,03)
- 91 Pa Протактиний (а.м. 231,03)
- 92 U Уран (а.м. 238,02)
- 93 Np Нептуний (а.м. 237,04)
- 94 Pu Плутоний (а.м. 244,06)
- 95 Am Америций (а.м. 243,06)
- 96 Cm Кюрий (а.м. 247,07)
- 97 Bk Берклий (а.м. 247,07)
- 98 Cf Калифорний (а.м. 251,07)
- 99 Es Эйнштейний (а.м. 252,08)
- 100 Fm Фермий (а.м. 257,08)
- 101 Md Менделевий (а.м. 258,09)
- 102 No Нобелий (а.м. 259,1)
- 103 Lr Лоуренсий (а.м. 260,1)
- 104 Rf Резерфордий (а.м. 261)
- 105 Db Дубний (а.м. 262)
- 106 Sg Сиборгий (а.м. 266)
- 107 Bh Борий (а.м. 267)
- 108 Hs Хассий (а.м. 269)
- 109 Mt Мейтнерий (а.м. 276)
- 110 Ds Дармштадтий (а.м. 227)
- 111 Rg Ренгений (а.м. 280)
- 112 Cn Коперниций (а.м. 285)
- 113 Uut Унунтрий (а.м. 284)
- 114 Uuq Унунквадий (а.м. 289)
- 115 Uup Унунпентий (а.м. 288)
- 116 Uuh Унунгексий (а.м. 293)
- 117 Uus Унунсептий (а.м. 294)
- 118 Uuo Унуноктий (а.м. 294)
- 119 Uuе Унуненний (а.м. 316)
- 120 Ubn Унбинилий (а.м. 320)
- 121 Ubu Унбиуний (а.м. 320)
- 122 Ubb Унбибий
- 123 Ubt Унбитрий
- 124 Ubq Унбиквадий
- 125 Ubp Унбипентий (а.м. 332)
- 126 Ubn Унбигексий (а.м. 322)
-
Таблица Менделеева в картинках - Другие заметки по химии
Как расположены металлы в периодической таблице Менделеева какими особенностями строения атомов?
В периодической системе Менделеева металлы расположены ниже диагонали бор-астат. Т. е. … Радиус атомов металлов больше, чем неметаллов, на внешнем энергетическом уровне, они имеют от 1 до 3 электронов, таким образом, проявляют восстановительные свойства (т.
Как расположены металлы в периодической системе Какими особенностями строения атомов?
Какими особенностями строения атомов и кристаллов различаются металлы и неметаллы? Металлы располагаются преимущественно в левой и нижней части периодической таблицы от условной диагонали, проведённой от бора к астату, т. … в основном в I, II и III группах, а также к металлам относятся все элементы Б-групп.
Как расположены неметаллы в периодической таблице Менделеева?
Неметаллы в периодической системе расположены в начале главных подгрупп, начиная с третьей группы и конце периодов, т. … в правой верхней части периодической системы.
Какое место занимают металлы в периодической таблице Менделеева?
Элементы, образующие простые вещества — металлы, занимают левую нижнюю часть периодической системы (для наглядности можно сказать, что они расположены влево от диагонали, соединяющей Be и полоний, № 84), также к ним относятся элементы побочных (Б) подгрупп.
Как расположены металлы и неметаллы в периодической системе?
Менделеева Если в Периодической системе провести диагональ от бериллия к астату, то справа вверх по диагонали будут находиться элементы-неметаллы, а слева снизу – металлы, к ним же относятся элементы всех побочных подгрупп, лантаноиды и актиноиды.
Где располагаются металлы и неметаллы?
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы. Химические элементы металлы, образующие простые вещества с металлическими свойствами, располагаются в периодической таблице слева ниже диагонали «водород — бор — кремний — мышьяк — теллур — астат — № 118».
Где расположены атомы металлов и почему?
Строение атомов металлов определяет их положение в периодической системе химических элементов Д. И. Менделеева. … Следовательно, элементы-металлы А-групп расположены слева внизу от условной диагонали, проведённой от бора к астату.
Где находятся щелочные металлы в периодической системе?
Щелочны́е мета́ллы — элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы): литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
Какие свойства относятся к металлам?
Физические свойства металлов
- Твёрдость …
- Температура плавления …
- Плотность …
- Пластичность …
- Электропроводность …
- Теплопроводность …
- Цвет …
- Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Где находятся металлы и неметаллы в таблице Менделеева?
Они имеют разные свойства (например, разный цвет), но совсем не похожи на металлы. В нашей периодической таблице символы неметаллов красные, а металлов – синие. Если провести диагональ примерно из левого верхнего угла в правый нижний, то элементы главных подгрупп выше диагонали будут неметаллами, а ниже – металлами.
Каким цветом обозначаются металлы и неметаллы в таблице Менделеева?
Таким образом, седьмой период периодической системы теперь полностью завершен. Черным цветом изображены металлы, красным цветом — неметаллы, зеленым — элементы с амфотерными свойствами.
Как расположены элементы в таблице Менделеева?
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. … Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства.
В каком виде металлы находятся в природе?
Вследствие высокой активности большинство металлов находится в природе в виде соединений. Лишь немногие встречаются в самородном состоянии: Au, Ag, Pt, Hg, Cu (в песчаных россыпях, в жильных образованиях горных пород и т. д.). Химический состав руд чрезвычайно разнообразен.
Какое строение имеют металлы?
Металлы имеют кристаллическое строение. Оно характеризуется закономерным расположением атомов в пространстве и образованием кристаллической решетки. Типы кристаллических решеток. Кристаллическое строение металлов условно можно представить как упорядоченное расположение атомов в пространстве.
Кто на самом деле придумал таблицу Менделеева?
Периодическая система химических элементов/Изобретатели
Интересные материалы:
Что если запятая между? Что если жижа попадает в рот? Что говорят евреи когда здороваются? Что может быть если сгорит блок питания? Что может произойти если в доме отключили электричество? Что можно употреблять при правильном питании на перекус? Что надо делать когда у тебя перевернулся экран в компьютере? Что не хватает если хочется капусты? Что нужно делать если на светофоре постоянно мигает жёлтый свет? Что нужно делать если рассыпалась соль?
Положение металлов в периодической системе, строение их атомов
Билет № 4
1. Металлы: положение этих химических элементов в периодической системе, строение их атомов (на примере атомов натрия, магния, алюминия). Характерные физические свойства металлов. Химические свойства металлов: взаимодействие с кислородом, водой, кислотами
Элементы, образующие простые вещества — металлы, занимают левую нижнюю часть периодической системы (для наглядности можно сказать, что они расположены влево от диагонали, соединяющей Be и полоний, № 84), также к ним относятся элементы побочных (Б) подгрупп.
Для атомов металлов характерно небольшое число электронов на внешнем уровне. Так, у натрия на внешнем уровне расположен 1 электрон,
у магния — 2, у алюминия — 3 электрона. Эти электроны сравнительно слабо связаны с ядром, что обуславливает характерные физические свойства металлов:
- электрическую проводимость,
- хорошую теплопроводность,
- ковкость, пластичность.
- Металлы также отличает характерный металлический блеск.
В химических реакциях металлы выступают в роли восстановителей:
- При взаимодействии с кислородом металлы образуют оксиды, например, магний сгорает с образованием оксида магния:
2Mg + O2 = 2MgO
Наиболее активные металлы (щелочные) при горении на воздухе образуют пероксиды:
2Na + O2 = Na2O2 (пероксид натрия)
- Активные металлы, например, натрий, реагируют с водой с образованием гидроксидов:
2Na + 2HOH = 2NaOH + H2↑
или оксидов, как магний при нагревании:
Mg + H2O = MgO + H2↑
- Металлы, расположенные в электрохимическом ряду напряжений левее водорода (Н), вытесняют водород из кислот (кроме азотной). Так, цинк реагирует с соляной кислотой с образованием хлорида цинка и водорода:
Zn + 2HCl = ZnCl2 + H2↑
- Металлы, в том числе правее водорода, за исключением золота и платины, реагируют с азотной кислотой, с образованием различных
соединений азота: - Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2H2O + 2NO2↑
- Коэффициенты в этих уравнениях легче расставить методом электронного баланса. Проставляем степени окисления:
- Cu0 + 4HN+5O3 (конц.) = Cu+2(NO3)2 + 2H2O + 2N+4O2↑
- Записываем элементы с изменившейся степенью окисления:
| Cu0 − 2e− → Cu+2 | 2* | 1** — восстановитель |
| N+5 + 1e− → N+4 | 2 — окислитель |
* наименьшее общее кратное для добавленных
и отнятых электронов
** коэффициент для вещества, содержащего этот элемент, получаем делением наименьшего общего кратного на число добавленных или отнятых электронов (у этого атома)
2. Опыт. Получение и собирание кислорода. Доказательство наличия кислорода в сосуде
- В школьной лаборатории кислород чаще получают разложением перекиси водорода в присутствии оксида марганца (IV):
- 2H2O2 = 2H2O + O2↑
- или разложением перманганата калия при нагревании:
- 2KMnO4 = K2MnO4 + MnO2 + O2↑
- Чтобы собрать газ, сосуд закрывают пробкой с газоотводной трубкой.
- Чтобы доказать наличие кислорода в сосуде, вносят в него тлеющую лучинку — она ярко вспыхивает.
- автор: Владимир Соколов
Металлы, их положение в периодической системе химических элементов Д. И. Менделеева, строение атомов
Металлы, их положение в периодической системе химических элементов Д. И. Менделеева, строение атомов. Характерные физические и химические свойства металлов.
ПЛАН ОТВЕТА
- Строение атомов металлов.
- Строение простых веществ – металлов.
- Физические свойства металлов.
- Химические свойства металлов:
- a) взаимодействие с кислородом,
- b) взаимодействие с другими неметаллами,
- c) взаимодействие металлов с водой,
- d) взаимодействие металлов с кислотами( разбавленными растворами и кислотами-окислителями ),
- e) взаимодействие металлов с растворами солей.
Металличность определяется способностью атомов отдавать электроны. Чем меньше надо отдать электронов и чем легче их отдавать, тем ярче выражены металлические свойства атомов.
Элементы-металлы имеют на последнем слое от 1 до 4 электронов (сурьма, висмут – 5, полоний — 6 электронов, но большой радиус атома). В периодической системе элементы-металлы расположены в главных подгруппах ниже диагонали алюминий-германий-сурьма-полоний. Также металлами являются элементы побочных подгрупп, т.к.
они имеют на последнем слое 2 электрона и у них происходит заполнение d-подуровня предпоследнего слоя. В периоде с возрастанием заряда ядра атома металлические свойства ослабевают, т. к. увеличивается число электронов на последнем слое. В подгруппе с возрастанием заряда ядра металлические свойства усиливаются, т. к.
увеличивается радиус атома и отдавать электроны становится легче.. Наиболее активным металлом является франций.
В металлах имеет место металлическая связь – это связь между атомами и катионами металла посредством общих электронов. Металлы имеют металлическую кристаллическую решётку в узлах которой находятся атомы и катионы металлов, а пространство между ними заполнено «электронным газом».
Она определяет физические свойства металлов: все металлы твёрдые вещества (кроме ртути), от светло- до тёмно-серого цвета (искл. – золото, медь) с металлическим блеском, обладают ковкостью, пластичностью (т.е. способны под ударом расплющиваться, их можно прокатывать в тончайшие листы и вытягивать из них проволоку), проводят электрический ток и тепло.
Общие свойства металлов обусловлены наличием «электронного газа».
Во всех химических реакциях металлы являются восстановителями: Ме0 – n·? ® Меn+
По отношению металлов к кислороду их можно разделить на три группы. Металлы, реагирующие с кислородом при обычных условиях, например, 2Са0 + О20 = 2Са+2О-2. Металлы, взаимодействующие с кислородом только при нагревании, например, медь: 2Сu0 + O20 = 2Cu+2O-2. И третья группа – это металлы, не взаимодействующие с кислородом, например, золото, платина.
При различных условиях металлы взаимодействуют с неметаллами, причём, чем больше активность металла и неметалла, тем мягче условия протекания реакции. Например, натрий реагирует с хлором при обычных условиях с образованием хлорида натрия: Na0 + Cl20 = 2Na+Cl-. Магний взаимодействует с серой с образованием сульфида магния, но для начала реакции требуется нагревание: Mg0 + S0 = Mg+2S-2.
Щелочные и щелочноземельные металлы реагируют с водой при обычных условиях, при этом образуется щёлочь и выделяется водород, например: 2Na0 + 2H2+1O = 2Na+1OH + H20. В результате взаимодействия металлов с водой при нагревании образуются оксид металла и водород, например: Zn0 + H2+1O = Zn+2O + H20.Золото, медь, серебро, платина, ртуть не взаимодействуют с водой.
С растворами кислот взаимодействуют металлы, стоящие в ряду напряжения до водорода. В результате реакции образуются соль и водород. Например, Zn0 + 2H+1Cl = Zn+2Cl2 + H20.
Разбавленная азотная и концентрированные серная и азотная кислоты способны взаимодействовать и с металлами, стоящими в ряду напряжения после водорода. Это объясняется тем, что они проявляют окислительные свойства за счёт S+6 и N+5. В результате реакций обязательно образуются соль и вода и ещё продукт восстановления S+6 или N+5. Например:
- 2H2S+6O4(конц.) + Cu0 = Cu0SO4 + H2O + S+4O2
- 8HN+5O3(разб.) + 3Cu0 = 3Cu+2(NO3)2 + H2O + 2N+2O
- 4HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + H2O + 2N+4O2
- В зависимости от активности металла сера может восстанавливаться до сероводорода H2S-2 , серы S0 или оксида серы(IV) S+4O2 . продукт восстановления азота: аммиак N-3H3 , оксид азота(I) N2+1O , оксид азота(II) N+2O или оксид азота(IV) N+4O2 зависит от концентрации азотной кислоты и активности металла
Более активные металлы вытесняют менее активные металлы из растворов их солей. Активность металла определяется его положением в электрохимическом ряду напряжения металлов: она уменьшается слева направо. Т. о.
металл вытесняет из солей металлы, стоящие в ряду напряжения правее его. В результате взаимодействия металла с раствором соли образуются новая соль и новый металл, например: Zn0 + Cu+2SO4 = Zn+2SO4 + Cu0.
Металлы, реагирующие с водой, взаимодействуют с растворами солей с образованием новой соли, нерастворимого основания и водорода, например:
CuSO4 + 2Na + 2H2O = H2 + Na2SO4 + Cu(OH)2?.
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
| государственное образовательное учреждение начального профессионального образования профессиональное училище № 39 |
| Положение металлов в периодической системе Д.И. Менделеева |
| Открытый урок по химии |
| Преподаватель Борисенко И. А. |
| 17.12.2010 |
- Оглавление
- Цель и задачи урока:
- Форма урока:
- Методы и приёмы:
- Оборудование:
- Ход урока
- I. Организационный момент урока
II. Постановка и оглашение темы урока, его целей и задач.
III. Изучение нового материала.
IV. Закрепление изученного материала.
V. Подведение итогов урока
VI. Домашнее задание.
Цель и задачи урока:
- На основе положения металлов в ПСХЭ подвести учащихся к пониманию особенностей строения их атомов и кристаллов (металлической химической связи и кристаллической металлической решетки), изучить общие физические свойства металлов. Повторить и обобщить знания о химической связи и металлической кристаллической решетке.
- Развивать умение анализировать, делать выводы о строении атомов исходя из положения металлов в ПСХЭ.
- Развивать умение владеть химической терминологией, чётко формулировать и высказывать свои мысли.
- Воспитывать самостоятельность мышления в ходе учебной деятельности.
- Формировать интерес к будущей профессии.
комбинированный урок с применением презентации
Методы и приёмы:
Рассказ, беседа, демонстрация видео типов кристаллических решеток металлов, тест, составление схем электронного строения атомов, демонстрация коллекции образцов металлов и сплавов.
Оборудование:
- Таблица «Периодическая система химических элементов Д.И. Менделеева»;
- Презентация урока на электронном носителе.
- Коллекция образцов металлов и сплавов.
- Проектор.
- Карточки с таблицей «Характеристика строения атома по положению в ПСХЭ»
Ход урока
I. Организационный момент урока.
II. Постановка и оглашение темы урока, его целей и задач
Слайд 1-2
III. Изучение нового материала.
Учитель: Человек использовал металлы с древних времён. Кратко об истории использования металлов.
Сообщение 1 учащегося. Слайд 3
В начале был век медный.
К концу каменного века человек открыл возможность использования металлов для изготовления орудий труда. Первым таким металлом была медь.
Период распространения медных орудий называют энеолитом или халколитом, что в переводе с греческого означает «медь». Медь обрабатывалась с помощью каменных орудий методом холодной ковки.
Самородки меди превращались в изделия под тяжелыми ударами молота. В начале медного века из меди делали лишь мягкие орудия, украшения, предметы домашней утвари.
Именно с открытием меди и других металлов стала зарождаться профессия кузнеца.
- Позже появилось литьё, а потом человек стал добавлять к меди олово или сурьму, делать бронзу, более долговечную, прочную, легкоплавкую.
- Сообщение 2 учащегося. Слайд 3
- Далее идет век бронзовый.
Бронза – сплав меди и олова. Хронологические границы бронзового века датируются в начале 3-го тысячелетия до н.э. до начала 1-го тысячелетия до н.э.
Сообщение 3 учащегося. Слайд 4
Далее идет железный век.
Третий и последний период первобытной эпохи характеризуется распространением железной металлургии и железных орудий и знаменует собой железный век. В современном значении этот термин был введен в употребление в середине IХ века датским археологом К. Ю. Томсоном и вскоре распространился в литературе наряду с терминами «каменный век» и « бронзовый век».
В отличие от других металлов железо, кроме метеоритного, почти не встречается в чистом виде. Ученые предполагают, что первое железо, попавшее в руки человека, было метеоритного происхождения, и не зря железо именуется « небесным камнем». Самый крупный метеорит нашли в Африке, он весил около шестидесяти тонн. А во льдах Гренландии нашли железный метеорит весом тридцать три тонны.
И настоящее время продолжается железный век. Ведь в настоящее время железные сплавы составляют почти 90 % всего металлов и металлических сплавов.
Учитель.
Золото и серебро – благородные металлы в настоящее время служат для изготовления ювелирных украшений, а также деталей в электронике, авиакосмической промышленности, в судостроении. Где в судоходстве могут применяться эти металлы? Исключительное значение металлов для развития общества обусловлено, конечно, их уникальными свойствами. Назовите эти свойства.
- Продемонстрировать учащимся коллекцию образцов металлов.
- Учащиеся называют такие свойства металлов как электропроводность и теплопроводность, характерный металлический блеск, пластичность, твердость (кроме ртути) и др.
- Учитель задает учащимся ключевой вопрос: а чем же обусловлены эти свойства?
- Ожидаемый ответ: свойства веществ обусловлены строением молекул и атомов этих веществ.
Слайд 5. Итак, металлы – группа веществ с общими свойствами.
Демонстрация презентации.
Учитель: Металлами являются элементы 1-3 групп главных подгрупп, и элементы 4-8 групп побочных подгрупп.
Слайд 6. Задание 1. Самостоятельно, используя ПСХЭ, в тетради допишите представителей групп, являющиеся металлами.
| I | II | III | IV | V | VI | VII | VIII |
| Na | Mg | Al | Ti | V | Cr | Mn | Fe |
| K | Ca | In | Sn | Ta | Mo | Tc | Pd |
| Cs | Ba | Tl | Pb | Bi | W | Re | Ir |
- Заслушивание ответов учащихся выборочно.
- Учитель: металлами будут элементы, размещенные в левом нижнем углу ПСХЭ.
- Учитель подчеркивает, что в ПСХЭ металлами будут все элементы, расположенные ниже диагонали В — Аt, даже те, у которых на внешнем слое 4 электрона (Gе, Sn, Рb), 5 электронов (Sb, Вi), 6 электронов (Ро), так как они отличаются большим радиусом.
- Таким образом, из 109 элементов ПСХЭ 85 являются металлами. Слайд № 7
Учитель: положение элемента в ПСХЭ отражает строение атома элемента. С помощью таблиц, которые вы получили в начале урока, охарактеризуем строение атома натрия по его положению в ПСХЭ.Демонстрация слайда 8.
Что представляет собой атом натрия? Посмотрите на приближенную модель атома натрия, в которой видны ядро и электроны, движущиеся по орбитам.
Демонстрация Слайда 9. Модель атома натрия.
Напомню вам, как составляется схема электронного строения атома элемента.
Демонстрация слайда 10. У вас должна получиться следующая схема электронного строения атома натрия.
Слайд 11. Задание 2. Составьте схему электронного строения атома кальция и алюминия в тетради самостоятельно по примеру с атомом натрия.
Учитель проверяет работу в тетради.
Какой вывод можно сделать об электронном строении атомов металлов?
— На внешнем энергетическом уровне 1-3 электрона. Мы помним, что вступая в химические соединения, атомы стремятся восстановить полную 8-электронный оболочку внешнего энергетического уровня. Для этого атомы металлов легко отдают 1-3 электрона с внешнего уровня, превращаясь в положительно-заряженные ионы. При этом проявляют восстановительные свойства.
Демонстрация слайда 12.Металлы – это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в положительные ионы. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
- Рассмотрим простые вещества – металлы.
- Демонстрация слайда 13.
- Сначала обобщим сведения о типе химической связи, образуемой атомами металлов и строении кристаллической решетки
- сравнительно небольшое количество электронов одновременно связывают множество ядер, связь делокализована;
- валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален;
- металлическая связь не обладает направленностью и насыщенностью.
- Демонстрация
- Слайд 14 «Типы кристаллических решёток металлов»
- Слайд 15 Видео кристаллической решетки металлов.
- Учащиеся делают вывод, что в соответствие именно с таким строением металлы характеризуются общими физическими свойствами.
- Учитель подчеркивает, что физические свойства металлов определяются именно их строением.
- Слайд 16 Свойства металлов определяются строением их атомов
а) твердость – все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло (демонстрация).
б) плотность — металлы делятся на лёгкие (5г/см) и тяжелые (больше 5г/см) (демонстрация).
в) плавкость — металлы делятся на легкоплавкие и тугоплавкие (демонстрация).
г) электропроводность, теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.
- При повышении температуры амплитуда движения атомов и ионов, находящихся в узлах кристаллической решетки резко возрастает, и это мешает движению электронов, и электропроводность металлов падает.
- Следует отметить, что у некоторых неметаллов, при повышении температуры электропроводность возрастает, например, у графита, при этом с повышением температуры разрушаются некоторые ковалентные связи, и число свободно перемещающихся электронов возрастает.
- д) металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают, как стекло.
Поэтому все металлы в кристаллическом состоянии имеют металлический блеск. Для большинства металлов в равной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо – белый цвет.
Только золото и медь в большой степени поглощают короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый свет. Самые блестящие металлы – ртуть, серебро, палладий.
В порошке все металлы, кроме АI и Мg, теряют блеск и имеют черный или темно-серый цвет.
е) пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.
IV. Закрепление изученного материала
Учитель: мы рассмотрели строение и физические свойства металлов, их положение в периодической системе химических элементов Д.И. Менделеева. Теперь для закрепления предлагаем выполнить тест.
Слайды 15-16-17.
1) Электронная формула кальция.
- а) 1S 2 2S2 2Р6 3S1
- б) 1S 2 2S 2 2Р6 3S 2
- в) 1S 2 2S 2 2Р6 3S 2 3S6 4S1
- г) 1S 2 2S 2 2Р6 3S 2 3Р6 4S 2
2) Электронную формулу 1S2 2S2 2Р6 3S2 3Р6 4S2 имеет атом:
3) Электропроводность, металлический блеск, пластичность, плотность металлов определяются :
- а) массой металла
- б) температурой плавления металлов
- в) строением атомов металлов
- г) наличием неспареных электронов
4) Металлы при взаимодействии с неметаллами проявляют свойства
- а) окислительные;
- б) восстановительные;
- в) и окислительные, и восстановительные;
- г) не участвуют в окислительно-восстановительных реакциях;
5) В периодической системе типичные металлы расположены в:
- а) верхней части;
- б) нижней части;
- в) правом верхнем углу;
- г) левом нижнем углу
Проверяем работу соседа по парте по ключу Слайд 18
| Номер вопроса | Правильный ответ |
| 1 | Г |
| 2 | Б |
| 3 | В |
| 4 | Б |
| 5 | Г |
V. Подведение итогов урока
Каждому ученику выставляется оценка.
VI. Домашнее задание
Строение атомов металлов, их физические свойства






