Кодификатор ЕГЭ. Раздел 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
У атомов переходных элементов (меди, цинка, хрома и железа) происходит заполнение энергетического d-подуровня.
Рассмотрим строение электронной оболочки этих элементов. У атомов цинка и железа заполнение электронной оболочки происходит согласно энергетическому ряду орбиталей (подуровней), который рассмотрен в статье Строение атома. Электронная конфигурация атома железа:
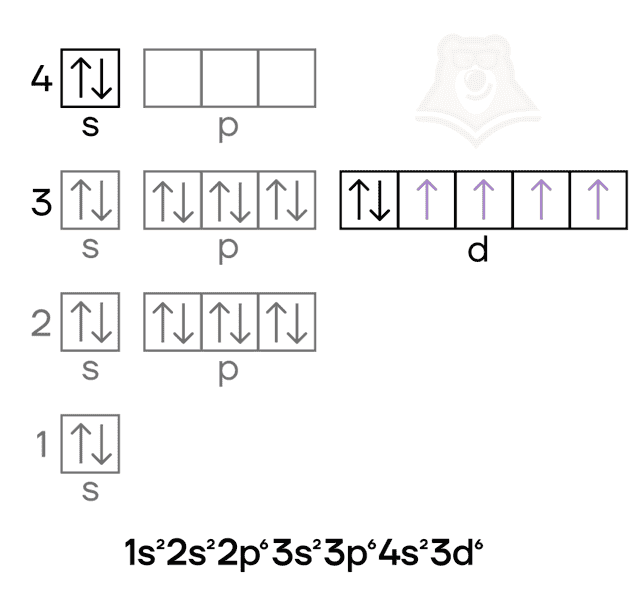
- +26Fe [Ar]3d64s2 [Ar] 4s 3d
- У атома цинка на происходит полное заполнение 3d-подуровня:
- +30Zn [Ar]3d104s2 [Ar] 4s 3d
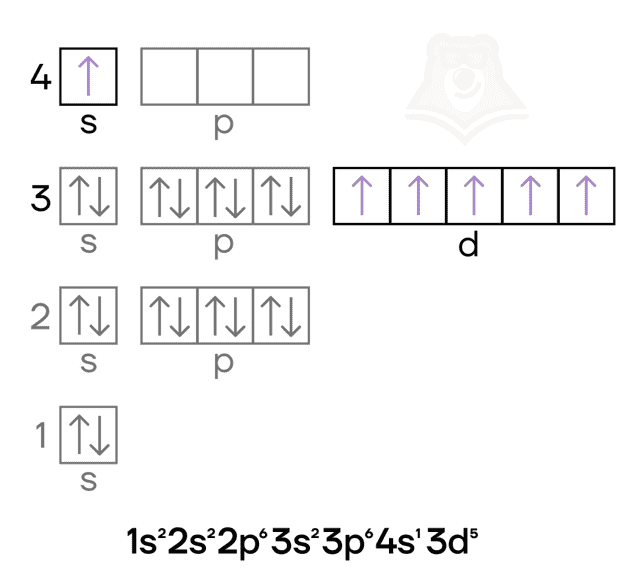
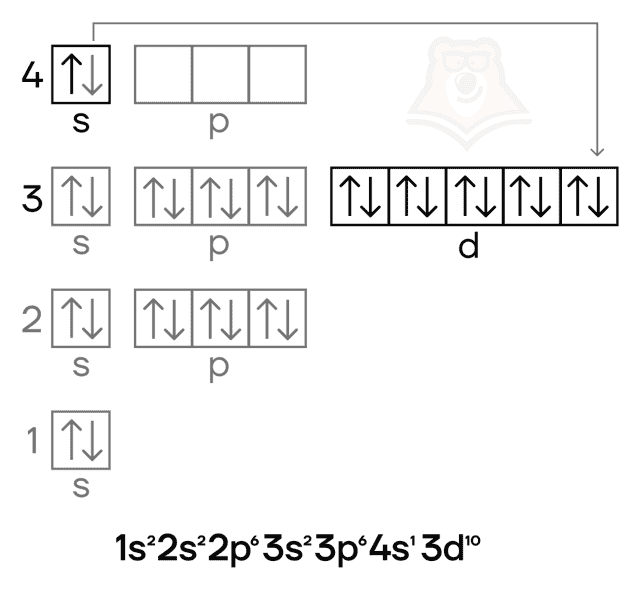
У атомов хрома и меди наблюдается «проскок» или «провал» электрона, когда один электрон переходит с более энергетически выгодного 4s-подуровня на менее выгодный 3d-подуровень.
Этот переход обусловлен тем, что в результате образуются более устойчивые электронные конфигурации (3d5 у атома хрома и 3d10 у атома меди).
Дело в том, что энергетически более выгодно, когда d-орбиталь заполнена наполовину или полностью.

| Элемент | Электронная конфигурация валентной зоны | |
| Теоретическая | Реальная | |
| Медь +29Cu | [Ar]3d94s2 | [Ar]3d104s1 [Ar] 4s 3d |
| Хром +24Cr | [Ar]3d44s2 | [Ar]3d54s1 [Ar] 4s 3d |
Мы используем, конечно же, реальную электронную конфигурацию меди и хрома, теоретическая будет неверной.
Обратите внимание! У всех 3d-элементов внешним энергетическим уровнем считается четвертый уровень и 4s-подуровень. При образовании катионов атомы металлов отдают электроны с внешнего энергетического уровня.
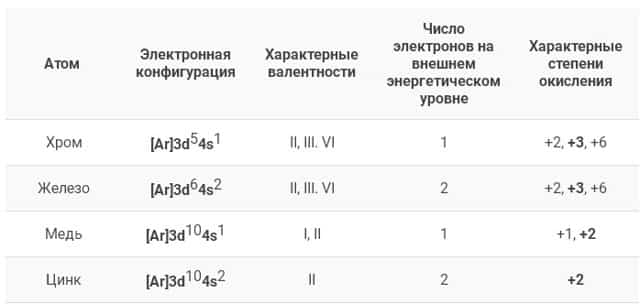
| Атом | Электронная конфигурация | Характерные валентности | Число электронов на внешнем энергетическом уровне | Характерные степени окисления |
| Хром | [Ar]3d54s1 | II, III. VI | 1 | +2, +3, +6 |
| Железо | [Ar]3d64s2 | II, III. VI | 2 | +2, +3, +6 |
| Медь | [Ar]3d104s1 | I, II | 1 | +1, +2 |
| Цинк | [Ar]3d104s2 | II | 2 | +2 |
Рассмотрим характеристики хрома, железа, меди и цинка:
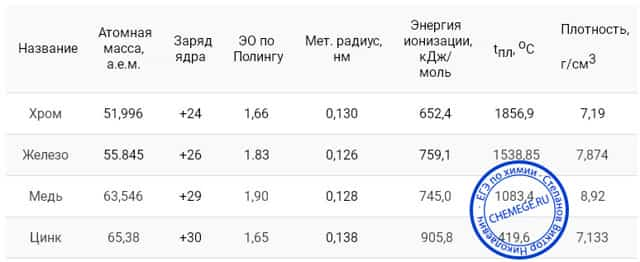
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность, г/см3 |
| Хром | 51,996 | +24 | 1,66 | 0,130 | 652,4 | 1856,9 | 7,19 |
| Железо | 55.845 | +26 | 1.83 | 0,126 | 759,1 | 1538,85 | 7,874 |
| Медь | 63,546 | +29 | 1,90 | 0,128 | 745,0 | 1083,4 | 8,92 |
| Цинк | 65,38 | +30 | 1,65 | 0,138 | 905,8 | 419,6 | 7,133 |
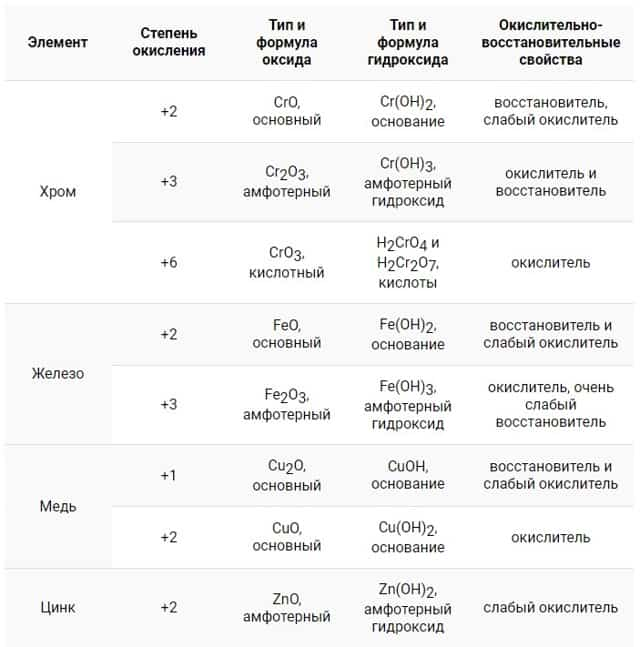
Свойства соединений железа, меди, цинка и хрома.
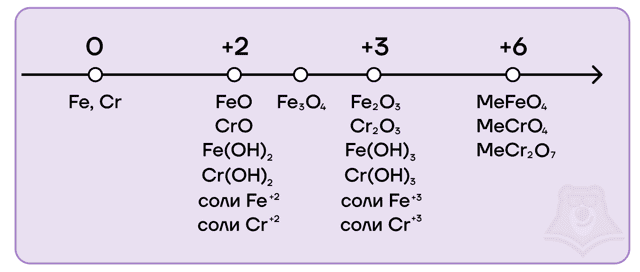
Для хрома характерны степени окисления +2, +3 и +6. Оксид и гидроксид хрома (II) (CrO и Cr(OH)2) проявляют основные свойства. Степени окисления +3 соответствуют амфотерные оксид и гидроксид: Cr2O3 и Cr(OH)3 соответственно.
Соединения хрома +6 проявляют сильные кислотные свойства: оксид CrO3 и сразу две сильных кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7.
Соединения хрома (II) проявляют сильные восстановительные свойства, соединения хрома (VI) проявляют только сильные окислительные свойства.
Характерные степени окисления железа: +2 и +3. Оксид и гидроксид железа (II) — основные (FeO и Fe(OH)2), а соединения железа (III) проявляют амфотерные свойства (Cr2O3 и Cr(OH)3 соответственно) с преобладанием основных. Соединения железа (II) проявляют также восстановительные свойства.
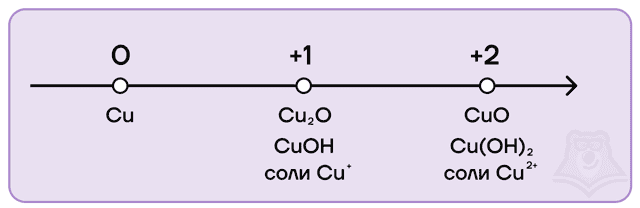
Для меди характерны степени окисления +1 и +2. Оксид меди (I) CuO и гидроксид меди (I) CuOH — основные. Оксид и гидроксид меди (II) проявляют амфотерные свойства с преобладанием основных: CuO и Cu(OH)2.
Характерная степень окисления цинка +2. Соединения цинка (II) проявляют амфотерные свойства: ZnO и Zn(OH)2.
| Элемент | Степень окисления | Тип и формула оксида | Тип и формула гидроксида | Окислительно-восстановительные свойства |
| Хром | +2 | CrO, основный | Cr(OH)2, основание | восстановитель, слабый окислитель |
| +3 | Cr2O3, амфотерный | Cr(OH)3, амфотерный гидроксид | окислитель и восстановитель | |
| +6 | CrO3, кислотный | H2CrO4 и H2Cr2O7, кислоты | окислитель | |
| Железо | +2 | FeO, основный | Fe(OH)2, основание | восстановитель и слабый окислитель |
| +3 | Fe2O3, амфотерный | Fe(OH)3, амфотерный гидроксид | окислитель, очень слабый восстановитель | |
| Медь | +1 | Cu2O, основный | CuOH, основание | восстановитель и слабый окислитель |
| +2 | CuO, основный | Cu(OH)2, основание | окислитель | |
| Цинк | +2 | ZnO, амфотерный | Zn(OH)2, амфотерный гидроксид | слабый окислитель |
Переходные элементы: медь, хром, железо — Умскул Учебник
- Что такое переходные металлы;
- Основные характеристики меди, хрома и железа;
- Их физические и химические свойства.
К переходным элементам относятся такие, которые расположены в побочных подгруппах больших периодов периодической системы Д.И. Менделеева. К ним принадлежат d– и f–элементы.
Название «переходные» связано с тем, что переходные элементы расположены между s– и р–элементами.
Мы рассмотрим три металла: железо, хром и медь.
Железо — металл VIIIB-группы четвёртого периода. Его особенностью, как и особенностью других переходных металлов, является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях.
Хром — металл VIB-группы четвёртого периода. Как и железо, это d-элемент, у которого валентные электроны находятся и на внешнем слое и на предвнешнем подуровне. Помимо этого, в атоме хрома в основном состоянии происходит провал электрона.
Железо и хром имеют идентичный набор степеней окисления, а также возможных оксидов и гидроксидов: 0, +2, +3, +6.
Медь — металл IB-группы четвёртого периода. Как и в случае других элементов побочных подгрупп, особенностью для неё является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях. Как и у хрома, у меди в электронной конфигурации наблюдается провал электрона.
Степени окисления меди следующие:
- низшая степень окисления равна 0, как и у всех металлов;
- высшая равна +2;
- промежуточная равна +1.
Физические свойства
По физическим свойствам железо и хром — совершенно типичные металлы серебристо-белого цвета, которые не растворяются в воде, а на воздухе покрываются прочной оксидной плёнкой.
Особенностью железа является его быстрая коррозия (то есть окисление) кислородом во влажном воздухе, а особенностью хрома — высокая твёрдость: он является одним из самых твёрдых металлов.
Медь же — металл красного цвета, один из четырёх металлов, имеющих явную цветовую окраску, которая отлична от серой или серебристой.
1.2.3 Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
Видеоурок 1: Медь
Видеоурок 2: Цинк
Лекция: Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
Переходными называются элементы, содержащие d-/f-элементы и располагающиеся между s+-элементами и р—элементами. Отличие d- и f-элементов от s- и p-элементов состоит в том, что электроны первых заполняют внутренние nd- или nf- оболочки, тогда как электроны вторых заполняют внешние ns- и np-оболочки.
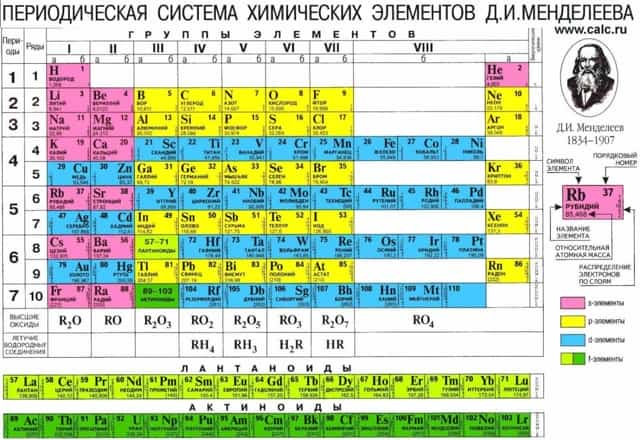
В Периодической таблице данные элементы находятся в побочных подгруппах 4, 5 и 6 периодов. Все они металлы. Всего их на сегодняшний день 65. Однако по требованию кодификатора на данном уроке мы более подробно рассмотрим медь, цинк, хром и железо.
Медь Cu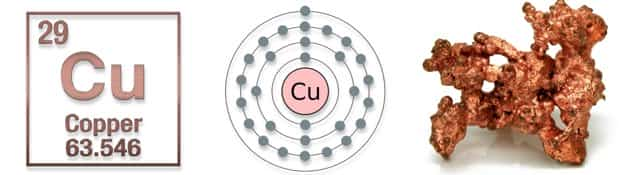
| Химический элемент | Медь/ Cuprum(Cu) | Особенности |
| Расположение в Периодической таблице | 4 период I группа побочная подгруппа, порядковый номер 29 | Инертный металл. Относится к d-элементам. Не взаимодействует с водой, некоторыми неметаллами: с водородом, азотом, углеродом, и кремнием, с растворами соляной и серной кислот, с щелочами. Реагирует с конц/растворами серной и азотной кислот. |
| Характеристика | Золотисто-розовый пластичный, тягучий, легко прокатывается в листы | Отличный электропроводник после серебра. Температура плавления 1083 |
| Масса атома | 63,546 | |
| Расположение электронов по орбиталям (электронная формула или конфигурация) |
|
Наблюдается проскок одного электрона s-подуровня на d-подуровень. Это обеспечивает более устойчивое положение. |
| Степень окисления | 0, +1, +2 | Самая устойчивая среди них +2 |
| Оксиды | Оксид меди (I)* Сu2О | Обладает основными свойствами |
| Оксид меди (II) СuО | Обладает амфотерными свойствами с преобладанием основных | |
| Гидроксиды | Гидроксид меди (I) СuОН | Обладает основными свойствами |
| Гидроксид меди (II) Cu(ОН)2 | Обладает амфотерными свойствами с преобладанием основных | |
| Способы получения | Поскольку в природе медь, как и другие металлы встречается в составе соединений, то для получения простого вещества Cu применяются:1. Пирометаллургический способ – восстановление металла при высоких t с помощью водорода, оксида угля. | Водородотермия:Cu+2O + H2 → Cu0 + H2O |
| 2. Гидрометаллургический способ – восстановление из солей в растворах. |
|
|
| 3. Электролиз – способ получения металлов с помощью электрического тока. |
|
|
| Применение в быту |
|
*Римские цифры в таблице указана валентность
Цинк Zn
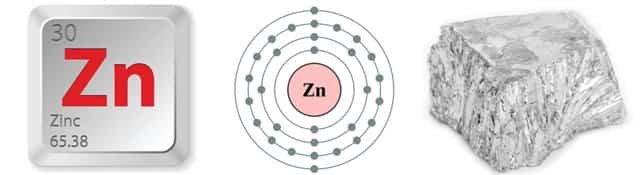
| Химический элемент | Цинк / Zincum(Zn) | Примечания |
| Расположение в Периодической таблице | 4 период II группа побочная подгруппа, порядковый номер 30 | Амфотерный металл. Не взаимодействует с водородом, азотом, бором, кремнием, углеродом. Не растворяется в воде, но при очень высокой t реагирует на водяной пар, образуя оксид цинка и водорода. Реагирует с щелочами. Из растворов солей и оксидов, вытесняет металлы, расположенные правее в ряду напряжений* |
| Характеристика | Хрупкий металл голубовато-белого цвета | |
| Масса атома | 65,37 | |
| Расположение электронов по орбиталям | 1s2 2s22p6 3s23p63d10 4s2(в основном состоянии) | |
| Степень окисления | 0, +2 | Единственно возможная |
| Оксиды | Оксид цинка ZnO | Обладает амфотерными свойствами |
| Гидроксиды | Гидроксид цинка Zn(ОН)2 | Обладает амфотерными свойствами |
| Способы получения | 1. Пирометаллургический способ | С помощью оксида угля: ZnO+ Ct → CO + Zn |
| 2. Гидрометаллургический способ | ZnO + H2SO4 → ZnSO4+ H2OZnSO4+ Fe → FeSO4+ Zn | |
| 3. Электролиз | Поскольку цинк в ряду напряжений стоит после Al и до Н, то на катоде будут протекать два процесса восстановления ионов цинка и водорода (т.к. среда кислая):
|
|
| Применение в быту | Применение цинка объемно и широко, к примеру, используется:
|
*Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Хром Cr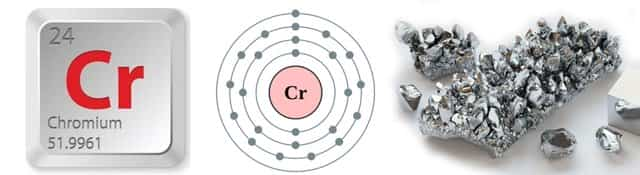
| Химический элемент | Хром / Chromium(Cr) | Примечания |
| Расположение в Периодической таблице | 4 период VI группа побочная подгруппа, порядковый номер 24 | Не взаимодействует с водородом. Вытесняет его из неокисляющих кислот: соляной, фосфорной и др. При сильном нагревании хром растворяется в серной или азотной кислотах. |
| Характеристика | Твердый металл голубовато-белого цвета | |
| Масса атома | 51,996 | |
| Расположение электронов по орбиталям | 1s2 2s22p6 3s23p63d5 4s1(в основном состоянии) | |
| Степень окисления | 0, +2, +3, +6 | Повышение степени ведет к возрастанию кислотности и ослабеванию основных свойств. Наиболее устойчивая степень +3 |
| Оксиды | Оксид хрома (II) — СгО | Обладает основными свойствами |
| Оксид хрома (III) Сг2О3 | Обладает амфотерными свойствами | |
| Оксид хрома (VI) СгО3 | Обладает кислотными свойствами (Н2СгО4 – хромовая кислота и дихромовая Н2Cr2О7). | |
| Гидроксиды | Гидроксид хрома (II) Сг(ОН)2 | Обладает основными свойствами |
| Гидроксид хрома (III) Сг(ОН)3 | Обладает амфотерными свойствами | |
| Способы получения | 1. Пирометаллургический способ | Например, алюмотермией (вид металлотермии): Cr2O3 + 2Al → Al2O3 + 2Cr |
| 2. Электролиз | Из концентрированных водных растворов СrО3 или Сr2О3, содержащих H2SO4, либо электролизом сульфата Хрома Cr2(SO4)3 хром получают в наиболее чистом виде. | |
| Применение в быту |
|
Железо Fe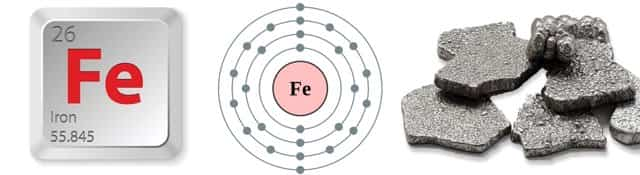
| Химический элемент | Железо / Ferrum(Fe) | Примечания |
| Расположение в Периодической таблице | 4 период VIII группа побочная подгруппа, порядковый номер 26 | При нагревании более 2000 взаимодействует с кислородом. Окисляется в воде. |
| Характеристика | Ковкий металл серебристо-белого цвета | |
| Масса атома | 55,849 | |
| Расположение электронов по орбиталям | 1s2 2s22p6 3s23p63d6 4s2(в основном состоянии) | |
| Степень окисления | 0, +2, +3, +6 | Из них самая устойчивая +3;Fe+6- сильнейший окислитель |
| Оксиды | Оксид железа (II) FeО | Обладает основными свойствами |
| Оксид железа (III) Fe2О3 | Обладает амфотерными свойствами с преобладанием основных | |
| Гидроксиды | Гидроксид железа (II) Fe(ОН)2 | Обладает основными свойствами |
| Гидроксид железа (III) Fe(ОН)3 | Обладает амфотерными свойствами с преобладанием основных | |
| Способы получения | 1. Пирометаллургический способ |
|
| 2. Электролиз |
Реакция в сумме:6Н2О +2FeCl3 → 3H2↑ + 3Cl2↑+2Fe(OH)3 |
|
| Применение в быту |
|
| Предыдущий урок | Следующий урок |






