- Катод
- Анод
- Примеры решения
- Электролиз расплавов
- Электролиз
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- Применение электролиза в производстве металлов: в чем заключается процесс и его применения
- Определение электролиза
- В чём заключается процесс
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- Активные металлы
- Менее активные металлы и неактивные металлы
- Практическое применение в производстве
- Видео
- 1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
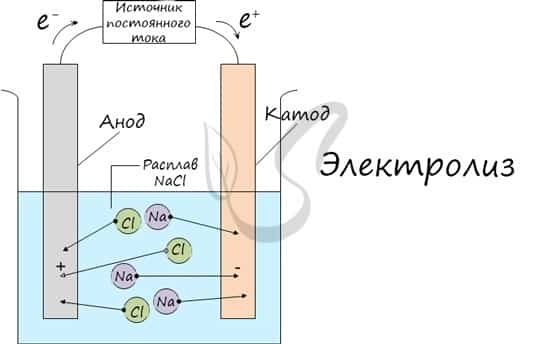
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na+, K+, Cu2+, Fe3+, Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
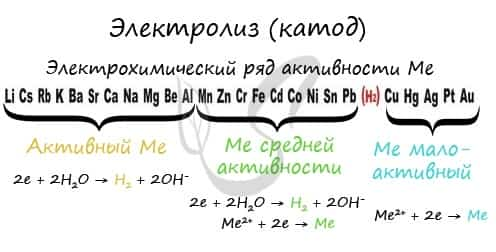
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO42-, PO43-, Cl-, Br-, I-, F-, S2-, CH3COO-.
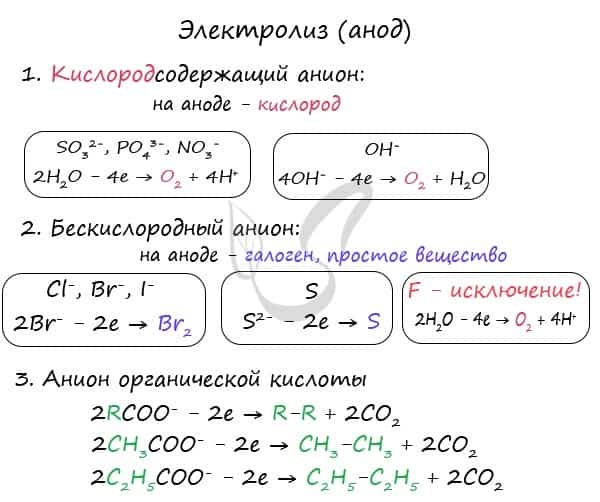
При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.

Теперь вы точно будете знать, что выделяется на катоде ?
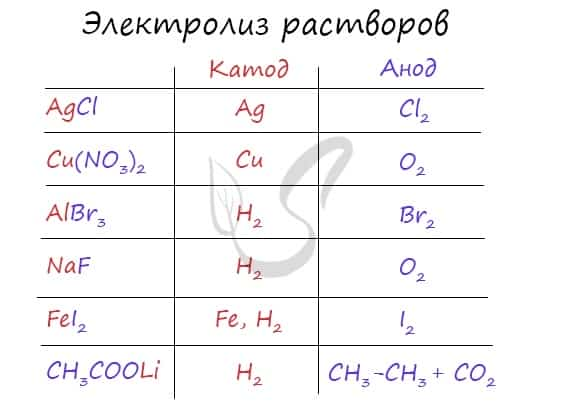
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно ? Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
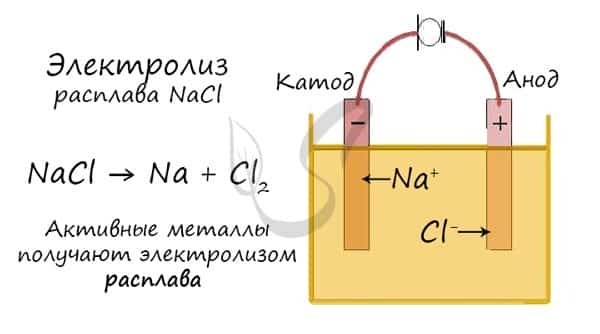
- В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
- AlCl3 → Al + Cl2
- LiBr → Li + Br2
Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну.
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды.
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы. Положительно заряженный электрод (анод) притягивает отрицательно заряженные частицы (анионы). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
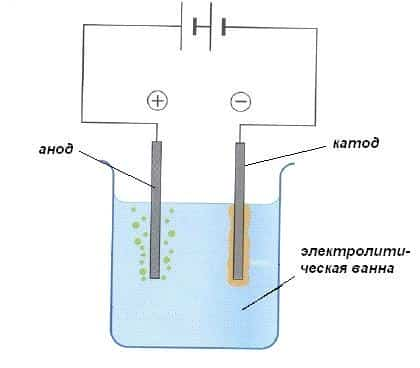
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза.
Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются.
Их изготавливают из неактивных металлов, например, платины, или графита.
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений:

Каждый металл характеризуется значением электрохимического потен-циала.
Чем меньше потенциал, тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла.
Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H+.
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1.
Если металл в соли — активный (до Al3+ включительно в ряду напряжений), то вместо металла на катоде восстанавливается (разряжается) водород, т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH—, среда возле катода — щелочная:
- 2H2O +2ē → H2 + 2OH—
- Например, при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
- 2. Если металл в соли – средней активности (между Al3+ и Н+), то на катоде восстанавливается (разряжается) и металл, и водород, так как потенциал таких металлов сравним с потенциалом водорода:
- Men+ + nē → Me0
- 2H+2O +2ē → H20 + 2OH—
- Например, при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
- Fe2+ + 2ē → Fe0
- 2H+2O +2ē → H20 + 2OH—
- 3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов), то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
- Men+ + nē → Me0
- Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
- Cu2+ + 2ē → Cu0
- 4. Если на катод попадают катионы водорода H+, то они и восстанавливаются до молекулярного водорода:
- 2H+ + 2ē → H20
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H2O-2).
- При электролизе растворов солей на аноде наблюдаются следующие закономерности:
- 1. Если на анод попадает бескислородный кислотный остаток, то он окисляется до свободного состояния (до степени окисления 0):
- неМеn- – nē = неМе0
- Например: при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
- 2Cl— – 2ē = Cl20
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент.
Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение. Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода.
Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы:
- 2H2O-2 – 4ē → O20+ 4H+
- 2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион, то окислению подвергается вода с выделением молекулярно-го кислорода:
- 2H2O-2 – 4ē → O20 + 4H+
- 3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
- 4O-2H– – 4ē → O20 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например, при электролизе растворов ацетатов выделяется углекислый газ и этан:
2CH3C+3OO– –2ē → 2C+4O2+ CH3-CH3
Суммарные процессы электролиза
- Рассмотрим электролиз растворов различных солей.
- Например, электролиз раствора сульфата меди.
На катоде восстанавливаются ионы меди:
- Катод (–): Cu2+ + 2ē → Cu0
- На аноде окисляются молекулы воды:
- Анод (+): 2H2O-2 – 4ē → O2 + 4H+
- Сульфат-ионы в процессе не участвуют.
Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
- 2Cu2+SO4 + 2H2O-2 → 2Cu0 + 2H2SO4 + O20
- Электролиз раствора хлорида натрия выглядит так:
- На катоде восстанавливается водород:
- Катод (–): 2H+2O +2ē → H20 + 2OH–
- На аноде окисляются хлорид-ионы:
- Анод (+): 2Cl– – 2ē → Cl20
- Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия:
- 2H+2O +2NaCl– → H20 + 2NaOH + Cl20
- Следующий пример: электролиз водного раствора карбоната калия.
- На катоде восстанавливается водород из воды:
- Катод (–): 2H+2O +2ē → H20 + 2OH–
- На аноде окисляются молекулы воды до молекулярного кислорода:
- Анод (+): 2H2O-2 – 4ē → O20 + 4H+
- Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
- 2H2+O-2 → 2H20 + O20
- Еще один пример: электролиз водного раствора хлорида меди (II).
- На катоде восстанавливается медь:
- Катод (–): Cu2+ + 2ē → Cu0
- На аноде окисляются хлорид-ионы до молекулярного хлора:
- Анод (+): 2Cl– – 2ē → Cl20
- Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
- Cu2+Cl2– → Cu0 + Cl20
- Еще несколько примеров: электролиз раствора гидроксида натрия.
- На катоде восстанавливается водород из воды:
- Катод (–): 2H+2O +2ē → H20 + 2OH–
- На аноде окисляются гидроксид-ионы до молекулярного кислорода:
- Анод (+): 4O-2H– – 4ē → O20 + 2H2O
- Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
- 2H2+O-2 → 2H20 + O20
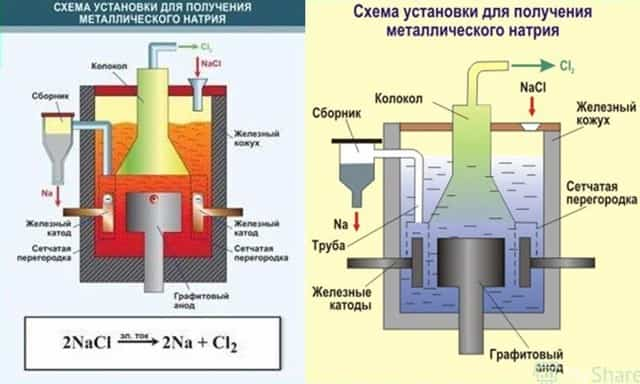
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
- Например: электролиз расплава хлорида натрия. На катоде восстанавливаются катионы натрия:
- Катод (–): Na+ + ē → Na0
- На аноде окисляются анионы хлора:
- Анод (+): 2Cl– – 2ē → Cl20
- Суммарное уравнение электролиза расплава хлорида натрия:
- 2Na+Cl– → 2Na0 + Cl20
- Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
- Катод (–): Na+ + ē → Na0
- На аноде окисляются гидроксид-ионы:
- Анод (+): 4OH– – 4ē → O20 + 2H2O
- Суммарное уравнение электролиза расплава гидроксида натрия:
- 4Na+OH– → 4Na0 + O20 + 2H2O
- Многие металлы получают в промышленности электролизом расплавов.
Например, алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100оС), чем оксид алюминия (2050оС). А оксид алюминия отлично растворяется в расплавленном криолите.
- В растворе криолите оксид алюминия диссоциирует на ионы:
- Al2O3 = Al3+ + AlO33-
- На катоде восстанавливаются катионы алюминия:
- Катод (–): Al3+ + 3ē → Al0
- На аноде окисляются алюминат-ионы:
- Анод (+): 4AlO33– – 12ē → 2Al2O3 + 3O20
- Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
- 2Al2О3 = 4Al0 + 3О20
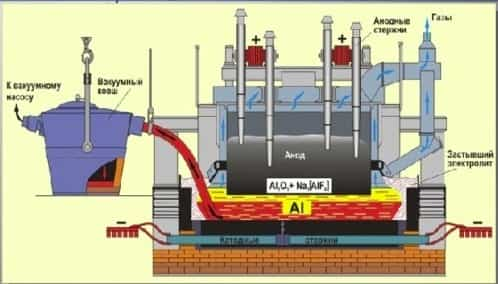
- В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
- C0 + О20 = C+4O2-2
Электролиз с растворимыми электродами
- Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
- Например, рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
- На катоде разряжаются ионы меди из раствора:
- Катод (–): Cu2+ + 2ē → Cu0
- На аноде окисляются частицы меди из электрода:
- Анод (+): Cu – 2ē → Cu2+
- Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами)
Применение электролиза в производстве металлов: в чем заключается процесс и его применения
Электролиз в промышленных масштабах используется для извлечения из металлосодержащих руд металлов и их очищения от примесей. При помощи этого физико-химического процесса на производстве получают медь и алюминий. Заряд химических источников тока (аккумуляторов) также происходит, благодаря протеканию этой реакции.
Определение электролиза
Химическая реакция, в результате которой на электродах происходит оседание компонентов из электролитических растворов веществ, и протекающая под действием электрического тока – вот что такое электролиз. Он включает в себя комплекс процессов окисления и восстановления, происходящих на электродах. Обязательным условием является движение постоянного тока от электрода к электроду.
В чём заключается процесс
Катод — определение и практическое применение
Технологический порядок электролиза, или ещё его называют гальванолизом, происходит по законам химии и физики. При этом берутся электропроводящие растворы (жидкости), в которых при помощи двух электродов организовано электрическое поле.
Внимание! Электроды имеют названия. Катод (К) – электрод, имеющий отрицательный потенциал, анод (А) – электрод с положительным потенциалом.
Ионы движутся упорядоченно через раствор, который носит название электролита.
При этом ионы, относящиеся к металлам, водороду (катионы) направляются к катоду, к аноду стремятся ионы, принадлежащие к кислотным остаткам или гидроксильной группы (анионы).
Катионы имеют положительный знак заряда, анионы – отрицательный. Пропускание электрического тока при электролизе может осуществляться, как через растворы, так и через расплавы электролитов.
Информация. При приготовлении электролита происходит диссоциация раствора на ионы. Это обусловлено взаимодействием растворителя на растворяемое вещество. Такая реакция называется первичной. Дальнейшее воздействие электрического тока на электролит вызывает вторичную реакцию гальванолиза.
Подобное разделение на первичность и вторичность позволило Майклу Фарадею обосновать законы, применяемые к гальванолизу.
Электролиз растворов
Использование воды для приготовления раствора электролита осложняет процесс. В растворах солей и щелочей вода ведёт себя при электролизе неоднозначно. Это проявляется в том, что H2O ведёт себя как окислитель, так и как восстановитель.
На катоде она получает электроны и восстанавливает атомы водорода до газообразной формы водорода. На аноде вода отдаёт отрицательно заряженные частицы, тогда атомы кислорода окисляются до газообразной формы кислорода.
Кислота, используемая в качестве раствора для электролита, лишена этой проблемы.
Катодные процессы
Катод, помещённый в растворы солей, притягивает к себе катионы металлов. Эти катионы выступают как окислители.
Важно! У отдельных металлов способности ионов окислять различны. Чтобы оценить способности окисления – восстановления, необходимо опираться на электрохимический ряд напряжений.
Электрохимический ряд металлов
У каждого металла (далее обозначен как М) свой электрохимический потенциал (ЭХП). Чем он меньше, тем восстановительные свойства выше, а окислительная способность у соответствующих ионов этого металла ниже.
ЭХП величина относительная, потому у отдельных ионов разная величина ЭХП. У водорода он равен нулю.
Во время процесса электролиза, протекающего в растворах солей, выявлены следующие замечания:
- когда в солях присутствуют активные М, то не они восстанавливаются на катоде, а водород;
- если М в электролите имеет среднюю активность, то на катоде разряжаются (восстанавливаются) оба: и водород, и М;
- при неактивном М на катоде восстанавливается только он, потому что его ион – более сильный окислитель, чем водородный ион.
Примерами таких процессов на катоде могут служить следующие реакции:
- при активном М: 2H2O +2ē → H2 + 2OH—;
- при М средней активности: Men+ + nē → Me0 и 2H+2O +2ē → H20 + 2OH—, где Ме – это растворённый металл;
- в случае неактивного М в солях: Men+ + nē → Me0.
Замечено, что, когда с катодом взаимодействуют водородные катионы H+, происходит их разряжение до молекул водорода — 2H+ + 2ē → H20
Анодные процессы
Плюс, поданный на анод, притягивает к себе анионы вместе с молекулами воды. В данном случае анод является окислителем, а восстановители – молекулы H2O или анионы кислотных остатков.
В процессе гальванолиза на аноде происходят следующие реакции:
- кислотные остатки, не содержащие кислорода, окисляются до нулевой степени окисления: неМеn- – nē = неМе0, где – неМе – это неметалл;
- при содержании в остатке кислорода окисляется вода и выделяет молекулы кислорода (молекулярный кислород О2): 2H2O-2 – 4ē → O20 + 4H+;
- в случае контакта с анодом гидроксид-иона последний также окисляется: 4O-2H– – 4ē → O20 + 2H2O, с выделением молекулярного кислорода.
Исключение. Фтор обладает электроотрицательностью более высокой, чем кислород. Поэтому электролиз растворов фторидов протекает с окислением молекул воды вместо фторид-ионов.
Суммарные процессы электролиза
Что получается в суммарной реакции гальванолиза, можно рассмотреть на примере хлорида натрия. При пропускании электрического тока на электродах происходит следующее:
- катод – на нём восстанавливается H – водород: 2H+2O +2ē → H20 + 2OH–;
- анод – на электроде происходит окисление хлорид-ионов: 2Cl– – 2ē → Cl20.
В этой реакции электролиза не принимают участия ионы натрия. Тем не менее, они входят в суммарное уравнение раствора хлорида натрия при электролизе. Оно имеет вид:
2H+2O + 2NaCl– → H20 + 2NaOH + Cl20.
Электролиз расплавов
Если сравнить гальванолиз расплавов и растворов, то в расплавах все М: активные, малоактивные и неактивные, реагируют на процесс электризации одинаково.
Внимание! Вода при электролизе расплавов в электролите отсутствует. Поэтому осложнений, связанных с её вмешательством, не возникает. Описание такой реакции можно рассмотреть на примере расплава NaCl (хлористого натрия).
- В этом случае на катоде происходит восстановление катионов Na:
- Na+ + ē → Na0.
- Анод вызывает окисление анионов Cl:
- 2Cl– – 2ē → Cl20.
- Общее уравнение гальванолиза расплава NaCl будет иметь вид:
- 2Na+Cl– → 2Na0 + Cl20.
Схема электролиза расплава NaCl
Электролиз с растворимыми электродами
В этом случае электролиз металлов осуществляется при помощи электродов, выполненных из того же М, который присутствует в электролите. Также электроды могут быть изготовлены из М активностью выше.
Важно! При протекании этого процесса на аноде восстанавливаются не анионы или молекулы H2O, а окисляется сам анод. Его частицы растворяются (окисляются) и восстанавливаются уже на катоде.
В случае с медным анодом при электролизе меди, где электролитом является сульфат меди, происходит следующее:
- ионы меди, входящие в раствор, восстанавливаются на катоде: Cu2+ + 2ē → Cu0;
- медный анод подвергается окислению своих частиц меди: Cu0 – 2ē → Cu2+.
Таким образом, если медную заготовку, имеющую примеси, использовать в качестве анода при гальванолизе в сульфате меди, то на катоде будет оседать медь в чистом виде. Анодный электрод при этом будет растворяться.
Электролиз с растворимыми анодами
Вот перечень некоторых металлов, которые могут быть растворимыми электродами:
- медь (Cu);
- серебро (Ag);
- цинк (Zn);
- кобальт (Co);
- олово (Sn);
- никель (Ni);
- кадмий (Cd).
На растворимом аноде в начальной стадии электролиза процессы проходят при минимальном стандартном потенциале на электроде. Если электролиз не остановить, то значение потенциала отклоняется в отрицательную сторону. Это вызвано поляризацией из-за пребывания на катоде электронов.
К сведению. Потенциалы электродов могут отклоняться от их изначального значения в ходе электролиза. Это явление называют поляризацией. Она бывает электрохимической и концентрационной.
Активные металлы
Это тот тип металлов, который легко вступает в реакции. В периодической таблице это элементы 1-й и 2-й группы. Так как металлические свойства у элементов становятся слабее в ряду слева направо, то к ним относятся:
- щелочные металлы: литий, калий, натрий, цезий, франций, рубидий;
- щелочноземельные элементы: бериллий, магний, кальций, стронций, барий, радий;
- алюминий.
Данные металлы имеют один или два валентных электрона и легко их отдают, являясь восстановителями. К отличительным особенностям активных металлов относятся:
- мягкость;
- лёгкость;
- низкая температура плавления.
При взаимодействии с кислородом (на воздухе) щелочных металлов возможно самовозгорание. Самовозгорание щелочноземельных металлов происходит при повышении температуры. При взаимодействии их с водой образуются щёлочь и водород, вступая в реакцию с кислотами, они образуют соли.
Менее активные металлы и неактивные металлы
Среднюю активность проявляют металлы, стоящие в ряду после алюминия Al и до водорода H2.
К неактивным относятся элементы, стоящие правее водорода: медь (Cu), ртуть (Hg), серебро (Ag), платина (Pt), золото (Au).
Таблица химической активности металлов
Практическое применение в производстве
Такой электрохимический процесс, как электролиз, примеры которого можно увидеть повсеместно, является неотъемлемой частью промышленности:
- получение химически чистого сырья: фтор, хлор, щёлочи, чистые водород и кислород и т.д.;
- применение электролиза в гидрометаллургии: переработка сырья с содержанием металлов;
- элекрорафинирование (применение растворимых анодов) для окончательной очистки металлов;
- электроэкстракция (использование нерастворимых анодов) для выделения нужных металлов из растворов;
- гальванические процессы: гальванопластика и гальваностегия.
Информация. Процессы электролиза не протекают бесконтрольно. В цепь электролизёра включают медный кулонометр. Единица измерений прибора – 1 Кл (кулон). В этом случае контролируется количество результата (продукта) анодных, катодных реакций при 100%-ном выходе по току, необходимому для прохождения реакций.
Гальваностегия – способ электрохимического покрытия металлических поверхностей другими металлами:
- сталь подвергают никелированию, хромированию, оцинкованию;
- медь покрывают серебром, никелем и иными металлами.
Поверхность основания обрабатывают так, чтобы покрытие держалось крепко и защищало конструкцию от влияния внешних факторов. В то же время изделиям придавался эстетический вид.
Гальванопластика позволяет получать точные копии заготовки, выполненные из благородных металлов. Широко используется при изготовлении матриц, копий со скульптур, ювелирных изделий, деталей сложной геометрии. При этом способе важно, чтобы заготовка отделилась от покрытия.
Украшения после гальванопластики
Электролиз открывает широкие возможности для работы с металлами и электролитами. При помощи этого процесса можно самостоятельно выполнять работы не только в области гальванотехники, но и получать чистые металлы в небольших количествах. При этом не стоит путать самопроизвольные химические реакции в гальванических элементах и реакции, протекающие в электролизёрах.
Видео
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Что такое электролиз? Для более простого понимания ответа на этот вопрос давайте представим себе любой источник постоянного тока. У каждого источника постоянного тока всегда можно найти положительный и отрицательный полюс:
Подсоединим к нему две химически стойких электропроводящих пластины, которые назовем электродами. Пластину, присоединенную к положительному полюсу назовем анодом, а к отрицательному катодом:
Далее, представьте, что у вас есть возможность опустить эти два электрода в расплав хлорида натрия:
Хлорид натрия является электролитом, при его расплавлении происходит диссоциация на катионы натрия и хлорид-ионы:
NaCl = Na+ + Cl−
Очевидно, что заряженные отрицательно анионы хлора направятся к положительно заряженному электроду – аноду, а положительно заряженные катионы Na+ направятся к отрицательно заряженному электроду – катоду.
В результате этого и катионы Na+ и анионы Cl− разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na+ и потери электронов в случае ионов Cl−.
То есть на катоде протекает процесс:
- Na+ + 1e− = Na0,
- А на аноде:
- Cl− − 1e− = Cl
- Поскольку каждый атом хлора имеет по неспаренному электрону, одиночное существование их невыгодно и атомы хлора объединяются в молекулу из двух атомов хлора:
- Сl∙ + ∙Cl = Cl2
- Таким образом, суммарно, процесс, протекающий на аноде, правильнее записать так:
- 2Cl− − 2e− = Cl2
- То есть мы имеем:
- Катод: Na+ + 1e− = Na0
- Анод: 2Cl− − 2e− = Cl2
- Подведем электронный баланс:
- Na+ + 1e− = Na0 |∙2
- 2Cl− − 2e− = Cl2 |∙1 2Na + Cl2
- Рассмотренный выше случай является с теоретической точки зрения наиболее простым, поскольку в расплаве хлорида натрия из положительно заряженных ионов были только ионы натрия, а из отрицательных – только анионы хлора.
- Другими словами, ни у катионов Na+, ни у анионов Cl− не было «конкурентов» за катод и анод.
А, что будет, например, если вместо расплава хлорида натрия ток пропустить через его водный раствор? Диссоциация хлорида натрия наблюдается и в этом случае, но становится невозможным образование металлического натрия в водном растворе. Ведь мы знаем, что натрий – представитель щелочных металлов – крайне активный металл, реагирующий с водой очень бурно. Если натрий не способен восстановиться в таких условиях, что же тогда будет восстанавливаться на катоде?
Давайте вспомним строение молекулы воды. Она представляет собой диполь, то есть у нее есть отрицательный и положительный полюсы:
Именно благодаря этому свойству, она способна «облеплять» как поверхность катода, так и поверхность анода:
- При этом могут происходить процессы:
- Катод:
- 2H2O + 2e− = 2OH− + H2
- Анод:
- 2H2O – 4e− = O2 + 4H+
- Таким образом, получается, что если мы рассмотрим раствор любого электролита, то мы увидим, что катионы и анионы, образующиеся при диссоциации электролита, конкурируют с молекулами воды за восстановление на катоде и окисление на аноде.
Так какие же процессы будут происходить на катоде и на аноде? Разрядка ионов, образовавшихся при диссоциации электролита или окисление/восстановление молекул воды? Или, возможно, будут происходить все указанные процессы одновременно?
В зависимости от типа электролита при электролизе его водного раствора возможны самые разные ситуации. Например, катионы щелочных, щелочноземельных металлов, алюминия и магния просто не способны восстановиться в водной среде, так как при их восстановлении должны были бы получаться соответственно щелочные, щелочноземельные металлы, алюминий или магний т.е. металлы, реагирующие с водой.
- В таком случае является возможным только восстановление молекул воды на катоде.
- Запомнить то, какой процесс будет протекать на катоде при электролизе раствора какого-либо электролита можно, следуя следующим принципам:
- 1) Если электролит состоит из катиона металла, который в свободном состоянии в обычных условиях реагирует с водой, на катоде идет процесс:
- 2H2O + 2e− = 2OH− + H2
- Это касается металлов, находящихся в начале ряда активности по Al включительно.
- 2) Если электролит состоит из катиона металла, который в свободном виде не реагирует с водой, но реагирует с кислотами неокислителями, идут сразу два процесса, как восстановления катионов металла, так и молекул воды:
- 2H2O + 2e− = 2OH− + H2
- Men+ + ne = Me0
- К таким металлам относятся металлы, находящиеся между Al и Н в ряду активности.
- 3) Если электролит состоит из катионов водорода (кислота) или катионов металлов, не реагирующих с кислотами неокислителями — восстанавливаются только катионы электролита:
- 2Н+ + 2е− = Н2 – в случае кислоты
- Men+ + ne = Me0 – в случае соли
- На аноде тем временем ситуация следующая:
- 1) Если электролит содержит анионы бескислородных кислотных остатков (кроме F−), то на аноде идет процесс их окисления, молекулы воды не окисляются. Например:
- 2Сl− − 2e = Cl2
- S2- − 2e = So
- Фторид-ионы не окисляются на аноде поскольку фтор не способен образоваться в водном растворе (реагирует с водой)
- 2) Если в состав электролита входят гидроксид-ионы (щелочи) они окисляются вместо молекул воды:
- 4ОН− − 4е− = 2H2O + O2
- 3) В случае того, если электролит содержит кислородсодержащий кислотный остаток (кроме остатков органических кислот) или фторид-ион (F−) на аноде идет процесс окисления молекул воды:
- 2H2O – 4e− = O2 + 4H+
- 4) В случае кислотного остатка карбоновой кислоты на аноде идет процесс:
- 2RCOO− − 2e− = R-R + 2CO2
- Давайте потренируемся записывать уравнения электролиза для различных ситуаций:
- Пример №1
- Напишите уравнения процессов протекающих на катоде и аноде при электролизе расплава хлорида цинка, а также общее уравнение электролиза.
- Решение
- При расплавлении хлорида цинка происходит его диссоциация:
- ZnCl2 = Zn2+ + 2Cl−
Далее следует обратить внимание на то, что электролизу подвергается именно расплав хлорида цинка, а не водный раствор. Другими словами, без вариантов, на катоде может происходить только восстановление катионов цинка, а на аноде окисление хлорид-ионов т.к. отсутствуют молекулы воды:
- Катод: Zn2+ + 2e− = Zn0 |∙1
- Анод: 2Cl− − 2e− = Cl2 |∙1
- ZnCl2 = Zn + Cl2
- Пример №2
- Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора хлорида цинка, а также общее уравнение электролиза.
Так как в данном случае, электролизу подвергается водный раствор, то в электролизе, теоретически, могут принимать участие молекулы воды. Так как цинк расположен в ряду активности между Al и Н то это значит, что на катоде будет происходить как восстановление катионов цинка, так и молекул воды.
- Катод:
- 2H2O + 2e− = 2OH− + H2
- Zn2+ + 2e− = Zn0
- Хлорид-ион является кислотным остатком бескислородной кислоты HCl, поэтому в конкуренции за окисление на аноде хлорид-ионы «выигрывают» у молекул воды:
- Анод:
- 2Cl− − 2e− = Cl2
- В данном конкретном случае нельзя записать суммарное уравнение электролиза, поскольку неизвестно соотношение между выделяющимися на катоде водородом и цинком.
- Пример №3
- Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора нитрата меди, а также общее уравнение электролиза.
- Нитрат меди в растворе находится в продиссоциированном состоянии:
- Cu(NO3)2 = Cu2+ + 2NO3−
- Медь находится в ряду активности правее водорода, то есть на катоде восстанавливаться будут катионы меди:
- Катод:
- Cu2+ + 2e− = Cu0
- Нитрат-ион NO3− — кислородсодержащий кислотный остаток, это значит, что в окислении на аноде нитрат ионы «проигрывают» в конкуренции молекулам воды:
- Анод:
- 2H2O – 4e− = O2 + 4H+
- Таким образом:
- Катод: Cu2+ + 2e− = Cu0 |∙2
- Анод: 2H2O – 4e− = O2 + 4H+ |∙1
- 2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+
Полученное в результате сложения уравнение является ионным уравнением электролиза. Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
- 2Cu(NO3)2 + 2H2O = 2Cu0 + O2 + 4HNO3
- Пример №4
- Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора ацетата калия, а также общее уравнение электролиза.
- Решение:
- Ацетат калия в водном растворе диссоциирует на катионы калия и ацетат-ионы:
- СН3СООК = СН3СОО− + К+
Калий является щелочным металлом, т.е. находится в ряду электрохимическом ряду напряжений в самом начале. Это значит, что его катионы не способны разряжаться на катоде. Вместо них восстанавливаться будут молекулы воды:
- Катод:
- 2H2O + 2e− = 2OH− + H2
- Как уже было сказано выше, кислотные остатки карбоновых кислот «выигрывают» в конкуренции за окисление у молекул воды на аноде:
- Анод:
- 2СН3СОО− − 2e− = CH3−CH3 + 2CO2
- Таким образом, подведя электронный баланс и сложив два уравнения полуреакций на катоде и аноде получаем:
- Катод: 2H2O + 2e− = 2OH− + H2 |∙1
- Анод: 2СН3СОО− − 2e− = CH3−CH3 + 2CO2 |∙1
- 2H2O + 2СН3СОО− = 2OH− + Н2+ CH3−CH3 + 2CO2
- Мы получили полное уравнение электролиза в ионном виде. Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
- 2H2O + 2СН3СООK = 2KOH + Н2+ CH3−CH3 + 2CO2
- Пример №5
- Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора серной кислоты, а также общее уравнение электролиза.
- Серная кислота диссоциирует на катионы водорода и сульфат-ионы:
- H2SO4 = 2H+ + SO42-
- На катоде будет происходить восстановление катионов водорода H+ , а на аноде окисление молекул воды, поскольку сульфат-ионы являются кислородсодержащими кислотными остатками:
- Катод: 2Н+ + 2e− = H2 |∙2
- Анод: 2H2O – 4e− = O2 + 4H+ |∙1
- 4Н+ + 2H2O = 2H2 + O2 + 4H+
- Сократив ионы водорода в левой и правой и левой части уравнения получим уравнение электролиза водного раствора серной кислоты:
- 2H2O = 2H2 + O2
- Как можно видеть, электролиз водного раствора серной кислоты сводится к электролизу воды.
- Пример №6
- Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора гидроксида натрия, а также общее уравнение электролиза.
- Диссоциация гидроксида натрия:
- NaOH = Na+ + OH−
- На катоде будут восстанавливаться только молекулы воды, так как натрий – высокоактивный металл, на аноде только гидроксид-ионы:
- Катод: 2H2O + 2e− = 2OH− + H2 |∙2
- Анод: 4OH− − 4e− = O2 + 2H2O |∙1
- 4H2O + 4OH− = 4OH− + 2H2 + O2 + 2H2O
- Сократим две молекулы воды слева и справа и 4 гидроксид-иона и приходим к тому, что, как и в случае серной кислоты электролиз водного раствора гидроксида натрия сводится к электролизу воды:
- 2H2O = 2H2 + O2






