Щелочные металлы
Сегодня мы поговорим о строении и свойствах атомов элементов I A группы, о физических и химических свойствах щелочных металлов, об основных соединениях щелочных металлов, истории открытия некоторых щелочных металлов и ещё много чего интересного.
Как вы помните, к щелочным металлам относятся элементы I A группы. Это литий, натрий, калий, рубидий, цэзий, франций. Франций является редким радиоактивным элементом.
Теперь рассмотрим строение и свойства атомов элементов I A группы.
Посмотрев в Периодическую таблицу, мы видим, что на внешнем энергетическом уроне у этих атомов один электрон, потому что все они расположены в I A группе, этот внешний электрон находится далеко от ядра, поэтому он легко отрывается и атом превращается в ион. Для всех элементов этой группы характерна только степень окисления +1.
Все щелочные металлы являются восстановителями из-за способности отдавать электроны. Причём восстановительные свойства сверху вниз в группе увеличиваются, так как увеличиваются радиусы атомов, металлические свойства также усиливаются сверху вниз. Элементы I A группы – типичные металлы.
Строение мы разобрали, а теперь поговорим о физических свойствах щелочных металлов.
Как вы уже знаете, это серебристо-белые мягкие металлы. Наиболее твёрдым является литий, но он также как и все щелочные металлы легко режется ножом.
Посмотрите таблицу, здесь указана температура плавления, температура кипения и плотность щелочных металлов.
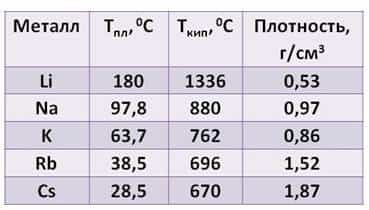
- Из таблицы видно:
- · плотность их увеличивается от лития к цезию
- · температура плавления, в отличие от плотности, уменьшается от лития к цезию
- · температура кипения тоже уменьшается от лития к цезию.
Все щелочные металлы лёгкие. Например, плотность лития примерно в два раза ниже плотности воды. А температура плавления цезия меньше температуры человеческого тела.
С физическими свойствами мы разобрались, теперь можем перейти и к химическим свойствам.
Элементы I A группы обладают очень высокой химической активностью. В лабораториях эти металлы хранят под слоем керосина, с которым они не взаимодействуют.
В реакции с кислородом оксид образует только литий, при этом образуется оксид лития, степень окисления лития +1, а кислорода -2. А натрий в реакции с кислородом образует пероксид натрия, в этом соединении, в отличие от оксида, степень окисления кислорода -1, а натрия степень окисления +1.
В реакцию с азотом при обычной температуре вступает только литий, при этом образуется нитрид лития, в этих бинарных соединениях степень окисления азота -3, а лития +1. Остальные щелочные металлы реагируют с азотом тольлко при нагревании.
В реакции с водородом щелочные металлы образуют гидриды. Так в реакции водорода с натрием образуется гидрид натрия. Степень окисления натрия +1, а водорода -1.
С галогенами щелочные металлы образуют галогениды. Так в реакции калия с бромом образуется бромид калия, где степень окисления калия +1, брома -1, в реакции натрия с хлором образуется хлорид натрия, где степень окисления натрия +1, а хлора -1.

С серой эти щелочные металлы образуют сульфиды. Например в реакции лития с серой образуется сульфид лития, где степень окисления лития +1, а серы -2.
- Как вы помните, все щелочные металлы активно реагируют с водой с образованием щелочей, при этом вода восстанавливается до водорода.
- Например, в результате взаимодействия натрия с водой образуется газ водород, который можно собрать методом вытеснения воздуха.
- Так в реакии натрия с водой образуется щёлочь – гидроксид натрия и выделяется водород.
- Причём скорость взаимодействия металла с водой будет увеличиваться от лития к цэзию, ведь металлические и восстановительные свойства также усиливаются.
Все щелочные металлы легко растворяются в растворах кислот с образованием соответствующих солей и водорода. Однако эти реакции проводят редко из-за того, что идут побочные реакции с водой. Например, в реакции калия с соляной кислотой образуется соль – хлорид калия и газ водород, в реакции натрия с серной кислотой образуется соль – сульфат натрия и газ водород.
Сами щелочные металлы получают путём электролиза расплавленных хлоридов или гидроксидов. Например, твёрдый хлорид натрия под действием электрического тока разлагается на металл натрий и газ – хлор.
- Вы убедились, что щелочные металлы обладают высокой химической активностью, поэтому в свободном виде они не встречаются, а только в виде соединений.
- Познакомимся с некоторыми из них.
Оксиды щелочных металлов – твёрдые вещества, обладают ярко выраженными основными свойствами, они реагируют с водой, кислотами и кислотными оксидами.
Так, в реакции оксида лития с водой образуется гидроксид лития, в реакции оксида натрия с серной кислотой образуется соль – сульфат натрия и вода, в результате взаимодействия оксида калия с оксидом углерода четыре, образуется соль – карбонат калия.
Оксиды натрия и калия получают, прокаливая пероксиды с соответствующими металлами. Это окислительно-восстановительная реакция, при которой кислород меняет свою степень окисления с минус -1 до -2, а натрий повышает свою степень окисления с 0 до +1.
Гидроксиды элементов I A группы – твёрдые белые вещества, хорошо растворимые в воде с образованием щелочей, очень гигроскопичны, поэтому расплываются на воздухе.
Растворы щелочей мыльные на ощупь. При растворении их в воде выделяется большое количество теплоты.
Гидроксиды щелочных металлов – сильные основания, они реагируют с кислотами, кислотными оксидами, солями, амфотэрными оксидами и гидроксидами.
Например, в рекции гидроксида калия с серной кислотой, образуетсся соль – сульфат калия и вода. В реакции гидроксида натрия с кислотным оксидом серы (VI) – образуется соль – сульфит натрия и вода.
В результате взаимодействия гидроксида натрия с солью сульфатом меди (II) , образуется соль – сульфат натрия и нерастворимое основание гидроксид меди (II). В реакции гидроксида калия с амфотэрным оксидом цинка, образуется соль – цинкат калия и вода.
В результате взаимодействия гидроксида калия с амфотэрным гидроксидом цинка в водной среде , образуется комплексная соль – тэтрагидроксоцинкат натрия.
Естественно, что гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов с водой или их оксидов с водой. При зиимодействии натрия с водой образуется гидроксид натрия и водород, в результате реакции оксида натрия с водой также образуется гидроксид натрия.
Рассморим свойства и применения соединений щелочных металлов.
Например, гидроксид натрия – NaOH – в технике известен как едкий натр, каустическая сода, а также каустик, а вот гидроксид калия – KOH называют в технике едкое кали. Оба этих гидроксида разъедают ткани и бумагу, поэтому их называют едкими щелочами.
Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, производства мыла и волокон, а едкое кали – для производства жидкого мыла.
Соли щелочных металлов – твёрдые кристаллические вещества с ионным типом кристаллической решётки. В прошлом из-за соли нередко вспыхивали войны и народные волнения (соляные бунты), а в некоторых странах куски соли служили разменной монетой.
- Рассмотрим наиболее значимые соли.
- Кристаллическую соду – Na2CO3 ∙ 10 H2O – используют при производстве стекла, бумаги, мыла, в быту и стиральных порошках.
- Питьевую соду – NaHCO3используют в быту и пищевой промышленности, а также в медицине.
- Поташ, или карбонат калия – K2CO3используют при производстве жидкого мыла, в качестве удобрения и получения тугоплавкого стекла.
- Кристаллогидрат сульфата натрия, или глауберова соль –
- Na2SO4 ∙ 10 H2O применяется для производства соды и стекла, в качестве слабительного средства.
Поваренная соль, или хлорид натрия – NaCl используется при производстве соляной кислоты, гидроксида натрия, хлора, натрия и соды, для консервирования, как приправа к пище, при производстве мыла. Хлорид натрия – галит содержится в моской воде и при высыхании морей образует мощные пласты каменной соли.
Биологическая роль ионов натрия и калия очень велика. Так, ионы натрия содержатся в крови и лимфе, ионы калия – основной внутриклеточный ион.
Соотношение концентраций этих ионов регулирует давление крови, обеспечивает перемещение растворов солей из корней в листья растений. В организме человека концентрация ионов калия внутри клеток выше, чем ионов натрия.
В межклеточном постранстве, наоборот, концентрация ионов натрия выше, чем ионов калия. Различные концентрации этих ионов внутри и снаружи клеток позволяет регулировать водные потоки через мембраны.
Кроме этого, калий поддерживает работу сердечной мышцы.
Взрослому человеку в сутки необходимо три с половиной грамма калия. Калий содержится в кураге, сое, фасоле, зелёном горошке, черносливе, изюме и других продуктах.
Ребята, решите интересную задачу. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
В условии задачи нам сказано, что в 100 г кураги содержится 2,034 г калия, а в сутки человеку необходимо 3,5 г калия. Найти необходимо массу кураги.
Для решения этой задачи составим выражение: 2 г калия содержится в 100 г кураги, 3,5 г калия содержится в Х граммах кураги, найдём Х. Для этого 3,5 умножим на 100 и разделим на 2,034, получаем 172 г.
Для того, чтобы получить суточную норму калия человеку необходимо съесть 172 г кураги.
Калий нужен и растениям. Он является одним из элементов питания. Ежегодно большое количество калия уходит из почвы. Недостаток калия в почве, понижает интенсивность фотосинтеза. Это приводит:
- · к уменьшению содержания сахаров в корнеплодах свёклы и крахмала в зерне
- · отмиранию листьев растений
- · повышению восприимчивости к грибковых и бактериальным заболеваниям
- · снижению всхожести семян.
- Поэтому для получения высоких урожаев сельскохозяйственных культур необходимо внесение калийных удобрений, таких солей калия, как хлорид, нитрат, карбонат, сульфат калия.
- Соли щелочных металлов окрашивают пламя в различные цвета: литий – в карминово-красный цвет, натрий – в жёлтый, калий, рубидий и цэзий – в фиолетовый.
Для того чтобы это доказать, проведём лабораторный опыт. Возьмём лучинку и закрепим на ней спираль из проволоки. Обмакнём её сначала в соляную кислоту, затем в сухую соль натрия и поднесём к пламени спиртовки. Пламя, окрашивается в жёлтый цвет.
Сейчас возмём лучинку со спиралью из проволоки, обмакнём в кислоту, но теперь поместим в сухую соль калия и поднесём к пламени спиртовки. Пламя окрашивается в фиолетовый цвет.
Открытии щелочных металлов. Так, литий был открыт в 1817 году шведским химиком Арфвэдсоном и назван литием, так как литос от греческого означает камень, потому что он был обнаружен в камне.
Натрий и калий был получен английским химиком Дэви в 1807 году при электролизе едких щелочей. Натрий от арабского натрун означает сода, а калий от арабского алкали – щёлочь.
Сделаем вывод: щелочные металлы – это элементы I А группы, у них один электрон на внешнем энергетическом уровне. Все они – восстановители, проявляют степень окисления равную +1.
Это мягкие металлы и легко режутся ножом, у них сравнительно невысокие температуры плавления, они обладают высокой химической активность, реагируют с простыми и сложными веществами .
Их получают в результате электролиза расплавов, встречаются в природе только в виде соединений, соединения щелочных металлов имеют большое значение в жизни человека и в народном хозяйстве.
Натрий и калий [1986 Николаев Л.А. — Металлы в живых организмах]
Оба эти элемента находятся в первой группе системы Менделеева — они соседи и во многих отношениях похожи друг на друга. Активные, типичные металлы, атомы которых легко расстаются со своим единственным внешним электроном, переходя в ионное состояние, эти элементы образуют многочисленные соли, широко распространенные в природе.
Однако более внимательное исследование обнаруживает, что биологические функции натрия и калия не одинаковы. Соли калия лучше поглощаются почвенным комплексом, поэтому в тканях растений оказывается относительно больше калия, тогда как соли натрия преобладают в морской воде.
В биологических машинах оба эти иона иногда действуют совместно, иногда прямо противоположным образом.
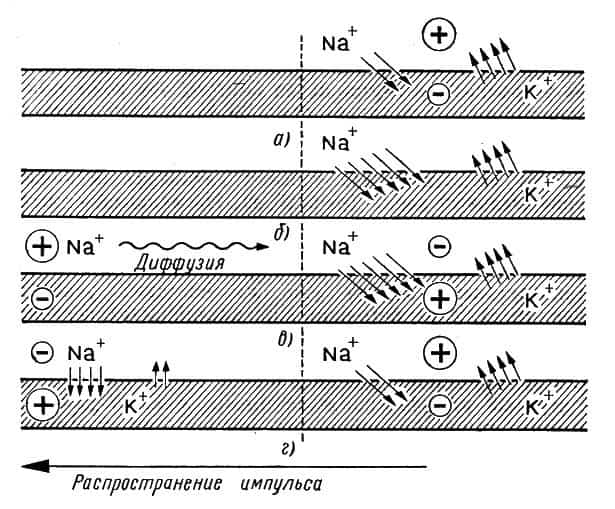 Рис. 20. Распространение нервного импульса: а — ионы калия покидают нервное волокно быстрее, чем ионы натрия входят в него; б — диффузия ионов натрия усиливается; в — на внешней стороне нервного волокна возникает отрицательный заряд; г — исходное состояние восстанавливается, но отрицательный заряд появляется слева — в направлении распространения нервного импульса
Рис. 20. Распространение нервного импульса: а — ионы калия покидают нервное волокно быстрее, чем ионы натрия входят в него; б — диффузия ионов натрия усиливается; в — на внешней стороне нервного волокна возникает отрицательный заряд; г — исходное состояние восстанавливается, но отрицательный заряд появляется слева — в направлении распространения нервного импульса
В распространении по нерву электрических импульсов принимают участие оба иона. В покоящемся нерве, во внутренней его части, сосредоточен отрицательный заряд (рис. 20, а), а на внешней стороне — положительный; концентрация ионов калия больше концентрации ионов натрия внутри нерва.
При раздражении изменяется проницаемость мембраны нервного волокна, и ионы натрия устремляются внутрь нерва быстрее, чем ионы калия успевают выходить оттуда (рис. 20, б).
В результате на внешней стороне нервного волокна появляется отрицательный заряд (там не хватает катионов), а внутри нерва (где имеется теперь избыток катионов) возникает положительный заряд (рис. 20, в).
На внешней стороне волокна начинает происходить диффузия ионов натрия от соседних участков к тому, который обеднен ионами этого металла. Энергичная диффузия ведет к появлению отрицательного заряда уже на соседних участках (рис. 20, г), а на исходном восстанавливается первоначальное состояние.
Таким образом, состояние поляризации (плюс — внутри, минус — снаружи) передвинулось по нервному волокну. Дальше все процессы повторяются, и нервный импульс довольно быстро распространяется по всему нерву. Следовательно, механизм распространения электрического импульса по нерву обусловлен различной проницаемостью мембраны нервного волокна по отношению к ионам натрия и калия.
Вопрос о проницаемости мембран клеток для тех или иных веществ крайне важен. Прохождение вещества через биологическую мембрану далеко не всегда напоминает простую диффузию через пористую перегородку.
Так, например, глюкоза и другие углеводы проходят через мембрану эритроцита с помощью специального переносчика, который проводит молекулы через мембрану.
При этом должны выполняться специальные условия — молекула углевода должна иметь определенную форму, она должна быть изогнута так, чтобы ее контур приобрел очертания кресла, иначе перенос может не состояться. Концентрация углеводов во внешней среде больше, чем внутри эритроцита, поэтому такой перенос называют пассивным.
Бывают случаи, когда мембрана наглухо закрывается для определенных ионов: в частности, в митохондриях внутренняя мембрана вообще не пропускает ионов калия.
Однако эти ионы попадают внутрь митохондрии, если в окружающей среде имеются антибиотики валиномицин или грамицидин.
Валиномицин специализируется, главным образом, на ионах калия (может переносить и ионы рубидия и цезия), а грамицидин переносит, кроме калия, также ионы натрия, лития, рубидия и цезия.
Было выяснено, что молекулы таких проводников имеют форму баранки, радиус отверстия которой таков, что внутри баранки помещается ион калия, натрия или другого щелочного металла. Эти антибиотики назвали ионофорами («носителями ионов»). На рис. 21 показаны схемы переноса ионов сквозь мембрану молекулами валиномицина и грамицидина.
Весьма вероятно, что то токсическое действие, которое антибиотики оказывают на различные микроорганизмы, как раз и связано с тем, что в их присутствии мембраны начинают пропускать внутрь те ионы, которым быть там не полагается; это нарушает работу химических систем клетки микроорганизма и ведет к ее гибели или к серьезным расстройствам, прекращающим ее размножение.
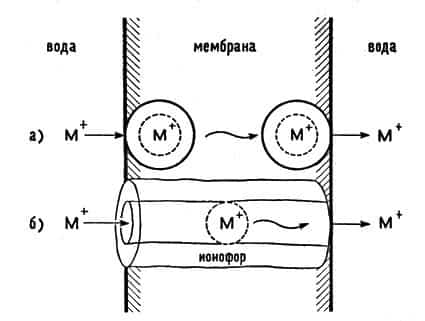 Рис. 21. Схема работы переносчиков ионов — ионофоров: а — подвижный переносчик (валиномицин); б — перенос с помощью канала (грамицидин)
Рис. 21. Схема работы переносчиков ионов — ионофоров: а — подвижный переносчик (валиномицин); б — перенос с помощью канала (грамицидин)
Существенную роль в биологических машинах играют активные переносы через мембраны (см. гл. 8). Возникает вопрос: откуда же черпается энергия, необходимая для активного переноса, и можно ли осуществить его без специального переносчика?
Что касается энергии, то в конечном счете она доставляется все теми же универсальными молекулами АТФ или креатинфосфатом, гидролиз которых сопровождается освобождением больших количеств энергии. А вот относительно переносчиков вопрос менее ясен, хотя несомненно, что без ионов металлов калия и натрия здесь не обойтись.
Концентрация различных веществ в клетке (белковых и минеральных) выше, чем в окружающей среде; по этой причине чаще всего клетка оказывается под угрозой чрезмерного проникновения в нее воды (в результате осмоса).
Для того чтобы избавиться от этого, клетка выкачивает ионы натрия в окружающую среду и тем самым выравнивает осмотическое давление. По этой причине концентрация ионов натрия в клетке меньше, чем в среде. Здесь опять обнаруживается различие между натрием и калием.
Удаляется натрий, и концентрация ионов калия оказывается относительно больше внутри клетки. Так, эритроцит содержит калия примерно в пять раз больше, чем натрия.
И в мышцах велико содержание калия: на 100 г сырой мышечной ткани калия содержится 366 мг, а натрия 65 мг. Калий в мышцах облегчает переход глобулярной формы актина в фибриллярную, которая и соединяется с миозином (см. выше).
Известны некоторые случаи, когда фермент, активируемый ионом калия, подавляется ионами натрия, и наоборот. Поэтому открытие фермента, для действия которого необходимы оба иона, привлекло внимание биохимиков. Фермент этот ускоряет гидролиз АТФ и называется (K + Na) АТФ-аза. Для понимания его роли и механизма действия надо опять обратиться к процессам переноса.
Как мы уже указывали, внутри клеток повышена концентрация ионов калия, а в окружающей клеточной среде относительно больше натрия. Выкачивание ионов натрия из клетки ведет к усиленному поступлению в клетку ионов калия, а также и других веществ (глюкозы, аминокислот).
Ионы натрия и калия могут обмениваться по принципу «ион на ион», и тогда не возникает разности потенциалов по обе стороны клеточной мембраны. Но если внутри клетки оказывается больше ионов калия, чем оттуда ушло ионов натрия, возможно возникновение скачка потенциалов (около 100 мВ); система выкачивания натрия называется «натриевым насосом».
Если при этом появляется разность потенциалов, то применяют термин «электрогенный натриевый насос».
Введение больших количеств ионов калия в клетку оказывается необходимым, так как ионы калия способствуют синтезу белка (в рибосомах), а также ускоряют процесс гликолиза.
В мембране клетки и располагается (K + Na) АТФ-аза — белок с молекулярной массой 670 000, который до сих пор не удалось отделить от мембран. Этот фермент гидролизует АТФ, а энергия гидролиза используется для переноса в направлении роста концентрации.
Замечательным свойством (К + Na) АТФ-азы является то, что она в процессе гидролиза АТФ активируется изнутри клетки ионами натрия (и тем обеспечивает выведение натрия), а снаружи клетки (со стороны среды) — ионами калия (облегчая их введение в клетку); в итоге и происходит необходимое клетке распределение ионов этих металлов. Интересно отметить, что ионы натрия в клетке никакими другими ионами заменить нельзя. АТФ-аза активируется изнутри только ионами натрия, но ионы калия, действующие снаружи, можно заменить на ионы рубидия или аммония.
Для функций отдельных органов, в частности сердца, имеет значение не только концентрация ионов калия, натрия, кальция и магния, но и их отношение, которое должно лежать в определенных пределах.
Отношение концентраций этих ионов в крови человека не слишком отличается от соответствующего отношения, характерного для морской воды.
Возможно, что биологическая эволюция от первых форм жизни, возникших в водах первичного океана или на его отмелях, до ее высших форм, сохранила некоторые химические «отпечатки» далекого прошлого…
Возвращаясь к началу этой главы, мы снова вспоминаем о многофункциональности ионов, об их способности выполнять в организмах самые разнообразные обязанности. Кальций, натрий, калий, а также кобальт проявляют эту способность неодинаковым образом.
Кобальт образует прочный комплекс корринового типа, и уже этот комплекс катализирует разнообразные реакции. Кальций, натрий, калий выполняют функции активаторов.
А вот ион магния может действовать и как активатор, и как составная часть прочного комплексного соединения — хлорофилла, одного из самых важных соединений, созданных природой.
Выдающийся ученый К. А. Тимирязев посвятил хлорофиллу труд, названный им «Солнце, жизнь и хлорофилл», указав в нем, что именно хлорофилл и есть то звено, которое связывает процессы выделения энергии на Солнце с жизнью на Земле.
В следующей главе мы и рассмотрим свойства этого интересного соединения.
С. Т. Жуков Химия 8-9 класс Глава 14. Химия s-элементов. Натрий и калий. Магний и кальций
С. Т. Жуков Химия 8-9 класс
| [предыдущий раздел] | [содержание] | [следующий раздел] |
14.1. Общая характеристика элементов IA и IIA групп
В IA группу входят литий, натрий, калий, рубидий и цезий. Эти элементы называют щелочными элементами. В эту же группу входит искусственно полученный малоизученный радиоактивный (неустойчивый) элемент франций.
Иногда в IA группу включают и водород (см.главу 10). Таким образом, в эту группу входят элементы каждого из 7 периодов. Во IIA группу входят бериллий, магний, кальций, стронций, барий и радий.
Последние четыре элемента имеют групповое название – щелочноземельные элементы.
Говоря о том, сколь часто встречаются природе атомы того, или иного элемента, обычно указывают его распространенность в земной коре. Под земной корой понимают атмосферу, гидросферу и литосферу нашей планеты.
Так, в земной коре наиболее распространены четыре из этих тринадцати элементов: Na (w =2,63 %), K (w = 2,41 %), Mg (w = 1,95 %) и Ca (w = 3,38 %).
Остальные встречаются значительно реже, а франций вообще не встречается.
Орбитальные радиусы атомов этих элементов (кроме водорода) изменяются от 1,04 А (у бериллия) до 2,52 А (у цезия), то есть у всех атомов превышают 1 ангстрем. Это приводит к тому, что все эти элементы представляют собой элементы, образующие истинные металлы, а бериллий – элемент, образующий амфотерный металл.
Общая валентная электронная формула элементов IA группы – ns1, а элементов IIА группы – ns2.
Большие размеры атомов и незначительное число валентных электронов приводят к тому, что атомы этих элементов (кроме бериллия) склонны отдавать свои валентные электроны. Наиболее легко отдают свои валентные электроны атомы элементов IA группы (см. приложение 6), при этом из атомов щелочных элементов образуются однозарядные катионы, а из атомов щелочноземельных элементов и магния – двухзарядные катионы. Степени окисления в соединениях у щелочных элементов равна +I, а у элементов IIA группы – +II.
Простые вещества, образуемые атомами этих элементов, – металлы. Литий, натрий, калий, рубидий, цезий и франций называют щелочными металлами, так как их гидроксиды представляют собой щелочи. Кальций, стронций и барий называют щелочноземельными металлами. Химическая активность этих веществ увеличивается по мере увеличения атомного радиуса.
Из химических свойств этих металлов наиболее важны их восстановительные свойства. Щелочные металлы – сильнейшие восстановители. Металлы элементов IIA группы также довольно сильные восстановители. Все они (кроме бериллия) реагируют с водой (магний при кипячении):
2M + 2H2O = 2M aq + 2OHaq + H2 ,
M + 2H2O = M2 + 2OH + H2 .
- В случае магния, кальция и стронция из-за малой растворимости образующихся гидроксидов реакция сопровождается образованием осадка:
- M2 + 2OH = Mg(OH)2
- Щелочные металлы реагируют с большинством неметаллов: 2M + H2 = 2MH (при нагревании), 4M + O2 = 2M2O (M – Li), 2M + Cl2 = 2MCl (при обычных условиях), 2M + S = M2S (при нагревании).
Из щелочных металлов, сгорая в кислороде, обычный оксид образует только литий. Остальные щелочные металлы образуют пероксиды (M2O2) или надпероксиды (MO2 – соединения, содержащие надпероксид-ион с формальным зарядом –1 е). Как и щелочные металлы, металлы элементов IIA группы реагируют со многими неметаллами, но при более жестких условиях:
M + H2 = MH2 (при нагревании; кроме бериллия),
2M + O2 = 2MO (при обычных условиях; Be и Mg – при нагревании), M + Cl2 = MCl2 (при обычных условиях), M + S = MS (при нагревании). В отличие от щелочных металлов с кислородом они образуют обычные оксиды. С кислотами спокойно реагирует только магний и бериллий, остальные простые вещества очень бурно, часто со взрывом. Бериллий реагирует с концентрированными растворами щелочей:
- Be + 2OH + 2H2O = [Be(OH)4]2 + H2
- В соответствии с положением в ряду напряжений с растворами солей реагируют только бериллий и магний, остальные металлы в этом случае реагируют с водой. Являясь сильными восстановителями, щелочные и щелочноземельные металлы восстанавливают многие менее активные металлы из их соединений, например, при нагревании протекают реакции:
- 4Na + MnO2 = 2Na2O + Mn;
2Ca + SnO2 = 2CaO + Sn. Общий для всех щелочных металлов и металлов IIA группы промышленный способ получения – электролиз расплавов солей.
Кроме бериллия оксиды всех рассматриваемых элементов – основные оксиды, а гидроксиды – сильные основания (у бериллия эти соединения амфотерные, гидроксид магния – слабое основание).
Усиление основных свойств гидроксидов с увеличением порядкового номера элемента в группе легко прослеживается в ряду гидроксидов элементов IIA группы. Be(OH)2 – амфотерный гидроксид, Mg(OH)2 – слабое основание, Ca(OH)2, Sr(OH)2 и Ba(OH)2 сильные основания, но с увеличением порядкового номера растет их растворимость, и Ba(OH)2 уже можно отнести к щелочам.
НАДПЕРОКСИДЫ 1.Составьте сокращенные электронные формулы и энергетические диаграммы атомов элементов IA и IIA групп. Укажите внешние и валентные электроны. 2.По каким причинам водород помещают в IA группу, а по каким – в VIIA группу?
3.Составьте уравнения реакций следующих веществ с избытком кислорода: Li, Na, K, LiH, NaH, Li3N, Na2C2.
4.Кристаллы некоторого вещества состоят из однозарядных ионов. В состав каждого иона входит по 18 электронов. Составьте а) простейшую формулу вещества; б) сокращенные электронные формулы ионов; в) уравнение одной из реакций получения этого вещества; г) два уравнения реакций с участием этого вещества.
| [предыдущий раздел] | [содержание] | [следующий раздел] |
14.2. Натрий и калий
Натрий и калий – важнейшие щелочные элементы. Простые вещества, образуемые этими элементами, – мягкие легкоплавкие серебристые металлы, легко режутся ножом, быстро окисляются на воздухе. Хранят их под слоем керосина. Температура плавления натрия 98 °С, а калия 64 °С. Оксиды этих элементов типичные основные оксиды.
Они очень гигроскопичны: поглощая воду, превращаются в гидроксиды. Гидроксиды натрия и калия – щелочи. Это твердые бесцветные кристаллические вещества, плавящиеся без разложения. Как и оксиды, они очень гигроскопичны: поглощая воду, превращаются в концентрированные растворы.
Как твердые гидроксиды, так и их концентрированные растворы – очень опасные вещества: при попадании на кожу вызывают труднозаживающие язвы, вдыхание их пыли приводит к поражению дыхательных путей.
Гидроксид натрия (тривиальные названия – едкий натр, каустическая сода) относится к важнейшим продуктам химической промышленности – с его помощью создается щелочная среда во многих химических производствах. Гидроксид калия (тривиальное название – «едкое кали») используют для производства других соединений калия.
Большинство средних солей натрия и калия термически устойчивые вещества и разлагаются только при очень высоких температурах. При умеренном нагревании разлагаются только соли галогенсодержащих оксокислот, нитраты и некоторые другие соединения:
NaClO4 = NaCl + 2O2 ; 8NaClO3 = 6NaClO4 + 2NaCl; 2NaNO3 = 2NaNO2 + O2 ; Na2[Zn(OH)4] = Na2ZnO2 + 2H2O .
Кислые соли
менее устойчивы, при нагревании все они разлагаются:
2NaHS = Na2S + H2S ; 2NaHSO4 = Na2S2O7 + H2O ; 2NaHCO3 = Na2CO3 + H2O + CO2 ; NaH2PO4 = NaPO3 + H2O ; Na2HPO4 = Na4P2O7 + H2O .
Основных солей
эти элементы не образуют.
Из солей наибольшее значение имеет хлорид натрия – поваренная соль. Это не только необходимая составная часть пищи, но и сырье для химической промышленности. Из него получают гидроксид натрия, питьевую соду (NaHCO3), соду (Na2CO3) и многие другие соединения натрия. Соли калия – необходимые минеральные удобрения.
Почти все соли натрия и калия растворимы, поэтому доступных качественных реакций на ионы этих элементов не.
(Качественными реакциями называют химические реакции, позволяющие обнаружить в соединении атомы или ионы какого-либо химического элемента, доказав при этом, что обнаружен именно эти атомы или ионы, а не какие-нибудь другие, похожие на них по химическим свойствам.
Также называют реакции, позволяющие обнаружить какое-либо вещество в смеси) Определить наличие в соединении ионов натрия или калия можно по окрашиванию бесцветного пламени при внесении в него исследуемого образца: в случае натрия пламя окрашивается в желтый цвет, а в случае калия – в фиолетовый.
КАЧЕСТВЕННЫЕ РЕАКЦИИ Составьте уравнения реакций, характеризующих химические свойства а) натрия, б) гидроксида калия, в) карбоната натрия, г) гидросульфида натрия. Окрашивание пламени солями натрия и калия
| [предыдущий раздел] | [содержание] | [следующий раздел] |
14.3. Магний и кальций
Простые вещества
магний и кальций – металлы. Кальций быстро окисляется на воздухе, а магний в этих условиях значительно устойчивее – он окисляется лишь с поверхности. Кальций хранят под слоем керосина. Температуры плавления магния и кальция – 650 и 851 °С соответственно. Магний и кальций значительно более твердые вещества, чем щелочные металлы. Невысокая плотность магния (1,74 г/см3) при значительной прочности дает возможность использовать его сплавы в авиационной промышленности. И магний, и кальций – сильные восстановители (особенно при нагревании). Их часто используют для восстановления других, менее активных, металлов из их оксидов (магний – в лаборатории, а кальций – в промышленности).
Магний и кальций – одни из немногих металлов реагирующих с азотом. При нагревании они образует с ним нитриды Mg3N2 и Ca3N2. Поэтому, сгорая на воздухе, магний и кальций превращаются в смесь оксидов с нитридами.
Кальций легко реагирует с водой, а магний – только при кипячении. В обоих случаях выделяется водород и образуются малорастворимые гидроксиды.
Оксиды магния и кальция – ионные вещества; по химическому поведению они – основные оксиды. Оксид магния с водой не реагирует, а оксид кальция (тривиальное название – «негашеная известь») реагирует бурно с выделением теплоты. Образующийся гидроксид кальция в промышленности называют «гашеной известью».
Гидроксид магния нерастворим в воде, тем не менее он является основанием. Гидроксид кальция заметно растворим в воде; его насыщенный раствор называют «известковой водой», это щелочной раствор (изменяет окраску индикаторов). Гидроксид кальция в сухом, а особенно во влажном состоянии поглощает углекислый газ из окружающего воздуха и превращается в карбонат кальция. Это свойство гашеной извести много веков использовалось в строительстве: гашеная известь как основной компонент входила в состав строительных известковых растворов, в настоящее время почти полностью замененных цементными. Оба гидроксида при умеренном нагревании, не плавясь, разлагаются. Соли магния и особенно кальция входят в состав многих породообразующих минералов. Из этих горных пород наиболее известны мел, мрамор и известняк, основным веществом которых является карбонат кальция. Карбонаты кальция и магния при нагревании разлагаются на соответствующие оксиды и углекислый газ. С водой, содержащей растворенный диоксид углерода, эти карбонаты реагируют, образуя растворы гидрокарбонатов, например:
- MCO3 + CO2 + H2O = M2 + 2HCO3.
- При нагревании, и даже при попытке выделить гидрокарбонаты из раствора, удаляя воду при комнатной температуре, они разлагаются по обратной реакции:
- M2 + 2HCO3 = MCO3 + CO2 + H2O.
Гидратированный сульфат кальция CaSO4·2H2O представляет собой бесцветное кристаллическое вещество малорастворимое в воде. При нагревании оно частично обезвоживается, переходя в кристаллогидрат состава 2CaSO4·H2O. Тривиальное название двуводного гидрата – гипс, а полуводного – алебастр.
При смешивании алебастра с водой он гидратируется, при этом образуется плотная твердая масса гипса. Это свойство алебастра используется в медицине (гипсовые повязки) и строительстве (армированные гипсовые перегородки, заделка дефектов). Скульпторы используют алебастр для изготовления гипсовых моделей и форм. Карбид (ацетиленид) кальция CaC2.
Структурная формула (Ca2)(CC). Получают спеканием негашеной извести с углем:
- CaO + 3C = CaC2 + CO
- Это ионное вещество не является солью и полностью гидролизуется водой с образованием ацетилена, который долгое время и получали таким способом:
- CaC2 + 2H2O = C2H2 + Ca(OH)2.
Гидратированный ион магния [Mg(H2O)6]2 – катионная кислота (см. приложение 13), поэтому растворимые соли магния подвергаются гидролизу. По этой же причине магний может образовывать основные соли, например, Mg(OH)Cl. Гидратированный ион кальция не является катионной кислотой.
Кальций в соединении может быть обнаружен по окрашиванию пламени. Цвет пламени – оранжево-красный.
Качественная реакция на ионы Ca2, Sr2 и Ba2, не позволяющая однако различить эти ионы между собой – осаждение соответствующих сульфатов разбавленным раствором серной кислоты (или любым раствором сульфата в кислотной среде):
M2 + SO42 = MSO4.
1.Почему магний и кальций не образуют однозарядных ионов? 2.Составьте уравнения всех реакций, приведенных параграфе описательно. 3.Составьте уравнения реакций, характеризующих химические свойства а) кальция, б) оксида кальция, в) гидроксида магния, г) карбоната кальция, д) хлорида магния.
Исследование свойств соединений магния и кальция
| [предыдущий раздел] | [содержание] | [следующий раздел] |
14.4. Жесткость воды и методы ее устранения
Природная вода в той, или иной степени содержит ионы растворимых солей. Если в пресной воде суммарная концентрация ионов Mg2 и Ca2 превышает 2 ммоль/л, то такую воду называют жесткой (если не превышает, то – мягкой). В качестве анионов в жесткой воде могут содержаться HCO3, SO42, Cl и другие ионы.
При нагревании жесткой воды из нее выделяются карбонаты магния и кальция, а при кипячении – еще и сульфаты. Образующийся плотный осадок часто называют «накипью». Именно он появляется на внутренних поверхностях чайников.
В промышленности этот осадок образуется на стенках котлов, снижая их теплопроводность, и трубопроводов, уменьшая их внутренний диаметр.
При стирке в жесткой воде с использованием мыла его расход сильно возрастает, а качество стирки снижается, так как из раствора мыла (натриевых солей некоторых органических кислот) выделяются нерастворимые кальциевые и магниевые соли. При использовании синтетических стиральных порошков этот эффект не наблюдается.
Различают временную (карбонатную) жесткость, устраняемую кипячением, и постоянную (некарбонатную), сохраняющуюся после кипячения воды.
Устранение жесткости заключается в удалении из нее ионов Mg2 и Ca2. Временная жесткость устраняется кипячением. Для устранения общей жесткости в воду добавляют различные реагенты:
1. Гашеную известь Ca(OH)2.
Ca2 + HCO2 +OH = CaCO3 + H2O Mg2 + 2HCO3 + Ca2 + 2OH = MgCO3 + CaCO3 + 2H2O Mg2 + 2OH = Mg(OH)2
2. Соду Na2CO3. M2 +CO32 = MCO3
3. Фосфат натрия Na2PO4. 3M2 + 2PO43 = M3(PO4)2
Фосфаты кальция и магния менее растворимы, чем карбонаты. Поэтому применение фосфата натрия приводит к более полному устранению жесткости. Современный способ устранения жесткости основан на применении ионообменных смол (ионитов).
Иониты представляют собой полимерные кислоты RHn (катиониты) и полимерные основания R(OH)n (аниониты).
При пропускании растворов солей через трубки (ионообменники), заполненные зернами ионитов, протекают реакции, называемые реакциями ионного обмена: катиониты как бы обменивают свои атомы водорода на катионы (отсюда и их название), а аниониты – гидроксильные группы на анионы:
RHn + (n/2)M2 + nH2O = RMn/2 + nH3O, R(OH)n + nA = RAn + nOH.
Последовательно пропуская жесткую воду через ионообменник, заполненный катионитом, и ионообменник, заполненный анионитом, жесткость можно устранить полностью. Таким способом можно очистить не только жесткую, но и морскую воду, что иногда и делается для ее опреснения. В промышленности иониты используют для получения чистой (деионизированной) воды вместо дистиллированной.
ЖЕСТКОСТЬ ВОДЫ,ЖЕСТКАЯ ВОДА,МЯГКАЯ ВОДА, ВРЕМЕННАЯ ЖЕСТКОСТЬ, ПОСТОЯННАЯ ЖЕСТКОСТЬ, ИОНООБМЕННЫЕ СМОЛЫ (ИОНИТЫ), КАТИОНИТ, АНИОНИТ, ИОНООБМЕННИК, РЕАКЦИЯ ИОННОГО ОБМЕНА. Составьте молекулярные уравнения реакций, ионные уравнения которых приведены в тексте параграфа.
| [предыдущий раздел] | [содержание] | [следующий раздел] |






