
АБВГДЕЖЗИКЛМНОПРСТУФХЦЧШЩЭЮЯ
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ,разностьэлектростатич. потенциалов между электродоми находящимся с ним в контактеэлектролитом. Возникновение электродного потенциала обусловлено пространств.
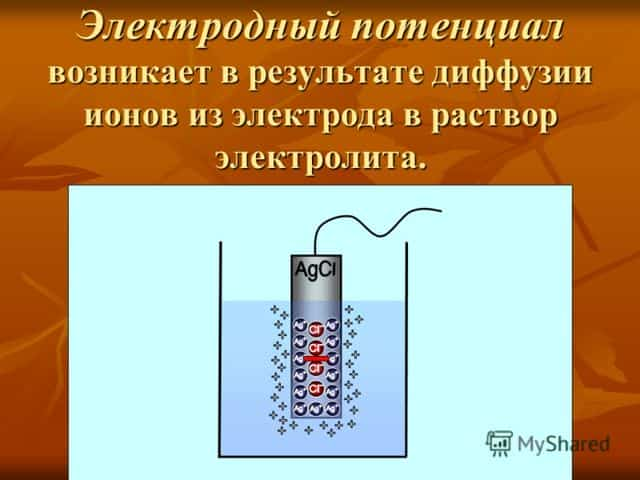
разделениемзарядов противоположного знака на границе раздела фаз и образованиемдвойногоэлектрического слоя. На границе между металлич. электродоми р-ромэлектролитапространств.
разделение зарядов связано со след. явлениями:переносом ионовиз металлав р-р в ходе установления электрохим. равновесия,кулоновской адсорбциейионовиз р-ра на пов-сть металла, смещением электронногогазаза пределы положительно заряженного ионного остова кристаллич.
решетки,специфич. (некулоновской) адсорбциейионовили полярных молекулр-рителяна электродеи др. Последние два явления приводят к тому, что электродный потенциал неравен нулю даже при условиях, когда заряд пов-сти металларавен нулю (см.Потенциалнулевого заряда).Абс.
величину электродного потенциала отдельного электродаопределить невозможно, поэтому измеряют всегда разность потенциалов исследуемогоэлектродаи нек-рого стандартного электрода сравнения.Электродный потенциал равенэдс электрохим.
цепи, составленной из исследуемого и стандартного электродов(диффузионный потенциалмежду разными электролитами, обусловленныйразличием скоростей движения ионов, при этом должен быть устранен).
Дляводных р-ров в качестве стандартного электродаобычно используют водородныйэлектрод(Pt, Н2[0,101 МПа] | Н+[a= 1]), потенциалк-рого при давленииводорода0,101 МПа и термодинамич.
активностиаионовН+ в р-ре, равной 1, принимают условно равным нулю(водородная шкала электродных потенциалов). При схематич. изображении цепи водородный электродвсегда записывают слева; напр.
, потенциал медного электродав р-ре солимедиравен эдс цепи Pt, H2|HClCuCl2|Cu|Pt(две штриховые черты означают, что диффузионный потенциална фанице НС1и СuС12устранен).
Если исследуемый электроднаходится встандартных условиях, когда активностивсех ионов, определяющих электродный потенциал,равны 1, а давлениегаза(для газовых электродов) равно 0,101 МПа, значениеэлектродного потенциала наз.
стандартным (обозначение E°).Оно связано со стандартным изменениемэнергии Гиббсаи константой равновесияКрэлектрохим. р-ции ур-нием:, где F – число Фарадея; п – число электронов, участвующихв р-ции; R – газовая постоянная; Т – абс. т-ра.
ЗначенияE°электрохим. систем по отношению к водородному электродуи протекающие наэлектродахр-ции сведены в спец. таблицы (подробнее см.
Стандартныйпотенциал).Зависимость электродного потенциала от термодинамич. активностейaiучастников электрохим. р-ции выражаетсяНернстауравнением:
где vi- стехиометрич. коэф. участника р-ции, причем для исходных в-в это отрицат.

величина, адля продуктов р-ции -положительная.Если через электродпротекает электрич. ток, электродный потенциал отклоняется от равновесного значения из-за конечной скоростипроцессов, происходящих непосредственно на границе электрод- электролит(см. Поляризация).Лит.: Корыта И., Дворжак И., БогачковаВ., Электрохимия, пер.
с чеш., М., 1977; Антропов Л.И., Теоретическаяэлектрохимия, 4 изд., М., 1984; Дамаскин Б. Б., Петрий О. А., Электрохимия,М., 1987; Багоцкий B.C., Основы электрохимии, М., 1988; Практикум по электрохимии,под ред.Б. Б.
Дамаскина, М., 1991.О. А. Петрий.АБВГДЕЖЗИКЛМНОПРСТУФХЦЧШЩЭЮЯ ___ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ— разность электрических потенциалов (напряжений) между электродом и находящимся с ним в контакте электролитом.Появление Э. п.
вызвано образованием у поверхности электрода двойного электрического слоя.На практике используют значения так… … Большая политехническая энциклопедияЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ— в электрохимии разность электрических потенциалов на границе фаз электрод электролит. На практике пользуются значениями т. н.
относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода… … Большой Энциклопедический словарьЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ— ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, мера способности электрода вступать в реакцию.
Электрод из элемента М, помещенный в раствор его ионов (М+), представляет собой ПОЛУЭЛЕМЕНТ. Теоретически в ходе реакций типа ММ++е между электродом и раствором всегда… … Научно-технический энциклопедический словарьЭлектродный потенциал— мера способности электрода вступать в реакцию.
Между электродом и раствором всегда образуется разность потенциалов.
Стандартные потенциалы электродов определяют относительно водородного электрода при определенных величинах температуры,… … Официальная терминологияэлектродный потенциал— — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.
] Тематики электротехника, основные понятия EN electrode potentialelectrolytic potentialelectropolarization… … Справочник технического переводчикаэлектродный потенциал— [electrode potential] разность электрических потенциалов между электродами и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).Практическое значение имеют относительные электродные потенциалы,… … Энциклопедический словарь по металлургииэлектродный потенциал— 3.8 электродный потенциал: Мера способности электрода вступать в реакцию. Между электродом и раствором всегда образуется разность потенциалов.
Стандартные потенциалы электродов определяют относительно водородного электрода при определенных… … Словарь-справочник терминов нормативно-технической документацииЭлектродный потенциал— У этого термина существуют и другие значения, см.Потенциал.
Электродный потенциал разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение… … ВикипедияЭлектродный потенциал— Electrode potential Электродный потенциал.
Потенциал электрода в электролизе измеренный относительно электрода сравнения.
В электродный потенциал не входят потери противодействия потенциалу, как в растворе, так и внешней цепи.
Он представляет… … Словарь металлургических терминовэлектродный потенциал— elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Dydis, išreiškiamas potencialų skirtumu, susidarančiu tarp joninės terpės (elektrolito tirpalo ar lydalo) ir į ją įdėto elektrodo.atitikmenys: angl.
electrode… … Penkiakalbis aiškinamasis metrologijos terminų žodynasэлектродный потенциал— elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Elektrodo potencialas kito kūno arba terpės, kurioje jis yra, atžvilgiu.
atitikmenys: angl.electrode potential vok. Elektrodenpotential, n rus. потенциал электрода … Penkiakalbis aiškinamasis metrologijos terminų žodynasравновесный (электродный) потенциал— — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров.Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.
] Тематики электротехника, основные понятия EN equilibrium (electrode) potential … Справочник технического переводчикаНормальный электродный потенциал— В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации… … ВикипедияСтандартный электродный потенциал— В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации… … ВикипедияОкислительно-восстановительный потенциал— равновесный Электродный потенциал, характеризующий данную электролитическую среду.

О. в. п.
при постоянной температуре зависит только от состава среды и может быть сообщен ею погруженному в неё электронному проводнику (электроду), если… … Большая советская энциклопедияЭЛЕКТРОХИМИЯ— раздел физической химии, изучающий химические процессы, которые сопровождаются появлением электрического тока или, наоборот, возникают под действием электрического тока. Предметом электрохимических исследований также являются электролиты и… … Энциклопедия КольераЕ949— Водород / Hydrogenium (H) Атомный номер 1 Внешний вид простого вещества газ без цвета, вкуса и запаха Свойства атома … Википедияцементационный процесс— [electrolitic precipitation] процесс осаждения металлов, основанный на электрохимическом протекании реакции между металлом цементатором и ионом осаждаемого металла, имеющего более положительный электродный потенциал.Цементационный процесс… … Энциклопедический словарь по металлургииЭЛЕКТРООСАЖДЕНИЕ— выделение фазы (металла, сплава, оксида и др.) на пов сти электрода в результате протекания электрохим. р ции.
Э.металлов лежит в основе гидроэлектрометаллургии (см. Электролиз )и гальванотехники. Металлы Au, Ag, Cu, Bi, Pb, Sn, Cd, Co, Ni, Fe,… … Химическая энциклопедияЭЛЕКТРОХИМИЧЕСКИЕ СЕНСОРЫ— устройства, в к рых аналит.
сигнал обеспечивается протеканием электрохим. процесса. Предназначены для качеств.
и количеств. анализа хим. соед.
в жидких и газообразных средах. По сравнению с обычными аналит.
приборами отличаются портативностью,… … Химическая энциклопедияВ электрохимиистандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей).

Объёмы чаще всего взяты при 25 °C.
Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окислениена аноде (потеря электрона) и восстановлениена катоде (приобретение электрона).
Электричествовырабатывается вследствие различия электростатического потенциаладвух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродовпо отношению к электролиту.
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически.
Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки.
Для этого установлен водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки.
Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов.
Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
- Например:
- Fe3++ 3e−→ Fe(тв) −0.036 В
- Fe2++ 2e−→ Fe(тв) −0.44 В
- Для получения третьего уравнения:
- Fe3++ e−→ Fe2+(+0.77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Основная статья: Таблица стандартных электродных потенциалов
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем.
Например, F2имеет 2,87 В, а Li+имеет −3,05 В, фтор — окислитель, литий — восстановитель.
Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр.
, H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия ГиббсаΔGoдолжна быть отрицательной, в соответствии со следующим уравнением:
ΔGoяч= -nFEoяч
где nэто количество молейэлектронов на моль продуктов, а Fявляется постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
если Eoяч> 0, тогда процесс самопроизвольный (гальваническая ячейка)
если Eoяч< 0, тогда процесс несамопроизвольный (электролитическая ячейка)
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
- Таблица стандартных электродных потенциаловВосстановительный потенциалАбсолютный электродный потенциалЭлектрохимический потенциалРавновесный электродный потенциалУравнение НернстаЭлектрохимическая ячейкаГальваническая ячейка
- Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry(5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8Atkins, Peter, Jones, Loretta (2005) Chemical Principles(3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-XZu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408Shuttleworth, SJ (1820) Electrochemistry(50th ed.), Harper Collins.
- Источники:
- www.xumuk.ru
- dic.academic.ru
- official.academic.ru
- dic.academic.ru
Что такое электродный потенциал
Потенциал электрода или электродный потенциал металла — это разность потенциалов, которая возникает на границе раздела фаз металл-раствор при погружении металла в раствор электролита в результате взаимодействия поверхностных ион-атомов металла, находящихся в узлах кристаллической решетки, с полярными молекулами воды, ориентированными у поверхности электрода. Это связано с образованием двойного электрического слоя, то есть несимметричного распределения заряженных частиц у границы раздела фаз.

Явления растворения металлов в электролитах используются в химических источниках электроэнергии. Металлическая пластина, опушенная в раствор своей же соли, в той или иной мере стремится в ней раствориться. Это стремление иногда называется упругостью растворения металла.
Цинковая пластина, опущенная в раствор сернокислого цинка ZnSO4, отдает в раствор частицы цинка в виде положительно заряженных ионов.
Вследствие того, что атомы пинка уходят в виде положительно заряженных ионов, на цинковой пластине образуется избыток свободных электронов и она заряжается отрицательно, а в слое жидкости вблизи поверхности цинка образуется избыток положительных ионов и, следовательно, этот слой заряжается положительно. Таким путем на границе жидкости и металла возникает двойной электрический слой из пространственно разделенных зарядов противоположного знака.
Эти заряды будут противодействовать дальнейшему переходу металла в раствор — отрицательные пластины удерживают положительный ион металла, а положительный заряд электролита отталкивает ион металла назад на пластину.
Иными словами, электрическое поле двойного слоя на границе металл — жидкость противодействует дальнейшему переходу ионов металла в раствор.
Устанавливается равновесие между химическими по своей природе силами стремления металла перейти в раствор и электрическими силами, им противодействующими.
Схема образования двойного электрического слоя на границе металла и электролита
Таким образом, вследствие растворения в электролите металлический электрод приобретает по отношению к электролиту определенный электродный (иначе электрохимический) потенциал, зависящий от материала электрода и состава электролита.
Однако электродные потенциалы могут иметь положительное значение. Это имеет место в тех случаях, когда положительные ионы раствора переходят на электрод, заряжая его положительно, а слой электролита — отрицательно, например, когда медная пластина погружена в достаточно концентрированный раствор сернокислой меди (CuSO4).
Двойной электрический слой можно уподобить конденсатору, одна из обкладок которого представляет собой поверхность металла, а другая — слой ионов в растворе у поверхности металла. Между разноименно заряженными обкладками и возникает разность, или скачок, потенциала.
Скачок потенциала на границе электрод-раствор может служить мерой окислительно-восстановительной способности системы.
Однако невозможно произвести измерение такого скачка потенциала или, что то же, разности потенциалов между двумя фазами. Но можно произвести измерение э. д. с.
элементов, составленных из интересующих нас электродов и какого-нибудь одного (одинакового во всех случаях) электрода, потенциал которого условно принят за нуль.
Измеренная э. д. с. будет характеризовать окислительно-восстановительную способность интересующего нас электрода относительно некоторого условного нуля. Полученная таким способом величина называется собственным потенциалом металла.
Чтобы измерить электродный потенциал любого металла, необходимо поместить в электролит второй электрод, который и свою очередь будет обладать определенным электродным потенциалом, зависящим от его материала. Следовательно, непосредственно измерить можно только алгебраическую сумму двух электродных потенциалов.
По этой причине электродные потенциалы различных материалов определяются по отношению к стандартному (водородному электроду, потенциал которого условно принимают за нуль.
Для измерения могут применяться и другие электроды сравнения, потенциал которых относительно водородного стандартного электрода известен. Этот потенциал также находят на основании измерения э. д. с. цепи, составленной из выбранного электрода сравнения и стандартного водородного электрода.
Если изучаемый электрод в паре со стандартным водородным электродом является отрицательным, то собственному потенциалу приписывается знак «-«, в противном случае — знак «+».
Например, измеренный таким образом в растворе соответствующей соли металла электродный потенциал цинка -0,76 В, меди +0,34 В, серебра +0,8 В. Э. д. с, которую дает элемент, определяется вычитанием потенциала более отрицательного из потенциала более положительного.
Если в соответствующий электролит помещены две пластины из металлов, имеющих различный электродный потенциал, например, в раствор серной кислоты (H2SO4) помещены цинковая (Zn) и медная (Сu) пластины, то вольтметр, присоединенный к этим пластинам, покажет между ними напряжение немного более 1 В.
Это напряжение, называемое в данном случае э. д. с. гальванической пары, будет обусловлено разностью электродных потенциалов меди, обладающей небольшим положительным потенциалам, и цинка, обладающего значительным отрицательным потенциалом. Такое устройство является простейшим гальваническим элементом — элементом Вольта.
В гальваническом элементе происходит превращение химической энергии в электрическую и с его помощью можно совершить электрическую работу за счет энергии химической реакции.

Измерение э. д. с. гальванических элементов необходимо производить при отсутствии тока в цепи элемента. В противном случае измеренная э. д. с. будет меньше, чем величина, определяемая как разность равновесных потенциалов обоих электродов.
Действительно, равновесному потенциалу отвечает определенная концентрация электронов на электродах: на более положительном она ниже, на более отрицательном выше.
Сообразно с этим различно и строение той части двойного слоя, которая расположена в растворе.
Измерение э. д. с. элемента без протекания тока обычно производится компенсационным методом. Для осуществления его необходимо иметь некоторый эталон э. д. с. Таким эталоном служит так называемый нормальный элемент. Чаще всего пользуются ртутно-кадмиевым нормальным элементом Вестона, э. д. с. которого равна 1,01830 В при 20 °С.
Понятие об электродном потенциале
Электроды– электрохимические системы, состоящие из металла или полупроводника, погруженного в раствор или расплав электролита.
Фактически, это металлические или графитовые изделия (проводники первого рода), находящиеся в среде, проводящей электрический ток (проводники второго рода).
Носителями свободных зарядов в проводниках первого рода являются электроны, а в проводниках второго рода – ионы обоих знаков.
Металлы, как правило, имеют кристаллическое строение. В узлах кристаллической решетки расположены положительные ионы (катионы), находящиеся в равновесии с электронным газом:
Me Á Men+ + nē.
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора.
Катионы металла выходят в электролит, а катионы электролита встраиваются в кристаллическую решетку металла. Со временем устанавливается равновесие между электродом и электролитом.
В зависимости от того, куда смещено это равновесие, поверхность металла приобретает больший или меньший потенциал.
В результате перераспределения зарядов на границе «металл – раствор» возникает двойной электрический слой (рис. 9.1) и возникает скачок потенциала между металлом и раствором.
| Рис. 9.1. Двойной электрический слой на границе раздела «металл – раствор» |
Потенциал электрода, опущенного в электролит, называется электродным потенциалом. Его значения зависят от многих факторов: материала электрода, состава электролита, температуры, давления и т. д.
Величину электродного потенциала измеряют относительно некоторого выбранного электрода сравнения, потенциал которого принимают равным нулю.
В качестве электрода сравнения обычно принимают стандартный водородный электрод.
Стандартным электродным потенциалом (j0)называется потенциал металла, погруженного в раствор собственной соли и измеренный относительно водородного электрода в стандартных условиях. Стандартные условия: концентрация ионов в растворе 1 моль/л, температура Т = 298 К, давление Р = 1,01325∙105 Па.
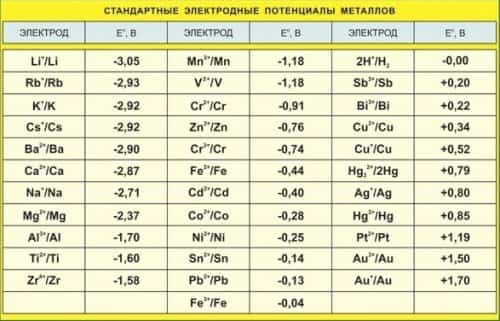
По результатам измерений получен ряд стандартных электродных потенциалов (табл. 9.1), который позволяет дать количественную характеристику электрохимической активности металлов.
Чем меньше значение φ0, тем сильнее выражены восстановительные свойства металла, т. е. он легче отдает электроны, легче окисляется.
Чем больше значение φ0, тем сильнее окислительные свойства катиона металла, находящегося в растворе.
Таблица 9.1
Стандартные электродные потенциалы φ0 некоторых металлов
| Электрод | Электродный потенциал, В | Электрод | Электродный потенциал, В |
| Li+/Li | –3,05 | Cd2+/Cd | –0,40 |
| Rb+/Rb | –2,93 | Co2+/Co | –0,28 |
| K+/K | –2,92 | Ni2+/Ni | –0,25 |
| Ba2+/Ba | –2.90 | Sn2+/Sn | –0,136 |
| Ca2+/Ca | –2,87 | Pb2+/Pb | –0,127 |
| Na+/Na | –2,71 | 2H+/H | 0,00 |
| Mg2+/Mg | –2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | –1,70 | Bi3+/Bi | +0,22 |
| Ti2+/Ti | –1,60 | Cu2+/Cu | +0,34 |
| V2+/V | –1,18 | Ag+/Ag | +0,85 |
| Mn2+/Mn | –1,18 | Hg2+/Hg | +0,85 |
| Zn2+/Zn | –0,76 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | –0,74 | Au3+/Au | +1,5 |
| Fe2+/Fe | –0,44 |
Для вычисления электродных потенциалов в условиях, отличных от стандартных, используют уравнение Нернста:
| , | (9.1) |
- где T – температура, К;
- F – число Фарадея, равное 96 500 Кл/моль;
- R – универсальная газовая постоянная, равная 8,314 Дж/(моль. К);
- n – число электронов, принимающих участие в элементарном акте окислительно-восстановительного процесса;
При T = 298 К формула Нернста приобретает вид:
| . | (9.2) |
Электродные потенциалы металлов
Электрохимические процессы относятся к окислительно-восстановительным. В окислительно-восстановительных реакциях электроны непосредственно переходят от восстановителя к окислителю.
Если же процессы окисления и восстановления пространственно разделить, а электроны направить по металлическому проводнику, то такая система будет представлять собой гальванический элемент.
Причиной возникновения электрического тока в гальваническом элементе является разность электродных потенциалов.
Что такое электродный потенциал? Представим, что пластинка металла опущена в воду. Металлы являются кристаллами и в них существует подвижное равновесие между атомами и ионами металлов и свободными электронами, которое можно выразить уравнением
Ме Û Меn+ + nе. (9.1)
При погружении металла в воду ионы его поверхностного слоя под действием полярных молекул воды отрываются и гидратированными переходят в раствор:
Меn+ + mН2О Û Меn+×mН2О. (9.2)
В результате такого перехода жидкость заряжается положительно, а металл – отрицательно, поскольку на нем появляется избыток электронов. С течением времени по мере перехода ионов металла в водную среду и накопления их начинает замедляться дальнейшее растворение металла и устанавливается подвижное равновесие:
Ме + mH2O Û Men+×mH2O + ne. (9.3)
Состояние равновесия уравнения (9.3) зависит от природы металла (энергии ионизации), от концентрации ионов металла в растворе.
Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в раствор равновесие смещается вправо (по принципу Ле-Шателье), и ионы металла переходят в раствор.
Электроны остаются на поверхности металла, заряжая его отрицательно по отношению к раствору. Этот процесс является окислением.
Электростатическое притяжение между катионами металла в растворе и избыточными электронами на поверхности металла образует двойной электрический слой (ДЭС), что приводит к возникновению на границе соприкосновения металла и жидкости определенной разности потенциалов, или скачка потенциала. Двойной электрический слой можно уподобить плоскому конденсатору с определенной разностью потенциалов.
Скачок потенциала, возникающий на границе фаз металл-раствор называют электродным потенциалом металла.
Способность посылать ионы металла в раствор у разных металлов неодинакова и зависит от энергии ионизации, сублимации и гидратации.
Чем меньше энергия ионизации, тем больше способность металла посылать ионы в раствор и тем ниже его равновесный потенциал.
По такой схеме идет образование двойного электрического слоя у активных металлов. Этот процесс можно выразить уравнением; например, для цинка:
mZn + xH2O ® [(m — n)Zn×ne]- + nZn2+×H2O. (9.4)
металл раствор
Неактивные металлы имеют большую энергию ионизации и практически не посылают ионы в раствор, поэтому равновесная концентрация их в растворе очень мала.
Если поместить такой металл в раствор его соли с концентрацией больше равновесной, то в данном случае возникает двойной электрический слой за счет адсорбции ионов металла из раствора на металлической пластинке.
Поверхность металла поэтому заряжается положительно, а раствор — отрицательно за счет избытка кислотных остатков. Строение двойного электрического слоя у неактивных металлов можно выразить уравнением:
nCu + mCu2+ + mSO42- + 8H2O ® [nCu + mCu2+]++ mSO42 -×8H2O. (9.5)
металл раствор
Потенциал каждого электрода зависит от природы металла, концентрации его ионов в растворе и температуры.
Если металл опустить в раствор его соли, содержащий 1 г-ион металла в 1 литре (точнее, активность которого а = 1), то электродный потенциал будет постоянной величиной при данной температуре и давлении.
Такой потенциал называется нормальным или стандартным электродным потенциалом. Обозначается электродный потенциал металла следующим образом: ЕМеn+/Me0, а стандартный – E0Men+/Me0.
Газовые электроды. Измерение электродных потенциалов.
Ряд напряжений металлов
Благородные металлы золото, платина и др. из-за высокой энергии ионизации не могут создать разность потенциалов за счет выхода положительных ионов в раствор.
В возникновении скачка потенциала на границе металл-раствор в данном случае важную роль играет избирательная адсорбция молекул, атомов или ионов среды.
Например, платиновый электрод энергично поглощает водород и это используется в водородном электроде.
Опытным путем можно определить только относительные величины электродных потенциалов. Если потенциал одного из электродов принять равным нулю, то относительный потенциал второго электрода будет равен ЭДС цепи, составленной из данного электрода и измеряемого. За нуль принят потенциал стандартного водородного электрода.
Он состоит из платиновой пластинки, покрытой платиновой чернью, контактирующей с газообразным водородом, находящимся под давлением 101,3 кПа, и раствором, в котором активность ионов Н+ равна единице. При контакте платины с молекулярным водородом происходит адсорбция водорода на платине.
Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в платине электроны. При этом платина заряжается отрицательно, а раствор – положительно. Возникает скачок потенциала между платиной и раствором.
Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на водородном электроде можно представить в виде 2Н+ + 2е Û Н2. Абсолютное значение потенциала водородного электрода неизвестно, но условно считают за нуль потенциал стандартного водородного электрода, т.
е. потенциал при давлении водорода 100 кПа и активности ионов водорода 1 моль/л. Схематически водородный электрод обозначают 2Н+/Н2, Pt.
Для определения потенциала электродов по водородной шкале собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод. Схему такого элемента записывают следующим образом: слева – водородный электрод, справа – измеряемый электрод. Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид:
- H2, Pt / H+½½Zn2+/ Zn,
- а схема элемента для измерения потенциала медного электрода –
- H2, Pt /H+½½Cu2+/Cu.
ЭДС элемента равна разности потенциалов правого и левого электродов. Так как потенциал левого электрода условно принимается равным нулю, то ЭДС измеряемого элемента будет равна потенциалу правого электрода. Потенциалы записываются с индексами исходных веществ и продуктов реакции:
EZn2+/Zn; ECu2+/Cu.
Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получают электрохимический ряд напряжений металлов, или, точнее, ряд стандартных электродных потенциалов (табл. 9.1).
В таблице потенциалы расположены по возрастанию их величин, что соответствует уменьшению восстановительной и повышению окислительной активности соответствующих систем. Если составить электрохимическую цепь из двух электродов этого ряда, то на одном из них, потенциал которого ниже по сравнению с другим, будет идти процесс окисления, а на другом – процесс восстановления.
Таблица 9.1
| Электрод | Потенциал, В | Электрод | Потенциал, В |
| Li+/Li | –3,02 | Ni2+/Ni | –0,25 |
| Rb+/Rb | –2,99 | Sn2+/Sn | –0,14 |
| K+/K | –2,92 | Pb2+/Pb | –0,13 |
| Ba2+/Ba | –2,90 | H+/1/2 H2 | 0,00 |
| Sr2+/Sr | –2,89 | Sb3+/Sb | +0,20 |
| Ca2+/Ca | –2,87 | Bi3+/Bi | +0,23 |
| Na+/Na | –2,71 | Cu2+/Cu | +0,34 |
| La3+/La | –2,37 | Cu+/Cu | +0,52 |
| Mg2+/Mg | –2,34 | Hg22+/2Hg | +0,79 |
| Al3+/Al | –1,67 | Ag+/Ag | +0,80 |
| Mn2+/Mn | –1,05 | Pd2+/Pd | +0,83 |
| Zn2+/Zn | –0,76 | Hg2+/Hg | +0,86 |
| Cr3+/Cr | –0,71 | Pt2+/Pt | +1,20 |
| Fe2+/Fe | –0,44 | Au3+/Au | +1,42 |
| Cd2+/Cd | –0,40 | ||
| Co2+/Co | –0,28 |
Ряд напряжений характеризует химические свойства металлов:
1. Чем левее в ряду напряжений находится металл, тем он химически активнее, тем легче окисляется и труднее восстанавливается из своих ионов.
2. Каждый металл ряда, не разлагающий воду, вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей.
3. Все металлы, стоящие в ряду напряжений левее водорода, вытесняют (восстанавливают) его из разбавленных кислот (типа серной), а стоящие правее водорода его не вытесняют.
4. Чем дальше расположены друг от друга в ряду напряжений два металла, тем большую ЭДС будет иметь построенный из них биметаллический гальванический элемент.
- Для стандартных электродных потенциалов действительно выражение
- DG0 = nE0F = DH0 – TDS0 (9.6)
- где DG0 – уменьшение свободной энергии для электродной реакции; n – число электронов; F – число Фарадея; DH0 и DS0 – изменения энтальпии и энтропии.
- Величина электродного потенциала металла зависит от свойств металла, активности его ионов в растворе и температуры. Эта зависимость выражается уравнением Нернста:
ЕМеn+/Me = E0Men+/Me + ln aMen+ mH2O. (9.7)
где ЕМеn+/Me – потенциал металла в вольтах при данной активности ионов; Е0Меn+/Me – стандартный электродный потенциал металла; R – универсальная газовая постоянная, равная 8,314 Дж/град×моль; Т – температура в градусах абсолютной шкалы; n – заряд иона металла; F – число Фарадея, равное 96500 Кл; аMen+ – активность ионов металла в растворе, г-ион/л.
Переходя от натуральных логарифмов к десятичным и подставляя в уравнение (9.7) значения соответствующих величин, а также учитывая, что для разбавленных растворов активности мало отличаются от концентраций (а ~ с), получаем:
EMen+/Me = E0Men+/Me + lg CMen+. (9.8)
Величина E0Men+/Me называется стандартным потенциалом металлического электрода и получается при активности ионов металла в растворе, равной 1. Тогда lgaMen+ = 0 и E0Men+/Me = EMen+/Me. Следовательно, стандартным потенциалом металлического электрода называют потенциал этого электрода в растворе собственных ионов с их активностью, равной 1.
Гальванические элементы
Два металла, погруженные в растворы их солей, соединенные между собой электролитическим ключом, образуют гальванический элемент. Впервые гальванический элемент предложил Вольта. Этот элемент состоял из медных и цинковых пластинок, разделенных сукном, смоченным раствором серной кислоты. При последовательном соединении большого числа пластинок элемент Вольта обладает значительной ЭДС.
Рис. 9.1
Рассмотрим систему, в которой два электрода находятся в растворах собственных ионов. Примером может служить гальванический элемент Даниэля-Якоби (рис. 9.1).
Он состоит из медной пластины, погруженной в раствор сульфата меди, и цинковой пластины, погруженной в раствор сульфата цинка. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
На поверхности цинковой пластинки возникает двойной электрический слой и устанавливается равновесие:
Zn Û Zn2+ + 2e.
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой, устанавливается равновесие и возникает электродный потенциал меди Cu Û Cu2+ + 2e.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди.
В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместится вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде.
Итак, при работе элемента Даниэля-Якоби протекают следующие процессы:
1. Реакция окисления цинка Zn0 – 2e ® Zn2+ (анодный процесс).
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2. Реакция восстановления ионов меди Cu2+ + 2e ® Cu0 (катодный процесс).
Процессы восстановления получили название в электрохимии катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами.
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: сульфат-анионов к аноду, катионов цинка и меди к катоду.
Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем
Zn + Cu2+ = Cu + Zn2+.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т. е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
- При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода – двумя чертами, например, схема элемента Даниэля-Якоби записывается в виде:
- (-) Zn /Zn2+½½ Cu2+/ Cu (+).
- Как видно, в гальваническом элементе идет химическая реакция
- Zn + CuSO4 = ZnSO4 + Cu;
во внешней цепи элемента протекает электрический ток, т. е. в гальваническом элементе происходит превращение химической энергии в электрическую.
Необходимое условие работы гальванического элемента – разность потенциалов его электродов, она называется электродвижущей силой и обозначается Еэ.
Электродвижущая сила всякого работающего элемента есть величина положительная и для любого биметаллического элемента может быть вычислена по разности между стандартными потенциалами катода и анода.
Так, Еэ медно-цинкового элемента равна разности между стандартными потенциалами меди (катода) и цинка (анода):
Eэ = E0Cu2+/Cu – E0Zn2+/Zn = +34 – (-0,76) = 1,1 В.
Если на электродах испытывает превращение 1 моль вещества, то через систему протекает количество электричества, равное nF, где n – число молей эквивалентов в одном моле вещества (по закону Фарадея). Таким образом, максимальная электрическая работа Wm, э гальванического элемента при превращении 1 моля вещества
Wm, э = n F Eэ. (9.9)
В то же время максимальная полезная работа Wm, р, которую может совершить система, равна энергии Гиббса реакции:
Wm,p = –DG. (9.10)
Так как Wm,э = Wm,p, то, приравнивая правые части, получаем:
-DG = n×F×Eэ; Eэ = –DG/n×F. (9.11)
Таким образом, при известных значениях энергии Гиббса по реакции можно рассчитать электродвижущую силу Еэ и наоборот. Уравнение (9.11) показывает связь между химической и электрической энергиями.
-DG0 = n × F × Eэ = 2 × 96500 × 1,1 = 212300 Дж.
ЭЛЕКТРО́ДНЫЙ ПОТЕНЦИА́Л
Авторы: О. А. Петрий
ЭЛЕКТРО́ДНЫЙ ПОТЕНЦИА́Л, разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение Э. п. обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрич. слоя. На границе между металлич.
электродом и раствором электролита пространственное разделение зарядов связано со следующими явлениями: переносом ионов из металла в раствор (или наоборот) в ходе установления электрохимич. равновесия; электростатич.
(кулоновской) адсорбцией ионов из раствора на поверхность металла; смещением электронного газа металла относительно положительно заряженного ионного остова кристаллич. решётки; специфич. (некулоновской) адсорбцией ионов или полярных молекул растворителя на электроде.
Последние два явления приводят к тому, что Э. п. не равен нулю даже при условиях, когда свободный заряд поверхности металла равен нулю.
Абсолютную величину Э. п. отд. электрода определить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и некоторого электрода сравнения. Э. п. равен эдс электрохимич.
цепи, составленной из исследуемого электрода и электрода сравнения (диффузионный потенциал на границе между разными электролитами при этом должен быть устранён).
Для водных растворов в качестве электрода сравнения обычно используют водородный электрод ($ce{Pt,H2∣H+}$), потенциал которого при давлении водорода 0,101 МПа и термодинамич. активности $a$ ионов $ce{H+}$ в растворе, равной 1, принимают условно равным нулю (водородная шкала Э. п.). При схематич.
изображении цепи водородный электрод всегда записывают слева; напр., потенциал медного электрода в растворе соли меди равен эдс цепи $ce{Pt,H2∣HCl┊┊CuCl2∣Cu∣Pt}$ (две вертикальные штриховые черты означают, что диффузионный потенциал на границе растворов $ce{HCl}$ и $ce{CuCl2}$ устранён).
Если металл электрода инертен и погружён в раствор, который содержит окисленную $ce{Ox}$ и восстановленную $ce{Red}$ формы компонентов раствора, находящиеся в равновесии $ce{Ox + ne⇄Red}$, то возникающий Э. п. называют окислительно-восстановительным (или редокс) потенциалом.
В стандартных условиях, когда активности всех компонентов, определяющих Э. п., равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение Э. п. называют стандартным (обозначение $E^0$). Ранее для этой величины использовали термин «нормальный потенциал».
Величина $E^0$ связана со стандартным изменением энергии Гиббса и константой равновесия $K_р$ электрохимич. реакции, определяющей величину Э. п., уравнением: $–ΔG=nFE^0=RTln K_р$ ($F$ – число Фарадея; $n$ – число электронов, участвующих в реакции; $R$ – газовая постоянная; $T$ – абсолютная темп-ра).
Значения $E^0$ электрохимич. систем по отношению к водородному электроду (найденные экспериментально либо рассчитанные из термодинамич. данных) и соответствующие электродные реакции сведены в спец. таблицы. При помощи таких таблиц можно составлять уравнения разл. химич.
реакций, решать вопрос о направлении этих реакций и полноте их протекания.
Если расположить металлы в порядке увеличения их стандартных Э. п., получим т. н. электрохимич. ряд напряжений. Он характеризует изменение химич. активности при переходе от одного металла к другому.
В сокращённом виде этот ряд выглядит следующим образом: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H2, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Металлы, стоящие слева от H2, вытесняют водород из водных растворов кислот-неокислителей; металлы, стоящие левее, вытесняют металлы, стоящие правее, из растворов солей последних.
Зависимость Э. п. от термодинамич. активностей $a_i$ участников электрохимич. реакции выражается уравнением Нернста: $E=E^0-(RT/2F)sum_iv_iln a_i$ ($v_i$ – стехиометрич. коэф. участника реакции, причём для Ox формы это отрицат.
величина, для Red формы – положительная). Т. о., напр.
, для медного электрода в растворе соли меди $E_{ce{Cu^2+ / Cu}}=E_{ce{Cu^2+ / Cu}}^0+(RT/2F)ln a_{ce{Cu^2+}}$,а для редокс-реакции $ce{MnO4-}+5e+ce{8H+}=ce{Mn^2+}+ce{4H2O}$ $$E_{ce{MnO4- /Mn^2+}}=E^0_{ce{MnO4- /Mn^2+}}++(RT/5F)ln (a_{ce{MnO4- }}a^8_{ce{H+}}/a_{ce{Mn^2+}}).$$
Если через электрод протекает электрич. ток, величина Э. п. отклоняется от равновесного значения из-за конечной скорости процессов, происходящих непосредственно на границе электрод – электролит.






