- Средства для удаления коррозии с металла
- Лимонная
- Серная
- Ортофосфорная
- Щавелевая
- Уксусная
- Альтернативные варианты для очистки
- Домашние рецепты
- Покупные средства
- Рекомендации при обработке поверхностей
- Видео по теме статьи
- Заключение
- Какая кислота разъедает металл. Основные варианты
- Азотная кислота (HNO3)
- Какие кислоты разъедают металл
- Какая кислота быстро разъедает металл
- Форум химиков
- быстрое ржавление железа
- быстрое ржавление железа
- Коррозия металла — что это: виды и способы борьбы
- Коррозия металла — причины возникновения и методы защиты
- Что такое коррозия металлов
- Химическая коррозия
- Электрохимическая коррозия
- Другие причины коррозии металла
- Меры защиты металлов от коррозии
- Антикоррозийная защита неметаллическими покрытиями
- Защита железа от коррозии покрытиями из других металлов
- Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
- Меры противодействия электрохимической коррозии
- Защита от блуждающих токов
- Способы борьбы с коррозией металлов
- Причины коррозии металлов
- Виды коррозии металлов
- Способы борьбы с коррозией
- Изменение свойств металла для предотвращения коррозии
- Изменение свойств окружающей среды
- Изменение характера взаимодействия металла со средой
- Способы удаления коррозии

Один из способов устранить ржавчину — использовать кислоты. О том, какой кислотой можно быстро и безопасно убрать ржавчину, читайте в статье.
Средства для удаления коррозии с металла
Коррозийные процессы, поражающие металл, ухудшают его характеристики, а при непринятии никаких мер – способствуют разрушению. Справиться с проблемой в домашних условиях можно применением различных кислот.
Лимонная
- Использование лимонной кислоты для устранения коррозии может помочь при незначительном поражении металла.
- Применение:
 Лимонную кислоту растворить в воде в пропорции 1:1.
Лимонную кислоту растворить в воде в пропорции 1:1.- Нанести на участок с коррозией. Можно пропитать жидкостью ветошь и приложить к поврежденному металлу.
- Выдержать несколько часов, следя за тем, чтобы поверхность металла оставалась увлажненной.
- Счистить отслоившуюся ржавчину щеткой или скребком.
- Промыть участок металла, подвергавшийся воздействию кислоты, водой.
Лучший результат устранения ржавчины может быть достигнут при смешивании ее в равных пропорциях с уксусом. Подробнее о применении лимонной кислоты против ржавчины можно узнать здесь.
Серная
Серная кислота поможет решить проблему с коррозией быстро и эффективно. Для использования готовится водный раствор. Его плотность должна быть не более 1,15 г/см³, так как более высокая концентрация способна повредить металл.
Порядок воздействия включает окунание металла в раствор на полчаса. Если предмет большой, то применяется поверхностная обработка кистью. По окончанию воздействия металл рекомендуется обработать слабым раствором нашатыря для нейтрализации.
Ортофосфорная
Ортофосфорная кислота – один из часто используемых компонентов готовых средств устранения ржавчины и преобразователей. Применять ее можно в форме раствора.
 Порядок работ:
Порядок работ:
- зачистить поверхность металла, механически счистив верхний слой ржавчины;
- подготовить раствор кислоты концентрацией 15-20%;
- обработать поверхность.
В результате применения на поверхности металла образуется пленка, которая способна защитить поверхность от дальнейшей коррозии. И она может служить грунтом перед покраской. Подробнее о применении ортофосфорной кислоты в борьбе против ржавчины можно узнать тут.
Щавелевая
Применение щавелевой кислоты требует обязательного использования респиратора, очков.
Алгоритм действий:
- Участок металла, который требует очистки от ржавчины, необходимо промыть мыльным раствором или средством для мытья посуды.
- Смыть водой.
- Вытереть насухо.
- В отдельную емкость налить 0,3 литра воды.
- Добавить к воде 6 ч. л. кислоты.
- Погрузить в емкость предмет.
- Выдержать полчаса.
- Счистить налет.
- Промыть предмет горячей водой.
- Вытереть салфеткой.
Уксусная
- Столовый уксус может быть использован для устранения ржавчины за счет входящей в его состав уксусной кислоты.
- Порядок проведения работ методом погружения:
 подготовить емкость, в которую металлический ржавый предмет может быть погружен целиком;
подготовить емкость, в которую металлический ржавый предмет может быть погружен целиком;- заполнить емкость уксусом;
- поместить в раствор металлическое изделие;
- выдержать несколько часов (не менее 2-х);
- достать предмет;
- применяя металлическую щетку, счистить ржавчину;
- промыть предмет.
- Если предметы очень маленькие, возможно после выдерживания изделий в уксусе, воспользоваться алюминиевой фольгой для снятия налета.
- Предложенный способ удобен для обработки металлических предметов небольшого размера:
Если необходимо обработать металлическое изделие большого размера (например, лопату, арматуру и т.д.), то придется воспользоваться таким способом:
- Обильно смочить в уксусе ветошь.
- Покрыть пропитанной в уксусе тряпкой пострадавший от коррозии участок.
- Выдержать несколько часов (не менее 2-х), периодически увлажняя ветошь уксусом.
- Счистить ржавчину.
- Смыть с поверхности металла остатки уксуса.
Полезная информация о способе удаления ржавчины при помощи уксуса найдется в этой статье.
Альтернативные варианты для очистки
Кроме воздействия кислот, ржавчину возможно устранить при помощи специальных покупных средств и домашних рецептов.
Домашние рецепты
К самым простым вариантам можно отнести:
 Алюминиевую фольгу, которая найдется на кухне. Если сделать из нее комок, и им потереть место коррозии, повреждение будет устранено.
Алюминиевую фольгу, которая найдется на кухне. Если сделать из нее комок, и им потереть место коррозии, повреждение будет устранено.- Пищевую соду. Хорошо убирает ржавчину. Ее перед нанесением разводят водой до состояния кашицы, наносят на полчаса на поверхность, после чего счищают.
- Перекись водорода. Подойдет она для удаления ржавых разводов с сантехники и кафеля.
Домашние средства рекомендованы при небольших коррозийных повреждениях, так как в своем большинстве менее эффективны, чем покупные препараты.
Покупные средства
Специальные препараты для удаления ржавчины с металлических поверхностей могут быть как с вхождением кислот, так и бескислотные. Кроме активных компонентов, в состав препаратов входят загустители, ингибиторы и другие вещества.
К хорошо себя зарекомендовавшим относятся такие средства:
- Sonax;
- Кольчуга;
- Феном;
- Hi-Gear Rust Treatment и другие.
Рекомендации при обработке поверхностей
Для того, чтобы удаление ржавчины дало максимальный эффект и не нанесло вреда, рекомендуется воспользоваться следующими советами специалистов:
 При использовании едких кислот и их растворов необходимо применять средства индивидуальной защиты, включая респиратор.
При использовании едких кислот и их растворов необходимо применять средства индивидуальной защиты, включая респиратор.- Проводить работы желательно на открытом воздухе. Или в помещении с очень хорошей вентиляцией.
- При значительной коррозии перед обработкой кислотой рекомендуется зачистить металл жесткой щеткой.
- После смывания кислоты, поверхность металла необходимо просушить.
- Не следует смешивать несколько кислот вместе, если это не оговорено в рецептуре.
- Применение покупных средств, чтобы удалить ржавчину, удобнее, чем самостоятельное изготовление растворов.
- Много полезной информации об удалении ржавчины найдете в данном разделе сайта.
Видео по теме статьи
Удаление ржавчины с металла содой, уксусом, лимонной и ортофосфорной кислотой, видео-тестирование:
Заключение
Использование кислот для устранения ржавчины – метод эффективный, но требующий аккуратности, а также соблюдения всех мер личной безопасности. Кроме химически активных к коррозии кислот, могут быть использованы народные рецепты и специальные средства.
Источник
Какая кислота разъедает металл. Основные варианты
Многим интересно знать, какая кислота разъедает металл. Для этой цели подойдут практически все кислоты — они оказывают разрушающее действие разной силы на любую поверхность. Есть много рецептов растворения металла, но популярные методы подходят не всем. Кому-то нужно разделить лист стали на две части без болгарки, а иному — за пару дней проделать дыру в заборе. Рассмотрим основные способы, разбирая плюсы и минусы воздействия.
Азотная кислота (HNO3)

Это очень сильная кислота с резким запахом.
- Растворяет все металлы, кроме алюминия и железа.
- Низкая цена. От 15 руб. за килограмм для технической и от 50 руб. для чистой кислоты.
- Распространенность — купить азотную кислоту можно в любом городе, во многих интернет-магазинах, во всех объемах и концентрациях.
- Многофункциональность. Это соединение используют еще и как реагент ракетного топлива, удобрение и сырье для лекарств (нитроглицерина).
- Летучесть азотной кислоты. Концентрированное соединение «дымит», а при ярком свете разлагается на оксид азота и воду. Хранить его нужно в темных емкостях.
- Удушливый запах.
- Ядовитость. Кислота опасна для человеческого организма, вызывает удушье и интоксикацию при незащищенном контакте. Работать с ней нужно в маске и перчатках.
- Медленное действие. Если соединение не смешивать с другими кислотами, то 2 мм металла будут растворяться 5 часов.
- Растворение не только нужного, но и окружающих объектов — бетона, дерева и т. д.
Какие кислоты разъедают металл

Подойдут еще серная, хлорная и фосфорная кислоты в высокой концентрации.
- разъедают железо;
- действуют быстро, но нужно помнить, что «быстро» в химии — очень обширное понятие;
- доступность — найти эти кислоты проще, чем азотную;
- свет никак не влияет на соединения;
- устойчивость к низким температурам — если, например, серная кислота замерзнет, то ее свойства от этого не изменятся.
- Непереносимость высоких температур. Кислоты могут «гасить» — сами они после этого не пострадают, но место хранения будет сложно восстановить.
- Сложность работы. Необходимо соблюдать правила безопасности, голыми руками колбы с соединениями лучше не трогать. Нужно будет купить специальное оборудование, если вы собираетесь что-либо делать с кислотами.
Какая кислота быстро разъедает металл
Лучше использовать соединения нескольких веществ, например, «царскую водку». Это смесь одной части азотной и трех частей соляной кислоты. Окислительные способности такого соединения очень сильны — растворить можно даже золото.
«Царскую водку» нельзя хранить в открытом виде, потому что из нее испарится хлор и соединение потеряет основные свойства. Но за несколько минут металл не растворит даже это вещество — придется подождать пару часов, чтобы достичь нужного эффекта.
Если хочется увеличить скорость реакции, то можно нанести кислоту на нить (наносить без перерыва) и двигать этой нитью, как пилой по металлу.
Кислоты — это не лучшее решение проблемы. Намного эффективнее использовать газы, болгарку, термит или автоген (газовый резак).
Источник
Форум химиков
быстрое ржавление железа
быстрое ржавление железа
Сообщение ilona » Вт мар 25, 2008 1:58 pm
- Сообщение amik » Вт мар 25, 2008 2:06 pm
- Сообщение ilona » Вт мар 25, 2008 2:21 pm
- Сообщение aversun » Вт мар 25, 2008 2:34 pm
- Сообщение ilona » Вт мар 25, 2008 2:49 pm
- Сообщение ИСН » Вт мар 25, 2008 2:52 pm
- Сообщение ilona » Вт мар 25, 2008 3:07 pm
- Сообщение amik » Вт мар 25, 2008 3:43 pm
- А если взять готовую «ржавчину», разболтать в бесцветном лаке и покрасить. Типа краска под ржавчину
- ilona, химикам не надо рассказывать, что есть ржавчина и как ее смывать
- Сообщение ИСН » Вт мар 25, 2008 3:46 pm
- Сообщение ilona » Вт мар 25, 2008 4:04 pm
- Сообщение ilona » Вт мар 25, 2008 4:10 pm
- amik писал(а): А если взять готовую «ржавчину», разболтать в бесцветном лаке и покрасить. Типа краска под ржавчину
- ilona, химикам не надо рассказывать, что есть ржавчина и как ее смывать
- Сообщение ИСН » Вт мар 25, 2008 4:24 pm
- Сообщение dan14444 » Вт мар 25, 2008 4:24 pm
- А можа плюс на него подать?
з.ы. о, синхронно о електричестве вспомнили. но купорос — рыжая полумера
- Сообщение Polychemist » Вт мар 25, 2008 5:33 pm
- Сообщение Tokashi » Вт мар 25, 2008 5:37 pm
- Сообщение alexchem » Вт мар 25, 2008 5:55 pm
- Настоящее определяется прошлым, а будущее настоящим.
- В теории различия между теорией и практикой нет, но на практике они есть.
- Сообщение Iskander » Вт мар 25, 2008 7:41 pm
Не тот хлорид вы взяли (судя по цвету раствора — FeCl2*6H2O). Хлорное железо FeCl3*xH2O — очень мощный окислитель. Миллиметр нержавейки улетает за пару часов. Сложнее вовремя остановится.
Вообще — окалина очень неплохо противостоит коррозии, так что если надо заржавить железную деталь — то окалину сперва надо стравить кислотой.
Лет 12 назад я делал так: поверхность мазал раствором соляной кислоты (примерно 10-15%, точность не важна) затем, минут через 10 — 15 раствором соды. При этом на поверхности образуется густая зелёная грязь.
Её надо аккуратно высушить — и толстый слой художественной ржавчины гарантирован. Далее аккуратно промыть водой (смыть избыток соли и соды) и снова высушить.
- Сообщение aversun » Вт мар 25, 2008 11:09 pm
- Сообщение Гретхен » Ср мар 26, 2008 9:45 pm
Вот вот. Ионы хлора. Жидкости для унитазов бывают двух основных видов: 1. Для дезинфекции. С хлоркой. Типа «Доместаса».
2. Для удаления ржавчины и известкового налета. С фосфорной и другими кислотами. Типа «Силита».
Коррозия металла — что это: виды и способы борьбы
- 9 апреля 2021 г. в 08:57
- 1255
«Коррозия» — термин, который известен нам как процесс самопроизвольного разрушения металла.
Ежегодно миллионы тонн металла под воздействием физико-химических и химических реакций, возникающих во время взаимодействия с окружающей средой, «съедаются» коррозией.
Развитие саморазрушения может быть как частичным (местная коррозия), так и полным (сплошная коррозия), а все зависит от длительности и интенсивности разрушающего процесса.
По типу коррозия подразделяется на химическую и электрохимическую.

Химическая коррозия обусловлена взаимодействием поверхности металлических материалов с коррозионно-активной средой. Данный процесс разрушения металла протекает в жидкостях и газах, которые, в свою очередь, не в состоянии проводить электрический ток.
Из этого следует, что химическое саморазрушение подразделяется на газовую коррозию, где разрушение происходит именно под воздействием газов при высоких температурах, и коррозию в жидких неэлектролитах, которые бывают органического (нефть, бензин, керосин, различные спирты и т. п.
) и неорганического происхождения (расплавленная сера, жидкий бром и т. п.).
Электрохимическая коррозия подразумевает собой разрушение металла при непосредственном контакте с электролитически проводящей окружающей средой.
Для такого вида коррозии всегда требуется наличие электролита, с которым соприкасаются электроды.
Также это могут быть два разных металла с разными окислительно-восстановительными свойствами, соприкасающиеся друг с другом и образующие гальваническую пару.
Гальваническая пара это не что иное, как пара проводников, соединенных вместе с целью обеспечения электрического контакта, возможно, изготовленных из разных металлов. Каждый металл имеет свой электродный потенциал.
При воздействии электролита один возьмет на себя роль катода, а второй роль анода, и между ними будет происходить коррозионный процесс, по итогам которого катод будет разрушать анод.
В качестве электролита вполне сойдет влага из воздуха для приведения в действие электродного потенциала гальванической пары, при этом пары уязвимы в разной степени: одни больше, а другие меньше.
 Гальваническая пара
Гальваническая пара
В химии есть определенный порядок металлов, где они выставлены в последовательности, характеризующей их электродный потенциал в растворах электролитов, и называется она — электрохимический ряд напряжений металлов. Эта гальваническая шкала (Схема 1) может наглядно помочь разобраться, почему следует использовать крепеж из однородного материала.
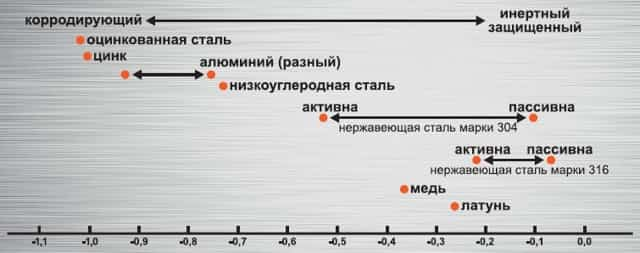 Схема 1. Гальваническая шкала
Схема 1. Гальваническая шкала
Итак, исходя из этой шкалы, мы получаем следующее: когда два металла находятся в непосредственном контакте, то тот, что левее, будет корродировать, а тот что правее, будет более инертно защищенным. Необходимо достигать минимальной разности потенциалов между двумя изделиями:
- разница в 0,1 будет являться допустимо безопасной;
- разница в 0,2 будет являться допустимой при выполнении некоторых условий:- контактная коррозия не будет влиять на сохранность изделия и на потерю его рабочей способности;- в сборочной единице специально предусмотрена электрохимическая защита одного изделия за счет коррозии другого.
Также темп коррозии будет находиться в зависимости от площади поверхности открытых металлов. При условиях, если деталь более инертна, чем крепеж, крепеж будет коррозировать более ускоренными темпами. Например, использование оцинкованной метизной продукции для соединения нержавеющих сталей приведет к ускоренному образованию коррозии на метизах и ухудшению их механических свойств.
 Гальваническая пара
Гальваническая пара
Защита от электрохимической коррозии; какой металл будет катодом, а какой анодом в гальванической паре; допустимые, недопустимые и ограниченно допустимые контакты металлов — регламентируются ГОСТ 9-005-72 «Электрохимическая коррозия, допустимость контактов металлов».
В Таблице 1 представлены справочные данные некоторых металлов для определения совместимости.
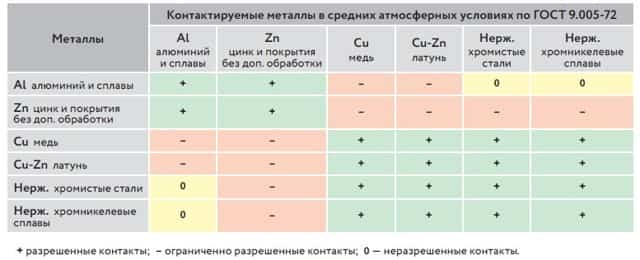 Таблица 1. Справочные данные некоторых металлов для определения совместимости
Таблица 1. Справочные данные некоторых металлов для определения совместимости
В данной таблице можно увидеть, что использование нержавеющей стали и металлических изделий с нанесением цинкового покрытия недопустимо и приведет к образованию коррозии, что уменьшит срок службы изделий.

В случае, если нет возможности исключить образование недопустимой гальванической пары, стоит выполнить дополнительные действия по уменьшению контактной коррозии с помощью следующих способов:
- дополнительная установка неметаллических шайб, вставок или прокладок в местах соединений;
- изолирование соединения от воздействия окружающей среды;
- нанесение дополнительных металлических покрытий, совместимых между собой;
- покраска поверхностей в местах соединений;
- электрическая изоляция металлических изделий.
Данные процедуры стоит проводить, отталкиваясь от технических требований к изделию, от сроков и условий их эксплуатации и от экономической составляющей.
Пренебрежение требованиями к методам защиты от контактной коррозии может привести к поломке, потере работоспособности или разрушению изделий. Не исключено, что это приведет к дополнительным материальным затратам, нанесению морального или физического ущерба.
Источник: ООО «КМ-профиль», опубликовано в журнале «Электротехнический рынок» № 2 (98) 2021
Коррозия металла — причины возникновения и методы защиты
Словосочетания «коррозия металла» заключает в себе намного больше, чем название популярной рок-группы.
Коррозия безвозвратно разрушает металл, превращая его в труху: из всего, произведенного в мире железа, 10% полностью разрушится в этот же год.
Ситуация с российским металлом выглядит примерно так — весь металл, выплавленный за год в каждой шестой доменной печи нашей страны, становится ржавой трухой еще до конца года.

Выражение «обходится в копеечку» в отношении коррозии металла более чем верно — ежегодный ущерб, приносимый коррозией, составляет не менее 4% годового дохода любой развитой страны, а в России сумма ущерба исчисляется десятизначной цифрой. Так что же вызывает коррозийные процессы металлов и как с ними бороться?
Что такое коррозия металлов
Разрушение металлов в результате электрохимического (растворение во влагосодержащей воздушной или водной среде — электролите) или химического (образование соединений металлов с химическими агентами высокой агрессии) взаимодействия с внешней средой. Коррозийный процесс в металлах может развиться лишь в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия).
Металл под воздействием кислорода и воды становится рыхлым светло-коричневым порошком, больше известным как ржавчина (Fе2O3·H2О).
Химическая коррозия
Этот процесс происходит в средах, не являющихся проводниками электрического тока (сухие газы, органические жидкости — нефтепродукты, спирты и др.), причем интенсивность коррозии возрастает с повышением температуры — в результате на поверхности металлов образуется оксидная пленка.
Химической коррозии подвержены абсолютно все металлы — и черные, и цветные. Активные цветные металлы (например — алюминий) под воздействием коррозии покрываются оксидной пленкой, препятствующей глубокому окислению и защищающей металл.
А такой мало активный металл, как медь, под воздействием влаги воздуха приобретает зеленоватый налет — патину.
Причем оксидная пленка защищает металл от коррозии не во всех случаях — только если кристаллохимическая структура образовавшейся пленки сообразна строению металла, в противном случае — пленка ничем не поможет.

Сплавы подвержены другому типу коррозии: некоторые элементы сплавов не окисляются, а восстанавливаются (например, в сочетании высокой температуры и давления в сталях происходит восстановление водородом карбидов), при этом сплавы полностью утрачивают необходимые характеристики.
Электрохимическая коррозия
Процесс электрохимической коррозии не нуждается в обязательном погружении металла в электролит — достаточно тонкой электролитической пленки на его поверхности (часто электролитические растворы пропитывают среду, окружающую металл (бетон, почву и т.д.)).
Наиболее распространенной причиной электрохимической коррозии является повсеместное применение бытовой и технической солей (хлориды натрия и калия) для устранения льда и снега на дорогах в зимний период — особенно страдают автомашины и подземные коммуникации (по статистике, ежегодные потери в США от использования солей в зимний период составляют 2,5 млрд. долларов).
Происходит следующее: металлы (сплавы) утрачивают часть атомов (они переходят в электролитический раствор в виде ионов), электроны, замещающие утраченные атомы, заряжают металл отрицательным зарядом, в то время как электролит имеет положительный заряд.
Образуется гальваническая пара: металл разрушается, постепенно все его частицы становятся частью раствора. Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла.
В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге).
Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Другие причины коррозии металла
Развитию коррозийных процессов способствуют радиация, продукты жизнедеятельности микроорганизмов и бактерий. Коррозия, вызываемая морскими микроорганизмами, наносит ущерб днищам морских судов, а коррозийные процессы, вызванные бактериями, даже имеют собственное название — биокоррозия.

Совокупность воздействия механических напряжений и внешней среды многократно ускоряет коррозию металлов — снижается их термоустойчивость, повреждаются поверхностные оксидные пленки, а в тех местах, где появляются неоднородности и трещины, активируется электрохимическая коррозия.
Меры защиты металлов от коррозии
Неизбежными последствиями технического прогресса является загрязнение нашей среды обитания — процесс, ускоряющий коррозию металлов, поскольку внешняя окружающая среда проявляет к ним все большую агрессию. Каких-либо способов полностью исключить коррозийное разрушение металлов не существует, все, что можно сделать, это максимально замедлить этот процесс.
Для минимизации разрушения металлов можно сделать следующее: снизить агрессию среды, окружающей металлическое изделие; повысить устойчивость металла к коррозии; исключить взаимодействие между металлом и веществами из внешней среды, проявляющими агрессию.
Человечеством за тысячи лет испробованы многие способы защиты металлических изделий от химической коррозии, некоторые из них применяются по сей день: покрытие жиром или маслом, другими металлами, коррозирующими в меньшей степени (самый древний метод, которому уже более 2 тыс. лет — лужение (покрытие оловом)).
Антикоррозийная защита неметаллическими покрытиями
Неметаллические покрытия — краски (алкидные, масляные и эмали), лаки (синтетические, битумные и дегтевые) и полимеры образуют защитную пленку на поверхности металлов, исключающую (при своей целостности) контакт с внешней средой и влагой.
Применение красок и лаков выгодно тем, что наносить эти защитные покрытия можно непосредственно на монтажной и строительной площадке.
Методы нанесения лакокрасочных материалов просты и поддаются механизации, восстановить поврежденные покрытия можно «на месте» — во время эксплуатации, эти материалы имеют сравнительно низкую стоимость и их расход на единицу площади невелик.
Однако их эффективность зависит от соблюдения нескольких условий: соответствие климатическим условиям, в которых будет эксплуатироваться металлическая конструкция; необходимость применения исключительно качественных лакокрасочных материалов; неукоснительное следование технологии нанесения на металлические поверхности. Лакокрасочные материалы лучше всего наносить несколькими слоями — их количество обеспечит лучшую защиту от атмосферного воздействия на металлическую поверхность.

В роли защитных покрытий от коррозии могут выступать полимеры — эпоксидные смолы и полистирол, поливинилхлорид и полиэтилен. В строительных работах закладные детали из железобетона покрываются обмазками из смеси цемента и перхлорвинила, цемента и полистирола.
Защита железа от коррозии покрытиями из других металлов
Существует два типа металлических покрытий-ингибиторов — протекторные (покрытия цинком, алюминием и кадмием) и коррозионностойкие (покрытия серебром, медью, никелем, хромом и свинцом).
Ингибиторы наносятся химическим способом: первая группа металлов имеет большую электроотрицательность по отношению к железу, вторая — большую электроположительность.
Наибольшее распространение в нашем обиходе получили металлические покрытия железа оловом (белая жесть, из нее производят консервные банки) и цинком (оцинкованное железо — кровельное покрытие), получаемые путем протягивания листового железа через расплав одного из этих металлов.
Часто цинкованию подвергаются чугунная и стальная арматура, а также водопроводные трубы — эта операция существенно повышает их стойкость к коррозии, но только в холодной воде (при проводе горячей воды оцинкованные трубы изнашиваются быстрее неоцинкованных).
Несмотря на эффективность цинкования, оно не дает идеальной защиты — цинковое покрытие часто содержит трещины, для устранения которых требуется предварительное никелерование металлических поверхностей (покрытие никелем).
Цинковые покрытия не позволяют наносить на них лакокрасочные материалы — нет устойчивого покрытия.
Лучшее решение для антикоррозийной защиты — алюминиевое покрытие. Этот металл имеет меньший удельный вес, а значит — меньше расходуется, алюминированные поверхности можно окрашивать и слой лакокрасочного покрытия будет устойчив.
Кроме того, алюминиевое покрытие по сравнению с оцинкованным покрытием обладает большей стойкостью в агрессивных средах.
Алюминирование слабо распространено из-за сложности нанесения этого покрытия на металлический лист — алюминий в расплавленном состоянии проявляет высокую агрессию к другим металлам (по этой причине расплав алюминия нельзя содержать в стальной ванне).
Возможно, эта проблема будет полностью решена в самое ближайшее время — оригинальный способ выполнения алюминирования найден российскими учеными. Суть разработки заключается в том, чтобы не погружать стальной лист в расплав алюминия, а поднять жидкий алюминий к стальному листу.
Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
Введение в стальной сплав хрома, титана, марганца, никеля и меди позволяет получить легированную сталь с высокими антикоррозийными свойствами. Особенную стойкость стальному сплаву придает большая доля хрома, благодаря которому на поверхности конструкций образуется оксидная пленка большой плотности.
Введение в состав низколегированных и углеродистых сталей меди (от 0,2% до 0,5%) позволяет повысить их коррозийную устойчивость в 1,5-2 раза.
Легирующие добавки вводятся в состав стали с соблюдением правила Таммана: высокая коррозийная устойчивость достигается, когда на восемь атомов железа приходится один атом легирующего металла.
Меры противодействия электрохимической коррозии
Для ее снижения необходимо понизить коррозийную активность среды посредством введения неметаллических ингибиторов и уменьшить количество компонентов, способных начать электрохимическую реакцию. Таким способом будет понижение кислотности почв и водных растворов, контактирующих с металлами.
Для снижения коррозии железа (его сплавов), а также латуни, меди, свинца и цинка из водных растворов необходимо удалить диоксид углерода и кислород. В электроэнергетической отрасли проводится удаление из воды хлоридов, способных повлиять на локальную коррозию.
С помощью известкования почвы можно снизить ее кислотность.
Защита от блуждающих токов
Снизить электрокоррозию подземных коммуникаций и заглубленных металлоконструкций возможно при соблюдении нескольких правил:
- участок конструкции, служащий источником блуждающего тока, необходимо соединить металлическим проводником с рельсом трамвайной дороги;
- трассы теплосетей должны размещаться на максимальном удалении от рельсовых дорог, по которым передвигается электротранспорт, свести к минимуму число их пересечений;
- применение электроизоляционных трубных опор для повышения переходного сопротивления между грунтом и трубопроводами;
- на вводах к объектам (потенциальным источникам блуждающих токов) необходима установка изолирующих фланцев;
- на фланцевой арматуре и сальниковых компенсаторах устанавливать токопроводящие продольные перемычки — для наращивания продольной электропроводимости на защищаемом отрезке трубопроводов;
- чтобы выровнять потенциалы трубопроводов, расположенных параллельно, необходимо установить поперечные электроперемычки на смежных участках.
Защита металлических объектов, снабженных изоляцией, а также стальных конструкций небольшого размера выполняется с помощью протектора, выполняющего функцию анода.
Материалом для протектора служит один из активных металлов (цинк, магний, алюминий и их сплавы) — он принимает на себя большую часть электрохимической коррозии, разрушаясь и сохраняя главную конструкцию.
Один анод из магния, к примеру, обеспечивает защиту 8 км трубопровода.
© Абдюжанов Рустам, специально для рмнт.ру
18.03.10
Способы борьбы с коррозией металлов
Коррозией металла называется нарушение его структуры в результате химических или электрохимических реакций. Это может приводить к разрушению деталей, конструкций, приводить к выходу из строя узлов автомобилей, станков, другого производственного оборудования, инструментов, трубопроводов и иных металлических изделий. Каждый год коррозия разрушает около 13 миллионов тонн металла.
Предотвратить и замедлить этот негативный процесс призваны меры антикоррозийной защиты металла. На это в мире тратится ежегодно более 2,5 триллионов долларов США, по данным NACE International. Как показывает практика, металлические изделия просто не способны служить без специальных защитных мер в течение длительного времени
Причины коррозии металлов
Основными «виновниками» коррозии являются воздействие природных факторов – воды и повышенной влажности, высокой температуры, кислых веществ с содержанием сульфатов и хлоридов, взвешенных в воздухе частиц различных веществ, солей, промышленных смазочных составов.
Виды коррозии металлов
В зависимости от того, какие именно реакции протекают на границе металла с окружающей средой, выделяют три основных вида коррозии.
- Химическая развивается, когда металл соприкасается с солями или сухими газообразными соединениями. Яркий пример – контакт днища кузова автомобиля с солью, которой зимой в России посыпают автодороги. На деталях машин образуется слой из солей натрия и калия, разъедающих сталь и любой другой металл.
- Электрохимическая происходит при соприкосновении с водой. Встречается чаще других видов.
- Биологическая (биокоррозия) заключается в том, что поверхность металла разрушают микроорганизмы или радиоактивное излучение.
В соответствии с формой поражения коррозия может быть точечной, когда появляются узкие глубокие отверстия внутри металла с сохранением целостности поверхности. Она чаще наблюдается в изделиях из алюминиевых сплавов и нержавеющей стали.
Второй тип – равномерная коррозия, проявляющаяся на поверхности металла в виде равномерного слоя отложений. Третий – щелевая, захватывает участки с небольшими углублениями, где накапливается влага.
Четвертый – межкристаллическая, развивается в зернистой структуре металла, приводя к локальным повреждениям.
Выделяют также коррозионное растрескивание, когда под действием агрессивной среды в сочетании с постоянной или периодической высокой нагрузкой в металле появляются трещины.
Способы борьбы с коррозией
Сегодня применяются различные способы защиты металлов от коррозии. Выбор определяется условиями эксплуатации металлических изделий, в том числе климатом региона, характеристиками самой металлической конструкции, а также совместимостью антикоррозийного состава и обрабатываемого материала, другими факторами.
Все виды борьбы с коррозией металла можно разделить на три основных, направленных на изменение одного из факторов:
- свойств самого металла;
- свойств окружающей среды;
- характера взаимодействия металлического изделия и среды на границе контакта.
Изменение свойств металла для предотвращения коррозии
В эту группу методов включаются легирование, поверхностная и термическая обработка. Первые два можно отнести к химическим методам. Третий – к технологическим методам.
Легирование предполагает включение в состав металла в процессе его производства химических элементов, которые наименее склонны вступать в химическую реакцию с кислородом. Эти компоненты по возрастанию химической эффективности располагаются в следующем порядке: хром, медь, цинк, серебро, алюминий, платина.
Другой способ – металлизация (гальванический метод), когда поверхность изделия покрывается более устойчивым к действию кислорода металлом. Он подается в мелкодисперсном виде в форме ионизированного потока. Сюда относятся холодное цинкование и горячее цинкование.
Для защиты от коррозии могут также применяться фосфатирование или оксалатирование – обработка поверхности металла фосфатными солями марганца и цинка, либо щавелевой кислоты.
Термическая обработка означает нагрев металла до температуры выше +900◦С. Как правило, применяется в сочетании с насыщением поверхности заготовки хромом, азотом, алюминием, кремнием и другими элементами, повышающими сопротивляемость металла коррозии.
Перечисленные выше методы защиты относят к активным. Сюда же можно причислить и преобразование структуры двойного электрического слоя — анодирование.
На металлическую поверхность воздействуют постоянным электрическим полем с заданными параметрами напряжения, которые подбираются в соответствии со свойствами металла.
Это увеличивает его электродный потенциал и повышает устойчивость к коррозии верхнего слоя. Такой способ обычно используют для создания антикоррозийной защиты алюминия.
Изменение свойств окружающей среды
Параметры окружающей металлическое изделие среды можно менять с помощью ее ингибирования, обескислороживания, осушения воздушной смеси и устранения агрессивных веществ – солей, кислот и других.
Если объект небольшой, вокруг него может создаваться вакуум: в воздухе практически не остается кислорода, соответственно, риск появления коррозии минимизируется.
Другой метод – заполнение пространства вокруг металлической детали или конструкции инертным газом (неоном, ксеноном, аргоном).
Этот способ дает высокий эффект, но довольно сложен в применении: необходимо обустройство защитной камеры, а также наличие специальных защитных костюмов для людей, обслуживающих оборудование из металла.
Его используют обычно в научно-исследовательских лабораториях и на опытных производственных участках, где требуется поддерживать особый микроклимат.
Изменение характера взаимодействия металла со средой
Это антикоррозийная обработка металла, для которой применяется большое разнообразие способов.
- Защитные покрытия – лаков и красок, масел, смазок и так далее.
- Устранение катодной поляризации в форме защиты от коррозии контактного типа, электродренажа, удаления блуждающих токов и так далее.
- Грамотное проектирование металлических конструкций, при котором подбирается наиболее устойчивый к действию факторов конкретной среды металл, устраняются зазоры, застойные зоны, соприкосновения разнородных металлов, и так далее.
Для борьбы с коррозией металлов широко распространены лакокрасочные покрытия. На сегодняшний день этот вариант применяется особенно часто.
Используются специальные органические ЛКМ, компоненты которых не вступают в реакцию с кислородом, в также составы с алюминием. Первые перекрывают доступ О₂.
Вторые не допускают коррозионного разрушения стали за счет наличия в составе химически инертного элемента – алюминия. Кроме того, используют защитные пленки и жидкий пластик – относительно новое решение.
На эффективность такой защиты влияют качество подготовки металлической поверхности к нанесению покрытия, равномерность его нанесения, толщина и прочность слоя, исключение образования воздушных полостей и другие факторы.
Этот способ отличается простотой реализации и низкими финансовыми затратами. Однако эффект недолговечен: со временем происходит механическое разрушение покрытия.
Важно также понимать, что ЛКМ и пленки препятствуют появлению коррозии, но не способны его предотвратить, что дает основания называть данный способом защиты от коррозии пассивным.
Можно покрыть ржавый металл специальной краской, которая трансформирует ржавчину и создаст антикоррозийный защитный слой.
К необычным способам относится высоковязкая технологическая смазка из окислов железа – закиси-окиси Fe3O4. Температура образования данного вещества составляет +250-500◦С. Им можно обработать металл, чтобы не ржавел.
Образуя на поверхности плотную пленку, Fe3O4 не дает кислороду проникать к металлу, не позволяя развиваться трибохимической коррозии.
Данный метод применяется на металлургических предприятиях в процессе скоростной высадки сплавов и металлов труднодеформируемых типов.
Способы удаления коррозии
Если ржавчина на металле уже появилась, риск разрушения деталей или конструкций резко возрастает. Необходимо удалить коррозию, для чего предлагается использовать один из способов.
- Ручная механическая очистка – традиционный вариант. Поверхность изделия обрабатывается металлической щеткой, наждачной бумагой либо абразивным кругом. Можно делать это вручную или с помощью дрели с соответствующей насадкой, либо углошлифовальной машины. Метод требует больших усилий и много времени.
- Специальные химические составы, вступающие в реакцию с оксидом железа. Данный вариант актуален для изделий, форма которых сложная, поверхность рифленая. Однако применять этот метод на изделиях с неметаллическими компонентами нельзя. Кроме того, работа с такими средствами требует особой осторожности, поскольку они могут нанести вред здоровью человека.
- Электрохимический способ. Металлическое изделие опускают в раствор электролита, подключив к источнику электротоку. Ток, проходящий через электролит и деталь, заставляет слой ржавчины отделяться от ее поверхности. Но этот вариант подходит не для всех изделий из металла.
- Пескоструйная и дробеструйная обработка, ультразвук очищают металл от оксида железа, отбивая его от поверхности.
- Сухой лед (криобластинг) – очищение с помощью струи из гранул сухого льда. При ударе о металл происходит испарение частичек льда. Высвобождается углекислый газ: мгновенно расширяясь, он захватывает и удаляет ржавчину.
Вложения в защиту металла от коррозии позволяют продлить срок службы деталей и конструкций, а, значит, увеличить периодичность их замены.
Максимальный эффект дает сочетание нескольких методов. Например, для сохранения металлических элементов, находящихся под водой, применяют комбинацию катодной защиты и ЛКМ. Антикоррозийная защита направляющих насадок гребных винтов включает применение коррозионностойкой стали, электроразъединение разнородных материалов, катодную защиту и ЛКМ.






