- 1.1. Гидрирование
- 1.2. Присоединение воды
- 1.3. Присоединение спиртов
- 1.4. Присоединение циановодородной (синильной) кислоты
- 2. Окисление альдегидов и кетонов
- 2.1. Окисление гидроксидом меди (II)
- 2.2. Окисление аммиачным раствором оксида серебра
- 2.3. Жесткое окисление
- 2.4. Горение карбонильных соединений
- 3. Замещение водорода у атома углерода, соседнего с карбонильной группой
- 4. Конденсация с фенолами
- 5. Полимеризация альдегидов
- Альдегиды
- Номенклатура и изомерия альдегидов
- Получение альдегидов и кетонов
- Химические свойства альдегидов и кетонов
- Химия. 10 класс
- 3.6. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
- Гидрирование альдегидов и кетонов
- Окисление альдегидов
- Химические свойства карбоновых кислот
- Реакции образования солей
- Реакции с участием ОН группы
- Реакции замещения атомов водорода в углеводородном заместителе
- Реакции разрушения карбоксильной группы (декарбоксилирование)
- Особые химические свойства муравьиной кислоты
- Физические и химические свойства альдегидов
- Химические свойства альдегидов
- Физические свойства альдегидов
- Получение альдегидов
- Применение альдегидов
- Примеры решения задач
- Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
- Химические свойства альдегидов
- Химические свойства карбоновых кислот
- Химические свойства сложных эфиров
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
- Строение, изомерия и гомологический ряд альдегидов и кетонов
- Химические свойства альдегидов и кетонов
- Способы получения альдегидов и кетонов
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:
| Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами. |
- Структурная формула кетонов:
- 1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
- Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
- При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
- В качестве катализаторов процесса используют кислоты или основания.
- Полуацетали существует только при низкой температуре.
| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении альдегиды превращаются в карбоновые кислоты. Альдегид → карбоновая кислота |
| Метаналь окисляется сначала в муравьиную кислоту, затем в углекислый газ: Формальдегид→ муравьиная кислота→ углекислый газ |
| Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны |
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Видеоопыт окисления муравьиного альдегида гидроксидом меди (II) можно посмотреть здесь.
| Например, муравьиный альдегид окисляется гидроксидом меди (II) |
- HCHO + 2Cu(OH)2 = 2Cu + CO2 + 3H2O
- Чаще в этой реакции образуется оксид меди (I):
- CH3CHO + 2Cu(OH)2 = Cu2O + CH3COOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
- Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
- Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
| Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония |
| Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония |
- Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
- Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
| Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота |
- Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
- Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + (3n-1)/2O2 → nCO2 + nH2O + Q
| Например, уравнение сгорания метаналя: |
CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
| Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя |
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
- Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
- Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
- Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
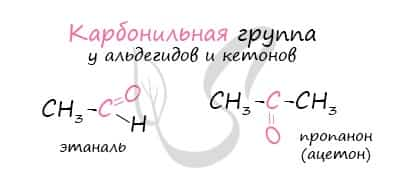
Альдегиды
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
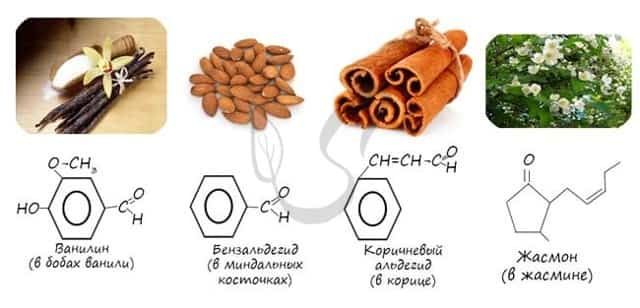
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
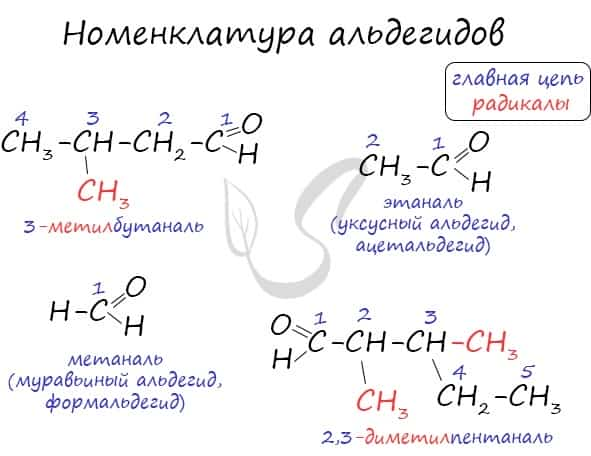
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь — CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
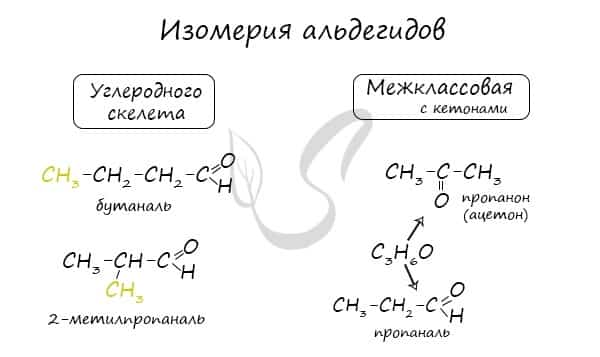
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
- Окисление спиртов
- Пиролиз солей карбоновых кислот
- Каталитическое дегидрирование спиртов
- Реакция Кучерова
- Гидролиз дигалогеналканов
- Окисление метана
- Кумольный способ получения ацетона (и фенола)
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов. 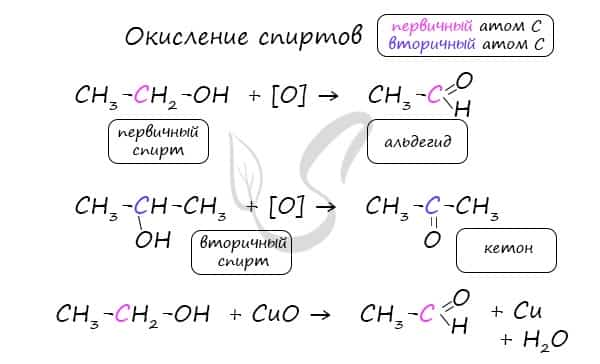
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов. 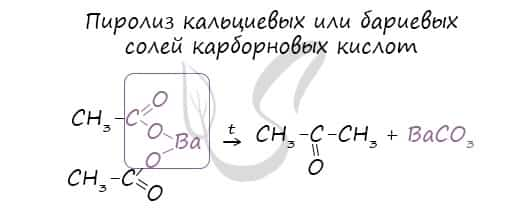
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа. 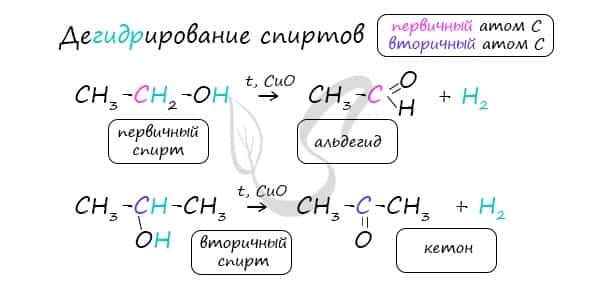
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути. В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны. 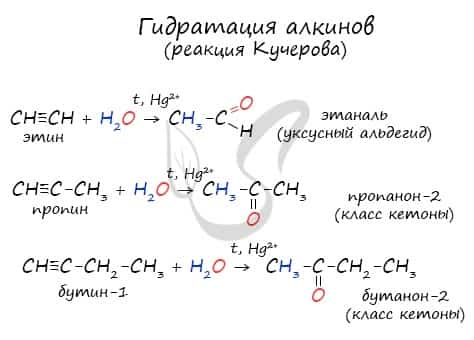
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного. В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду. 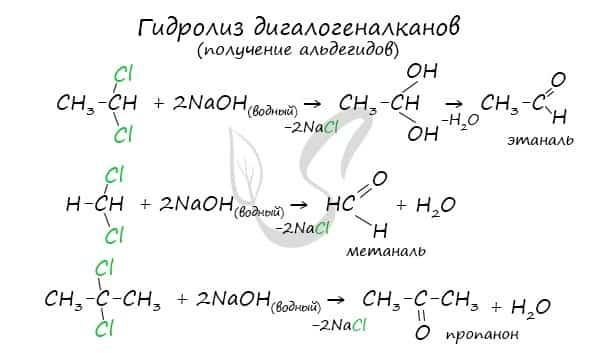
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид. 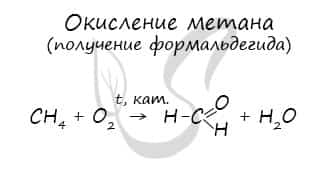
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
- Реакции присоединения
- Окисление альдегидов
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+). Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов. Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода. 2CH3CHO + 5O2 → 4CO2 + 4H2O Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов. Кетоны, в отличие от альдегидов, в реакции окисления не вступают. Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты. Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
Химия. 10 класс
Химические свойства альдегидов прежде всего обусловлены наличием в их молекулах альдегидной группы. По месту двойной связи альдегидной группы могут протекать реакции присоединения.
1. Гидрирование. Присоединение водорода
Молекула альдегида может присоединить по двойной связи молекулу водорода. Такая реакция сопровождаются разрывом π-связи в молекуле альдегида, так как она менее прочная, чем σ-связь:
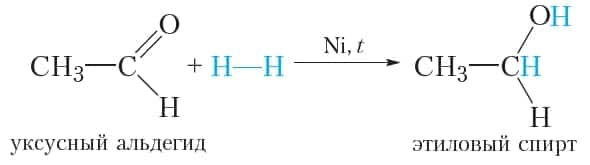
- Условия протекания данной реакции схожи с реакцией гидрирования алкенов: смесь водорода с парами альдегида пропускают над нагретым никелевым катализатором.
- Продуктом присоединения водорода к альдегиду является первичный спирт.
- В результате присоединения водорода молекула альдегида восстанавливается, поэтому реакцию с водородом также называют реакцией восстановления альдегидов.
- 2. Окисление
Альдегидная группа легко окисляется. В качестве окислителей могут выступать ионы металлов, расположенных в ряду активности правее водорода — ионы серебра (Ag+) и меди (Cu2+).
Окисление альдегидов аммиачным раствором оксида серебра
Если к разбавленному раствору нитрата серебра приливать раствор аммиака, то выпадает белый осадок оксида серебра:
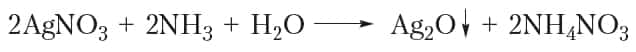
Видео 30.1Реакция «серебряного
зеркала»
Этот осадок сразу же растворяется в избытке аммиака. Образующийся прозрачный раствор называется аммиачным раствором оксида серебра. Если к этому раствору прибавить раствор уксусного альдегида и смесь осторожно нагреть, то вскоре на стенках пробирки образуется блестящий зеркальный налёт серебра, благодаря чему эта реакция называется реакцией «серебряного зеркала».
В протекающей реакции уксусный альдегид окисляется до уксусной кислоты, а оксид серебра восстанавливается с образованием металлического серебра:
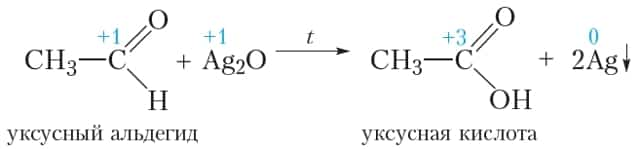
Реакция «серебряного зеркала» является качественной реакцией на альдегиды.
Окисление альдегидов гидроксидом меди(II)
В качестве окислителя альдегидов до соответствующих кислот может быть использован также гидроксид меди(II). Для проведения такой реакции в пробирку помещают раствор сульфата меди(II), затем прибавляют раствор щёлочи. При этом выпадает голубой осадок гидроксида меди(II):
![]()
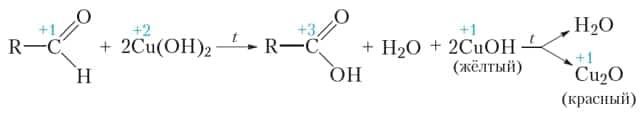
- Как видно из приведённого уравнения реакции, в результате восстановления гидроксида меди(II) образуется жёлтый осадок гидроксида меди(I), который при нагревании разлагается с образованием красного оксида меди(I).
- Как и в случае реакции «серебряного зеркала», продуктом окисления альдегида является карбоновая кислота.
- Реакция окисления альдегидов гидроксидом меди(II) так же, как и реакция «серебряного зеркала», является качественной реакцией на альдегиды.
- Способность альдегидов окисляться до карбоновых кислот и восстанавливаться до спиртов особенно наглядно демонстрирует взаимосвязь между классами органических соединений, благодаря которой вещества одного класса могут быть получены из представителей других классов.
3.6. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Альдегидами называют соединения, молекулы которых содержат карбонильную группу, соединенную с атомом водорода, т.е. общая формула альдегидов может быть записана как
- где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
- Группу –СНО называют альдегидной.
- Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
- где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах.
По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е.
обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
2) аммиаком
- 4) основными и амфотерными гидроксидами металлов:
- 5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
- Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| CH3COOH | уксусная/ этановая | ацетат/ этаноат |
| CH3 CH2COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| CH3 CH2 CH2COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
- Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
- Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
- Обратный реакции этерификации процесс называют гидролизом сложного эфира:
- Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
- При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
- В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Реакции разрушения карбоксильной группы (декарбоксилирование)
Особые химические свойства муравьиной кислоты
- Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
- В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
- При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
Физические и химические свойства альдегидов
Общая формула предельных альдегидов и кетонов CnH2nO. В названии альдегидов присутствует суффикс –аль.
Простейшие представители альдегидов – формальдегид (муравьиный альдегид) –СН2 = О, ацетальдегид (уксусный альдегид) – СН3-СН = О. Существуют циклические альдегиды, например, циклогексан-карбальдегид; ароматические альдегиды имеют тривиальные названия – бензальдегид, ванилин.
Атом углерода в карбонильной группе находится в состоянии sp2-гибридизации и образует 3σ-связи (две связи С-Н и одну связь С-О). π-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием σ- и π-связей. Электронная плотность смещена в сторону атома кислорода.
- Для альдегидов характерна изомерия углеродного скелета, а также межклассовая изомерия с кетонами:
- СН3-СН2-СН2-СН = О (бутаналь);
- СН3-СН(СН3)-СН = О (2-метилпентаналь);
- СН3-С(СН2-СН3) = О (метилэтилкетон).
Химические свойства альдегидов
- В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; α-СН кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
- 1. Реакции присоединения:
- — воды с образованием гем-диолов
- R-CH = O + H2O ↔ R-CH(OH)-OH;
- — спиртов с образованием полуацеталей
- CH3-CH = O + C2H5OH ↔CH3-CH(OH)-O-C2H5;
- — тиолов с образованием дитиоацеталей (в кислой среде)
- CH3-CH = O + C2H5SH ↔ CH3-CH(SC2H5)-SC2H5 + H2O;
- — гидросульфита натрия с образованием α-гидроксисульфонатов натрия
- C2H5-CH = O + NaHSO3 ↔ C2H5-CH(OH)-SO3Na;
- — аминов с образованием N-замещенных иминов (основания Шиффа)
- C6H5CH = O + H2NC6H5 ↔ C6H5CH = NC6H5 + H2O;
- — гидразинов с образованием гидразонов
- CH3-CH = O +2HN-NH2 ↔ CH3-CH = N-NH2 + H2O;
- — циановодородной кислоты с образованием нитрилов
- CH3-CH = O + HCN ↔ CH3-CH(N)-OH;
- — восстановление. При взаимодействии альдегидов с водородом получаются первичные спирты:
- R-CH = O + H2 → R—CH2-OH;
- 2. Окисление
- — реакция «серебряного зеркала» — окисление альдегидов аммиачным раствором оксида серебра
- R-CH = O + Ag2O → R-CO-OH + 2Ag↓;
- — окисление альдегидов гидроксидом меди (II), в результате которого выпадает осадок оксида меди (I) красного цвета
- CH3-CH = O + 2Cu(OH)2 → CH3-COOH + Cu2O↓ + 2H2O;
- Эти реакции являются качественными реакциями на альдегиды.
Физические свойства альдегидов
Первый представитель гомологического ряда альдегидов – формальдегид (муравьиный альдегид) – газообразное вещество (н.у.), альдегиды неразветвленного строения и состава С2-С12 – жидкости, С13 и длиннее – твердые вещества.
Чем больше атомов углерода входит в состав неразветвленного альдегида, тем выше его температура кипения. С увеличением молекулярной массы альдегидов увеличиваются значения величин их вязкости, плотности и показателя преломления.
Формальдегид и ацетальдегид способны смешиваться с водой в неограниченных количествах, однако, с ростом углеводородной цепи эта способность альдегидов снижается. Низшие альдегиды обладают резким запахом.
Получение альдегидов
- Основные способы получения альдегидов:
- — гидроформилирование алкенов. Эта реакция заключается в присоединении СО и водорода к алкену в присутствии карбонилов некоторых металлов VIII группы, например, октакарбонилдикобальта (Cо2(СО)8) Реакция проводится при нагревании до 130С и давлении 300 атм
- СН3-СН = СН2 + СО +Н2 →СН3-СН2-СН2-СН = О + (СН3)2СНСН = О;
- — гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей ртути (II) и в кислой среде:
- НС≡СН + Н2О → СН3-СН = О;
- — окисление первичных спиртов (реакция протекает при нагревании)
- СН3-СН2-ОН + CuO → CH3-CH = O + Cu + H2O.
Применение альдегидов
Альдегиды нашли широкое применение в качестве сырья для синтеза различных продуктов. Так, из формальдегида (крупнотоннажное производство) получают различные смолы (фенол-формальдегидные и т.д.
), лекарственные препараты (уротропин); ацетальдегид — сырье для синтеза уксусной кислоты, этанола, различных производных пиридина и т.д. Многие альдегиды (масляный, коричный и др.
) используют в качестве ингредиентов в парфюмерии.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
Органические вещества обладают разными составными группами. У каждого соединения есть химическая формула, она определяет характерные химические свойства для альдегидов, карбоновых кислот, сложных эфиров. Знания о химических формулах, реакциях взаимодействия применяются в промышленности, фармакологии, научных лабораториях.
Химические свойства альдегидов
Альдегиды – химические соединения, содержащие карбонильную группу. То есть для альдегидов характерна следующая формула:
- R – радикал углеводорода, имеющий степень насыщения;
- CHO – альдегидная группа.
Альдегиды подразделяются по числу карбонильных групп, их максимальное количество – не более 3. В зависимости от насыщенности углеводорода выделяют предельные, непредельные ароматические альдегиды.
Гидрирование
Для гидрирования добавляют водород. Чтобы действие прошло быстрее и качественнее, применяют катализатор. Реакция происходит под влиянием высокой температуры. Альдегид превращается во вторичный спирт. Этому соответствует формула:
Окисление
Альдегиды окисляются под действием химических веществ. Для этого применимы мягкие соединения. Реакция происходит под действием высокой температуры. Во время реакции исчезает голубое окрашивание, появляется коричнево-красный оттенок. Выпадает мутный осадок. Формула:
Если использовать вместо гидроксида меди аммиачный раствор оксида серебра, образуется аммониевая соль. Формула реагирования аммиака с кислотами:
Помимо мягких окислителей, на альдегид действуют сильные вещества, например, дихромат калия. При взаимодействии веществ образуются карбоновые кислоты:
Химические свойства карбоновых кислот
Карбоновые кислоты – органические вещества, содержащие карбоксильную группу . Они включают 1 или 2 карбоксильные группы, которые содержат карбонильную и гидроксильную группу.
Так как эти вещества взаимодействуют между собой, связь OH обладает большей популярностью, чем фенолы и спирты. Поэтому карбоновые кислоты имеют сильные кислотные свойства.
Но если используется водный раствор, образуются свойства слабых кислот.
Реакции образования солей
- Взаимодействие карбоновой кислоты и аммиака:
- Реакция взаимодействия с оксидами:
- Реакция с гидроксидами металлов:
- Взаимодействие с солями слабых и высших кислот:
- 2CH3—COOH + NA2S = 2CH3COONa + H2S↑
- CH3COOH + KHCO3 = CH3COOK + H2O + CO2↑
- C17H35COONa + CH3COOH = CH3COONa + C17H35COOH↓
Реакции с участием гидроксильной группы
Если происходит взаимодействие карбоновых кислот и спиртов, образуется реакция этерификации. Образуются сложные эфиры по формуле:
Так как реакция обратима, ее осуществляют при помощи нагревания. Равновесие смещается с образованием сложного эфира. Если реакция обратилась, она называется гидролизом сложного эфира:
- Если требуется необратимая реакция, добавляют щелочи, в осадок выпадает соль:
- Реакция замещения атомов водорода в углеводородном заместителе
- Чтобы в карбоновых кислотах заместить атом водорода на галоген, требуется добавить хлор, бром, красный фосфор. Реакцию проводят при повышении температуры:
- Реакция декарбоксилирования
Если взять карбоновую кислоту с добавлением кальция, воздействовать на нее температурой, образуется углекислый кальций. Схожая реакция образуется под воздействием гидроксида натрия.
- Характеристика муравьиной кислоты
- В отличие от других кетоновых кислот, муравьиная кислота содержит две группы:
- альдегидная;
- карбоксильная.
- Из-за этого вещество проявляет свойства кислот и альдегидов. Выделяют следующие формулы:
- При взаимодействии муравьиной и серной кислоты остается вода, выделяется углекислый газ:
Химические свойства сложных эфиров
- Сложные эфиры – производные кислот с общей формулой:
- Сложные эфиры делятся на 2 класса:
- сложные эфиры карбоновых кислот (R1-COO-R2);
- ортоэфиры карбоновых кислот (R1-C(OR*)2-R**).
В отдельную группу выделяют лактоны. Это циклические сложные эфиры.
- Гидролиз
- Омыление для сложных эфиров проходит легко. Образуется спирт и обратимая водная кислота или необратимая щелочь:
Если сохраняются условия кислотного катализа, реакция обратима. Происходит расщепление сложного эфира при воздействии воды и температуры. Образуется карбоновая кислота, спирт. Это гидролиз сложного эфира:
- Если эфир взаимодействует с щелочью, реакция необратима. Карбоксилат анион не вступает в реакцию со спиртом:
- Реакция гидрирования или восстановления
- Если взаимодействуют сложные эфиры и водород, образуется два спирта:
- Реакция образования амидов
- При взаимодействии сложного эфира и аммиака появляется амид кислоты, спирт:
- Реакция горения
- При горении сложного эфира образуется оксид углерода и вода:
- 2СH3-COO-CH3 + 7O2 = 6CO2 + 6H2O
- Реакция присоединения
Если в эфире присутствует кислота или спирт, возможна реакция присоединения. То есть сложный эфир присоединяет водород.
Смотри также:






