- Периодический закон
- Группы и периоды Периодической системы
- Свойства таблицы Менделеева
- Лантаниды (редкоземельные элементы) и актиниды
- Галогены и благородные газы
- Переходные металлы
- Металлоиды
- Постпереходными металлами
- Неметаллы
- Коды ТНВЭД
- Металлы щелочные или щелочно-земельные; металлы редкоземельные, скандий и иттрий в чистом виде, в смесях или сплавах; ртуть
- Таблица Менделеева — периодическая таблица
- В чем особенность периодической таблицы менделеева?
- Группы цветных металлов
- ПОИСК
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории.
Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная.
Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
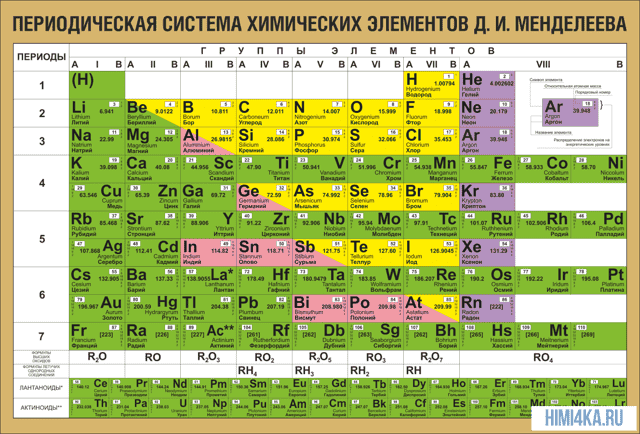 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом.
Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу.
Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме.
Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп.
Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов.
Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений.
В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы.
Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
- Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
- Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
- В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию.
Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами.
По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы.
Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов.
Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке.
В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е.
ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску.
В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке.
Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Коды ТНВЭД
| 2805 | Металлы щелочные или щелочноземельные; металлы редкоземельные, скандий и иттрий в чистом виде, в смесях или сплавах; ртуть: |
| — металлы щелочные или щелочно-земельные: | |
| 2805 11 000 0 | — — натрий |
| 2805 12 000 0 | — — кальций |
| 2805 19 | — — прочие: |
| 2805 19 100 0 | — — — стронций и барий |
| 2805 19 900 0 | — — — прочие |
| 2805 30 | — металлы редкоземельные, скандий и иттрий в чистом виде, в смесях или сплавах: |
| 2805 30 100 0 | — — смеси или сплавы |
| 2805 30 900 0 | — — прочие |
| 2805 40 | — ртуть: |
| 2805 40 100 0 | — — во флягах нетто-массой 34,5 кг (стандартная масса), ценой на условиях ФОБ за каждую флягу не более 224 евро |
| 2805 40 900 0 | — — прочая |
(А) Щелочные металлы
Пять следующих щелочных металлов представляют собой мягкое и достаточно легкое вещество. Они растворяются в холодной воде; они разлагаются на воздухе, образуя гидроокиси.
1) Литий
Это самый легкий (удельный вес 0,54) и самый твердый из металлов этой группы. Он хранится в минеральном масле или в инертных газах.
Литий способствует улучшению качественных характеристик металлов, применяется в различных сплавах (например, антифрикционные сплавы). Благодаря его свойствам, он используется, кроме прочего, для получения других металлов в чистом виде.
2) Натрий
Твердое вещество (удельный вес 0,97) с металлическим блеском, быстро тускнеющее после разрезания. Оно хранится в минеральном масле или в герметически запаянной оловянной посуде.
Натрий получают электролизом расплавленного хлорида натрия или гидроксида натрия.
Натрий используется в производстве пероксида натрия («диоксида»), цианида натрия, натрий-амида и т.п., в производстве индигокрасителей, при производстве взрывчатых веществ (химических взрывателей), при полимеризации бутадиена, используется в антифрикционных сплавах и в титановой или циркониевой металлургии.
Из этой товарной позиции исключается амальгама натрия (товарная позиция 2853).
3) Калий
Серебристо-белый металл (удельный вес 0,85), который можно разрезать обычным ножом. Он хранится в минеральном масле или в запаянной ампуле.
Калий используется при изготовлении некоторых фотоэлектрических элементов, используется в антифрикционных сплавах.
4) Рубидий
Серебристо-белое твердое вещество (удельный вес 1,5), более плавкий, чем натрий. Он хранится в запаянных ампулах или в минеральном масле.
- Подобно натрию, рубидий используется в антифрикционных сплавах.
- 5) Цезий
- Серебристо-белый или желтоватый металл (удельный вес 1,9), который воспламеняется при соприкосновении с воздухом; самый быстроокисляющийся металл; хранится в запаянных ампулах или в минеральном масле.
- Радиоактивный щелочной металл франций не включается в данную товарную позицию (товарная позиция 2844).
- (Б) Щелочноземельные металлы
- Три нижеуказанных щелочноземельных металла являются ковкими веществами, быстро и полностью растворимы в холодной воде; их качества ухудшаются при хранении во влажной атмосфере.
- 1) Кальций
Его получают алюмотермическим восстановлением оксида кальция или электролизом расплавленного хлорида кальция. Кальций представляет собой белый металл (удельный вес 1,57), используется при очистке аргона, при рафинировании меди и стали, в производстве циркония, гидрида кальция (гидролиз), в антифрикционных сплавах и т.п.
- 2) Стронций
- Белый или бледно-желтый тягучий металл (удельный вес 2,5).
- 3) Барий
- Белый металл (удельный вес 4,2); используется в некоторых антифрикционных сплавах и при изготовлении газопоглотителей для вакуумных трубок (товарная позиция 3824).
- Данная товарная позиция не включает радий, радиоактивный элемент (товарная позиция 2844), магний (товарная позиция 8104) и бериллий (товарная позиция 8112); все эти щелочноземельные металлы в некоторых аспектах являются сходными.
- (В) Редкоземельные металлы; скандий и иттрий в чистом виде, в смесях или сплавах
Редкоземельные металлы (термин «редкоземельный» относится к их оксидам) или лантаноиды включают элементы с атомными номерами (атомный номер элемента является общим числом орбитальных электронов, содержащихся в атоме этого элемента) с 57 по 71 в периодической системе, т.е.:
Прометий (элемент 61), который является радиоактивным элементом, классифицируется в товарной позиции 2844.
Редкоземельные металлы обычно имеют сероватый или желтоватый цвет, характеризуются тягучестью и ковкостью.
Церий, самый важный из группы, получают из монацита (фосфаты редкоземельных металлов) или из торита (силикаты редкоземельных металлов) после удаления тория.
Церий получают металлотермическим восстановлением галогенидов (галидов) при помощи кальция или лития, используемых в качестве восстановителя, или путем электролиза плавленого хлорида.
Он представляет собой серый тягучий металл, немного тверже свинца, при трении о грубую поверхность появляются искры.
Лантан, присутствующий в неочищенном виде в солях церия, используется в производстве голубого стекла.
В эту товарную позицию также включают скандий и иттрий, близко напоминающие редкоземельные металлы; скандий, кроме того, сходен с металлами группы железа. Эти два металла извлекают из тортвейтитовой руды, являющейся силикатом скандия и содержащей иттрий и другие элементы.
Эти элементы классифицируются в данной товарной позиции независимо от того, находятся они в смесях или в сплавах.
например, в данную товарную позицию включен «мишметалл», который является сплавом, содержащим от 45 до 55% церия, от 22 до 27% лантана, других лантаноидов, иттрия и различных примесей (до 5% железа, следы кремния, кальция, алюминия).
«Мишметалл» используется, в основном, в металлургии и для производства более легких видов кремния. В сплаве с железом (5% и более) или с магнием и другими металлами он классифицируется в других товарных позициях (например, если он имеет характер пирофорного сплава, то относится к товарной позиции 3606).
- Из этой товарной позиции исключаются соли и соединения редкоземельных металлов, иттрия и скандия (товарная позиция 2846).
- (Г) Ртуть
- Ртуть является единственным металлом, который при комнатной температуре находится в жидком состоянии.
- Ее получают путем обжига природного сульфида ртути (киновари) и отделяют от других металлов, содержащихся в руде (свинец, цинк, олово, висмут), путем фильтрации, дистилляции в вакууме и обработки разбавленной азотной кислотой.
Ртуть — это блестящая серебристо-окрашенная жидкость, тяжелая (удельный вес 13,59), токсичная и разъедающая драгоценные металлы. При комнатной температуре чистая ртуть на воздухе не окисляется, но металл с примесями покрывается коричневатой пленкой оксида ртути. Ртуть хранится в специальных железных контейнерах («колбах»).
Ртуть используется для приготовления амальгам, описанных в товарных позициях 2843 и 2852. Она используется для производства золота и серебра, позолоченных и посеребренных изделий и в производстве хлора, гидроксида натрия, солей ртути, искусственной киновари и фульминатов. Она также применяется в производстве ртутных ламп, используется в различных физических приборах, в медицине и т.п.
Металлы щелочные или щелочно-земельные; металлы редкоземельные, скандий и иттрий в чистом виде, в смесях или сплавах; ртуть
- (А) Щелочные металлы
- Пять щелочных металлов являются мягкими и достаточно легкими.
- Они разлагаются в холодной воде; на воздухе окисляются с образованием гидроксидов.
Это самый легкий (удельный вес 0,54) и самый твердый из металлов этой группы. Он хранится в минеральном масле или в инертных газах.
Литий способствует улучшению качественных характеристик металлов, применяется в различных сплавах (например, антифрикционные сплавы). Благодаря его высокому сродству к другим элементам он используется, inter alia, для получения других металлов в чистом виде.
Твердое вещество (удельный вес 0,97) с металлическим блеском, быстро тускнеющее после разрезания. Оно хранится в минеральном масле или в герметично запаянной оловянной посуде.
Натрий получают электролизом расплавленного хлорида натрия или гидроксида натрия.
Натрий используется в производстве пероксида натрия («диоксида»), цианида натрия, амида натрия и т.д., в производстве индиго, при производстве взрывчатых веществ (химических инициирующих взрывчатых веществ), при полимеризации бутадиена, используется в антифрикционных сплавах и в металлургии титана или циркония.
В данную товарную позицию не включается амальгама натрия (товарная позиция 2853).
Серебристо–белый металл (удельный вес 0,85), который можно разрезать обычным ножом. Он хранится в минеральном масле или в запаянных ампулах.
Калий используется при изготовлении некоторых фотоэлектрических элементов и в антифрикционных сплавах.
Серебристо–белое твердое вещество (удельный вес 1,5), плавится легче, чем натрий. Он хранится в запаянных ампулах или в минеральном масле.
- Подобно натрию, рубидий используется в антифрикционных сплавах.
- Серебристо–белый или желтоватый металл (удельный вес 1,9), который воспламеняется при соприкосновении с воздухом; самый быстроокисляющийся металл; хранится в запаянных ампулах или в минеральном масле.
- Радиоактивный щелочной металл франций не включается (товарная позиция 2844).
- (Б) Щелочно–земельные металлы
- Три нижеуказанных щелочно–земельных металла являются ковкими веществами, быстро и полностью разлагаются в холодной воде; их качества ухудшаются при хранении во влажной атмосфере.
Его получают алюмотермическим восстановлением оксида кальция или электролизом расплавленного хлорида кальция. Кальций представляет собой белый металл (удельный вес 1,57), используется при очистке аргона, при рафинировании меди или стали, в производстве циркония, гидрида кальция (гидролит), в антифрикционных сплавах и т.п.
- Белый или бледно–желтый тягучий металл (удельный вес 2,5).
- Белый металл (удельный вес 4,2); используется в некоторых антифрикционных сплавах и при изготовлении газопоглотителей для вакуумных трубок (товарная позиция 3824).
- В данную товарную позицию не включаются радий, радиоактивный элемент (товарная позиция 2844), магний (товарная позиция 8104) или бериллий (товарная позиция 8112); все эти щелочно–земельные металлы в некоторых аспектах являются сходными.
- (В) Редкоземельные металлы; скандий и иттрий в чистом виде или в смесях или сплавах
Редкоземельные металлы (термин «редкоземельный» относится и к их оксидам) или лантаноиды включают элементы с атомными номерами 2*) 57 – 71 в периодической системе, а именно:
| Группа церия | Группа тербия | Группа эрбия | |||
| 57 | лантан | 63 | европий | 66 | диспрозий |
| 58 | церий | 64 | гадолиний | 67 | гольмий |
| 59 | празеодим | 65 | тербий | 68 | эрбий |
| 60 | неодим | 69 | тулий | ||
| 62 | самарий | 70 | иттербий | ||
| 71 | лютеций |
Прометий (элемент 61), который является радиоактивным элементом, включается в товарную позицию 2844.
Редкоземельные металлы обычно имеют сероватый или желтоватый цвет, характеризуются тягучестью или ковкостью.
Церий, самый важный из группы редкоземельных элементов, получают из монацита (фосфаты редкоземельных металлов) или из торита (силикаты редкоземельных металлов) после удаления тория.
Церий получают металлотермическим восстановлением галогенидов с помощью кальция или лития, используемых в качестве восстановителя, или путем электролиза плавленого хлорида.
Он представляет собой серый тягучий металл, немного тверже свинца, при трении которого о грубую поверхность появляются искры.
Лантан, присутствующий в неочищенном виде в солях церия, используется в производстве голубого стекла.
В данную товарную позицию также включаются скандий и иттрий, очень похожие на редкоземельные металлы, скандий, кроме того, сходен с металлами группы железа. Эти два металла извлекают из тортвейтитовой руды, являющейся силикатом скандия и содержащей иттрий и другие элементы.
Эти элементы включаются в данную товарную позицию независимо от того, находятся они в смесях или в сплавах.
Например, в данную товарную позицию включен «мишметалл», который является сплавом, содержащим 45 – 55% церия, 22 – 27% лантана, другие лантаноиды, иттрий и различные примеси (до 5% железа, следы кремния, кальция, алюминия). «Мишметалл» используется в основном в металлургии и для производства более прозрачных оптических стекол.
В сплаве, где железа более 5%, или с магнием или другими металлами он классифицируется в других товарных позициях (например, если он имеет свойства пирофорного сплава, то включается в товарную позицию 3606).
- В данную товарную позицию не включаются соли и соединения редкоземельных металлов, иттрия и скандия (товарная позиция 2846).
- (Г) Ртуть
- Ртуть является единственным металлом, который при комнатной температуре находится в жидком состоянии.
- Ее получают путем обжига природного сульфида ртути (киновари) и отделяют от других металлов, содержащихся в руде (свинец, цинк, олово, висмут), путем фильтрации, дистилляции в вакууме и обработки разбавленной азотной кислотой.
Ртуть – это блестящая серебристая жидкость, тяжелая (удельный вес 13,59), токсичная и разъедающая драгоценные металлы. При комнатной температуре чистая ртуть на воздухе не окисляется, но металл с примесями покрывается коричневатой пленкой оксида ртути. Ртуть хранится в специальных железных сосудах («колбах»).
Ртуть используется для приготовления амальгам (товарная позиция 2843 или 2853). Она используется в металлургии золота и серебра, в производстве позолоченных и посеребренных изделий и в производстве хлора, гидроксида натрия, солей ртути, искусственной киновари или фульминатов. Она также применяется в производстве ртутных ламп и в различных физических приборах, в медицине и т.п.
Таблица Менделеева — периодическая таблица
Периодической системой химических элементов принято называть таблицу, в которой химические элементы классифицируются по разным свойствам, определяемым зарядом атомного ядра. Называют ее периодической таблицей Менделеева, в честь российского ученого-химика Д.И. Менделеева. Именно он в 1869 году открыл периодический закон химических элементов.
В 1869-1871 был разработан самый первый вариант таблицы, в котором определялась зависимость свойств химических элементов от атомной массы. Было выдвинуто множество предложений относительно того, как изображать свойства элементов. Это были различные геометрические фигуры, графики с аналитическими кривыми.
- Но ученые приняли решение, что удобнее всего двухмерная химическая таблица, где каждый столбик указывает на физико-химические свойства определенного элемента, а в строках определяются периоды элементов, максимально близких один к другому.
- Значение таблицы Менделеева для науки
- Развитие химии в значительной степени обязано открытию, сделанному Менделеевым, в частности, оно способствовало развитию учения про атомы и молекулы.
Благодаря этому было получено понятное представление про простые и сложные химические соединения. Человек может понять, что такое элементы, которые используются сегодня. В ХХ веке периодическая система начала играть прогнозирующую роль, когда оцениваются химические свойства трансурановых элементов, которую показал еще сам Менделеев.
Периодическая таблица позволила систематизировать типы атомов, что имела большое значение для развития физики (атом и его ядро) в ХХ веке. Так, в начале века ученые проводили исследования, в ходе которых было установлено, что порядковый номер элемента является мерой электронного заряда его атомного ядра.
Номер же периода в таблице указывает на число электронных оболочек, которыми обладает атом. На фото было установлено, что номером вертикального ряда таблицы определяется квантовая структура внешней оболочки элемента (этим обусловлен тот факт, что химические свойства у элементов, которые находятся в одном ряду, схожи между собой).
Сделанное Менделеевым открытие положило начало новой эры в мировой науке, что позволило сделать огромный прорыв в химии и ряде других направлениях науки. Таблица Менделеева в хорошем качестве стала основой сведений про элементы, ее использование позволило делать важные выводы в науке, прогнозировать открытия.
В чем особенность периодической таблицы менделеева?
Одним из важных свойств таблицы можно назвать то, что у группы элементов (колонка) более выражена периодическая тенденция, если сравнивать с периодами или блоками.
Также можно увидеть, что по мере того, как возрастает атомная масса, стабильно изменяются свойства. Так, к примеру, фотография таблицы дает возможность увидеть, что в блоках D и F более явно выражены горизонтальные свойства, а не вертикальные.
Группам таблицы Менделеева с лева на право присвоено номера 1-18, в соответствии с международной системой названия групп. Ранее использовались римские цифры.
Вступление в силу новой системы нотации ИЮПАК (1988 г.), которой пользуются и сегодня, привело к тому, что прежние идентификаторы групп перестали существовать.
У многих групп появились травиальные несистематические названия, к примеру, «галогены», «щелочноземельные металлы» и др.
Химические элементы из одной группы периодической таблицы Менделеева проявляют тенденции по таким параметрам:электроотрицательность, атомный радиус, энергия ионизации.
Так, картинка химической таблицы показывает, что в одной группе сверху в низ возрастает радиус атома, валентные электроны элемента удаляются от ядра по мере того, как заполняются энергетические уровни.
Энергия ионизации при этом снижается, связи в атоме слабеют, в результате чего изымать электроны проще. Сверху вниз у элементов снижается электроотрицательность, что объясняется увеличением расстояния между ядром и валентными электронами.
Но в таблице есть и исключения из таких закономерностей, к примеру, в 11 группе данный показатель растет сверху вниз.
Группы цветных металлов
Написать автору
Цветные металлы разделяют на следующие группы: тяжёлые металлы, лёгкие металлы, благородные металлы, малые металлы, тугоплавкие металлы, рассеянные металлы, радиоактивные металлы.
Группы цветных металлов Цветные металлы разделяют на следующие группы:
- тяжёлые металлы — медь, никель, цинк, свинец, олово
- лёгкие металлы — алюминий, магний, титан, бериллий, кальций, стронций, барий, литий, натрий, калий, рубидий, цезий
- благородные металлы — золото, серебро, платина, осмий, рутений, родий, палладий
- малые металлы — кобальт, кадмий, сурьма, висмут, ртуть, мышьяк
- тугоплавкие металлы — вольфрам, молибден, ванадий, тантал, ниобий, хром, марганец, цирконий
- редкоземельные металлы — лантан, церий, празеодим, неодим, самарий, европий, гадолиний, тербий, иттербий, диспрозий, гольмий, эрбий, тулий, лютеций, прометий, скандий, иттрий
- рассеянные металлы — индий, германий, таллий, таллий, рений, гафний, селен, теллур
- радиоактивные металлы — уран, торий, протактиний, радий, актиний, нептуний, плутоний, америций, калифорний, эйнштейний, фермий, менделевий, нобелий, лоуренсий
Цветные металлы и их сплавы широко применяются в технике.
К наиболее важным цветным металлам относятся алюминий и алюминиевые сплавы (дюралюминий), медь и её сплавы — бронза и латунь, магний, никель, титан и мягкие металлы — олово, свинец и цинк.
В сплавах часто используются такие металлы, как сурьма, висмут, кадмий, ртуть, кобальт, хром, молибден, вольфрам и ванадий. Последние четыре металла условно относят к ферросплавам, хотя они могут содержать железо лишь в виде примеси.
Медь
Технически чистая медь обладает высокой пластичностью и коррозийной стойкостью, высокой электропроводностью и теплопроводностью (100% чистая медь-эталон, то 65%-алюминий, 17% железо), а также стойкостью против атмосферной коррозии. Позволяет использовать ее в качестве кровельного материала ответственных зданий. Температура плавления меди 1083°С. Кристаллическая решетка гранецентрированная кубическая ГЦК. Плотность меди 8,94 г/см3 . Благодаря высокой пластичности медь хорошо обрабатывается давлением (из меди можно сделать фольгу толщиной 0,02 мм), плохо резанием.
Литейные свойства меди низкие из-за большой усадки.На электрические свойства меди большое влияние оказывают примеси: все, кроме серебра и бериллия ухудшают электропроводность даже в сотых долях процентного содержания. Из меди марки М1 производят медный лист , пруток, медную ленту, трубку. Электротехническую медную проволоку производят из меди марки ММ.
Бронза
Бронзы – это сплавы меди с оловом (4-33% Sn), свинцом (до 30% Pb), алюминием (5-11% AL), кремнием (4-5% Si), сурьмой, фосфором и другими элементами. Бронзы – это сплавы меди, в которых цинк не является основным легирующим элементом. Общей характеристикой бронз является высокая коррозионная стойкость и антифрикционность. Бронзы отличаются высокой коррозионной устойчивостью и антифрикционными свойствами. Из них изготавливают вкладыши подшипников скольжения, венцы червячных зубчатых колес и другие детали.
Высокие литейные свойства некоторых бронз позволяют использовать их для изготовления художественных изделий, памятников, колоколов. Бронзовая втулка (бронзовая труба) широко используется в промышленности, машиностроении, станкостроении.
По химическому составу делятся на оловянные бронзы и без оловянные (специальные бронзы).
- Латунь
- Алюминий
- Источник: Цветные металлы — металлопрокат
Латунь – сплав меди с цинком (до 50% Zn) и небольшими добавками алюминия, кремния, свинца, никеля, марганца (ГОСТ 15527-70, ГОСТ 17711-80). Медные сплавы (латуни), предназначенные для изготовления деталей методами литья, называют литейными, а сплавы, предназначенные для изготовления деталей пластическим деформированием – сплавами, обрабатываемыми давлением. Латуни дешевле меди и превосходят ее по прочности, вязкости и коррозионной стойкости. Обладают хорошими литейными свойствами. Латуни, применяются в основном для изготовления деталей штамповкой, вытяжкой, раскаткой, вальцовкой, т.е. процессами, требующими высокой пластичности материала заготовки. Из латуни изготавливаются гильзы различных боеприпасов. В зависимости от числа компонентов различают простые (двойные) и специальные (многокомпонентные) латуни. Простые латуни содержат только Cu и Zn. Специальные латуни содержат от 1 до 8% различных легирующих элементов, повышающих механические свойства и коррозионную стойкость. Алюминий, марганец и никель повышают механические свойства и коррозионную стойкость латуней. Свинец улучшает обрабатываемость резанием. Кремнистые латуни обладают хорошей жидкотекучестью и свариваемостью. Алюминий – лёгкий цветной металл серебристо-белого цвета. Температура плавления алюминия 650°С. Алюминий имеет кристаллическую гранецентрированную кубическую ГЦК решетку, обладает хорошей электрической проводимостью, составляющей 65% электрической проводимости меди. Алюминий занимает 3 место по распространению в земной коре после кислорода и кремния. Алюминий устойчив против атмосферной коррозии благодаря образованию на его поверхности плотной окисной пленки. Наиболее важной особенностью алюминия является низкая плотность – 2,7г/см3 против 7,8г/см3 для железа и 8,94г/см3 для меди. Имеет хорошую тепло- и электропроводность. Алюминий и его сплавы (в большинстве случаев) хорошо обрабатываются давлением.
ПОИСК
Палладий Pd Платина Pt Плутоний Ри Празеодим Рг Рений Re Родий Rh Ртуть Hg Рубидий Rb Рутений Ru Самарий Sm Свинец РЬ Селен Se Сера S Серебро Ag Скандий S Стронций Sr Сурьма Sb Таллий Т1 Тантал Та Теллур Те Тербий ТЬ Титан Ti Торий Th Тулий Ти
[c.9]
Рубидий КЬ Рутений Ри Самарий. тп Свинец РЬ Селен Se Сера S Серебро Скандий 5с Стронций 5г Сурьма Sb Таллий TI Тантал Та Теллур Те
[c.306]
Селен — Ст Серебро — Ср Скандий — Скм Сурьма — Су Таллий — Тл Тантал — ТТ
[c.234]
Многочисленные цветные металлы в свою очередь подразделяются в зависимости от физико-механических свойств на ряд групп тяжелые (медь, никель, свинец, цинк, олово) легкие (алюминий, магний, кальций, бериллий, титан, литий, барий, стронций, натрий, калий, рубидий, цезий) благородные (золото, серебро, платина, осмий, рутений, родий, палладий) редкие металлы. Последние в свою очередь условно делят на тугоплавкие (вольфрам, молибден, ванадий, тантал, ниобий, цирконий) редкоземельные (скандий, иттрий, лантан, церий, празеодим, неодим, самарий, европий и др.) рассеянные (германий, рений, селен и др.) и радиоактивные (уран, торий, радий, протактиний).
[c.20]
Цветные металлы, в свою очередь, подразделяют в зависимости от их физико-механических свойств на ряд групп тяжелые (никель, медь, цинк, олово, свинец), легкие (литий, бериллий, натрий, магний, алюминий, калий, кальций, титан, рубидий, стронций, цезий, барий) благородные (рутений, родий, палладий, серебро, осмий, платина, золото) и редкие, которые, в свою очередь, условно делят на тугоплавкие (ванадий, цирконий, ниобий, молибден, тантал, вольфрам), редкоземельные (скандий, иттрий, лантан, церий, празеодим, неодим, самарий, европий и др.), рассеянные (германий, селен, рений и др.) и радиоактивные (радий, торий, протактиний, уран).
[c.5]
- Углерод О Натрий Кремний Spi Фосфор Р32 Сера S33 Калий КЖелезо Кобальт Со Никель NiG Медь uS4 Цинк Zn Германий Ge»i Мышьяк As Селен Se j Цирконий Zr js Олово Sn i Сурьма Sbl [c.70]
-
КАЛИЙ КАЛЬЦИЙ СКАНДИИ ТИТАН ВАНАДИЙ ХРОМ МАРГАНЕЦ ЖЕЛЕЗО КиБАЛЬТ НИКЕЛЬ МЕДЬ цинк ГАЛЛИЙ ГЕРМАНИЙ ммшьяк СЕЛЕН ВРОМ КРИПТОН
[c.49] -
Никель Ниобий Олово Осмий Палладий Платина Полоний Празеодим Протактиний Радий Рений Родий Ртуть Рубидий Рутений Самарий Свинец обыкновенный Свинец тори-евый Свинец урановый Селен Сера Серебро Скандий Стронций Сурьма Таллий Тантал Теллур Тербий Титан Торий Тулий Углерод Уран Фосфор Фтор Хлор Хром Цезий Церий Цинк Цирконий Эманация Эрбий
[c.27]
Самарий. . Свинец обыкн Свинец торие вый. … Свинец урано вый. … Селен. … Сера. … Серебро.. . Скандий. , Стронций. . Сурьма. . . [c.971]
А) по сравнению с остальными металлами IV — VIII групп, аналогично щелочноземельцым металлам — скандию, иттрию и лантаноидам (которые имеют тоже большие радиусы) —образуют с селеном структуры ти-
[c.24]
Ш К Кати 20 Са 0 Кальций П S 0 Скандий г Ti 0Ш Титан 23. V Ватдий 2 . Сг Хром Л Мл Марганец 26 Fe Железо 21 Со 0 Кобальт 23. Ni Никель 29 u Медь 30. In 0 UuHH 31 6(3 О Га,ъш зг e s Германш 33 йъ о Мышьяк 34 Se 0 Селен 35 бг О бром [c.11]
Литий Натрий. Калий Рубидий. Цезий. . Медь. . Серебро. Золото Бериллий Магний. Кальций Стронций Барий, . Радий. . Цинк. . Кадмий Ртуть. . Бор. . . Алюминий Скандий. Иттрий Лантан. Актиний Галлий Индий Таллий Кремний Германий Олово. . Свинец Титан. .
Цирконий Гафний. Ванадий. Ниобий. Тантал Сурьма. Висмут Хром. . Молибден Вольфрам Селен. . Теллур. Марганец Рений. . Железо. Кобальт. Никель Рутений. Родий. . Палладии Осмнй. . Иридий. Платина Торий. . Уран. . Лантан Церий
[c.
293]
К калий 39,096 20 Са кальций 40,08 21 8с скандий 45.10 22 Т1 титан 4 7.90 23 V панадий 50,95 24 Сг хром 52,01 25 Мп марганец 54.93 26 Fe железо 55,85 27 Со кобальт 58,94 28 N1 никель 58.69 29 Си мель 63.54 30 Zn цинк 05,38 31 Оа галлий 69.72 32 Ое германий 72,60 33 As мышьяк 74,91 34 8е селен 78,96 35 Вг бром 79,916 36 Кг криптон 83,7
[c.10]
Неодим Неон Никель Ниобий Олово. Осмий. Палладий Платина Полоний Празеодим Протакти ний. . Радий. Радон Рений. Родий. Ртуть Рубидий Рутений Самарий Свинец, Селен. , Сера. . Серебро Скандий Строицлй Сурьма. Таллий, Тантал Теллур Тербий. Титан. Гор ИЙ. Тулий. Углсфод уран. . Фосфор Фтор. . Хлор. . Хром. . Цезий. [c.271]
На ВНИИХТ возлагалась задача создания технологии переработки радиоактивных и редкометаллических руд с получением исходных химических соединений для нужд оборонной промышленности ( фан, торий, литий, бериллий) и зарождающейся атомной энергетики, в том числе конструкционных материалов (цирконий, гафний, тантал, ниобий). В сферу деятельности ВНИИХТа вошли также такие ценные элементы, как молибден, вольфрам, скандий, ванадий, рений, селен, редкоземельные элементы, золото, серебро, металлы платиновой группы, многие из которых присутствуют в урановых рудах. Главными задачами являлись разработка технологий эффективного извлечения зфана и сопутствующих элементов, создание малоотходных экологически безопасных производств, экономное расходование реагентов, материалов и энергоресурсов.
[c.307]
Селен Титан, ванадий, марганец, никель, медь, цинк, алюминий, олово, иттрий, цирконий, молиб- ден, железо, палладий, серебро, кадмий, скандий, лантан, гафний, торий, уран, кобальт, платина, серебро, золото, ртуть, галлий, индий, таллий, сурьма, свинец, висмут (10 5) Экстракция примесей в виде оксихинолинатов и дитизонатов То же 45
[c.15]
Смотреть страницы где упоминается термин Скандий — селен
:
[c.338]
[c.257]
[c.403]
[c.6]
Смотреть главы в:
Диаграммы состояния двойных металлических систем Т.3
-> Скандий — селен
Селенит —
Скандий
© 2021 Mash-xxl.info Реклама на сайте