- Общая характеристика элементов IVa группы
- Природные соединения
- Получение
- Химические свойства
- Оксид углерода II — СO
- Оксид углерода IV — CO2
- Угольная кислота
- Углерод: формула, химические свойства, характеристики
- Строение углерода
- Аллотропия углерода
- Алмаз
- Графит
- Графен
- Карбин
- Уголь
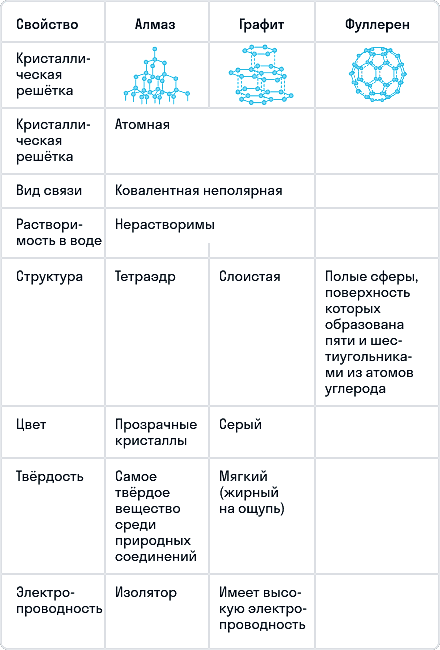
- Сравнение основных аллотропных модификаций углерода
- Нахождение углерода в природе
- Доля углерода в составе горючих ископаемых
- Химические свойства углерода
- Углерод — характеристика элемента и химические свойства
- Химические свойства углерода
- Углерод как восстановитель:
- Углерод как окислитель:
- Нахождение углерода в природе
- Неорганические соединения углерода
- Оксид углерода (II) СО
- Оксид углерода (IV) СO 2
- Угольная кислота и её соли
- Карбиды
- Цианиды
- Карбонаты
- Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
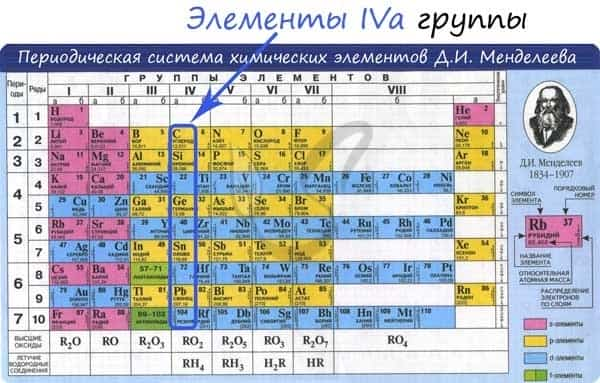
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
- C + H2 → (t) CH4 (метан)
- 2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
- С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
- С + F2 → (t) CF4
- Реакции с металлами
- Ca + C → CaC2 (карбид кальция, СО углерода = -1)
- Al + C → Al4C3 (карбид алюминий, СО углерода -4)
- Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
- Восстановительные свойства
- Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
- Fe2O3 + C → Fe + CO2
- ZnO + C → Zn + CO
- FeO + C → Fe + CO
- Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
- SiO2 + C → (t) Si + CO
- Может восстановить и собственный оксид:
- CO2 + C → CO
- Реакция с водой
- Реакции с кислотами
- В реакциях с кислотами углерод проявляет себя как восстановитель:
- C + HNO3(конц.) → (t) CO2 + NO2 + H2O
- C + HNO3 → CO2 + NO + H2O
- C + H2SO4(конц.) → CO2 + SO2 + H2O
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.


Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
- Получение
- В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
- CO2 + C → (t) CO
- C + H2O → (t) CO + H2
- В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
- HCOOH → (H2SO4) CO + H2O
- Химические свойства
- Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
- CO + O2 → CO2
- Fe2O3 + CO → Fe + CO2
- FeO + CO → Fe + CO2
- Образование карбонилов — чрезвычайно токсичных веществ.
- Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
- Получение
- В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
- CaCO3 → (t) CaO + CO2↑
- C6H12O6 → C2H5OH + CO2↑
- В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
- CaCO3 + HCl → CaCl2 + H2O + CO2↑
- Углекислый газ образуется при горении органических веществ:
- C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
- 2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
- KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
- Na2O + CO2 → Na2CO3
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ. CO2 + H2O ⇄ H2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
- Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
- CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)
- Средние и кислые соли
- Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
- Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
- LiHCO3 + LiOH → Li2CO3 + H2O
- Нагревание солей угольной кислоты
- При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
- MgCO3 → (t) MgO + CO2
- KHCO3 → (t) K2CO3 + CO2↑ + H2O
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха. MgCO3 + HCl → MgCl2 + CO2↑ + H2O Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Углерод: формула, химические свойства, характеристики
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
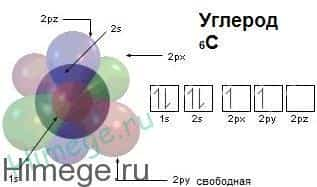
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой.
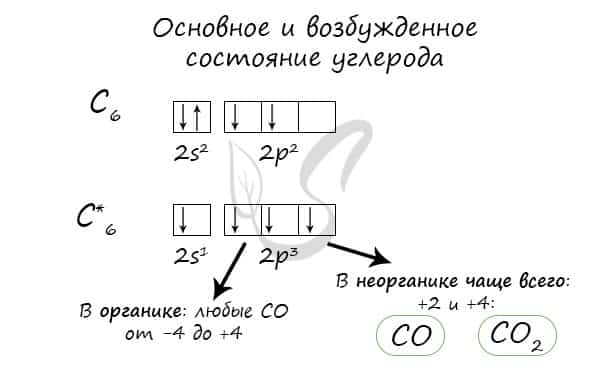
Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен.
Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное.
Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
-
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
-
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность.
Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий.
Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
- Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
- На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
- При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния.
Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется.
Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
- Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
- Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
- Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли «Элементы», углерод занимает 11-е место по распространенности в природе. Содержание углерода составляет 0,1% массы земной коры. Свободный углерод представлен в виде алмаза и графита.
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Доля углерода в составе горючих ископаемых
Химические свойства углерода
Химические свойства углерода добавить в закладки
Химический элемент углерод расположен во 2-м периоде, главной подгруппе IV группы периодической системы химических элементов, наиболее характерные степени окисления –4, +2, +4.
На внешнем энергетическом уровне у углерода 4 электрона: 2 парных и 2 непарных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние, он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
- Возможные степени окисления: -4, 0, +2, +4
- В связи со всем выше сказанным углерод проявляет окислительные и восстановительные свойства.
- I. Окислительные свойства
- Свойства окислителя углерод проявляет в реакциях с металлами при высоких температурах с образованием карбидов.
Са + 2С → CaC2 4Al + 3C → Al4C3
- В присутствии катализатора и высоких температур протекает процесс взаимодействия углерода и водорода, при этом образуется метан.
C + 2H2 → CH4↑
II. Восстановительные свойства
- Как восстановитель углерод вступает в реакцию с кислородом. Продуктом реакции будет углекислый газ – при избытке кислорода, при недостатке – угарный газ.
C + O2 → CO2↑ 2C + O2 → 2CO
- При комнатной температуре углерод вступает в реакцию взаимодействия только с одним галогеном – фтором, с образованием фторида углерода.
C + 2F2 → CF4
- С азотом углерод реагирует при действии электрического разряда, образуя соединение, получившее название дициан. Представляет собой бесцветный высокотоксичный и огнеопасный газ с резким запахом.
N2 + 2C → (CN)2
- Реакция с серой и кремнием углерода протекает при повышенных температурах. С серой продуктом реакции является сероуглерод — бесцветная жидкость, легко воспламеняется, хороший растворитель для некоторых органических соединений.
- C + 2S → CS2
- С кремнием углерод образует каброрунд – соединение по твердости сравнимое с алмазом.
- Si + C → SiC
- При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород.
- Из кислотного оксида, в данном случае оксида кремния, углерод восстанавливает кремний.
- Углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции.
C + CaO → CaC2 + CO↑
- Углерод используют для получения металлов из их оксидов (цинк, медь, железо, свинец). Это один из способов промышленного получения металлов.
2ZnO + C → 2Zn + CO
- Углерод в качестве восстановителя вступает в реакции со сложными веществами, проявляющими свойства окислителей. Такими веществами являются концентрированная серная и азотная кислоты.
- Продуктом реакции серной кислоты и углерода являются оксид серы (IV), оксид углерода (IV) и вода.
- C + 2H2SO4 (конц.) → CO2↑ + 2SO2 + 2H2O
- Вследствие реакции углерода с азотной кислотой образуются оксид азота (IV), оксид углерода (IV) и вода.
- C + 4HNO3 (конц.) → CO2↑ + 4NO2 + 2H2O
Углерод — характеристика элемента и химические свойства
Характеристика углерода. Свойства простых веществ и соединений
 Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа .
Атом углерода имеет 6 электронов: 1s 2 2s 2 2p 2 . Последние два электрона располагаются на отдельных р-орбиталях и являются неспаренными. В принципе, эта пара могла бы занимать одну орбиталь, но в таком случае сильно возрастает межэлектронное отталкивание. По этой причине один из них занимает 2р х , а другой, либо 2р у , либо 2р z -орбитали.
Различие энергии s- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 2s-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1s 2 2s 1 2p x 1 2p y 1 2p z 1 . Именно такое состояние атома углерода характерно для решетки алмаза — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и энергия связей.
Это явление, как известно, называют sp 3 -гибридизацией, а возникающие функции – sp 3 -гибридными . Образование четырех sp 3 -связей обеспечивает атому углерода более устойчивое состояние, чем три р—р- и одна s—s-связи.
Помимо sp 3 -гибридизации у атома углерода наблюдается также sp 2 — и sp-гибридизация . В первом случае возникает взаимное наложение s- и двух р-орбиталей. Образуются три равнозначные sp 2 — гибридных орбитали, расположенные в одной плоскости под углом 120° друг к другу.
Третья орбиталь р неизменна и направлена перпендикулярно плоскости sp 2 .
При sp-гибридизации происходит наложение орбиталей s и р. Между двумя образующимися равноценными гибридными орбиталями возникает угол 180°, при этом две р-орбитали у каждого из атомов остаются неизменными.
Аллотрорпия углерода. Алмаз и графит
В кристалле графита атомы углерода расположены в параллельных плоскостях, занимая в них вершины правильных шестиугольников. Каждый из атомов углерода связан с тремя соседними sp 2 -гибридными связями. Между параллельными плоскостями связь осуществляется за счет ван-дер-ваальсовых сил.
Свободные р-орбитали каждого из атомов направлены перпендикулярно плоскостям ковалентных связей. Их перекрыванием объясняется дополнительная π-связь между атомами углерода.
Таким образом, от валентного состояния, в котором находятся атомы углерода в веществе, зависят свойства этого вещества .
Химические свойства углерода
Наиболее характерные степени окисления: +4, +2.
При низких температурах углерод инертен, но при нагревании его активность возрастает.
Углерод как восстановитель:
- — с кислородом C 0 + O 2 – t° = CO 2 углекислый газ при недостатке кислорода — неполное сгорание:
- 2C 0 + O 2 – t° = 2C +2 O угарный газ
- — со фтором С + 2F 2 = CF 4
- — с водяным паром C 0 + H 2 O – 1200° = С +2 O + H 2 водяной газ
— с оксидами металлов. Таким образом выплавляют металл из руды. C 0 + 2CuO – t° = 2Cu + C +4 O 2
— с кислотами – окислителями: C 0 + 2H 2 SO 4 (конц.) = С +4 O 2 + 2SO 2 + 2H 2 O С 0 + 4HNO 3 (конц.) = С +4 O 2 + 4NO 2 + 2H 2 O
— с серой образует сероуглерод: С + 2S 2 = СS 2 .
Углерод как окислитель:
- — с некоторыми металлами образует карбиды
- 4Al + 3C 0 = Al 4 C 3
- Ca + 2C 0 = CaC 2 -4
- — с водородом — метан (а также огромное количество органических соединений)
- C 0 + 2H 2 = CH 4
- — с кремнием, образует карборунд (при 2000 °C в электропечи):
- Si + C = SiC.
Нахождение углерода в природе
Ссвободный углерод встречается в виде алмаза и графита.
В виде соединений углерод находится в составе минералов: мела, мрамора, известняка – СаСО 3 , доломита – MgCO 3 *CaCO 3 ; гидрокарбонатов – Mg(НCO 3 ) 2 и Са(НCO 3 ) 2 , СО 2 входит в состав воздуха; углерод является главной составной частью природных органических соединений – газа, нефти, каменного угля, торфа, входит в состав органических веществ, белков, жиров, углеводов, аминокислот, входящих в состав живых организмов.

Неорганические соединения углерода
Ни ионы С 4+ , ни С 4- ‑ ни при каких обычных химических процессах не образуются: в соединениях углерода имеются ковалентные связи различной полярности.
Оксид углерода (II) СО
Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, t°кип = -192°C; t пл. = -205°C.
- Получение 1) В промышленности (в газогенераторах):
- C + O 2 = CO 2
- CO 2 + C = 2CO
- 2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H 2 SO 4 (конц.): HCOOH = H 2 O + CO
- H 2 C 2 O 4 = CO + CO 2 + H 2 O
- Химические свойства
- При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид.
- 1) с кислородом
- 2C +2 O + O 2 = 2C +4 O 2
- 2) с оксидами металлов
- C +2 O + CuO = Сu + C +4 O 2
- 3) с хлором (на свету)
- CO + Cl 2 – hn = COCl 2 (фосген)
- 4) реагирует с расплавами щелочей (под давлением)
- CO + NaOH = HCOONa (формиат натрия)
- 5) с переходными металлами образует карбонилы
- Ni + 4CO – t° = Ni(CO) 4
- Fe + 5CO – t° = Fe(CO) 5
Оксид углерода (IV) СO 2
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H 2 O растворяется 0,9V CO 2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO 2 называется «сухой лёд»); не поддерживает горение.
Получение
- Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO 3 – t° = CaO + CO 2
- Действием сильных кислот на карбонаты и гидрокарбонаты:
- CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2
- NaHCO 3 + HCl = NaCl + H 2 O + CO 2
- Химические свойства СO 2 Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
- Na 2 O + CO 2 = Na 2 CO 3
- 2NaOH + CO 2 = Na 2 CO 3 + H 2 O
- NaOH + CO 2 = NaHCO 3
- При повышенной температуре может проявлять окислительные свойства
- С +4 O 2 + 2Mg – t° = 2Mg +2 O + C 0
- Качественная реакция
- Помутнение известковой воды:
- Ca(OH) 2 + CO 2 = CaCO 3 ¯(белый осадок) + H 2 O
Оно исчезает при длительном пропускании CO 2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO 3 + H 2 O + CO 2 = Сa(HCO 3 ) 2
Угольная кислота и её соли
- H 2 CO 3 — Кислота слабая, существует только в водном растворе:
- CO 2 + H 2 O ↔ H 2 CO 3
- Двухосновная: H 2 CO 3 ↔ H + + HCO 3 — Кислые соли — бикарбонаты, гидрокарбонаты HCO 3 — ↔ H + + CO 3 2- Средние соли — карбонаты
- Характерны все свойства кислот.
- Карбонаты и гидрокарбонаты могут превращаться друг в друга:
- 2NaHCO 3 – t° = Na 2 CO 3 + H 2 O + CO 2
- Na 2 CO 3 + H 2 O + CO 2 = 2NaHCO 3
- Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
- CuCO 3 – t° = CuO + CO 2
- Качественная реакция — «вскипание» при действии сильной кислоты:
- Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
- CO 3 2- + 2H + = H 2 O + CO 2
Карбиды
- Карбид кальция:
- CaO + 3 C = CaC 2 + CO
- CaC 2 + 2 H 2 O = Ca(OH) 2 + C 2 H 2 .
- Ацетилен выделяется при реакции с водой карбидов цинка, кадмия, лантана и церия:
- 2 LaC 2 + 6 H 2 O = 2La(OH) 3 + 2 C 2 H 2 + H 2 .
- Be 2 C и Al 4 C 3 разлагаются водой с образованием метана:
- Al 4 C 3 + 12 H 2 O = 4 Al(OH) 3 = 3 CH 4 .
- В технике применяют карбиды титана TiC, вольфрама W 2 C (твердые сплавы), кремния SiC (карборунд – в качестве абразива и материала для нагревателей).
Цианиды
получают при нагревании соды в атмосфере аммиака и угарного газа:
Na 2 CO 3 + 2 NH 3 + 3 CO = 2 NaCN + 2 H 2 O + H 2 + 2 CO 2
Синильная кислота HCN – важный продукт химической промышленности, широко применяется в органическом синтезе. Ее мировое производство достигает 200 тыс. т в год. Электронное строение цианид-аниона аналогично оксиду углерода (II), такие частицы называют изоэлектронными:
- C = O: [:C = N:] –
- Цианиды (0,1-0,2%-ный водный раствор) применяют при добыче золота:
- 2 Au + 4 KCN + H 2 O + 0,5 O 2 = 2 K[Au(CN) 2 ] + 2 KOH.
- При кипячении растворов цианидов с серой или сплавлении твердых веществ образуются роданиды : KCN + S = KSCN.
- При нагревании цианидов малоактивных металлов получается дициан: Hg(CN) 2 = Hg + (CN) 2 . Растворы цианидов окисляются до цианатов :
- 2 KCN + O 2 = 2 KOCN.
- Циановая кислота существует в двух формах:
- H-N=C=O; H-O-C = N:
В 1828 г. Фридрих Вёлер (1800-1882) получил из цианата аммония мочевину: NH 4 OCN = CO(NH 2 ) 2 при упаривании водного раствора.
Это событие обычно рассматривается как победа синтетической химии над «виталистической теорией».
Существует изомер циановой кислоты – гремучая кислота
H-O-N=C. Ее соли (гремучая ртуть Hg(ONC) 2 ) используются в ударных воспламенителях.
Синтез мочевины (карбамида):
CO 2 + 2 NH 3 = CO(NH 2 ) 2 + H 2 O. При 130 0 С и 100 атм.
Мочевина является амидом угольной кислоты, существует и ее «азотный аналог» – гуанидин.
Карбонаты
Важнейшие неорганические соединения углерода – соли угольной кислоты (карбонаты). H 2 CO 3 – слабая кислота (К 1 =1,3·10 -4 ; К 2 =5·10 -11 ).
Карбонатный буфер поддерживает углекислотное равновесие в атмосфере. Мировой океан обладает огромной буферной емкостью, потому что он является открытой системой.
Основная буферная реакция – равновесие при диссоциации угольной кислоты:
- H 2 CO 3 ↔ H + + HCO 3 — .
- При понижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты: CO 2 + H 2 O ↔ H 2 CO 3 .
- При повышении кислотности происходит растворение карбонатных пород (раковины, меловые и известняковые отложения в океане); этим компенсируется убыль гидрокарбонатных ионов:
- H + + CO 3 2- ↔ HCO 3 —
- CaCO 3 (тв.) ↔ Ca 2+ + CO 3 2-
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс химического растворения избыточного углекислого газа противодействует «парниковому эффекту» – глобальному потеплению из-за поглощения углекислым газом теплового излучения Земли. Примерно треть мирового производства соды (карбонат натрия Na 2 CO 3 ) используется в производстве стекла.
Углерод
- Глава 15. ЭЛЕМЕНТЫ IV ГРУППЫ
- IVА-группа: углерод С 2s22p2, кремний Si 3s23p2 и элементыподгруппы германия – германий Ge 4s24p2, олово Sn 5s25p2, свинец Pb 6s26p2.
- IVВ-группа (подгруппа титана) – титан Ti 3d24s2, цирконий Zr 4d25s2, гафний Hf 5d26s2, резерфордий Rf 6d27s2.
- В большинстве неорганических соединений углерод проявляет степени окисления –4, +4, +2.
В природе содержание углерода составляет 0,15% (мол.
доли) и находится в основном в составе карбонатных минералов (прежде всего известняка и мрамора СаСО3, магнезита МgСО3, доломита МgСО3∙СаСО3, сидерита FeСО3), каменного угля, нефти, природного газа, а также в виде графита и реже алмаза. Углерод – главная составная часть живых организмов.
Простые вещества.
Простые вещества элемента углерода имеют полимерное строение, и в соответствии с характерными гибридными состояниями орбиталей атомы углерода могут объединяться в полимерные образования координационной (sp3), слоистой (sp2) и линейной (sp) структуры, что соответствует типам простых веществ: алмаз (β-С), графит (α-С) и карбин (С2)n. В 1990 г. получена четвертая модификация углерода – фуллерен С60 и С70.
Алмаз – бесцветное кристаллическое вещество с кубической решеткой, в которой каждый атом углерода связан σ-связями с четырьмя соседними – это обусловливает исключительную твердость и отсутствие электронной проводимости в обычных условиях.
Карбин – черный порошок с гексагональной решеткой, построенной из прямолинейных σ- и π-связей: –С≡С–С≡С–С≡ (полиин) или =С=С=С=С=С= (поликумулен).
Графит – устойчивая форма существования элемента углерода; серо-черный, с металлическим блеском, жирный на ощупь, мягкий неметалл, обладает проводимостью. При обычной температуре весьма инертен.
При высоких температурах непосредственно взаимодействует с многими металлами и неметаллами (водородом, кислородом, фтором, серой). Типичный восстановитель; реагирует с водяным паром, концентрированной азотной и серной кислотами, оксидами металлов.
В «аморфном» состоянии (уголь, кокс, сажа) легко сгорает на воздухе.
- C + H2O(пар, 800-1000°С) = CO + H2
- C + 2H2SO4(конц.) = CO2↑ + 2SO2↑ + 2H2O
- C + 4HNO3(конц.) = CO2↑ + 4NO2↑ + 2H2O
- C + 2H2(600°С, kat. Pt) = CH4
- C + O2(600-700°С) = CO2
- 2C + O2(выше 1000°С) = 2CO
- 2С + Ca(550°С) = CaC2
- С + 2PbO(600°С) = 2Pb + CO2
- C + 2F2(выше 900°С) = CF4
Вследствие очень высокой энергии активации превращения модификаций углерода возможны лишь при особых условиях. Так, алмаз превращается в графит при нагревании до 1000–1500°С (без доступа воздуха). Переход графита в алмаз требует очень высокого давления (6∙109–10∙1010 Па); освоен метод получения алмаза при низком давлении.
C(алмаз) = С(графит) (выше 1200°С)
(C2)n(карбин) = 2nС(графит) (2300°С)
Получение и применение.Из графита изготовляют электроды, плавильные тигли, футеровку электрических печей и промышленных электролизных ванн и др. В ядерных реакторах его используют в качестве замедлителя нейтронов. Графит применяют также как смазочный материал и т. д.
Исключительная твердость алмаза обусловливает его широкое применение для обработки особо твердых материалов, при буровых работах, для вытягивания проволоки и т. д. Наиболее совершенные кристаллы алмаза используют после огранки и шлифовки для изготовления ювелирных изделий (бриллианты).
Благодаря большой адсорбционной способности древесного и животного углей (кокс, древесный уголь, костяной уголь, сажа) они применяются для очистки веществ от примесей. Кокс, получаемый при сухой переработке каменного угля, применяется главным образом в металлургии при выплавки металлов. Сажа используется в производстве черной резины, для изготовления красок, туши и т. д.
Диоксид углерода CO2 используют в производстве соды, для тушения пожаров, приготовления минеральной воды, как инертную среду при проведении различных синтезов.
Соединения с отрицательной степенью окисления. С менее электроотрицательными, чем он сам, элементами углерод дает карбиды. Поскольку для углерода характерно образовывать гомоцепи, состав большинства карбидов не отвечает степени окисления углерода –4. По типу химической связи можно выделить ковалентные, ионно-ковалентные и металлические карбиды.
Ковалентные карбиды кремния SiC и бора B4C – полимерные вещества, характеризующиеся очень высокой твердостью, тугоплавкостью и химической инертностью.
Простейшим ковалентным карбидом является метан СН4 – химически весьма инертный газ; на него не действуют кислоты и щелочи, однако он легко загорается, и его смеси с воздухом чрезвычайно взрывоопасны. Метан – основной компонент природного (60–90%) рудничного и болотного газа. Богатые метаном газы используются как топливо и сырье для химического производства.
Углерод образует многообразные перкарбиды, например, некоторые простейшие углеводороды – этан С2Н6, этилен С2Н4, ацетилен С2Н2.
Ионно-ковалентные карбиды – кристаллические солеподобные вещества. При действии воды или разбавленной кислоты они разрушаются с выделением углеводородов. Поэтому карбиды подобного типа можно рассматривать как производные соответствующих углеводородов. Производные метана – метаниды, например, карбиды Ве2С и АlС3. Они разлагаются водой, выделяя метан:
- АlС3 + 12Н2О = 4Al(ОН)3 + 3СН4↑
- Из солеподобных перкарбидов наиболее изучены ацетилиды типа М2+1С2, М+2С2 и М2+3(С2)3. Имеющий наибольшее значение ацетилид кальция СаС2 (называемый карбидом) получают нагреванием СаО с углем в электропечах:
- СaO + 3C = CaC2 + CO
- Ацетилиды более или менее легко разлагаются водой с образованием ацетилена:
- СаС2 + 2Н2O = Са(ОН)2 + С2Н2↑
- Эта реакция используется в технике для получения ацетилена.
Металлическими являются карбиды d-элементов IV–VIII групп. Чаще всего встречаются карбиды среднего состава МС (TiC, ZrC, HfC, VC, NbC, ТаС), М2С (Мо2С, W2С), М3С (Мn3С, Fe3С, Со3С).
Металлические карбиды входят в состав чугунов и сталей, придавая им твердость, износоустойчивость и другие ценные качества.
На основе карбидов вольфрама,титана и тантала производят сверхтвердые и тугоплавкие сплавы, применяемые для скоростной обработки металлов.
Соединения углерода (IV). Степень окисления углерода +4 проявляется в его соединениях с более электроотрицательными, чем он сам, неметаллами: СНаl4, СОНаl2, СО2, COS, CS2 и анионных комплексах CO32–, COS22–, CS32–.
- По химической природе эти соединения углерода (IV) являются кислотными. Некоторые из них взаимодействуют с водой, образуя кислоты:
- СO2 + Н2O = Н2СО3
- СOCl2 + 3Н2О = Н2СО3 + 2НCl
- и с основными соединениями, образуя соли:
- 2КОН + СO2 = К2СО3 + Н2О
- Из тетрагалогенидов CHal4 наибольшее применение получил тетрахлор метан СCl4 в качестве негорючего растворителя органических веществ, а также жидкости для огнетушителей. Его получают хлорированием сероуглерода в присутствии катализатора :
- CS2 + Cl2 = CCl4 + S2Cl2
Смешанный фторид-хлорид углерода ССl2F2 – фреон (t кип. –30 °С) применяется в качестве хладагента в холодильных машинах и установках. Не ядовит. При попадании в атмосферу разрушает озоновый слой.
- Дисульфид углерода или сероуглерод СS2 (ядовит) получают взаимодействием паров серы с раскаленным углем: C + 2S = СS2
- Сероуглерод легко окисляется, при небольшом нагреве воспламеняется на воздухе: СS2 + 3O2 = CO2 + 2SO2
- Все оксодигалогениды (карбонилгалогениды) COHal2 значительно более реакционноспособны, чем тетрагалогениды; в частности, они легко гидролизуются:
- СОСl2 + Н2O = СO2 + 2НCl
Наибольшее применение находит СОCl2 (фосген, хлористый карбонил) – чрезвычайно ядовитый газ. Его широко используют в органическом синтезе.
- Диоксид углерода CO2 (углекислый газ) в технике обычно получают термическим разложением СаСО3, а в лаборатории – действием на СаСО3 хлороводородной кислотой.
- СаСО3 = CaO + CO2↑ СаСО3 + 2HCl = CaCl2 + CO2↑
- Диоксид углерода легко поглощается растворами щелочей, при этом образуется соответствующий карбонат, а при избытке СО2 – гидрокарбонат:
- Ca(OH)2 + CO2 = CaCO3↓ + H2O
- CaCO3↓ + CO2 = Ca(HCO3)2
- Гидрокарбонаты в отличие от карбонатов в большинстве своем растворимы в воде.
- Растворимость CO2 в воде невелика, некоторая часть растворенного диоксида углерода взаимодействует с водой с образованием неустойчивой средней угольной кислоты Н2СО3 (триоксокарбонат водорода).
- Сульфидокарбонаты (IV) (тиокарбонаты) во многом напоминают триоксокарбонаты (IV). Их можно получить взаимодействием сероуглерода с основными сульфидами, например:
- К2S + СS2 = К2[СS3]
- Водный раствор Н2СS3 – слабая тиоугольная кислота. Постепенно разлагается водой, образуя угольную кислоту и сероводород:
- Н2СS3 + 3Н2О = Н2СО3 + 3Н2S
- Из нитридокарбонатов важное значение имеет цианамид кальция СаСN2, получаемый окислением карбида кальция СаС2 азотом при нагревании:
- СаС2 + N2 = СаСN2 + С
- Из оксонитридокарбонатов водорода наибольшее значение имеет мочевина (карбамид) СО(NH2)2, получаемая действием СО2 на водный раствор аммиака при 130° С и 1∙107 Па:
- СО2 + 2N3Н = СО(NH2)2 + Н2О
Мочевина применяется в качестве удобрения и для подкормки скота, как исходный продукт для получения пластических масс, фармацевтических препаратов (веронала, люминала и др.) и пр.
Сульфидонитридокарбонат (IV) водорода или тиоцианат водорода НSСN в водном растворе образует сильную (типа НCl) тиоцианистоводородную кислоту. Тиоцианиты в основном применяют при крашении тканей; NН4SСN используют как реактив на ионы Fe3+.
Соединения углерода (II). Производные углерода (II) – это СО, СS, HCN.
Оксид углерода (II) СО (угарный газ) образуется при сгорании углерода или его соединений в недостатке кислорода, а также в результате взаимодействия оксида углерода (IV) с раскаленным углем.
СО2 + С ↔ 2СО
В молекуле СО имеется тройная связь, как в N2 и цианид-ионе CN–. В обычных условиях оксид углерода (II) химически весьма инертен. При нагревании проявляет восстановительные свойства, что широко используется в пирометаллургии.
При нагревании СО окисляется серой, при облучении или в присутствии катализатора взаимодействует с хлором и т. д.
СО + S = СOS (оксосульфид углерода IV);
CO + Cl2 = СОCl2 (оксохлорид углерода IV)
Цианид водорода HCN имеет линейную структуру H–C≡N; существует также ее таутомерная форма (изоцианид водорода) H–N≡C. Водный раствор цианида водорода – очень слабая кислота, называемая синильной или цианистоводородной.
- HCN – сильнейший неорганический яд.
- Цианиды проявляют восстановительные свойства. Так, при нагревании их растворов они постепенно окисляются кислородом воздуха, образуя цианаты:
- 2KCN + O2 = 2KOCN
- а при кипячении растворов цианидов с серой образуются тиоцианаты (на этом основано получение тиоцианатов):
- 2KCN + S = 2KSCN
Цианид водорода применяют в органическом синтезе, NаСN и КСN – при добыче золота, для получения комплексных цианидов и т. д.
При нагревании цианидов малоактивных металлов образуется дициан (СN)2 – очень реакционноспособный ядовитый газ.
Hg(CN)2 = Hg + (CN)2↑






