- Характеристика амфотерных металлов
- Характеристики элементов-металлов
- Физические свойства
- Способы получения
- Химические свойства
- Оксиды алюминия и цинка
- Гидроксиды алюминия и цинка
- Важнейшие химические свойства солей
- Фактчек
- Проверь себя
- Получение и сферы применения амфотерных металлов
- Какие элементы относятся к амфотерным?
- Получение
- Амфотерные оксиды | это… Что такое Амфотерные оксиды?
- Таблица оксидов
- Таблица оксидов (1 часть):
- Таблица оксидов (2 часть):
- Таблица оксидов (3 часть):
- Урок 8: Амфотерные элементы
- Основное понятие амфотерности
- Расположение амфотерных элементов в таблице Менделеева
- Строение атома амфотерных элементов
- Представители амфотерных элементов
- Цинк как амфотерный элемент
- Алюминий как амфотерный элемент
- Свойства металлов Al и Zn как простых веществ
- Получение алюминия и цинка
- Химические свойства алюминия и цинка
- Взаимодействие с неметаллами
- Взаимодействие с металлами
- Взаимодействие с кислотами и щелочами
- Взаимодействие с водой
- Оксиды цинка и алюминия
- Применение алюминия и цинка
- Сплавы алюминия и цинка
- Сплавы алюминия
- Сплавы цинка
- Особенности строения атомов амфотерных металлов;
- Физические и химические свойства;
- И нашим, и вашим: обсудим амфотерность цинка и алюминия.
Кто-то любит соленое, кто-то любит сладкое, а кто-то — и то, и другое. То же самое происходит и с амфотерными металлами.
Характеристика амфотерных металлов
Под амфотерностью понимают способность соединений проявлять одновременно и кислотные, и основные свойства в зависимости от условий и природы реагентов, участвующих в реакции.
Список амфотерных металлов включает в себя множество наименований. Из них мы рассмотрим цинк и алюминий.
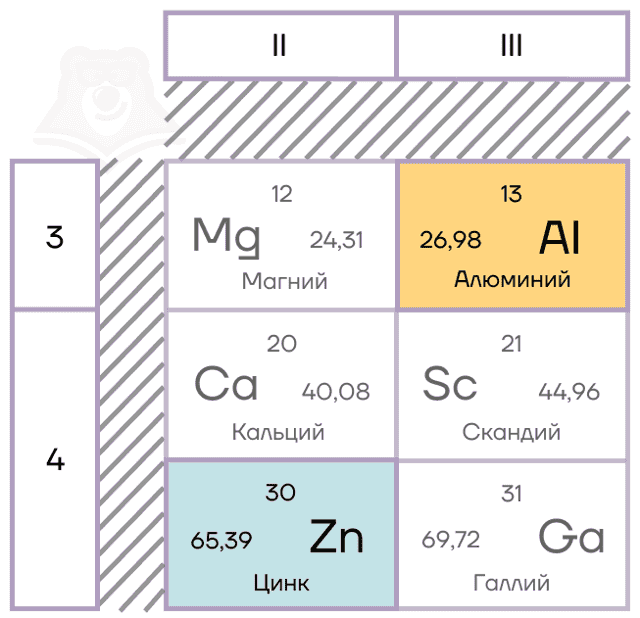
Характеристики элементов-металлов
Алюминий — элемент IIIA группы третьего периода. Его электронная конфигурация [Ne]3s23p1.
В возбужденном состоянии электронная пара на 3s-орбитали распаривается. В результате образуются три неспаренных электрона, которые способны образовывать химические связи. Поэтому у алюминия постоянная степень окисления +3.
Цинк — расположен во IIВ группе в четвертом периоде. Цинк относится к d-элементам, при этом атом цинка имеет полностью заполненные 3d– и 4s– электронные подуровни.
Его электронная конфигурация в основном состоянии [Ar]3d104s2. В соединениях цинк проявляет постоянную степень окисления +2.
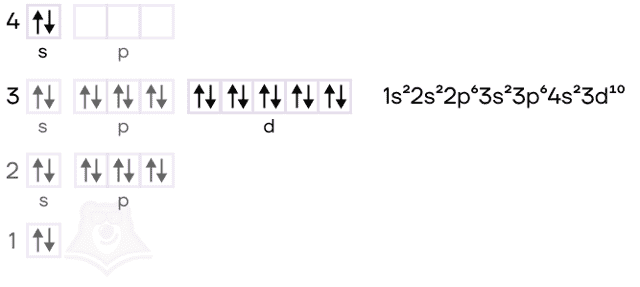
Физические свойства

Алюминий — лёгкий серебристо-белый металл, покрывающийся на воздухе оксидной плёнкой из-за взаимодействия с кислородом (на фото расположен слева). Из алюминия часто делают тысячи вещей, которые окружают нас в быту: от фольги на баночке йогурта до стильного корпуса смартфона.
Цинк — голубовато-белый металл (на фото расположен справа).
Способы получения

Химические свойства
По химическим свойствам они являются типичными восстановителями, а значит, способны реагировать с окислителями. Как и другие металлы, они будут взаимодействовать со своими противоположностями — неметаллами. Также они будут вступать в реакции вытеснения с водой, кислотами-неокислителями, щелочами и солями менее активных металлов.
Как типичные металлы, алюминий и цинк способны вступать в реакции с неметаллами и образовывать различные бинарные соединения.
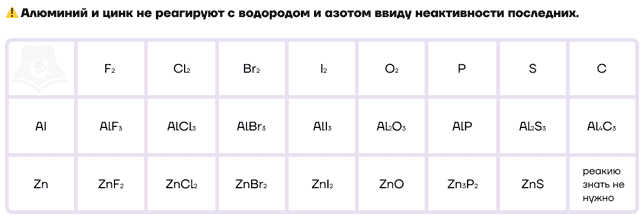
Ввиду низких значений электроотрицательности алюминий и цинк, как и другие металлы, являются отличными восстановителями. Настолько сильными, что они даже способны восстанавливать некоторые металлы и неметаллы из их оксидов. Этот процесс называется металлотермией.
| Активные металлы (стоящие до алюминия в ряду активности) не получают путём восстановления из оксидов. |
Алюминий является очень активным металлом, который, помимо этого, ещё и является одним из наиболее распространённых в земной коре.
Его очень часто используют в металлургии для получения других металлов из их оксидов. Этот процесс называется алюмотермией.
Так как алюминий и цинк — металлы, стоящие в ряду активности левее водорода, то они способны вытеснять водород из воды.

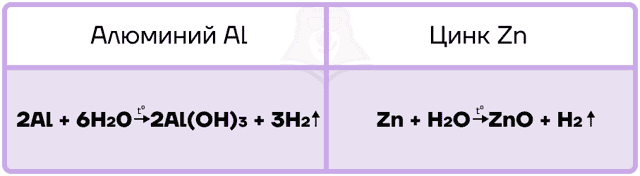
Алюминий, подобно другим активным металлам, при взаимодействии с водой образует гидроксид и водород.
Цинк является уже менее активным металлом, поэтому нуждается в создании более жёстких условий для реакции с водой. Он взаимодействует только с перегретым водяным паром и в таких жёстких условиях вытесняет из воды ОБА атома водорода, превращаясь в оксид.
Алюминий и цинк также способны вытеснять водород не только из воды, но и из кислот-неокислителей.
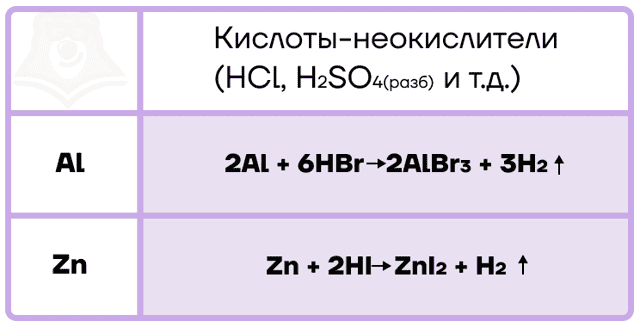
С кислотами-окислителями протекают более сложные ОВР, при этом помним, что в холодных концентрированных растворах кислот-окислителей алюминий пассивируется из-за наличия оксидной плёнки на его поверхности.
Амфотерные металлы реагируют со щелочами, причем продукты зависят от определенных условий:
Как и другие металлы, алюминий и цинк способны вытеснять менее активные металлы из их солей.
Оксиды алюминия и цинка
Оксиды алюминия и цинка по физическим свойствам представляют собой бесцветные порошки, нерастворимые в воде.
По химическим свойствам это типичные амфотерные оксиды, которые способны вступать в основно-кислотные взаимодействия как с основным, так и с кислотным. Как и другие оксиды, они могут вступать в ОВР с сильными восстановителями с восстановлением из них металла.
Оксидам алюминия и цинка соответствуют нерастворимые гидроксиды Al(OH)3 и Zn(OH)2, поэтому и сами оксиды с водой не взаимодействуют.
- Амфотерные свойства оксидов
Как типичные амфотерные оксиды, оксиды алюминия и цинка будут реагировать как с веществами, проявляющими основные свойства (основаниями, основными оксидами), так и с веществами, проявляющими кислотные свойства (кислотами, кислотными оксидами):
- ОВР с сильными восстановителями
Как и другие оксиды, оксид цинка может вступать в ОВР с сильными восстановителями (C, CO, H2, Al, Mg, Ca и т. д.) с восстановлением из них металла.
Гидроксиды алюминия и цинка
По физическим свойствам гидроксиды алюминия и цинка представляют собой белые порошкообразные вещества, нерастворимые в воде. Все их химические свойства обусловлены тем, что они являются амфотерными гидроксидами: они способны вступать в реакции как с основным, так и с кислотным.
Помимо этого, как и для других нерастворимых гидроксидов, для гидроксидов алюминия и цинка характерны реакции термического разложения.
- Гидроксиды алюминия и цинка как амфотерные гидроксиды
- Термическое разложение гидроксидов
Подобно другим нерастворимым гидроксидам, нерастворимые Al(OH)3 и Zn(OH)2 способны разлагаться при нагревании на соответствующий оксид и воду.
Важнейшие химические свойства солей
- Реакции с растворами щелочей
Соли алюминия и цинка реагируют с растворами щелочей.
- Разрушение комплексных солей и их аналогов кислотами
Если сильная кислота находится в недостатке, её хватает только для самого сильного металла (щелочного или щелочно-земельного). В результате образуется соль и амфотерный гидроксид, возможно также образование воды.
Если сильная кислота находится в избытке, её хватает на оба металла: образуются две соли и вода.
Со слабыми кислотами (угольной CO2(р-р), сернистой SO2(р-р), сероводородной H2S) ситуация немного сложнее:
- Если слабая кислота находится в недостатке, её также хватает только для самого сильного металла (щелочного или щелочно-земельного).
— Если слабая кислота находится в избытке, в продуктах образуется кислая соль (из-за избытка кислотного) и амфотерный гидроксид.Со слабой кислотой он не взаимодействует, так как сам слабый.
При нагревании комплексной соли будет происходить выпаривание из неё воды. В анионе там, где нет воды (например, в расплаве), образуются средние соли с амфотерными металлами.
Самые “страшные” реакции с участием комплексных солей — их реакции с солями. Чтобы их написать, можно для себя представить комплексную соль как совокупность щёлочи и амфотерного гидроксида.
Фактчек
- Алюминий и цинк относятся к амфотерным металлам, то есть таким, которые могут реагировать и с кислотами, и со щелочами в зависимости от природы реагирующих веществ.
- Алюминий относится к p-элементам, его постоянная степень окисления +3; цинк относится к d-элементам, его постоянная степень окисления +2.
- Алюминий и цинк реагируют с рядом веществ: неметаллами, водой, кислотами, щелочами, солями.
- Оксиды и гидроксиды алюминия и цинка также обладают амфотерными свойствами ,что определяет их химическое поведение в различных реакциях.
- Алюминий и цинк способны образовывать особый тип солей, называемый комплексными.
Проверь себя
Задание 1.Какими свойствами обладают алюминий, цинк и их оксиды и гидроксиды?
- Основными свойствами;
- Кислотными свойствами;
- Амфотерными свойствами;
- Нейтральными свойствами.
Задание 2.Цинк реагирует с водой с образованием:
- Оксида цинка и водорода;
- Гидроксид цинка и водорода;
- Цинката и водорода;
- Гидрида цинка и кислорода.
Задание 3.Что можно наблюдать при приливании раствора гидроксида натрия к раствору хлорида алюминия?
- Выделение газа;
- Выпадение осадка;
- Видимых изменений не наблюдается;
- Выпадение осадка, а затем его растворение.
Задание 4.Что образуется в реакции оксида цинка и сернистого газа?
- Сульфат цинка;
- Сульфит цинка;
- Сульфид цинка и кислород;
- Реакция не идет.
Задание 5.Какая соль образуется при взаимодействии тетрагидроксоалюмината натрия и избытка сероводорода?
- Средняя соль;
- Комплексная соль;
- Кислая соль;
- Основная соль.
ОТВЕТЫ: 1. — 3; 2. — 1; 3. — 4; 4. — 4; 5. — 3
Получение и сферы применения амфотерных металлов
Амфотерные металлы — группа простых элементов, которые похожи с материалами из металлической группы. Сходства проявляются в свойствах, характеристиках. Сами по себе компоненты из металлической группы не проявляют подобных свойств, но их соединения часто становятся амфотерными.
 Амфотерные металлы
Амфотерные металлы
Какие элементы относятся к амфотерным?
Амфотерными называют — соединения, которые проявляют химическую двойственность. Они делятся на 3 группы:
- Оксиды — Cu2O, Cr2O, PbO2, PbO, SnO
- Гидроксиды — Al(OH)3, Fe(OH)3, Zn(OH)2.
К третьей группе относятся металлы — алюминий, медь, железо, цинк, бериллий, свинец и т. д. Они занимают значительную часть в периодической таблице Менделеева и находятся под порядковыми номерами — 22–32, 40–51. Другие идут по отдельности.
Представители металлов:
- Железо. Относится к группе амфотерных. Представляет собой простое вещество. Характерные свойства — серебристо-белый цвет, ковкость, универсальность. Если поместить железо в чистый кислород, оно полностью перегорит, а если сделать его мелкодисперсным, может произойти самовозгорание на открытом воздухе. Оксид железа образуется при его горении в среде, насыщенной чистым кислородом. Он представляет собой окалину.
- Алюминий. На открытом воздухе покрывается прочной оксидной пленкой, которая защищает его от образования ржавчины. Если раздробить его до мелких частиц, начинает взаимодействовать с кислородом. При контакте с кислородом выделяется большое количество тепла. Если нагреть алюминий до 200°C, он начинает взаимодействовать серой. В результате такой реакции образуется сульфид алюминия.
Амфотерные металлы — простые элементы, которые являются аналогами группы веществ металлического типа. Сходства можно увидеть в химических, физических свойствах.
Получение
Для получения амфотерных металлов, ученые применяют тот же процесс, что при выделении нерастворимых в воде оснований. Перед проведением работ нужно получить больше информации о взаимодействии амфотерных соединений с щелочами, поскольку с помощью щелочного раствора будет выделяться металл.
Примеры:
- Для получения гидроксида цинка нужно смешать раствор сульфата цинка с гидроксидом натрия.
- Для получения гидроксида алюминия нужно смешать раствор сульфата алюминия с раствором гидроксида калия.
- Для получения трехвалентных гидроксидов хрома, алюминия нужно смешать раствор карбоната с раствором на основе солей этих металлов.
Амфотерные оксиды | это… Что такое Амфотерные оксиды?
- Оксиды металлов — это соединения металлов с кислородом. Многие из них могут соединяться с одной или несколькими молекулами воды с образованием гидроксидов. Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однако некоторые… … Официальная терминология
- ОКСИДЫ — ОКСИДЫ, неорганические соединения, в которых КИСЛОРОД связан с другим элементом. Оксиды часто образуются при горении элемента на воздухе или в присутствии кислорода. Так, магний (Mg) при горении образует оксид магния (MgO). Оксиды бывают… … Научно-технический энциклопедический словарь
- Оксиды — Оксид (окисел, окись) бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй… … Википедия
- Амфотерные гидроксиды — Амфотерные гидроксиды неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или основных гидроксидов. Содержание 1 Общие свойства 2 Получение … Википедия
- оксиды — Соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (наприме, Na2О, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды подразделяют на… … Справочник технического переводчика
- ОКСИДЫ — хим. соединения элементов с кислородом (устаревшее название окислы); один из важнейших классов хим. веществ. О. образуются чаще всего при непосредственном окислении простых и сложных веществ. Напр. при окислении углеводородов образуются О.… … Большая политехническая энциклопедия
- ОКСИДЫ — соединения элементов с кислородом. В О. степень окисления атома кислорода Ч2. К О. относятся все соед. элементов с кислородом, кроме содержащих атомы О, соединенные друг с другом (пероксиды, надпероксиды, озо ниды), и соед. фтора с кислородом… … Химическая энциклопедия
- ОКСИДЫ — окиси, окислы, соединения хим. элементов с кислородом. По хим. св вам все О. делятся на солеобразующие и несолеобразующие. Солеобразующие О. подразделяются на основные, кислотные и амфотерные (продукты их взаимодействия с водой являются… … Большой энциклопедический политехнический словарь
- Основные оксиды — Основные оксиды оксиды 1, 2 и некоторых 3 валентных металлов. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы) Li Fr оксиды металлов главной подгруппы второй группы (щелочноземельные металлы)… … Википедия
- Несолеобразующие оксиды — Несолеобразующие оксиды оксиды, не проявляющие ни кислотных, ни основных, ни амфотерных свойств и не образующие соли. Раньше такие оксиды называли индифферентными или безразличными, но это неверно, так как по своей химической природе данные … Википедия
Таблица оксидов
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ),
|
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ),
|
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния), SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора),
|
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы), SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты),
|
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)), Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия),
|
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома),
|
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца),
|
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа),
|
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта),
|
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит), Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт), CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия), Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия), GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка), As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит), SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
|
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
|
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)), Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения), RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия), Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия), Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)), Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)), CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия), InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись), SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид), Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
|
| 53 | Йод | I | I+12O (монооксид дийода),
|
| 54 | Ксенон | Xe | |
| 55 | Цезий | Cs | |
| 56 | Барий | Ba | |
| 57 | Лантан | La | |
| 58 | Церий | Ce | |
| 59 | Празеодим | Pr | |
| 60 | Неодим | Nd | |
| 61 | Прометий | Pm | |
| 62 | Самарий | Sm | |
| 63 | Европий | Eu | |
| 64 | Гадолиний | Gd | |
| 65 | Тербий | Tb | |
| 66 | Диспрозий | Dy | |
| 67 | Гольмий | Ho | |
| 68 | Эрбий | Er | |
| 69 | Тулий | Tm | |
| 70 | Иттербий | Yb |
Таблица оксидов (3 часть):
Урок 8: Амфотерные элементы
- План урока:
- Основное понятие амфотерности
- Расположение амфотерных элементов в таблице Менделеева
- Представители амфотерных элементов
- Свойства металлов Al и Zn как простых веществ
- Получение алюминия и цинка
- Химические свойства алюминия и цинка
- Оксиды цинка и алюминия
- Применение алюминия и цинка
- Сплавы алюминия и цинка
Основное понятие амфотерности
Что такое металлы и неметаллы – понять нетрудно. Металлы обладают восстановительными свойствами и в химической реакции отдают электроны. При этом, гидроксиды металлов – это основания. Неметаллы, напротив, являются окислителями и забирают электроны. Гидроксиды неметаллов – это кислоты.
Источник
Амфотерные соединения могут проявлять как окислительные, так и восстановительные свойства в зависимости от реакционной среды. Гидроксиды таких атомов могут выступать в качестве кислот или оснований.
Расположение амфотерных элементов в таблице Менделеева
В таблице Менделеева положение того или иного атома сообщает значительную часть информации о строении атома этого элемента и его химических свойствах.
Периодической эта система называется, потому что в разных периодах (горизонтальные строчки) и группах (вертикальные столбцы) повторяется определенное качество элементов.
Так, вся первая группа является щелочными металлами, а седьмая – галогенами (неметаллами), восьмая – инертными газами. Но, это характерно только для главной подгруппы. В побочной группе располагаются амфотерные элементы.
Строение атома амфотерных элементов
Особенность химических свойств амфотерных элементов связана со строением их атомов. У них происходит предзаполнение s-подуровня, из-за этого, незаполненным оказывается всегда d-подуровень. Все представители побочных подгрупп являются p- или d-элементами. В различных условиях может происходить перескок электронов с подуровней и увеличение неспаренных электронов.
Таблица. Строение атомов некоторых амфотерных элементов
Для некоторых из них характерен проскок электрона. Это состояние, при котором электрон с последнего уровня перескакивает на следующий. По этой причине оказывается неспаренным s-электрон.
Представители амфотерных элементов
Все элементы побочных групп являются амфотерными и проявляют сходные химические свойства. Наиболее распространены в природе три элемента: Al, Zn и Cr.
Цинк как амфотерный элемент
Цинк — это относительно мягкий светло-серый металл. Является одним из самых распространенных амфотерных элементов. В природе цинк встречается в составе 66 минералов, наиболее распространенные представлены в таблице.
Таблица. Минералы, в состав которых входит Zn
Цинк является d-элементом.
1s22s22p63s23p63d104s2
Химические свойства цинка обусловлены наличием незаполненной p-обитали. С s-подуровня происходит перескок электрона, за счет чего появляется два неспаренных электрона: Zn* 1s22s22p63s23p63d104s14p1.
Алюминий как амфотерный элемент
Al является самым распространенных элементом не только среди металлов, но и во всей таблице Менделеева. Он занимает 3 место после кислорода (O2) и кремния (Si).
Это мягкое вещество серебристо-серого цвета с низкой температурой плавления. В природе встречается как в виде минералов, так и в виде самородков. Является примесью многих минералов.
Наиболее распространенные минералы, содержащие Al:
- Авгит ((Ca,Na)(Mg,Fe,Al,Ti)(Si,Al)2O6)
- Боксит (Al2O3xH2O)
- Нефелин (Элиолит) ((NaK)AlSiO4)
- Алунит (K2SO4Al2(SO4)3·4Al(OH)3)
- Силлиманит ((Al2O3)(SiO2))
- Корунд (Al2O3)
Последний минерал в зависимости от примесей имеет разный окрас. Применяется в ювелирном деле и считается полудрагоценным камнем.
Его атом содержит 13 электронов, распределенных по 3 электронным уровням: 1s22s22p63s23p1. Это р-элемент, у которого может происходить переход электрона с s-подуровня на свободную р-орбиталь. За счет этого, металл приобретает 3 неспаренных электрона: Al* 1s22s22p63s13p2
Свойства металлов Al и Zn как простых веществ
Цинк – довольно плотный металл. Сохраняет свои качества в небольшом диапазоне температур: при низких значениях (до -30) становится хрупким, при температурах выше 1000 С очень пластичен. Это используется в металлургии, прокатывая цинковые листы толщиной несколько миллиметров (цинковая фольга). Некоторые примеси резко повышают хрупкость металла, поэтому используется очищенный материал.
Al – сильно пластичный легкий металл с низкой температурой плавления. Обладает высокой ковкостью и электропроводностью.
На воздухе он покрывается оксидной пленкой поэтому практически не подвергается коррозии. Благодаря этому он используется при изготовлении проводов и корпусов машинной техники.
Получение алюминия и цинка
Основной способ получения металлов – выделение их из состава руды. Для этого используется наиболее богатая металлом горная порода. Алюминий получают из боксита. Этот процесс состоит из трех этапов:
- Добыча горной породы;
- Обогащение (увеличение концентрации метала за счет очистки от примесей);
- Выделение чистого вещества путем электролиза.
- Получение цинка производится несколькими методами – электролитическим (так же как и Al) и пирометаллургический. Второй способ основан на восстановлении цинка из его оксида углеродом или оксидом углерода II (угарным газом):
- ZnO + C ⇄ Zn + CO
- ZnO + CO ⇄ Zn + CO2
- Достоинство этого метода в том, что продукты первой реакции могут использоваться во второй, что снижает количество выбросов в атмосферу.
Химические свойства алюминия и цинка
Оба вещества способны реагировать как обычные металлы. Так же, есть ряд специфических реакций.
Взаимодействие с неметаллами
С неметаллами и оба вещества взаимодействуют с образованием бинарных соединений – солей. Как правило, скорость течения реакции и условия зависят от активности неметалла. Так, с кислородом реакция идет реакция образования оксида при нагревании с цинком:
- 2Zn + O2 = 2ZnO
- с алюминием в обычных условиях:
- 4Al + 3O2 = 2Al2O3
- Оксид алюминия покрывает изделие плотной пленкой (оксидная пленка) и доступ кислорода прекращается, поэтому, для полной реакции его нужно брать в порошке.
- Zn не реагирует с Br, N2, Si, C, H2.
- Al не вступает в реакцию только с H2.
Взаимодействие с металлами
С восстановителями оба металла образуют сплавы:
- Алюминиды CuAl2, CrAl7, FeAl3
- Латунь ZnCu
Это не является химической реакцией, так как не происходит передачи электронов или изменения химических свойств веществ.
Взаимодействие с кислотами и щелочами
- С кислотами и алюминий, и цинк взаимодействуют при обычных условиях с образованием солей:
- 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O;
- 2Al + 6HCl = 2AlCl3 + 3H2;
- Zn + 2HCl = ZnCl2 + H2;
- Zn + H2SO4 = ZnSO4 + H2.
- Результат реакции со щелочами зависит от условий реакции: если реакция идет в растворе (в присутствии воды), то образуются комплексные соли:
- 2Al + 2NaOH + 10H2O = 2Na[Al(H2O)2(OH)4] + 3H2;
- Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2.
- В безводной среде (сплавление) образуются соли металлических кислот:
- Zn + 2KOH = K2ZnO2 + H2 (K2ZnO2 – цинкат калия);
- 2Al + 6KOH = 2KAlO2 + 2K2O + 3H2 (KAlO2 – алюминат калия).
Взаимодействие с водой
- Алюминий активно взаимодействует с водой, если очистить оксидную пленку. Реакцию нужно проводить быстро, так как пленка образуется практически мгновенно:
- 2Al + 6H2O = 2Al(OH)3 + 3H2;
- Zn реагирует с водой при очень высокой температуре (при накаливании до красного состояния):
- Zn + H2O = ZnO + H2.
Оксиды цинка и алюминия
ZnO – оксид, широко используемый в химической промышленности. Он применяется для получения солей. В реакции со щелочами образуются комплексные соли, легко разрушаемые кислотами.
Al2O3 –глинозем. Имеет очень плотную кристаллическую решетку, из-за чего практически не реагирует при обычных условиях. При экстремально высоких температурах вступает в реакцию со щелочами:
Al2O3 + 2KOH = 2KAlO2 + H2O
Может вступать в реакцию с кипящими кислотами с образованием комплексных солей.
Применение алюминия и цинка
Al как самый распространенный элемент широко используется в химической промышленности. Он способен вытеснять восстановители из соединений, поэтому применяется для получения металлов. Такой метод называется алюмотермия.
Благодаря оксидной пленке и низкой плотности используется в автомобиле-, самолето- и ракетостроении для снижения массы изделия. В строительстве алюминий применяется для изготовления каркасов высотных зданий.
Zn применяется для снижения коррозии металлических изделий –цинкование. Порошок этого металла используется для изготовления масляных красок с металлическим блеском. Также, оксид служит в качестве антисептика. Мази на основе цинкового порошка используются в лечении лишаев и других инфекционных поражений кожи.
Сплавы алюминия и цинка
В металлургии практически не применяются в чистом виде из-за высокой пластичности. Для того чтобы сохранить достоинства металлов, но убрать недостатки осуществляют сплавление с другими металлами.
Сплавы алюминия
Сплавы алюминия делятся на две группы:
- Литейные (без сохранения пластичности);
- Конструкционные (деформируемые).
Таблица. Характеристика основных сплавов алюминия
Сплавы цинка
Самый используемый сплав цинка – латунь (Cu — Zn). Он обладает хорошими сварными свойствами, поэтому применяется в изготовлении кухонной утвари и различных изделий интерьера.
Если к этому сплаву добавляют свинец, этот сплав называется мунц-металл. Оба сплава применяются при литье труб и каркасов.







