- Металлы и неметаллы – объясняю так, чтобы вы точно поняли разницу
- Почему металлические свойства слабеют «слева направо»
- Почему неметаллические свойства слабеют «сверху вниз»
- Свойства металлов
- Свойства неметаллов
- Урок 10: Металлы и неметаллы
- Физические свойства металлов
- Физические свойства неметаллов
- Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
- Закономерности в таблице Д.И. Менделеева
- Способы получения металлов
- Химические свойства металлов
- Способы получения неметаллов
- Химические свойства неметаллов
- Коррозия металла
- Химическая коррозия
- Электрохимическая коррозия
- Способы защиты от коррозии
- Биологическая роль металлов и неметаллов
- Применение металлов и неметаллов
- Химические элементы металлоиды
- Элементы металлоиды
- Электрические полупроводники
- Организация металлов и неметаллов
Общая характеристика и классификация металлов
В технике под металлами понимают материалы, обладающие целым комплексом специфических физических, химических, технологических, эксплуатационных и механических свойств.
Физические свойства отражают поведение материалов в различных тепловых, электромагнитных и гравитационных полях. К наиболее характерным физическим свойствам металлов следует отнести металлический блеск, высокую электро- и теплопроводность, способность испускать электроны при нагреве, а также сравнительно высокую плотность большинства металлов.
Химические свойства отражают способность материалов взаимодействовать с другими веществами. С точки зрения химических свойств металлы это химические элементы, расположенные в левой части таблицы Менделеева.
Атомы этих элементов содержат на внешней электронной оболочке небольшое число электронов, слабо связанных с ядром.
Вступая в химические взаимодействия с неметаллами, атомы металлов легко отдают им свои внешние валентные электроны и становятся положительно заряженными ионами.
Технологические свойства отражают способность материалов подвергаться тому или иному виду обработки. К наиболее характерным технологическим свойствам металлов следует отнести их относительно хорошую деформируемость (в частности, штампуемость и ковкость), а также хорошую свариваемость и возможность получать изделия методом литья.
Эксплуатационные свойства характеризуют поведение материалов в реальных условиях эксплуатации. Среди эксплуатационных свойств металлов можно выделить их неплохую износостойкость.
Механические свойства отражают способность материалов сопротивляться деформации и разрушению под воздействием различного рода нагрузок. К наиболее характерным механическим свойствам металлов относят их достаточно высокую пластичность и вязкость, а также твёрдость и прочность.
Физические и химические свойства металлов наиболее подробно изучаются в рамках дисциплин «Физика» и «Химия». Материаловедение большее внимание уделяет механическим и технологическим свойствам материалов.
Все металлы делят на две большие группы: на чёрные металлы и цветные металлы.
Чёрные металлы отличаются специфическим темно-серым цветом, высокой температурой плавления и относительно высокой твёрдостью. Цветные металлы имеют характерную белую, желтую или красную окраску, и отличаются от чёрных металлов большей пластичностью, меньшей твёрдостью и невысокой температурой плавления.
Чёрные металлы, в свою очередь, подразделяют на 5 групп:
1. Металлы группы железа – Fe, Cо, Ni и Mn.
Fe составляет основу самых распространённых в промышленности сплавов – сталей и чугунов. Остальные металлы этой группы применяются либо в качестве добавок к железоуглеродистым сплавам, либо в качестве основы для соответствующих сплавов (кобальтовых, никелевых и т.п.).
2. Тугоплавкие металлы – Ti, V, Cr, Mo, W и др.
Металлы этой группы имеют температуру плавления выше, чем у железа, т.е. более 1539°С. Их обычно используют в качестве добавок к легированным сталям, либо в качестве основы для специальных сплавов (например, титановых или хромовых). Вольфрам в чистом виде используют для изготовления нитей накала электроламп.
3. Урановые металлы или актиноиды – Ac, Th и т.д. Применяются, как правило, для изготовления сплавов, используемых в атомной энергетике.
4. Редкоземельные металлы или лантаноиды – La, Ce и т.д. Эти металлы обычно встречаются в смешанном виде и имеют близкие свойства. Их используют для изготовления специальных сплавов, обладающих особыми физическими и иными свойствами.
5. Щелочные металлы – Li, Na, K и т.д. Отличаются высокой химической активностью и поэтому в свободном виде не используются.
Цветные металлы подразделяют на 3 группы:
1. Легкие металлы – Al, Mg, Be. Обладают сравнительно низкой плотностью. Al из-за своей высокой электропроводности широко применяется для изготовления электропроводов. Кроме того, Al используют для получения алюминиевых сплавов, широко применяемых в машиностроении.
2. Благородные металлы – Ag, Au, Pt и т.д. в том числе Cu. Данные металлы отличаются высокой пластичностью, электропроводностью и коррозионной стойкостью. Благодаря этим свойствам они широко применяются в микроэлектронике и ювелирном деле. Медь используют также для получения бронз и латуней. Слитки благородных металлов, размещённые в банках, играют роль фактических денег.
3. Легкоплавкие металлы – Sn, Pb, Zn, Hg и т.д. Имеют сравнительно низкую температуру плавления. Температура плавления ртути (Hg) ниже комнатной и поэтому данный металл в обычных условиях является жидким. Sn и Pb используют для изготовления припоев, те сплавов, служащих для соединения деталей методом пайки.
Наиболее распространенным металлом на земном шаре является алюминий (8,8%). На втором месте находится железо (4,65%), которое к тому же является одним из наиболее дешёвых металлов.
2.2 Металлическая межатомная связь и модель «электронного газа»
Вышеназванные характерные свойства металлов, в большинстве своём, могут быть объяснены спецификой межатомного взаимодействия и особенностями структуры металлов. Атомы металлов, находящихся в твёрдом стоянии, связаны между собой особым типом химической связи, которую называют металлической связью.
Такая связь устанавливается посредством обобществления всех валентных электронов атомами материала.
Валентные электроны, потерявшие связь со своими атомами, оказываются принадлежащими всему металлу в целом и, будучи относительно свободными, образуют в объёме металла так называемый «электронный газ» или точнее «электронную жидкость». Сами же атомы при этом становятся положительно заряженными ионами.
Таким образом, на атомарном уровне металлы выглядят как совокупность расположенных в узлах кристаллической решётки положительно заряженных ионов, которые омываются газом относительно свободных электронов или иначе «электронной жидкостью» (рис. 7).
Рис. 7. Модель «электронного газа (жидкости)»
Наличием в объёме металла электронного газа или жидкости объясняются многие свойства металлов.
Так, если к металлу приложить разность потенциалов, то под воздействием электрического поля относительно свободные электроны наряду с хаотическим движением приобретут направленное движение в сторону от минуса к плюсу. Другими словами в металле возникнет электрический ток.
Поскольку в металлах свободных носителей заряда, т.е. электронов, достаточно много, их электропроводность оказывается очень высокой.
Эти же электроны проводимости весьма эффективно могут переносить тепловую энергию от разогретого участка металла к более холодным областям, и этим объясняется высокая теплопроводность металлов. Кроме того, электронная жидкость хорошо отражает фотоны, т.е. частицы света, и тем самым обеспечивает металлам характерный блеск.
При пластическом деформировании металлов наблюдается сдвиг атомных слоёв относительно друг друга и металлическая связь способствует этому процессу.
В данном случае электронная жидкость играет роль своеобразного клея, соединяющего атомные слои, и одновременно роль своеобразной смазки, облегчающей процесс скольжения этих слоёв.
В результате металлы оказываются достаточно пластичными материалами.
Металлическая связь, в отличие от ковалентной связи, не является строго направленной в пространстве и допускает произвольное число взаимодействующих частиц.
В результате атомы металлов, стремясь к более выгодной и устойчивой конфигурации, обладающей меньшей свободной энергией, располагаются в пространстве наиболее компактным образом.
Этим, в частности, объясняется относительно высокая плотность большинства металлов. Плотным атомным упаковкам металлов соответствуют следующие типы кристаллических структур:
1. Объёмоцентрированная кубическая структура или ОЦК-структура. Такую структуру описывает ОЦК-решётка, элементарная ячейка которой выглядит следующим образом:
Рис. 8. Элементарная ячейка ОЦК-структуры.
В узлах этой кристаллической решётки располагаются атомы, а точнее ионы, соответствующего металла. Координационное число в данном случае равно 8 (на ближайшем равном расстоянии от любого атома находится 8 аналогичных атомов). Коэффициент компактности равен 0,68.
Это означает, что 68% объёма металла занято атомами, а остальную его часть составляют пустоты. Это достаточно плотное расположение атомов. Базис образуют два атома соответствующего металла (один атом, расположенный в центре ОЦК-ячейки, полностью ей принадлежит, и ещё один атом (8 по ⅛) дают узлы, расположенные в вершинах ячейки).
ОЦК-структура наблюдается у таких металлов как Cr, Mo, W, V и др.
2. Гранецентрированная кубическая структура или ГЦК-структура. Эту структуру описывает ГЦК-решётка, элементарная ячейка которой выглядит следующим образом:
Рис. 9. Элементарная ячейка ГЦК-структуры.
В узлах решётки также располагаются атомы соответствующих металлов. Координационное число здесь равно 12, а коэффициент компактности имеет значение 0,74.
Базис образуют четыре атома металла (каждый атом, расположенный в центре грани принадлежит ячейке только наполовину, а поскольку таких атомов 6, то получается ровно 3; плюс один атом дают вершины ячейки).
ГЦК-структура характерна для Al, Cu, Ni, Ag, Au и Pt.
3. Гексагональная плотноупакованная структура или ГПУ-структура. Эту структуру описывает соответствующая ГПУ-решётка. Хотя ГПУ-решётку можно построить и с помощью меньшей по объёму ячейки, в данном случае в качестве элементарной ячейки лучше подойдёт шестигранная призма, которая нагляднее отражает гексагональную симметрию структуры (рис. 10).
Рис. 10. Элементарная ячейка ГПУ-структуры.
Координационное число для такой структуры равно 12 (если за начало отсчёта принять атом, расположенный в центре грани, то на равном ближайшем расстоянии от него находится 6 атомов, плюс по 3 атома сверху и снизу). Коэффициент компактности, как и у ГЦК-структуры, имеет значение 0,74. Это наивысшая степень упаковки атомов.
Базис образуют 6 атомов соответствующего металла (3 атома внутри призмы полностью ей принадлежат; атомы в центре верхней и нижней грани принадлежат ячейке только наполовину, а каждый из 12 атомов в вершинах призмы принадлежит рассматриваемой ячейке лишь на 1/6 часть, поскольку находится на пересечении 6 аналогичных ячеек).
ГПУ-структура наблюдается у таких металлов как Mg, Zn, Be и др.
Иногда у металлов наблюдается тетрагональная или простая гексагональная структура, но гораздо реже, чем три вышеназванные структуры.
Металлы и неметаллы – объясняю так, чтобы вы точно поняли разницу
Одни отдают электроны, другие принимают.
Металлы – это такие элементы, которые стараются отдавать свои электроны. Неметаллы – наоборот, стараются их принимать. Вам надо понять, почему это происходит, и что значат фразы типа «металлические свойства усиливаются, а неметаллические ослабевают». Сейчас я вам это объясню.
Почему металлические свойства слабеют «слева направо»
Итак. В атоме есть три частицы: протоны, нейтроны и электроны. У протонов заряд +1, у электронов -1. У нейтронов заряда нет.
Протоны и нейтроны находятся в ядре. Поэтому заряд ядра всегда плюсовой. А электроны крутятся вокруг ядра и притягиваются к нему, потому что у них заряд минусовой.
Электроны крутятся по электронным уровням – как планеты по орбитам вокруг Солнца.
Атомный номер показывает, сколько в атоме протонов. Как видите, это количество постоянно увеличивается.
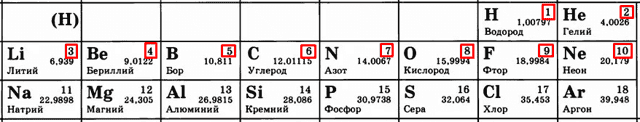
- Чем больше протонов, тем сильнее они «тянут» к себе электроны. Сравните:
Вывод – чем больше становится протонов, тем сильнее они удерживают электроны. Тем сложнее становится эти электроны отдавать. Поэтому слева направо, с увеличением порядкового номера (и, соответственно, числа протонов) металлические свойства слабеют, а неметаллические усиливаются.
На заметку – про радиус атома
Чем сильнее протоны притягивают электроны, тем ближе эти электроны становятся к протонам. Поэтому радиус атома уменьшается, атом как бы сжимается из-за увеличения заряда.
Почему неметаллические свойства слабеют «сверху вниз»
Идем дальше. Период в таблице показывает количество уровней (тех самых орбит), по которым летают электроны.
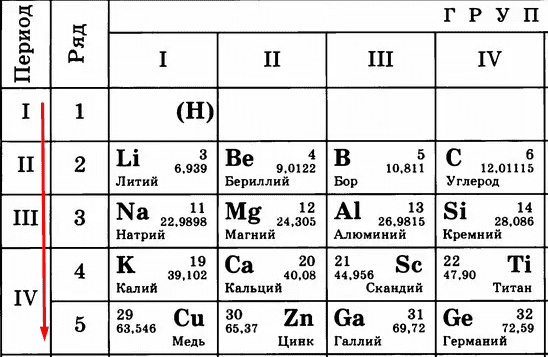
Чем больше период, тем больше этих орбит и тем дальше оказываются электроны от ядра. Сравните:
Кому сложнее удерживать электроны на последнем уровне? Меди, конечно, потому что эти электроны в два раза дальше от ядра, чем, например, у лития. Их проще становится отдать, чем пытаться удерживать.
Следовательно, «сверху вниз» количество уровней, по которым движутся электроны, растет, удерживать их становится сложнее, поэтому металлические свойства усиливаются, а неметаллические – слабеют.
Еще про радиус
Если смотреть на таблицу «сверху вниз» радиус ядра растет, потому что уровней становится больше.
Да, заряд атома тоже растет, но все-таки расстояние перевешивает. Чем больше уровней, тем труднее становится держать электроны, даже несмотря на то, что заряд увеличивается.
Обобщаю:
- Слева направо в таблице металлические свойства слабеют, неметаллические усиливаются из-за того, что ядро сильнее тянет к себе электроны.
- Сверху вниз металлические свойства усиливаются, неметаллические слабеют, потому что уровней становится больше, и удерживать электроны на последних уровнях становится труднее.
Из этих двух положений следует, что в правом углу таблицы Менделеева будут сосредоточены неметаллы, а в левом – металлы.
Я нашел вам вот такую картинку, на ней показаны все неметаллы. То, что выделено курсивом – это так называемые металлоиды – вроде и не совсем металлы, и в то же время не неметаллы. Нечто среднее.
Это основа основ. Надеюсь, я объяснил понятно и вы разобрались. Если нет – перечитайте еще раз, задайте вопросы мне в х. Только когда разберетесь – читайте дальше.
Свойства металлов
Эти свойства проявляются в разной мере, но все-таки присущи всем металлам:
- Плавятся.
- Их можно ковать.
- Обладают металлическим блеском.
- Проводят электрический ток. Это происходит благодаря металлической связи, которая соединяет их атомы.
- Проводят тепло.
- Твердые – это касается всех, кроме ртути.
На сегодняшний день металлов известно 87.
Свойства неметаллов
У них почти все наоборот:
- Ковать нельзя, потому что они хрупкие.
- Не обладают металлическим блеском.
- Не проводят электрический ток (за редким исключением – кремний и графит могут быть проводниками).
- Очень плохо проводят тепло.
- Есть твердые, газообразные, жидкие.
Неметаллов на данный момент 22.
Это первая статья по химии на нашем сайте. Напишите, что не так, что нравится и не нравится. Я буду думать, как сделать материал лучше.
https://www.youtube.com/watch?v=YZvfmcFYe0Qu0026t=27s
И еще – есть идея записывать видеоролики с объяснениями. Лично вам удобнее разбираться в чем-то, читая текст, или просматривая видео?
Буду рад каждому вашему отзыву и комментарию.
Урок 10: Металлы и неметаллы
- План урока:
- Физические свойства металлов
- Физические свойства неметаллов
- Способы получения металлов
- Химические свойства металлов
- Способы получения неметаллов
- Химические свойства неметаллов
- Коррозия металла
- Биологическая роль металлов и неметаллов
- Применение металлов и неметаллов
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.
Для металлов характерен ряд свойств:
- твердость (кроме ртути, которая представляет собой жидкость);
- металлический блеск;
- проводимость электрического тока и тепла;
- пластичность.
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Способы получения металлов
- Большую часть металлов получают из оксидов при нагревании.
- Fe2O3 + 3 CO →2 Fe + 3 CO2
- MnO2 + 2 C → Mn + CO2
- Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
- NaCl → Na+ + Cl-
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
- Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
- 4 Li + O2→ 2 LiO2
- 3 Mg + N2 → Mg3N2
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
- 2 Ca + MnO2 → 2 CaO + Mn(нагревание)
- Mg + H2SO4(разб)→MgSO4 + H2
- Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
- Fe + CuSO4→ Cu + FeSO4
- Cu + 2 AgNO3→ 2 Ag + Cu(NO3)2
- Более активные металлы вытесняют из соединений менее активные.
- Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Ca + 2 H2O →Ca(OH)2 + H2
Способы получения неметаллов
- Неметаллы синтезируют из природных соединений с помощью электролиза.
- 2 KCl → 2 K + Cl2
- Также неметаллы получают в результате окислительно-восстановительных реакций.
- SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
- Неметаллы вступают в реакции со следующими веществами.
- 3 F + 2 Al → 2 AlF3 (нагревание)
- S + Fe →FeS (нагревание)
- 2 F2 + C → CF2 (нагревание)
- S + O2→ SO2(нагревание)
- 4 F2 + CH4→CH3F + HF
- 3 O2 + 4 NH3→ 2 N2 + 6 H2O
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
4 H2 + Fe3O2 → 3 Fe + 4 H2O
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
3 Fe + 2 O2 → Fe3O4
2 Fe + 3 Cl2 → 2 FeCl3
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe2+ — 2e → Fe0
Катод: 2H+ + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.
Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор.
Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
Химические элементы металлоиды
В целом элементы периодической таблицы Менделеева можно разделить на металлы, неметаллы и металлоиды (полуметаллы).
Если смотреть по химическим свойствам, то видно, что несколько элементов иногда идентифицируются как металлоиды или полуметаллы и являются неметаллами, однако по типу проводимости являются проводниками.
Элементы металлоиды
Элементами, обычно признаваемыми металлоидами, являются бор, кремний, германий, мышьяк, сурьма и теллур.
Некоторые элементы как переходные иногда классифицируют также: углерод, алюминий, селен, полоний и астатин.
Металлоиды находятся между металлами и неметаллами в периодической таблице. То, как эти элементы ведут себя при химических взаимодействиях с другими элементами, зависит главным образом от количества электронов на внешнем энергетическом уровне их атомов. Они могут действовать либо как металлы, либо как неметаллы в химических реакциях.
Большинство металлоидов обладают некоторыми физическими свойствами металлов и некоторыми физическими свойствами неметаллов. Они находятся между металлами и неметаллами по своей способности проводить тепло и электричество. Они блестящие, как металлы, но хрупкие, как неметаллы. Все они существуют в виде твердых тел при комнатной температуре.
Электрические полупроводники
Уже более 120 лет известно, что металлоиды имеют преимущественно неметаллическую химию.
С появлением полупроводниковой промышленности в 1950-х годах и развитием твердотельной электроники с начала 1960-х годов металлоиды стали рассматриваться как “промежуточные элементы”.
По большей части они считаются электрическими полупроводниками и сильно зависят от концентрации примесей, температуры и воздействия различных видов излучения.
Как самые слабые из неметаллов, им присваиваются положительные степени окисления (отдают электроны) в их соединениях с неметаллами и отрицательные степени окисления (электроны смещаются к атому) в их соединениях с большинством металлов.
Писавший в начале истории интерметаллических соединений британский металлург Сесил Деш отметил, что “некоторые неметаллические элементы способны образовывать соединения с металлами явно металлического характера, и поэтому эти элементы могут входят в состав сплавов”.
Он связал кремний, мышьяк и теллур, в частности, с элементами, образующими сплавы. Соединения кремния, германия, мышьяка и сурьмы с металлами, вероятно, лучше всего классифицировать как сплавы. Что касается бора, то бориды переходных металлов часто обладают большей проводимостью, чем исходный металл.
Например, TiB2 в пять раз превосходит электропроводность титана холодного прессования.
Известно, что бор образует металлический, ковкий, экструдируемый и обрабатываемый сплав, имеющий состав Li5B4 и серебристый металлический блеск.
Металлоиды образуют солеподобные или ковалентные соединения с металлами. Их оксиды являются слабокислыми в зависимости от условий. Органические соединения металлоидов подпадают под определение металлоорганических соединений.
Металлоиды имеют энергию ионизации около 200 ккал/моль (837 кДж/моль) и значения электроотрицательности, близкие к 2,0.
Металлоиды, как правило, являются полупроводниками, хотя сурьма и мышьяк [полуметаллы с точки зрения физики] имеют электрическую проводимость, приближающуюся к проводимости металлов.
Селен и полоний подозревались как не участвующие в этой схеме, в то время как статус астатина (редкий элемент в земной коре) является неопределенным. Многие химики утверждают, что астатин будет полноценным металлом.
Организация металлов и неметаллов
Металлоиды имеют от трех до шести электронов на своем внешнем энергетическом уровне.
Бор, является единственным металлоидом, имеющим всего три электрона на внешнем энергетическом уровне. Он имеет тенденцию действовать подобно металлам, отдавая свои электроны в химических реакциях.
Металлоиды с более чем четырьмя электронами на внешнем энергетическом уровне (мышьяк, сурьма и теллур) имеют тенденцию действовать как неметаллы, получая электроны в химических реакциях. Те, у кого ровно четыре электрона на внешнем энергетическом уровне (кремний и германий), могут действовать как металлы или неметаллы, в зависимости от других элементов в реакции.
Углерод, промежуточный неметалл, является наиболее электропроводным и теплопроводным из неметаллов (как графит и алмаз соответственно). В то время как пограничное металлическое серебро, которое проявляет химию переходных металлов в своих более высоких, менее стабильных степенях окисления, является аналогом «два в одном» среди металлов.
Фосфор, промежуточный неметалл, имеет ту же кристаллическую структуру, что и марганец переходного металла. Йод, как почти металлоид, имеет кристаллическую структуру, аналогичную структуре галлия, другого близкого металлоида.
Ксенон в состоянии окисления образует бледно-желтый взрывоопасный оксид XeO4, в то время как осмий образует желтый сильный окисляющий оксид OsO4.