- Общая характеристика
- Физические свойства
- Химические свойства
- Получение фосфора
- Оксид фосфора (III) P2O3и фосфористая кислота H3PO3
- Оксид фосфора (V) P2O5
- Ортофосфорная кислота H3PO4и ортофосфаты
- Фактчек
- Проверь себя
- Оксид фосфора (III)
- Физические свойства
- Получение
- Химические свойства
- Фосфор
- Основное и возбужденное состояние фосфора
- Природные соединения
- Оксид фосфора V — P2O5
- Фосфорные кислоты
- Ортофосфорная кислота
- Соли фосфорной кислоты
- Оксиды фосфора — свойства, химическая формула, характеристика — Помощник для школьников Спринт-Олимпик.ру
- Обзор кислородных соединений
- Фосфористый ангидрид
- Фосфорный ангидрид
- p-Элементы
- О трех фосфорных братах;
- P2O5-разбойник: разберем, почему;
Фосфор был открыт в результате поисков философского камня. Хотели получить золото и бессмертие, а вместо этого обнаружили элемент, который светится зеленым цветом в темноте. Чем ещё отличается фосфор — расскажем в статье.
Общая характеристика
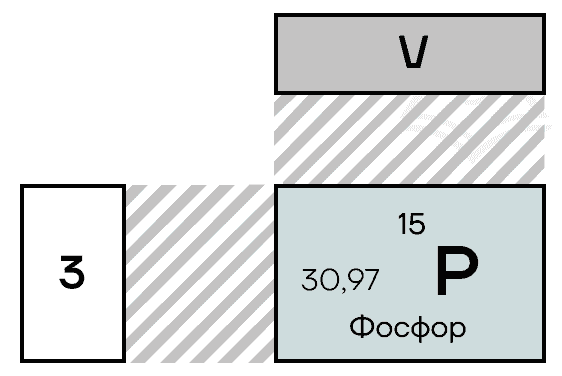
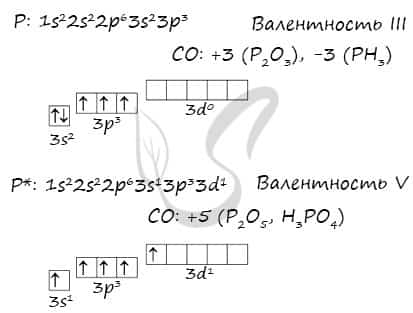
Фосфор находится в VA-группе третьего периода таблицы Менделеева, прямо под азотом. Электронная конфигурация фосфора в основном состоянии 1s22s22p63s23p3.
Конфигурация его внешнего слоя такая же, как и у азота. Но фосфор имеет на этом слое полностью свободный d-подуровень, куда в случае возбуждения атома может переехать его электрон.
Поэтому в возбужденном электронном состоянии атом фосфора имеет конфигурацию внешнего электронного уровня 3s13p33d1.
- Таким образом, благодаря наличию в возбужденном состоянии пяти неспаренных электронов, фосфор может максимально образовывать в соединениях пять химических связей.
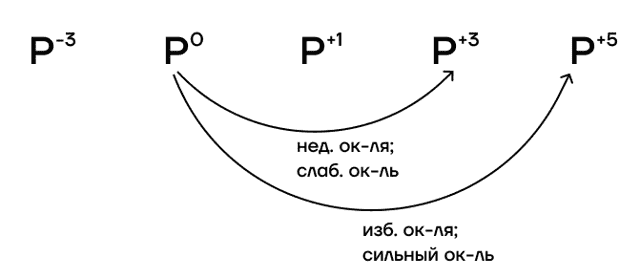
- В отличие от азота, у фосфора максимальная валентность (V) и высшая степень окисления (+5) численно совпадают.
- Какие степени окисления фосфора возможны?
- Высшая степень окисления равна номеру группы: +5.
- Низшая степень окисления определяется по формуле «номер группы — 8»: -3.
- Промежуточные степени окисления, как и сам номер группы, нечётные: +1, +3.
Физические свойства
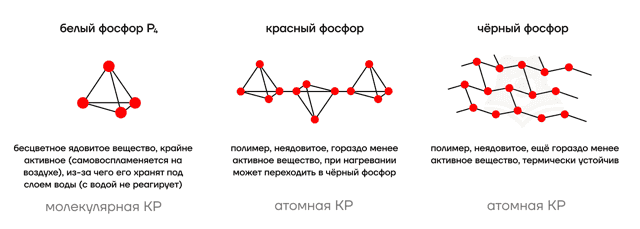
- Фосфор как простое вещество, аналогично углероду, имеет несколько аллотропных модификаций.
- О трех фосфорных братах
- Можно запомнить основные свойства по “характерам” модификаций:
- Белый фосфор — токсичный взрывной парень, который отравляет всем жизнь и легком можно возгореться. Поэтому его от греха подальше упрятали под воду.
- Красный фосфор не очень ценит качества своего белого “брата”. Поэтому он неядовит и при высокой температуре просто превращается в любимого брата — в черный фосфор.
- Черный фосфор — полная противоположность белому, самый мирный брат из тройки. Он неядовит, фактически не реагирует на температуру. Дзен среди фосфоров.
Химические свойства
Фосфор имеет низкое значение электроотрицательности. Это значит, что фосфор проявляет ярко выраженные восстановительные свойства. Онплохо притягивает к себе электроны, поэтому у него их легко отобрать.
При избытке окислителя или воздействии такого сильного окислителя, как F2, фосфор переходит в степень окисления +5. При недостатке окислителя или воздействии такого слабого окислителя, как I2, фосфор переходит только в степень окисления +3.
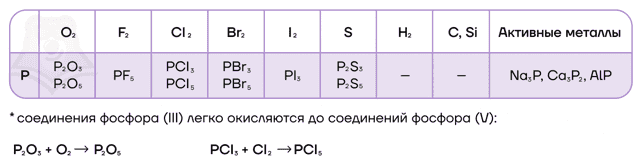
- Реакции с простыми веществами
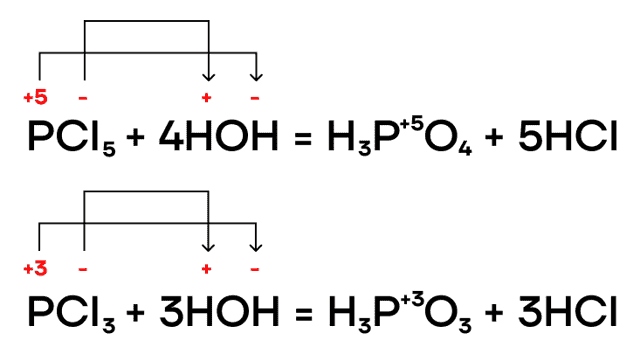
Как и многие бинарные соединения, галогениды фосфора способны гидролизоваться в различных средах (нейтральной, щелочной, кислой). Эти реакции мы, как и всегда, пишем по принципу «притяни плюс к минусу».
Фосфиды металлов также подвергаются гидролизу в разных средах.
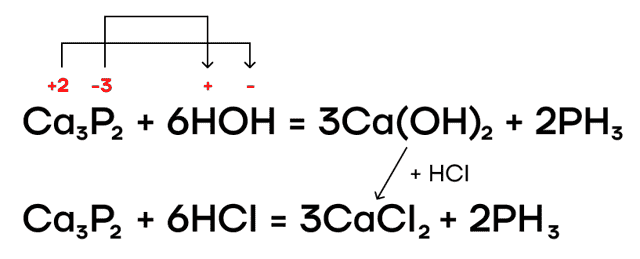
В результате протекания этих реакций образуется ядовитый газ с неприятным запахом чеснока (или тухлой рыбы) — фосфин PH3. Он проявляет очень слабые основные свойства.
За счет степени окисления фосфора -3 он проявляет ярко выраженные восстановительные свойства. Он богат, поэтому во время реакции можно его ограбить. Следовательно, способен взаимодействовать с окислителями.
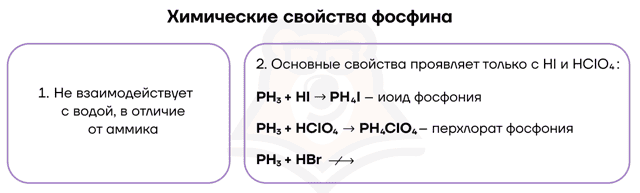
Фосфор — один из тех неметаллов, который способен взаимодействовать со щелочами (выражение для запоминания — «LiPSSi Ha»). Так как щёлочь не проявляет выраженных окислительных или восстановительных свойств, фосфору в этой реакции приходится отдуваться за двоих: играть роль как окислителя, так и восстановителя.
Из-за низкой электроотрицательности фосфор является типичным восстановителем («жертвой»). Поэтому он способен взаимодействовать с окислителями.
В ОВР он в подавляющем большинстве случаев как восстановитель повышает свою степень окисления до +5. Она является крайне устойчивой для него.
Из-за этого соединения фосфора (V) не являются типичными окислителями, потому что фосфор не хочет уходить из любимой степени окисления.
Получение фосфора
В промышленности главным способом получения фосфора является спекание фосфорита (ортофосфата кальция) с диоксидом кремния и коксом. Для чего это делают?
Оксид фосфора (III) P2O3 и фосфористая кислота H3PO3
Оксид фосфора (III) — типичный кислотный оксид. Это значит, он способен реагировать с водой с образованием соответствующей кислоты и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами.
За счет степени окисления +3 оксид фосфора (III) проявляет восстановительные свойства, повышая в реакциях степень окисления до +5.
Как типичный кислотный оксид, P2O3 способен взаимодействовать с водой с образованием соответствующего гидроксида (кислоты).
- Основно-кислотное взаимодействие
Тут все очень просто! P2O3 — кислотный оксид, он проявляет кислотные свойства. Значит, он способен вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами — с образованием солей.
Оксид фосфора (V) P2O5
Оксид фосфора (V) P2O5 как типичный кислотный оксид будет реагировать с водой и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами. Также как условно «сильный» оксид он способен вытеснять условно «слабые» из их солей при сплавлении.
При взаимодействии с водой оксид фосфора (V) образует соответствующий гидроксид — ортофосфорную кислоту.
- Кислотно-основные реакции
Происходят с основаниями и основными оксидами. При этом образуются соли.
В отношении реакций вытеснения P2O5 — это условно «сильный» оксид. Он способен вытеснять условно «слабые» (CO2 и SO2) из их солей при сплавлении (t).
Это вещество обладает крайне сильными дегидратирующими свойствами: оно активно осушает что?, отбирает воду. Он настолько жаден до воды, что может её отобрать даже у безводных кислородсодержащих летучих кислот.
Ортофосфорная кислота H3PO4 и ортофосфаты
Ортофосфорная кислота — ничем не примечательная слабая кислота.
Как и все кислоты, она обладает кислотными свойствами. Она способна вступать в основно-кислотные взаимодействия с веществами, проявляющими основные свойства.
Опять же как и другие кислоты, она является электролитом. Это значит, она может распадаться на ионы и обмениваться ими с другими электролитами, то есть вступать в реакции ионного обмена.
Фактчек
- Фосфор — химический элемент VA-группы третьего периода; электронная конфигурация 1s22s22p63s23p3;
- Возможные степени окисления фосфора: -3, 0, +1, +3, +5;
- Существует несколько аллотропных модификаций фосфора: белый фосфор, черный фосфор, красный фосфор;
- Фосфор является типичным восстановителем в ОВР из-за низкой электроотрицательности;
- Фосфор образует следующие соединения: фосфин, оксиды, кислоты и соответствующие соли.
Проверь себя
Задание 1.Количество электронов на внешнем энергетическом уровне атома фосфора равно:
Задание 2.Какой аллотропной модификации фосфора не существует?
- Белый фосфор
- Желтый фосфор
- Черный фосфор
- Красный фосфор
Задание 3.Фосфин можно получить реакцией:
- Фосфора и водорода
- Оксида фосфора(III) и водорода
- Оксида фосфора(V) и водорода
- Фосфора и раствора гидроксида калия
Задание 4.Фосфористая кислота H3PO3 является:
- Трехосновной кислотой
- Двухосновной кислотой
- Одноосновной кислотой
- Четырехосновной кислотой
Ответы: 1. — 3; 2. — 2; 3. — 4; 4. — 2.
Оксид фосфора (III)
Оксид фосфора (III), фосфор (III) оксид — неорганическое соединение состава P 4 O 6 (также записывается P 2 O 3). При обычных условиях являются белыми, плавными кристаллами с резким запахом. Самовоспламеняется при незначительной температуры и обладает токсичными свойствами.
Соединение является ангидридом фосфитнои кислоты, с щелочами образует ряд фосфиты.
Промышленного значения оксид фосфора нет.
Физические свойства
Оксид фосфора (III) являются мягкими кристаллами белого цвета. Вещество имеет резкий запах и очень токсична. Самовоспламеняется при температуре 70 ° C, а при наличии значительного содержания примеси белого фосфора самовозгорание может произойти даже при комнатной температуре.
Слабо растворяется в воде и хорошо — в органических растворителях (бензоле, Тетрахлорметан, хлороформе, сероуглероде).
Получение
Оксид фосфора (III) можно синтезировать при сжигании белого фосфора в атмосфере с ограниченной количества кислорода (75% кислорода, 25% азота) при 90 мм рт. в .:
Выход синтеза составляет около 50-60%. Образующийся оксид всегда иметь примесь белого фосфора, который можно перевести в красный фосфор путем воздействия на него ультрафиолетового излучения, существенно облегчает дальнейшую очистку.
Менее распространенными методами являются окисления фосфора оксидами N 2 O и CO 2, восстановление оксида P 4 O 10 белым фосфором:
Химические свойства
При комнатной температуре оксид фосфора (III) постепенно окисляется до оксида фосфора (V):
При нагревании до 200-400 ° C в герметичной камере оксид P 4 O 6 диспропорционирует с образованием красного фосфора и смеси оксидов общего состава P 4 O x (x = 7-9).
Оксид P 4 O 6 является кислотным оксидом: гидролизуясь в воде, он образует фосфитну кислоту, а со щелочами — соответствующие фосфиты:
При растворении в горячей воде соединение диспропорционирует на ортофосфорная кислота, фосфин и красный фосфор:
Оксид фосфора взаимодействует с некоторыми неметаллами: с хлором, бромом, йодом и серой:
Реагируя с газовать хлористым водородом, диспропорционирует на фосфитну кислоту и трихлорид фосфора:
P 4 O 6 может выступать в качестве лиганда, например, замещая лиганды в карбонил металлов:
Фосфор
Фосфор (греч. phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество, легко воспламеняющееся и светящееся.

Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*Ca(OH,F)2 — фосфорит
- Ca10(PO4)6(F,Cl,OH)2 — апатит

- Получение
- В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
- Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
- Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до P2.
- Реакции с неметаллами
- 4P + 3O2 → 2P2O3 (недостаток кислорода)
- 4P+ 5O2 → 2P2O5 (избыток кислорода)
- Схожим образом происходит взаимодействие фосфора и хлора.
- 2P + 3Cl2 → 2PCl3 (недостаток хлора)
- 2P + 5Cl2 → 2PCl5 (избыток хлора)
- P + S → P2S3
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое отравляющее вещество. Ca3P2 + H2O → Ca(OH)2 + PH3↑ 
2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество является и окислителем, и восстановителем). P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования. P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 — гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя. KClO3 + P → KCl + P2O5 
Оксид фосфора V — P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
- Получение
- P + O2 → P2O5
- Химические свойства
- Кислотные свойства
- P2O5 + Na2O → Na3PO4
- 6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
- 4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
- 2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)
- Дегидратационные свойства
- Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
- HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 — метафосфорная кислота)
- HNO3 + P2O5 → HPO3 + N2O5
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту. P2O5 + 3H2O = 2H3PO4 P2O5 + H2O = HPO3 (при недостатке воды) Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного оксида/основания и кислотного оксида.

Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (трехосновная кислота, соли — фосфаты PO43-)
- Метафосфорная кислота — HPO3 (одноосновная кислота, соли — метафосфаты PO3-)
- Фосфористая — H3PO3 (двухосновная кислота, соли — фосфиты HPO32-)
- Фосфорноватистая — H3PO2 (одноосновная кислота, соли гипофосфиты — H2PO2- )
- Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
- CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора, взаимодействия оксида фосфора V с водой.
- Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4
- P2O5 + H2O → H3PO4
- PCl5 + H2O → H3PO4 + HCl
- Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
- P + HNO3 + H2O → H3PO4 + NO

Химические свойства
- Кислотные свойства
- 3K2O + H3PO4 = 2K3PO4 + 3H2O
- 3KOH + H3PO4 = K3PO4 + 3H2O
- 2KOH + H3PO4 = K2HPO4 + H2O
- KOH + H3PO4 = KH2PO4 + H2O
- Реакции с солями
- AgNO3 + H3PO4 → Ag3PO4 + HNO3
- В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
- K2CO3 + H3PO4 → K3PO4 + H2O + CO2
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные соли (фосфаты, гидрофосфаты и дигидрофосфаты).
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
- Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
- 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
- Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4

Оксиды фосфора — свойства, химическая формула, характеристика — Помощник для школьников Спринт-Олимпик.ру
Фосфор — это не только один из компонентов земной коры и загрязнитель марганцевых руд.
В сложном составе фосфолипидов он присутствует во всех живых клетках, называется «элементом жизни и мысли» и является частью важных органических соединений — нуклеиновых кислот и АТФ.
Из-за высокой активности в свободном состоянии встречаются только его аллотропные модификации, которые окисляются с образованием оксидов фосфора, и их свойства зависят от проявленной валентности.
Обзор кислородных соединений
При горении твёрдого фосфора образуется ряд веществ, на состав которых влияет концентрация кислорода в окружающем воздухе.
Теоретически существует вероятность ряда метастабильных оксидов с общей формулой P4On, где коэффициент n лежит в интервале от 6 до 9.
При диссоциации таких веществ образуются молекулы PO, которые в составе паров обнаруживаются только спектроскопическими методами анализа.
Список номенклатуры соединений, которые индивидуально выделяются, но не имеют широкого практического применения, выглядит так:
Наиболее устойчивы, даже в парах остаются димерами и имеют для нужд химии практическую ценность Р2О3 — трёхвалентный оксид фосфора и Р2O5 — пятивалентный оксид фосфора. Физические свойства и основные характеристики приведены в таблице:
| Наименование систематическое | Традиционное название | Химическая формула | Молярная масса, грамм/моль | Плотность, грамм/куб. см | Состояние |
| оксид фосфора (III) | фосфористый ангидрид или гексаоксид тетрафосфора | P2O3 | 219,89 | 2,135 | белые хлопья или кристаллы |
| оксид фосфора (V) | фосфорный ангидрид или пентаоксид фосфора | P2O5 | 141,94 | 2.39 | белый порошок |
Фосфористый ангидрид
Относится к бинарным неорганическим соединениям, имеет формулу P2O3 и представлен в виде димеров Р4О6.
В основе молекулярной структуры лежит тетраэдр, где парные атомы фосфора разделяются атомом кислорода.
Получение оксида фосфора (III) происходит при медленном окислении или горении элементарного фосфора в условиях дефицита воздуха или кислорода. Реакция записывается следующими формулами:
4P + 3О2 = 2P2О3
При нормальной температуре, влажности и давлении вещество имеет вид белой воскообразной массы, плавящейся уже при 23,8 °C и легко возгоняющейся. Оно обладает неприятным запахом и очень ядовито, без труда растворяется в воде и органических растворителях, на свету неустойчиво и со временем приобретает сначала жёлтый, а затем красный цвет.
- Как типичный представитель класса кислотных оксидов, при растворении в холодной воде даёт фосфористую кислоту. Реакция такова:
- Р2О3 + 3H2О =2H3PO3
- При взаимодействии с горячей водой диспропорционирование протекает довольно интенсивно, образуются соединения фосфора с разными степенями окисления:
- 2Р2О3 + 6Н2О = PH3 + 3H3PO4.
- Реакция термического разложения в вакууме при температурах от 210 до 250 °C позволяет получить октаоксид тетрафосфора и красный фосфор:
- 4P4O6 = 3P4O8 + 4P.
- Гидроксиды металлов (щёлочи) реагируют с фосфористым ангидридом и образуют соли фосфористой кислоты:
- Р2О3 + 4KOH = 2K2HPO3 + Н2О.
- При взаимодействии с кислородом воздуха и галогенами выступает в роли восстановителя. В первом случае образуется фосфорный ангидрид:
- Р2О3 + O2 = Р2О5,
- во втором — галогеноводород и ортофосфорная кислота:
- Р2О3 + 2F2 + 5Н2О = 4HF + 2H3PO4.
- Малоактивные металлы при помощи фосфористого ангидрида легко восстанавливаются из растворов их соединений:
- 2P2O3 + 4HgCl2 + 10H2O = 4H3PO4 + 4Hg + 8HCl.
Оксид фосфора (III) нашёл применение в лабораторной практике в качестве осушающего средства.
Фосфорный ангидрид
Эмпирическая формула высшего оксида фосфора P2O5 свидетельствует о том, что в этом соединении элемент проявляет максимальную валентность, равную пяти. Структурная (графическая) формула более наглядна и показывает межатомные связи внутри молекулы.
В составе паров обнаруживаются димеры декаоксида тетрафосфора Р4О10. Твёрдое вещество обладает полиморфизмом и встречается как в аморфном стекловидном, так и в кристаллическом состоянии.
Для последнего известны гексагональные и орторомбические модификации, переходящие из одной формы в другую при повышении температуры до 300 °C.
В их молекулярной структуре группы PO4 образуют тетраэдры или кольца, что служит определяющим фактором для химических свойств соединения, влияет на лёгкость возгонки и активность взаимодействия с водой.
- Фосфорный ангидрид синтезируется при сжигании фосфора в условиях избытка воздуха или чистого кислорода. Процесс проводится в специальных камерах и состоит из окисления элементарного P осушенным воздухом, осаждение смеси разных форм оксидов и очистку отходящих газов возгонкой:
- 4P + 5О2 = 2P2О5.
При нормальных условиях это белая масса, напоминающая снег и не имеющая запаха. На воздухе быстро расплывается и образует сиропообразную жидкость — метафосфорную кислоту HPO3. Р2О5 — самый эффективный дегидратирующий (водоотнимающий) агент, иногда даже со взрывом поглощает воду и широко применяется для осушения нелетучих и газообразных веществ.
Как типичный кислотный оксид фосфорный ангидрид ведёт себя, взаимодействуя с водой, щелочами и основными оксидами. В результате гидратации при нагревании образуется ряд кислот: метафосфорная, дифосфорная (пирофосфорная) и ортофосфорная. Это записывается уравнениями:
- Р2О5 + Н2О = 2HPO3.
- Р2О5 + 2Н2О = Н4Р2О7.
- Р2О5 + 3H2О = 2H3PO4.
Последний продукт имеет наибольшее практическое применение для получения минеральных удобрений, незаменим при пайке и очистке металлов от ржавчины, промышленные морозильные установки используют его как компонент фреонов. Как пищевая добавка E338 фосфорная кислота служит недорогим регулятором кислотности в продуктах питания и шипучих напитках.
Щёлочи образуют в результате взаимодействия с пентаоксидом фосфора средних и кислых солей — ортофосфатов, гидрофосфатов и дигидрофосфатов. Это иллюстрируется уравнениями, приведёнными ниже:
- Р2О5 + 6KOH = 2K3PO4 + ЗН2О.
- Р2О5 + 4KOH = 2K2HPO4 + Н2О.
- Р2О5 + 2KOH = 2KH2PO4 + Н2О.
Сплавление с основными оксидами даёт твёрдые соли ортофосфорной кислоты, на природу которых существенно влияют условия реакции:
- Р2О5 + ЗCaO = Cа3 (PO4)2.
- Чрезвычайно сильные дегидратирующие свойства позволяют P2O5 отнимать не только влагу, поглощённую веществами из воздуха (гигроскопическую), но и связанную химически:
- Р2О5 + 2HNO3 = 2HPO3 + N2О5.
Такому водоотнимающему агенту покоряются даже оксикарбоновые кислоты, что с успехом применяется для получения их ангидридов. Спирты, эфиры, фенолы и другие органические растворители разрывают фосфор — кислородные связи в молекуле Р2О5 — и образуют фосфорорганические соединения. Реакции с аммиаком и галогеноводородами приводят к получению фосфатов аммония:
- P2O5 + NH3 + H2O = (NH4)3PO4
- и оксигалогенидов фосфора:
- P4O10 + 12HCL = 4POCL3 + 6H2O.
Фосфорный ангидрид нашёл применение при осушении жидких и газовых сред. В термическом способе получения ортофосфорной кислоты он является одним из промежуточных продуктов, а органический синтез широко использует его плюсы при дегидратации и конденсации.
ПредыдущаяСледующая
p-Элементы
К p-элементов периодической системы относятся элементы с валентным p-подуровнем. Эти элементы расположены в III, IV, V, VI, VII, VIII группах, главных подгруппах периодической системы Д.И.Менделеева. В периоде орбитальные радиусы атомов с увеличением атомного номера уменьшаются, а энергия ионизации в целом растет.
В подгруппах элементов с увеличением номера элемента, размеры атомов в общем увеличиваются, а энергия ионизации уменьшается.
p-Элементы III группы К p-элементов III группе относятся бор B, алюминий Al, галлий Ga, индий In и таллий Tl. По характеру этих элементов бор является типичным неметаллом, остальные — металлы.
В пределах подгруппы прослеживаются резкий переход от неметаллу к металлам.
Свойствами и поведением бор подобный кремния, что является результатом диагональной сродства элементов в периодической системе, согласно которой смещение в периоде вправо вызывает усиление неметаллического характера, а вниз по группе — металлического, поэтому аналогичные по свойствам элементы оказываются расположенными диагонально рядом, например Li и Mg, Ber и Al, B и Si.
Электронное строение валентных подуровней атомов p-элементов III группы в основном состоянии имеет вид ns2np1. В соединениях бор и трехвалентные алюминий, галлий и индий, кроме того, могут образовывать соединения со степенью окисления +1, а для таллия последний является довольно характерным.
Алюминий является одним из самых распространенных элементов природы, бор — достаточно распространенный, галлий, индий а таллий распространены мало и очень рассеяны, поэтому относятся к редким.
p-Элементы IV группы
К p-элементов IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. Общая электронная конфигурация валентных подуровней атомов p-элементов в основном состоянии ns2np2. Вследствие наличия 2-х неспаренных p-электронов в соединениях они могут проявлять степень окисления +2, причем эта тенденция усиливается в направлении к свинцу. Атомы могут переходить в возбужденное состояние с образованием четырех валентных электронов, что обусловливает возникновение соединений со степенью окисления +4. Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу. Характер изменения физических свойств элементов и соответствующих простых веществ свидетельствует о закономерное ослабление неметаллических и усиление металлических свойств в ряду C — Si — Ge — Pb.
Углерод и кремний — типичные неметаллы, образующие атомные кристаллические решетки с ковалентной связью. Их простые вещества характеризуются высокими твердостью, температурами плавления и кипения.
Для германия эти параметры остаются относительно большими, что вместе с хрупкостью характеризует его как алмазоподобный кристалл с ковалентным типом связи. В то же время в германию уже обнаружено некоторое взнос металлической связи.
На это указывает заметное уменьшение ширины запрещенной зоны и росту электропроводности. Для олова полупроводниковые свойства сохраняются лишь до температуры 13,2°С, при дальнейшем нагревании олово переходит в металлический состояние. Свинец — металл, который не проявляет полупроводниковых свойств.
Возрастание металлических свойств сопровождается постепенным уменьшением энергии ионизации элементов, их электроотрицательности и усилением восстановительной способности простых веществ.
p-Элементы V группы
К p-элементов V группы относятся азот N, фосфор P, мышьяк As, стибий Sb и висмут Bi, при чем азот и фосфор являются типичными элементами, а остальные элементы образуют подгруппу мышьяка. Электронная конфигурация валентных подуровней элементов в основном состоянии ns2np3.
На последнем энергетическом уровне атомы элементов этой подгруппы имеют по три одноэлектронные орбита ли, которые могут образовывать три ковалентные связи. В то же время в связывании могут принимать участие двухэлектронная орбиталь, а в случае элементов, размещенных после азота, — также свободные nd-орбитали.
Так, азот способен образовывать четвертая ковалентная связь по донорно-акцепторным механизмом с использованием своей неподеленной пары электронов. Примером может служить ион аммония NH4+ и его многочисленные производные.
Максимально возможная валентность азота в его соединениях равна 4, и каждая пара электронов четырех ковалентных связей занимает одну из четырех орбиталей.
- В отличие от азота остальное атомов p-элементов V группы имеют nd-подуровень, вакантные орбитали которого способны участвовать в образовании дополнительных ковалентных связей, за счет чего их ковалентность может расти до 5.
- Факторы увеличения радиусов атомов и уменьшение электроотрицательности в ряду N — P — As — Sb — Bi влияют на свойства простых веществ и соединений элементов: постепенно уменьшается стойкость неметаллических форм простых веществ и увеличивается устойчивость металоподобных (азот — типичный неметал с большой электронегативностью, а висмут — типичный металл, электроотрицательности которого лишь 1,70), ослабляются кислотные и усиливаются основные свойства бинарных соединений элементов, их гидроксидов и тому подобное.
- p-Элементы VI группы
К p-элементов VI группы относятся кислород O, сера S, селен Se, теллур Te и полоний Po. На валентных подуровням атомов p-Элементы VI группы размещено 6 электронов: электронная конфигурация валентных подуровней атомов в основном состоянии ns2np4.
За счет использования неспаренных электронов элементы в своих соединениях обнаруживают характерную для них валентность 2. Она может расти в случае образования донорно-акцепторных связей, в которых принимают участие двухэлектронные орбитали.
Например, в кислых водных растворах существуют ионы гидроксонию H3O+, в которых атом кислорода соединен с тремя атомами водорода ковалентными связями.
В отличие от кислорода атомы остальных p-элементов VI группы имеют свободный nd-подуровень, орбитали которого также способны принимать участие в образовании химических связей, в результате чего валентность серы, селена, теллура и полония может возрастать до 6.
Для атомов p-элементов VI группы характерно присоединение электронов для завершения np-подуровня и образования устойчивой электронной конфигурации следующего благородного газа ns2np6. Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
С переходом к полонию наблюдается характерное для групп p-элементов уменьшение устойчивости высшей степени окисления. Для полония соединения со степенью окисления +6 очень неустойчивы. Это обусловлено сильным ростом энергетической разницы между ns-и np-подуровнями, что затрудняет участие ns-электронов в образовании химических связей.
В ряду O — S — Se — Te — Po возрастают радиусы атомов, что характерно для групп p-элементов, уменьшение энергии их ионизации и электроотрицательности.
Ослабление неметаллических свойств элементов проявляется также в уменьшении стойкости неметаллических форм простых веществ и в росте устойчивости металлических.
Это приводит к тому, что в отличие от предыдущих элементов подгруппы полоний уже имеет металлическую кристаллическую решетку и относится к металлам.
p-Элементы VII группы — галогены
К p-элементов VII группы относятся фтор F, хлор Cl, бром Br, йод I и астату At. Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns2np5.
На последнем энергетическом уровне атомы элементов имеют по семь электронов, один из которых является неспаренным. Этим объясняется сходство их свойств.
Наличие одноэлектронной орбитали определяет характерную для всех элементов валентность 1.
Одновременно галогены (кроме фтора) имеют вакантный nd-подуровень, орбитали которого также могут участвовать в образовании химических связей и увеличивать валентность атомов элементов до 7.
Молекулы галогенов двухатомные, неполярные. Все галогены являются неметаллами. В ряду F — Cl — Br — I — At ослабляются признаки неметаличности: фтор — самый типичный элемент-неметала, а астату обнаруживает некоторые свойства элемента-металла.
В пределах своих периодов галогены характеризуются малыми атомными радиусами, что обуславливает их высокие электроотрицательности и сродство к электрону, поэтому для них в сложных веществах самым стойким является степень окисления -1.
p-Элементы VIII группы
К p-элементов VIII группы относятся гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rh, которые составляют главную подгруппу. Атомы этих элементов имеют завершенные внешние электронные слои, поэтому электронная конфигурация валентных подуровней их атомов в основном состоянии имеет вид 1s2 (Не) и ns2np6 (остальные элементы). Благодаря очень высокой устойчивости электронных конфигураций они в целом характеризуются большими значениями энергий ионизации и химической инертностью, поэтому их называют благородными (инертными) газами. В свободном состоянии они существуют в виде атомов (одноатомных молекул). Атомы гелия (1s2), неона (2s22p6) и аргона (3s23p6) имеют особо устойчивую электронную структуру, поэтому соединения валентного типа для них неизвестны.
Криптон (4s24p6), ксенон (5s25p6) и радон (6s26p6) отличаются от предыдущих благородных газов большими размерами атомов и, соответственно, меньшими энергиями ионизации. Они способны образовывать соединения, которые зачастую имеют низкую стойкость.






