- Понятие легкоплавких металлов/сплавов
- Галлий: металл, который плавится в руках
- 1) Общая информация по элементу
- 2) Почему галлий – это металл, который плавится в руке?
- 3) Получение галлия + области применения металла в промышленности/быту
- Металл, тающий в руках…
- Необычный металл, тающий на ладони
- Чем полезен галлий
- Внимание, опасное вещество!
- Галлий
- Как был открыт галлий
- Области применения галлия
- Удивительные вещества, смеющиеся в лицо науке
- 1. Галлий – металл, который плавится в руках
- 2. Газ, способный удерживать предметы
- 3. Вещество, не переносящее воду
- 4. Горячий лед
- 5. Металл, обладающий памятью
- 6. Взрывной порошок
Многие из нас видели в интернете фото металла, который плавится в руке. Единственный химический элемент в природе, который может безопасно для здоровья человека, провернуть подобный трюк – галлий.
В сегодняшней статье мы разберем отличительные свойства группы легкоплавких металлов + предоставим характеристику элемента, тающего в руках его владельца.
Понятие легкоплавких металлов/сплавов
Легкоплавкость – понятие растяжимое, особенно это актуально для промышленности. В химии легкоплавкими считаются элементы группы металлов + их сплавы, температура плавления которых ниже порога в 1000 градусов Цельсия.
Если температура плавления металла превышает 1 500 градусов Цельсия – его принято выделять в группу тугоплавких. Диаграмма выше четко дает понять, куда какой металл следует относить.
Обратите внимание: минимальная температура плавления у ртути — 39 градусов. Именно благодаря такому физическому свойству, мы можем наблюдать химический элемент в постоянно жидком состоянии.
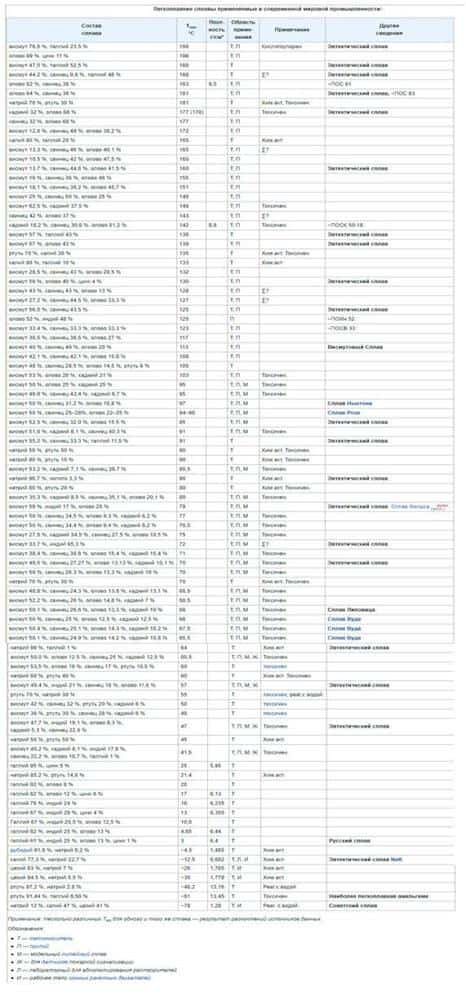
Ученым удалось добиться -78 градусов в качестве минимальной температуры плавления для советского сплава, который состоит на 12% из натрия, 47% калия и 41% цезия. Недостаток сплава — реакция с водой. Ближайший конкурент – амальгама. Токсичный сплав из ртути с таллием, сохраняющий жидкое состояние до температуры -61 градус по Цельсию.
Область применения легкоплавких металлов/сплавов:
- энергетическая промышленность и машиностроение. Основное направление – создание тепловых носителей с жидкометаллического типа;
- литьевая промышленность;
- как основа для датчиков температуры, что актуально в системах пожарной безопасности;
- как основа для разработки термометров;
- как ремонтный материал в вакуумных технологиях;
- припои, предохранители и прочие мелочи в микроэлектронике;
- медицинское направление. То же протезирование;
- как металлическая смазка.
Низкая температура плавления является базовых свойством, которое требуется от легкоплавких металлов и сплавов. Вторичные параметры, которые берутся во внимание в различных областях использования – плотность, прочность на разрыв и инертность в химическом плане.
Галлий: металл, который плавится в руках
Поистине, занимательный химический элемент, который имеется в любом школьном кабинете химии. Благодаря демонстрационной наглядности, галлий считается лучшим вариантом донесения до умов учащихся тепловых свойств химических элементов.

Gallium (Ga) – металл, который плавится в руках при достижении температуры в 29.8 градуса по Цельсию. Учитывая стандартные 36.6 в организме человека, чтобы получить желаемый эффект, достаточно кусочек галлия положить на ладошку и наблюдать как тот медленно по ней растекается в разные стороны.
1) Общая информация по элементу
В периодической системе химических элементов галлий находится на 31 позиции. Его латинское обозначение – «Ga». Металл принадлежит к группе легких металлов, куда также входит алюминий, индий, олово, таллий, свинец и висмут.
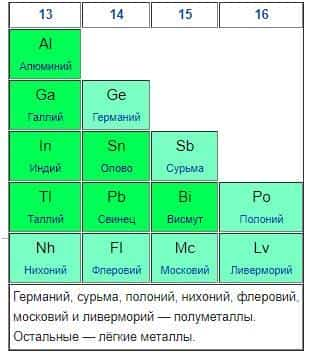
Внешне, галлий представляет собой мягкий или хрупкий металл (в зависимости от температуры), имеющий белый + серебристый оттенки. Иногда можно заметить синеватые отблески на поверхности чистого вещества.

Великий Менделеев заранее знал о данном химическом элементе. Впервые он просчитал некоторые свойства галлия еще в 1871 году. Изначальное название, присвоенное химиком, звучало как «экаалюминий».
К предугаданным свойствам галлия Менделеевым относились:
- оксидный тип;
- варианты связи с хлором;
- медленная растворимость при соприкасании с щелочами/кислотами;
- галлий не будет реагировать с кислородом;
- возможность легкоплавкого металла образовывать основные соли;
- химический элемент будет открыт при использовании спектроскопии.
Непосредственное выделение металла в чистом виде пришлось на француза Буабодраном. Открытие приходится на 1875 год. Из-за малого долевого содержания галлия в руде (менее 0.2%), пришлось потратить пару месяцев на получение минимального запаса чистого вещества для полноценного исследования его физических/химических свойств.
| Наличие нескольких модификаций полиморфного типа. | Низкая химическая активность замедляет протекание химических реакций металла в твердом состоянии. |
| При нормальных условиях кристаллическая решетка имеет орторомбическую структуру. При повышении давления наблюдается образование 2 структур полиморфного типа с кубической и тетрагональной решетками. | На воздухе галлий покрывается оксидной пленкой, которая предохраняет его от дальнейших реакций окисления. |
| Плотность галлия – 5.9 грамма на сантиметр кубический, а в жидком состоянии плотность увеличивается до 6.1 грамма на сантиметр кубический. | В контакте с горячей водой, он вытесняет из нее водород, в результате чего образуется гидроксид галлия. |
| Сопротивление электричеству у галлия в твердом и жидком состояниях одинаковы и равны 0.5 на 10-8 Ом*см при температурном режиме в 0 градусов по Цельсию. | Вступает в реакцию с паром (выше 340 градусов) и образует метагаллиевую кислоту. |
| Вязкость галлия колеблется в зависимости от температурного режима. При температуре в 100 градусов – 1.6 сантипуаз, а при 1000 градусов С – 0.6 сантипуаз. | Может взаимодействовать с кислотами минерального типа – происходит выделение Н и образование солевых веществ. |
| Поверхностное натяжение составляет 0.74 ньютона на метр, а отражательный коэффициент от 71% до 76% при разной длине волн. | Галлий инертен по отношению к водороду, азоту, углероду и кремнию. |
В земной коре металл, который плавится в руках, встречается довольно часто. На 1 тонну земли приходится 19 грамм чистого вещества. В химическом аспекте, галлий – элемент рассеянного типа, располагающий двойной природой по геохимии. Хотя кларки вещества и большие, из-за его сильной склонности к изоморфизму, больших скоплений чистого галлия в природе не найти.

К основным минералам, где сравнительно высокое содержание галлия в чистом виде относят сфалерит (до 0.1%), биотит (до 0.1%) и натролит (до 0.1%). В остальных 10+ минералах, которые также применяются для добычи галлия, долевое содержание чистого вещества менее 0.1%. В морской воде галлий также присутствует, но его содержание крайне мало – всего 30 на 10-6 миллиграммов на литр жидкости.
10 самых крепких металлов в мире
2) Почему галлий – это металл, который плавится в руке?
Обратимся к тепловым свойствам металла, и полностью разберем их при различных уровнях, хотя ответ на вопрос очевиден уже из базового понятия, температуры плавления, которая приравнивается к 29 градусам по Цельсию.
Термодинамические свойства чистого галлия:
- металл переходит из твердого в жидкое состояние при достижении температуры в 29.8 С или 302 градуса Кельвина;
- металл закипает при достижении температуры в 2 448 градусов Кельвина;
- удельная теплота плавления чистого галлия составляет 5600 Джоулей на моль;
- удельная теплота по испарению составляет 270 000 джоулей на моль;
- молярная теплоемкость составляет 26 джоулей, деленных на Кельвины, перемноженные на моли.
Главными поставщиками галлия на мировой рынок являются государства из Юго-Запада Африки, Российская Федерация и большинство стран СНГ. Галлий – металл, который не только плавится в руке, но и вещество, способное менять плотность при смене температурного режима на основании данного свойства можно провести интересный опыт.

Эксперимент: переводим галлий в жидкое состояние, а далее загоняем его в маленький стеклянный пузырек. По мере охлаждения емкости, металл станет постепенно превращаться в твердую субстанцию. Постепенно образующиеся кристаллы начнут расширяться, за счет чего колба рано или поздно треснет.
Во избежание повреждений со стороны зрителей, демонстрация должна проходить в изолированном пространстве с защитной перегородкой. Если слишком резко переохладить колбу, осколки могут разлететься в разные стороны в радиусе нескольких десятков метров.
Обзор свойств и характеристик плавящегося в руке металла, галлия:
3) Получение галлия + области применения металла в промышленности/быту
В основе добычи чистого вещества лежит галлит – редкий минерал, который является смесью галлия и сульфида меди. Наиболее часто он встречается в совокупности с такими минералами как сфалерит и германит.
Странный факт, но в залежах каменных углей иногда реально найти галлит в размере 1.
5% от всего объема добычи, что делает такие месторождения крайне важными стратегическими запасами для промышленного производства галлия.
Основные методы получения металлического галлия – это переработка боксита, нефелина и некоторые типы полиметаллических руд/угля.
Алгоритм извлечения галлия из руд:
- Электролиз с участием щелочных жидкостей, которые в свою очередь являются промежуточным продуктом с переработки бокситов в глинозем технического применения.
- Получение концентрированных растворов по методу спекания или через процесс Байера. В первом случае получаем до 70 миллиграмм на литр, а во втором до 160 миллиграмм на литр концентрата.
- Дальнейшая очистка галлия путем карбонизации.
- Обогащенный осадок отправляют в емкость с известью, вследствие чего получаем раствор.
- При помощи электролиза раствора получаем черновой вариант металла.
- Черновой галлий прогоняют через водяной напор.
- Смесь фильтруют при помощи пористых пластинок и греют в вакууме, из-за чего из чернового металла удаляются примеси летучего типа.
- В зависимости от степени чистоты конечного продукта, используют химический, электрохимический, либо физический методы разложения.
Эталонный вариант чистки может предоставить галлий с чистотой в 99.9%. В данном случае используется метод электрохимического рафинирования и восстановление с помощью очищенного водорода.
В промышленном плане у галлия нет широкого распространения. Металл сравнительно дорогой для металлургии + его физические/химические свойства редко где могут пригодиться для массового использования.
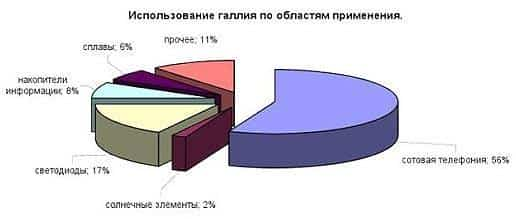
Где применяется галлий:
- в соединениях с натрием металл применяют при создании лазеров полупроводникового типа с ультрафиолетовым и синим диапазонами;
- как присадка к германию/кремнию;
- как отражающий элемент для зеркал среднего качества. В чистом виде материал способен отражать порядка 89% света. Достоинства подобных изделий обусловливаются способностью металл к пропуску ультрафиолетовых лучей;
- как компонент в смазочных материалах. Клеи с добавкой жидкого галлия весьма популярны и сегодня;
- как замена ртути в кварцевых термометрах;
- оксид галлия – это стратегически важный объект в производстве лазерных материалов.
Иногда галлий применяют как компонент для светящихся красок, а соли на основе металла являются катализаторами в аналитической химии, медицине и органическом синтезе. Чтобы купить 1 килограмма металла, который плавится в руках, потребуется выложить от 250 до 400 американских долларов в зависимости от степени чистоты химического элемента.
Металл, тающий в руках…
Галлий – это химический элемент с атомным номером 31. Относится к группе легких металлов и обозначается символом “Ga”. Галлий в чистом виде не встречается в природе, однако его соединения в ничтожно малых количествах содержатся в бокситах и цинковых рудах.
Галлий – мягкий пластичный металл серебристого цвета. При низких температурах находится в твердом состоянии, но плавится уже при температуре, не намного превышающей комнатную (29,8°C). На видео ниже можно увидеть, как ложка из галлия плавится в чашке с горячим чаем.

.
С момента открытия элемента в 1875 году и до наступления эры полупроводников, галлий в основном использовался для создания легкоплавких сплавов.

В настоящее время весь галлий используется в микроэлектронике. Арсенид галлия GaAs — перспективный материал для полупроводниковой электроники.

Нитрид галлия используется в создании полупроводниковых лазеров и светодиодов синего и ультрафиолетового диапазона.

Металлическим галлием также заполняют кварцевые термометры (вместо ртути) для измерения высоких температур. Это связано с тем, что галлий имеет значительно более высокую температуру кипения по сравнению с ртутью.

Галлий дорог, в 2005 году на мировом рынке тонна галлия стоила 1,2 млн долларов США, и в связи с высокой ценой и в то же время с большой потребностью в этом металле очень важно наладить его полное извлечение при алюминиевом производстве и переработке каменных углей на жидкое топливо.

Контакт кожи с галлием приводит к тому, что сверхмалые дисперсные частицы металла остаются на ней. Клиническая картина острого отравления: кратковременное возбуждение, затем заторможенность, нарушение координации движений, адинамия, арефлексия, замедление дыхания, нарушение его ритма. На этом фоне наблюдается паралич нижних конечностей, далее — кома, смерть.

Из-за низкой температуры плавления слитки галлия рекомендуется транспортировать в пакетах из полиэтилена.
Необычный металл, тающий на ладони
Каких только чудес не таит в себе наша планета. Кроме обычных металлов, которые отличаются прочностью и невероятной твердостью, в природе существует металл-антипод, пребывающий в жидком состоянии — это хорошо известная ртуть. Но далеко не все знают, что есть и другой химический элемент, который является настоящим рекордсменом по удивительным свойствам. И он также относится к металлам.

Если галлий соприкасается с поверхностью человеческого тела, например, лежит на ладони, он тут же начинает таять. Поэтому для поддержания его в твердом состоянии необходимо специальное устройство, которое будет сохранять окружающую температуру неизменной, ниже 36,6 градусов Цельсия.
В исходном виде галлий на поверхности или в недрах Земли не встречается, только в химических соединениях бокситов и цинковых руд. Интересно, что металл обладает крайне низкой температурой плавления — 29,8 градусов Цельсия.
Так, если из уникального галлия изготовить настоящую чайную ложку и положить ее в чашку с чаем, причем далеко не теплым, то изделие растает и расплавится прямо на глазах. Пройдет всего лишь несколько секунд, как галлиевая ложка начнет растворяться.
Загадка природы, да и только!

Галлий открыли еще в 1875-м году и начали применять при изготовлении различных сплавов, выгодно используя его чрезвычайно низкие показатели плавления. Известный по тем временам французский химик П. Э.
Лекок де Буабодран рассматривал цинковую обманку и неожиданно разглядел в ее спектре пару фиолетовых линий. Они свидетельствовали о присутствии какого-то нового вещества.
Чудо-металл ученый назвал в честь старинного наименования Франции, которую когда-то называли Галлией.
Чем полезен галлий
Но вот наступила эпоха полупроводников, и металл стал играть важную роль в такой отрасли, как микроэлектроника. Соединения галлия необходимы для процесса создания лазеров, которые относят к полупроводниковым. А также в изготовлении определенного рода светодиодов.

Еще одно почти магическое свойство поразительного по своей природе металла светлых серебристых оттенков — невероятно высокая температура, при которой галлий кипит. В данных показателях он оставляет ртуть далеко позади, поэтому способен заменить ее в специальных термометрах.
Зафиксировать показатели максимально высоких температур можно только с применением галлия. Столь редкий экземпляр в мире химических элементов и добыть непросто, и стоимость его запредельна: за одну тонну галлия придется заплатить миллион долларов и даже больше.
Ценник загадочного металла никак не уменьшается, а возрастает год от года.
Внимание, опасное вещество!
Для человеческого организма серебристое вещество является токсичным. Если галлий долгое время соприкасается с кожей тела, то действует, как ядовитый элемент, вызывая смертельно опасное отравление.
Сначала человек на какое-то время резко приходит в возбужденное состояние. Потом наступает апатия, сопровождающаяся потерей равновесия и нормальной координации. Перестают работать все рефлексы, нарушается дыхание, наступает паралич ног.
Отравленный галлием человек доходит до тяжелого состояния комы с последующим летальным исходом.
Галлий
Галлий — это серебристо-серый металл с синеватым отливом, достаточно хрупкий. В природе в чистом виде он не встречается и является рассеянным элементом. Среднее содержание галлия в земной коре составляет 19 г/т.
Галлий содержится в минералах, преимущественно это сфалерит, магнетит, касситерит, гранат, берилл, турмалин, сподумен, флогопит, биотит, мусковит, серицит, лепидолит, хлорит, полевые шпаты, нефелин, гекманит и натролит. Достаточно редкий минерал галлит CuGaS₂ используют для выделения чистого галлия.
Кроме того, галлий может быть получен в качестве побочного продукта переработки бокситов.
Галлий плавится всего при 29,76 °C, поэтому он тает даже в руке. При температуре, близкой к комнатной, плавятся еще три металла: ртуть, цезий и рубидий. Но из-за высокой токсичности или реакционной способности их, в отличие от галлия, нельзя брать в руки.
Как был открыт галлий
Существование галлия было предсказано Д. И. Менделеевым в 1871 на основании сформулированного им Периодического закона. Менделеев дал этому элементу название «экаалюминий» и предсказал у него такие свойства как плотность, температуру плавления. Также Менделеев предсказал:
- характер оксида,
- связь в соединениях с хлором.
- что металл будет медленно растворяться в кислотах и щелочах;
- он не будет реагировать с воздухом;
- оксид экаалюминия M₂O₃ должен реагировать с кислотами с образованием солей MX₃;
- что он должен образовывать основные соли;
- хлорид обладает большей летучестью, чем ZnCl₂;
- что этот элемент откроют с помощью спектроскопии.
Менделеев оказался Ностардамусом в химии: когда галлий был получен, все предсказанные ученым свойства подтвердились!
В 1875 году французский химик Поль Эмиль Лекок де Буабодран изучал сфалерит с помощью спектроскопии и обнаружил две фиолетовые линии, принадлежащие новому элементу. Год спустя ученый выделил новый элемент с помощью электролиза.
Этот элемент Буабодран назвал в честь латинского названия Франции — Gallia. Существует легенда, что в это название ученый вкладывал и другой смысл. Лекок созвучно с французским le coq, т.е. «петух» (на латыни gallus).
Буабодран как бы ненароком увековечил свое имя в названии нового элемента.
Изучая полученный галлий, Буабодран определил, что плотность отличается от предсказанной Менделеевым. Когда Менделеев узнал об этом, то написал французскому коллеге с рекомендацией перепроверить результаты. И как оказалось, не напрасно: первые данные Буабодрана действительно были неверными.
Области применения галлия
Бóльшая часть добываемого галлия используется для производства полупроводников. Арсенид (GaAs) и нитрид галлия (GaN) используются в электронных компонентах многих устройств, для создания интегральных схем, высокопроизводительных процессоров, микроволновых усилителей.
Арсенид галлия используется в различных электрооптических инфракрасных приборах. Арсенид галлия-алюминия применяется для создания инфракрасных лазерных диодов высокой мощности. На основе нитрида галлия и нитрида индия-галлия производят синие и фиолетовые лазерные диоды.
Кстати, лазер на нитриде галлия применяется в приводах Blu-ray дисков.
Фотоэлементы на основе арсенида галлия, фосфида и арсенида индия-галлия установлены на космических спутниках и марсоходах.
Галлий имеет интересную особенность: он сильно понижает температуру плавления сплавов, в которых содержится. При этом температура опускается ниже, чем у каждого компонента сплава по отдельности (эвтектические составы). Так, сплав Галинстан (68,5 % галлия, 21,5 % индия и 10 % олова) имеет температуру плавления -19 °С и используется в некоторых термометрах вместо ртути.
Галлий применяется и в медицине. В целом металл характеризуется низкой токсичностью и не выполняет естественной биологической функции.
Поэтому препараты на основе галлия могут применяться при лечении и диагностике раковых заболеваний (изотопы галлий-67 и -68).
Также галлий используется при лечении некоторых бактериальных инфекций: ион Ga³⁺ замещает Fe³⁺ в метаболических путях дыхания бактерий, вызывая их гибель. Препараты на основе галлия могут применяться при лечении малярии.
Еще галлий помогает обнаружить нейтрино-частицы, исходящие от Солнца. Как правило, выявление таких частиц — это весьма сложный и трудоемкий процесс. Галлий в составе регистрационной смеси повышает чувствительность анализа, а соответственно, и помогает зафиксировать нейтрино.
Детекторы GALLEX Национальной лаборатории Гран-Сассо содержат 12,2 тонны галлия-71. Они улавливают нейтрино, исходящие от Солнца, и превращают его в радиоактивный изотоп, излучение которого можно зафиксировать.
Подобные исследования также проводят в Баксанской нейтринной обсерватории (Кабардино-Балкария), где нейтрино-детекторы содержат 5 тонн жидкого галлия.
По температуре плавления галлия можно проверять термометры! Эта величина — 302,9146 K (29,7646 °C) – признана стандартом Международного бюро мер и весов.
В 2007 году с помощью пучков ионов галлия толщиной 7 нм в Simon Fraser University напечатали самую маленькую в мире книгу – Teeny Ted from Turnip Town. Книга получилась размером 0,07x 0,10 мм.
У галлия есть еще одно забавное применение: ложки из галлия, по виду не отличимые от алюминиевых, используют для фокуса с исчезающей ложкой. В горячем чае или кофе такая ложка попросту расплавится!
Источники:
Удивительные вещества, смеющиеся в лицо науке
Сейчас мы, конечно, можем посмеяться над нашими предками, которые считали, что порох – это происки нечистого, но в мире и по сей день существуют материалы, созданные научным путем, проявление свойств которых смахивает на гребаное колдовство. Их трудно достать, а некоторые даже чертовски опасны, но это делает их еще более крутыми.
1. Галлий – металл, который плавится в руках
Ты, конечно, в курсе про существование жидкого металла – ртути. И, конечно, тебе известно, что любой металл плавится при высокой температуре.
Но наш мир горазд на удивительные выдумки и полон необыкновенных вещей, например, существует твёрдый металл, который способен растаять, словно мороженое, у тебя в руке. Знакомься – галлий.
Этот металл даже при небольшой термической обработке превращается в неопасную версию Роберта Патрика из «Терминатора 2».
Галлий легко плавится при комнатной температуре, так что для строительства чего бы там ни было он совершенно не годится. Разве что ты решил создать что-нибудь ради шутки. Очень короткой шутки.
Ну, и еще с помощью галлия ты сможешь снискать себе славу великого фокусника, например, если размешаешь галлиевую ложку в горячей воде, то она раствориться за считанные секунды. И это еще не все.
На Youtube можно найти кучу роликов, где люди издеваются над алюминиевыми предметами, ведь по какой-то причине галлий не очень ладит с алюминием и способен превратить баночку Pepsi или компьютерный радиатор в бумажную салфетку.
Лично мы бы придумали более эпичный розыгрыш, например, капнули бы немного этой хрени на соседский велосипед, перед тем как сосед решит немного прокатиться вечерком по парковой зоне, но, возможно, именно поэтому закон запрещает нам приближаться к химикатам.
2. Газ, способный удерживать предметы
«Это вещество тяжелее воздуха.» Мда… Согласись, эта фраза способна вызвать легкий зевок.
Давай по-новой? «Ты только посмотри, на что способно это дерьмо под названием гексафторид серы!» Хоть раз в своей жизни ты баловался шариками с гелием, и в итоге твой голос походил на писк бурундука, особенно забавно говорить таким голосом грязные ругательства.
Но не только гелий может изменять голос. Гексафторид серы можно назвать злобным братом-близнецом гелия. Вдохни шарик, наполненный этим газом, и ты заговоришь так, словно помимо глистов в тебе поселился еще и демон.
Полюбуйся на Нила Патрика Харриса
Причина подобного преображения заключается в том, что гексафторид серы в несколько раз тяжелее воздуха, в результате чего он понижает частоту любого звука, проходящего через него. По такому же принципу, но наоборот, работает гелий. А теперь представь, что ты можешь вытворить с этим газом, обладая такой ценной информацией.
Например, если вылить газ в стеклянный контейнер, то он пройдёт через воздух и осядет на дне. Этот газ, как и вода, способен выдержать вес менее плотных предметов. Например, лодку из алюминия, которая будет парить в воздухе, как по волшебству.
Можешь глянуть и этот ролик, где парень берет стакан, черпает что-то невидимое глазу, на чем держится лодка, и выливает это нечто прямо на лодку. Лодка тонет.
3. Вещество, не переносящее воду
Звучит не так круто, как выглядит на деле. Видишь эту зеленую массу? Это не яблочное желе и не прямоугольный леденец, а вода на стеклянной плитке, окрашенная в зеленый цвет. Даже если ты размажешь ее по поверхности, она все равно примет свою изначальную форму.
Это происходит, потому что края плиты обработаны гидрофобным материалом, с помощью которого поверхность буквально отталкивает капли. В середине плита не обработана, поэтому вся жидкость стекает туда.
Если ты капнешь каплю воды на обработанную поверхность, то можешь воочию увидеть, как она удирает в сторону, где отсутствует гидрофобный материал.
- Если намажешь этой дрянью палец и окунешь его в воду, он останется абсолютно сухим, а вокруг него образуется своеобразная пленка, по текстуре похожая на крошечный гандон, при этом вода в отчаянии убежит прочь от твоего пальца.
- И еще один занимательный опыт можешь посмотреть на видео ниже: ложку опускают в воду, насыпают в нее песок, он превращается в нечто отвратное, похожее на кишки, а после ложку достают с идеально сухим песком.
4. Горячий лед
Горячий лёд, или ацетат натрия – это жидкость, которая затвердевает при малейшей стрессовой ситуации. Дотронься до него пальцем или крикни пару бранных слов, как вещество из жидкого состояния преобразуется в субстанцию из твердых ледяных кристаллов.
Например, ты можешь вылить эту штуковину в контейнер, дотронуться до него пальцем или членом, смотря как тебе больше нравится, а после наблюдать, как белые кристаллы хаотично распределяются по всей поверхности, чтобы через несколько секунд превратиться в лед.
Ацетат натрия очень медленно остывает и способен сохранять жидкое состояние даже при минусовой температуре. Но если его «разбудить», то он понимает, что «проспал» все на свете, и начинает заниматься очень активной деятельностью, а именно, его частицы начинают быстро затвердевать.
5. Металл, обладающий памятью
Теперь полюбуйся на металл, который имеет память. Посмотрев ролик, размещенный ниже, ты увидишь, как небольшой моток проволоки, на первый взгляд самой обычной, при контакте с кипятком образует слово HOT ( «горячий»). Это нитинол, сплав титана и никеля, который способен принимать свою изначальную форму даже после деформации до неузнаваемости.
Всё, что нужно, это вылить на него кипяток, и не важно, как сильно запутан и скручен провод, «запоминающий металл» приобретёт первоначальную форму. Как говорится, просто добавь воды. Современные инженеры на данном этапе изучения этого материала додумались создать лишь очки с оправой из нитинола.
Интересно, доживем ли мы до момента, когда из него начнут делать машины.
6. Взрывной порошок
Йодистый азот немного похож на кучу грязи или порцию огородных удобрений, но только не вздумай использовать эту штуку на своем заднем дворе. Только если ты не любитель суперского хардкора.
Эта субстанция крайне нестабильна, и даже легкого дуновения ветерка хватит, чтобы устроить мощный взрыв. Йодистый азот не нашел широкого практического применения, кроме как в сфере больных розыгрышей.
После взрыва этот порошок оставляет красивое фиолетовое облачко.
Кроме того, в первом сезоне сериала «Во все тяжкие» его использует Уолт, чтобы взорвать притон наркодилера. Единственная промашка режиссера заключается в том, что Уолтер погиб, даже не дойдя до места, с подобным ядреным веществом в сумке.