Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Термин «кофермент» был введён в начале XX века и обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе.
Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора — кофермента. Белковая часть получила название «апофермент», который в отсутствие кофермента не обладает каталитической активностью.
Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
А. Кофакторы
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
- 1. Роль металлов в присоединении субстрата в активном центре фермента
- Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
- Ионы металлов — стабилизаторы молекулы субстрата
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-АТФ.
В этом случае ион Мg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента (см. схему).
Схема
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить, как комплекс Е-S-Ме, где Е — фермент, S — субстрат, Ме — ион металла.
В качестве примера можно привести расположение субстратов в активном центре гексокиназы (рис. 2-3).
Гексокиназа катализирует перенос концевого, y-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата:
Рис. 2-3. Участие ионов магния в присоединении субстрата в активном центре гексокиназы. В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg2+-АТФ. В результате ферментативной реакции происходит перенос концевого, y-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.
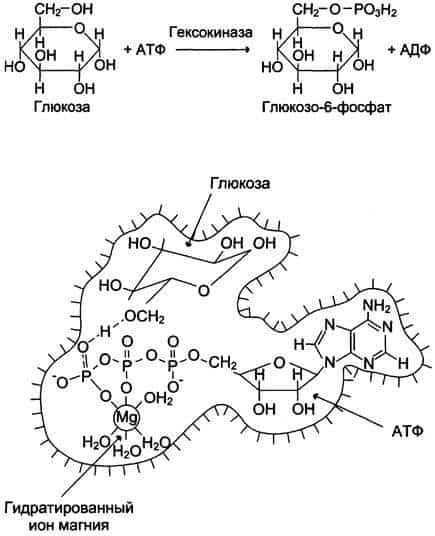
Ион Мg2+ участвует в присоединении и «правильной» ориентации молекулы АТФ в активном центре фермента, ослабляя фосфоэфирную связь и облегчая перенос фосфата на глюкозу.
Ионы металла — стабилизаторы активного центра фермента
В некоторых случаях ионы металла служат «мостиком» между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента.
Перечисленные выше функции выполняют такие металлы, как Мg2+, Мn2+, Zn2+, Со2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название «металлоэнзимы».
Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
Е-Ме-S
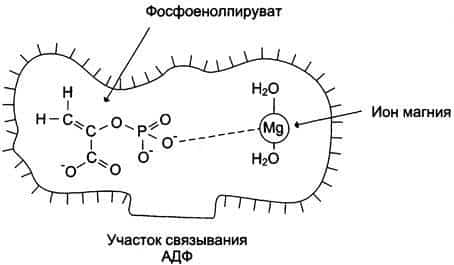
К металлоэнзимам относят, например, фермент пируват киназу (рис. 2-4), катализирующий реакцию:
Рис. 2-4. Участие ионов магния в присоединении субстрата в активном центре пируваткиназы. Активный центр пируваткиназы имеет участки связывания для фосфоеноппирувата и АДФ. Мg2+участвует в стабилизации активного центра, что облегчает присоединение фосфоеноппирувата. В ходе ферментативной реакции образуется пируват и АТФ.
2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны.
Их активность снижается и даже полностью исчезает при небольших изменениях pH, температуры и других незначительных изменениях внешнего окружения.
Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы К+.
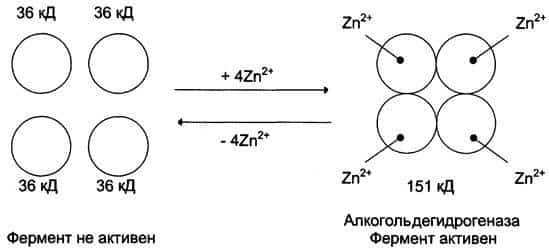
Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. Алкогольдегидрогеназа состоит из 4 субъединиц с молекулярной массой 151 кД. В состав фермента входят 4 атома Zn2+. Удаление Zn2+ приводит к потере активности фермента за счёт диссоциации на 4 неактивные субъединицы с молекулярной массой 36 кД (рис. 2-5).
Рис. 2-5. Роль ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы.
- 3. Роль металлов в ферментативном катализе
- Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
- Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn2+, Fе2+, Мn2+, Сu2+.
Ионы щелочноземельных металлов, такие как Na+ и К+, не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы.
Карбоангидраза — цинксодержащий фермент, катализирующий реакцию образования угольной кислоты:
CO2 + H2O H2CO3.
Ион Zn2+ в результате электрофильной атаки участвует в образовании Н+ и ОН- ионов из молекулы воды:
Протон и гидроксильная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты (см. схему А).
- В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
- Участие в окислительно-восстановительных реакциях
- Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
Другой пример участия ионов металлов в окислительно-восстановительных реакциях — работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С (см. схему Б).
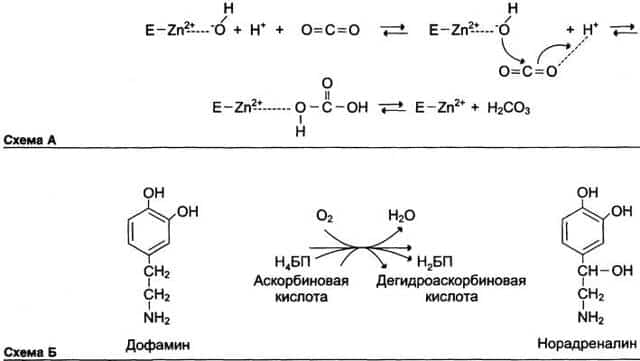
За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди (рис. 2-6).
Рис. 2-6. Участие иона меди в активации молекулы кислорода при функционировании дофамингидроксилазы. 1 — восстановление Сu2+, входящего в состав активного центра дофамингидроксилазы, до Сu+ с помощью аскорбиновой кислоты; 2 — взаимодействие Сu+ с кислородом с образованием перекисного соединения; 3 — перенос гидроксильной группы на молекулу дофамина с образованием норадреналина.
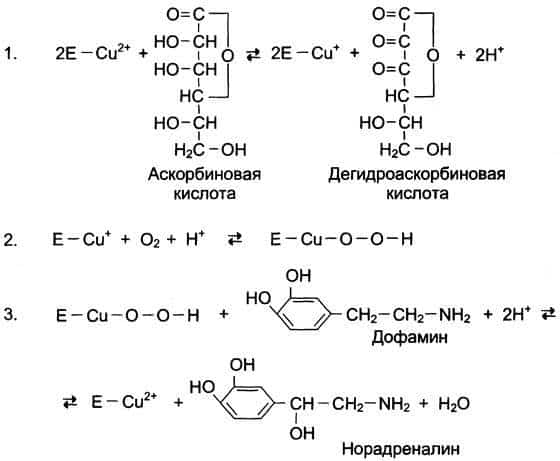
Фермент, содержащий ион Сu2+, не вступает в реакцию с молекулой кислорода. При восстановлении Сu2+ до Сu+ с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина.
4. Роль металлов в регуляции активности ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков (см. раздел 5). Ионы Са2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов (см. подраздел V).
Б. Коферменты
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов.
Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота).
Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например, тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры — NАD+, NАDР+.
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата.
Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата.
Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
- К коферментам относят следующие соединения:
- ✵ производные витаминов;
- ✵ гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO- синтазы и являющиеся простетической группой ферментов;
- ✵ нуклеотиды — доноры и акцепторы остатка фосфорной кислоты;
- ✵ убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
- ✵ фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
- ✵ S-аденозилметионин (SAM) — донор метальной группы;
- ✵ глутатион, участвующий в окислительновосстановительных реакциях.
- Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника.
- В. Мультисубстратные реакции
Большинство ферментов катализирует реакции, в которых участвует более чем один субстрат. В случае если кофермент не является простетической группой, его также можно рассматривать как ещё один субстрат. Следовательно, участников ферментативной реакции может быть несколько: непосредственно фермент, несколько субстратов и кофермент.
В этих случаях механизм ферментативной реакции, как правило, может идти по одному из двух путей: по механизму «пинг-понг» (механизму двойного замещения) или последовательному. Рассмотрим оба механизма.
1. Механизм «пинг-понг»
Схематично механизм «пинг-понг» может быть представлен следующим образом:
Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е') в результате модификации кофермента. Далее к активному центру Е' присоединяется субстрат В, подвергающийся преобразованию в продукт (Р2) с высвобождением нативной формы фермента (Е).
Хороший пример механизма «пинг-понг» — реакции трансаминирования с участием ферментов аминотрансфераз (кофермент пиридоксальфосфат). Аминотрансферазы, открытые отечественным учёным А. Е. Браунштейном, катализируют обратимые реакции переноса аминогруппы с аминокислоты на кетокислоту. Механизм «пинг-понг» данной реакции схематично представлен на рис. 2-7.
Рис. 2-7. События в активном центре аминотрансферазы как пример механизма «пинг-понг».
Кофермент пиридоксальфосфат (ПФ), связанный с ферментом, принимает α-аминогруппу от первой аминокислоты (АК1) которая при этом превращается в α-кетокислоту 1 (КК1) и высвобождается из активного центра фермента.
Далее в активный центр фермента присоединяется α-кетокислота 2 (КК2), которая забирает аминогруппу от кофермента и превращается в α-аминокислоту (АК2).
Другой пример механизма «пинг-понг» — реакции дегидрирования с участием кофермента FAD (флавинадениндинуклеотид) или FMN (флавинмононуклеотид), которые прочно связаны с ферментом и, следовательно, не могут рассматриваться в качестве второго субстрата.
Схематично структура этих коферментов и соответствующие им химические формулы представлены на рис. 2-8.
Рис. 2-8. Структура (А) и химическое строение (Б) коферментов FMN и FAD.
FMN и FAD участвуют в окислительно-восстановительных реакциях, акцептируя 2 е- и 2 Н+ в изоаллаксазиновом кольце (см. схему ниже).
- Схему реакции дегидрирования (как пример механизма «пинг-понг» с участием коферментов FMN и FAD) можно представить в следующем виде:
- где АН2 — донор водорода, окисляемый субстрат 1; А — окисленная форма субстрата 1; В — акцептор водорода — субстрат 2; ВН2 — восстановленная форма субстрата 2; Е (FAD), Е (FADH2) — окисленная и восстановленная формы кофермента FAD, входящего в состав фермента Е.
В качестве примера FAD-зависимой реакции можно привести сукцинатдегидрогеназную реакцию. В этой реакции в качестве второго субстрата участвует убихинон — один из посредников ЦПЭ (см. схему).
- 2. Последовательный механизм
- В случае последовательного механизма для протекания ферментной реакции требуется одновременно взаимодействие двух субстратов. В этом случае возможно присоединение субстратов двумя различными путями:
- Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
Первым в активный центр фермента присоединяется субстрат А, облегчая присоединение субстрата В. После химической модификации также наблюдают определённый порядок высвобождения продуктов реакции.
Механизм случайного взаимодействия субстрата с активным центром фермента:
Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет (каждый субстрат имеет свой центр связывания в активном центре). Также нет строгой закономерности высвобождения продуктов реакции.
Примером последовательного упорядоченного механизма может быть реакция дегидрирования с участием коферментов NАD+, NАDР+.
Схематично структура и химические формулы этих коферментов представлены на рис. 2-9.
Рис. 2-9. Структура (А) и химическое строение (Б) коферментов NAD+ и NАDР+.
Оба кофермента функционируют как посредники переноса двух электронов и одного протона от донора к акцептору, другого протона — в среду (см. схему А).
Донор и акцептор не обязательно участвуют в одном метаболическом пути. Другими словами, восстановленная форма этих нуклеотидов действует как общий пул электронов, образованный в результате окислительных реакций, и может быть использована в различных восстановительных реакциях. Такие реакции называют сопряжёнными (см. схему Б).
где АН2 — донор водорода, восстановленная форма субстрата 1; А — окисленная форма субстрата 1; В — акцептор водорода — второй субстрат; ВН2 — восстановленная форма субстрата 2; NAD+, NADH — окисленная и восстановленная формы кофермента; Е1 и Е2 — ферменты.
Две ферментативные реакции, катализируемые ферментами Е1 и Е2, сопряжены друг с другом посредством кофермента NAD+, служащего в каждом из этих случаев субстратом. Для первого фермента субстратом служит окисленная форма NAD, в качестве второго субстрата выступает донор водорода — пример последовательных реакций, продуктом — восстановленная форма NAD, для фермента Е2 — наоборот.
В качестве примера можно рассмотреть следующие сопряжённые реакции (см. схему), где Е1 — глицеральдегидфосфат дегидрогеназа; Е2 — лактатдегцдрогеназа.
- схема
ПредыдущаяСодержаниеСледующая
Кофакторы – ионы металлов
Более 25 % всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим их роль в ферментативном катализе.
Роль металлов в присоединении субстрата в активном центре фермента. Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов – стабилизаторы молекулы субстрата. Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла.
Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-АТФ.
В этом случае ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента.
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить как комплекс E-S-Me, где Е – фермент, S – субстрат, Ме – ион металла.
Ионы металлов – стабилизаторы активного центра фермента.В некоторых случаях ионы металлов служат «мостиком» между ферментом и субстратом.
Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента.
Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Mo2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название «металлоэнзимы».
К металлоэнзимам относят, например, фермент пируват- киназу.
Роль металлов в стабилизации структуры фермента. Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны.
Их активность снижается и даже полностью исчезает при небольших изменениях рН, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы К+.
Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка.
ПОИСК
Многие двухвалентные металлы (Mg , Мп , Са ), как будет показано далее, также выполняют роль кофакторов, хотя они не относятся ни к коферментам, ни к простетическим группам. Известны примеры, когда ионы металлов прочно связаны с белковой молекулой, выполняя функции [c.
121]
Металлы — активаторы, выполняющие роль кофакторов. Сюда относятся катионы металлов, необходимые для протекания ферментативной реакции, но не принимающие непосредственного участия в акте каталитического превращения субстрата.
В свою очередь кофакторы выполняют эти функции несколькими различными способами. [c.252]
Различают две группы кофакторов ионы металлов (а также некоторые неорганические анионы) и коферменты, представляющие собой органические вещества. Примерно треть из всех известных в настоящее время ферментов активируется ионами металлов. Прочность связи ионов металлов с белковой частью фермента колеблется в широких пределах. Некоторые металлокомплексы ферментов в процессе их выделения из биологических материалов вследствие достаточной лабильности теряют ион металла. Эти особенности приходится учитывать при исследовании фи-зико-химических и биохимических характеристик таких ферментов, восстанавливая их активность путем добавления в среду соответствующих ионов. Такие белки образуют группу ферментов, активируемых ионами металлов. Другие металлоферментные комплексы отличаются большей стабильностью, т. е. сохраняют ион металла при выделении и очистке ме-таллоферменты). В роли кофакторов ферментов могут выступать различные по природе ионы металлов. [c.95]
В роли кофактора могут выступать ионы различных металлов (табл. 2.1). Ион металла может участвовать в присоединении субстрата, собственно в катализе, в стабилизации оптимальной конформации молекулы фермента, в стабилизации четвертичной структуры. Активность металлозависимых ферментов после удаления металла либо утрачивается полностью, либо заметно снижается. [c.69]
Роль кофакторов в функционировании ферментов исключительно велика — они осуществляют перенос отдельных атомов и группировок (водорода, фосфатной группы и др.) в ходе ферментативного превращения, служат связными между отдельными родственными ферментами и обеспечивают их согласованную деятельность.
Ионы металлов, иногда входящие в состав ферментов в виде специальной, простетической группировки, часто выполняют роль активаторов ферментов, переводящих фермент в каталитически активное состояние. В качестве примера приведем строение одного из важнейших в биологическом отношении кофермента — коферемента А (рис. 10).
[c.42]
Все киназы (фосфотрансферазы) этого типа, т. е. ферменты, катализирующие образование обычных 0-фосфатных эфиров, используют в качестве донора фосфата какой-нибудь нуклеозидтрифосфат (по большей части АТФ) и нуждаются в катионе двухвалентного металла (обычно М +).
Данные кинетических исследований и спектры магнитного резонанса показывают, что ионы металла, играющие роль кофактора, сначала взаимодействуют с АТФ и образуют двойной комплекс. Именно этот комплекс служит истинным субстратом реакции и связывается с ферментом.
Эксперименты с субстратом, меченным с помощью 0 , показали, что реакция переноса фосфата протекает в действительности следующим образом [c.283]
Кофактор, выполняя каталитическую функцию, должен оставаться химически неизменным в результате катализируемой реакции. Если же в роли кофактора выступает истинно простетическая группа, то она осуществляет весь каталитический цикл, будучи присоединенной к одной и той же молекуле фермента. В ряде случаев, однако, кофакторы вступают в более сложные взаимодействия, будучи связующим звеном между двумя ферментами и обеспечивая тем самым образование единой ферментной системы. Такие кофакторы принято называть кофер-ментами. [c.16]
Многим ферментам для эффективной работы требуются те или иные небелковые компоненты, назьшаемые кофакторами. Кофакторы — это вещества, присутствие которьк совершенно необходимо для проявления каталитической активности ферментов, хотя сами они в отличие от ферментов сохраняют стабильность при довольно высоких температурах.
Роль кофакторов могут играть различные вещества — от простых неорганических ионов до сложных органических молекул в одних случаях они остаются неизменными в конце реакции, в других — регенерируют в результате того или иного последующего процесса. Кофакторы подразделяются на три типа неорганические ионы, простетические группы и коферменты.
Их мы и рассмотрим в последующих трех разделах. [c.165]
В живых системах роль кофакторов или метаболитов выполняют относительно немногие типы молекул. Кроме некоторых ионов [615, 616], наиболее типичными в этом отношении являются производные аденозина, глюкозы, порфирина и а-аминокислот. Большая часть белков специализируется во взаимодействии с одним или с большим числом таких стандартных строительных блоков [19]. [c.243]
ФМН.Нг и альдегид R СНО играют роль кофакторов люциферазы. [c.481]
Повышенное выделение лимонной кислоты при недостатке железа объясняется скорее всего тем, что железо выступает в роли кофактора аконитазы, медь же действует по отношению к нему как антагонист.
На этом основан новый технический прием, повышающий выход нужного продукта даже в присутствии небольших количеств ионов железа в растворе мелассы (10 мг на 1 л) можно получить максимальный выход лимонной кислоты, добавив к среде избыток ионов меди (150 мг на 1 л). [c.331]
Наряду с циклическим и нециклическим хлоропласты могут осуществлять и третий тип фотофосфорилирования, так называемое псевдоциклическое. Так же, как и нециклическое, оно протекает при участии обеих пигментных систем, однако видимое выделение свободного кислорода в его ходе не имеет места.
Причина состоит в том, что образующийся за счет действия II пигментной системы кислород способен в определенных условиях служить конечным акцептором электронов, которые его восстанавливают с образованием воды роль кофакторов в этом случае выполняют хиноны, флавиновые дегидрогеназы. [c.
160]
Заслуживает внимания тот факт, что в роли кофактора выступает не витамин В12 как таковой, а фактор А—корриноил, содержащий 5-окси-бензимидазол (стр. 286). Реакции, ведущие к синтезу метилкорринои-да, не известны, но если добавить витамин (Со+), то метильные [c.298]
Многие ферменты состоят из белковой макромолекулы (апофермента) и кофактора (простетической группы) — небелковой молекулы (иона, комплекса), который в совокупности с белком образует активный катализатор. В других случаях роль кофактора выполняют белковые функциональные группы по-липептидных цепей. [c.549]
Роль кофакторов в данной реакции выполняет глюкозо-1,6-бисфосфат, образующийся в реакции, катализируемой фосфоглюкокиназой глюкозо-Ьфосфат + АТФ глюкозо-1,6-бис-фосфат + АДФ. [c.322]
Реакция легкообратима, протекает в присутствии ионов Mg . Кофактором фермента является также 2,3-бисфосфоглицериновая кислота аналогично тому, как в фосфоглюкомутазной реакции роль кофактора выполняет глюкозо-1,6-бисфосфат [c.331]
Витамины необходимы именно потому, тто они служат кофакто-рагЛя или преобразуются в них. Тгк как роль кофакторов каталитическая, они нужны организму в малых количествах. [c.48]
Белки выполняют свою важнейшую — ферментативную функцию большей частью в комплексах с низкомолекулярными кофакторами и с простетическими группами. Последние связаны с белком валентными связями. Кофакторы, коферменты слабее связаны с апоферментом, т. е.
с белком, и способны переходить от одной молекулы белка к другой. Это, впрочем, не всегда так, и отличие кофермента от простетической группы не вполне определенно. Фермент в целом, т. е. комплекс белковой части молекулы, именуемой ферментом, с коферментом, называется хо-лоферментом.
Роль кофакторов в ряде случаев играют ионы металлов. [c.94]
Аскорбиновая кислота, по-видимому, играет роль кофактора в реакции ферментативного гидроксилирования, при котором остатки пролина в коллагене соединительной ткани позвоночных превращаются в остатки 4-гидроксипролина (рис. 5-7). Гидроксипролиновые остатки обнаружены только в коллагене (разд. 7.15) и не встречаются ни в одном другом белке животных. Таким образом, хотя аскорбиновая кислота, видимо, участвует [c.288]
Кофакторы — соединения небелковой природы, в присутствии которых.проявляется активность ферментов. В роли кофакторов могут выступать ионы металлов или сложные органические вещества — коферменты. Иногда для проявления каталитической активности необходимо наличие тех и других.
Кофакторы, как правило, термостабнльны, связывание их с ферментами характеризуется разной степенью сродства. Чаще всего кофактор можно отделить от ферментного белка путем диализа или каким-либо иным способом, но существуют и кофакторы, ковалентно связанные с белюм. [c.
109]
Терминология обусловлена следующим. В двухсубстратных реакциях ферменты обычно осуществляют перенос электрона, атома или группы атомов с одного субстрата на другой. Оба превращаемых компонента в равной мере относятся к субстратам данного фермента и до тех пор, пока рассматривается изолированная ферментативная ре-а кция, их можно разделить на субстраты-доноры и субстраты-акцепторы переносимых групп. Например, в реакциях переноса водорода, в которых роль кофактора играют пиридиннуклеотиды МАОР+ и МАО+, они служат акцепторами, а МАОРН и МАОН — донорами гидридных ионов. Вместе с тем роль донора и акцептора водорода [c.127]
FMN и FAD обычно прочно — но не ковалентно—связаны с соответствующим апоферментом. Многие флавопротеиновые ферменты содержат один или несколько ионов металлов, выполняющих роль кофакторов такие флавопротеиновые ферменты называют металлофлавопротеинами. [c.120]
Пример 17-Д. Роль кофактора в фермент-субстратном связывании, Дрожжевая алкогольдегидрогеназа превращает этанол в ацетальдегид, но только в присутствии кофактора ннкотинамид-адениндинуклеотида (НАД). Изучение ЯМР приводит к пониманию роли НАД в этой реакции. Линии протонов никотинамида уширяются при смешивании фермента и НАД.
Это уширение специфично к данному ферменту (т. е. с другими белками не происходит) и является, следовательно, результатом связывания кофактора с ферментом, а не эффекта вязкости, упомянутого в примере 17-Г. Если этанол (субстрат) или ацетальдегид (продукт) добавляются к смеси НАД — фермент, линии метильных протонов и субстрата, и продукта уширяются.
В отсутствие фермента уширения линий не происходит, так что и субстрат, и продукт должны связываться с комплексом фермент — кофактор Если фермент, субстрат и продукт смешиваются в отсутствие НАД, уширения линий метильных протонов этанола либо ацетальдегида не наблюдается. Следовательно, НАД должен связываться с ферментом, чтобы мог связаться субстрат.
[c.509]
Прокоагулянтный путь (рис. 21.15) занимает центральное место в свертывании крови. В циркулирующей крови содержатся проферменты протеолитических ферментов, секретируемые клетками печени факторы VII, XI, IX, X и фактор II (протромбин).
При повреждении сосуда включается каскадный механизм активации этих проферментов. В активации участвуют также циркулирующие в крови факторы VIII и V и мембранный белок Тф (тканевой фактор, фактор III) эти факторы выполняют роль кофакторов ферментов (активаторов).
В ходе активации образу- [c.507]
Особенности поведения ионов переходных металлов
Граница между ионами групп А и Б проходит по ионам переходных металлов.
О типичном поведении катионов переходных металлов вообще не приходится говорить, так как большое разнообразие состояний окисления для многих из них делает картину труднообозримой.
Так, многие ионы (Ti3+, V3f, Сг3*) благодаря окислению переходят в катионы, поведение которых типично для А-катионов (Ti4~, Vv, Crvl), другие благодаря восстановлению (Си2'), наоборот, образуют типичные Б-катионы (Си*).
Для того, чтобы сформулировать некоторые правила поведения ионов переходных металлов и выявить определенные закономерности, необходимо ограничиться определенной степенью окисления.
Все ионы М3+ и М2~ (а также Pt,v, Аиш) образуют очень слабые фторидные комплексы, что соответствует поведению Б-катионов. Особенностью комплексообразования ионов переходных металлов по сравнению с s2-, s2p6- и /-катионами является сродство к донорным атомам азота.
Действительно, при взаимодействии с растворами аммиака, в которых содержатся кислородные лиганды ОН и «азотные» лиганды NH3, ^-катионы обычно дают аммиачные комплексы, тогда как в таких условиях А-катионы и /катионы осаждаются в виде гидроксидов либо дают прочные гидроксоком- плексы.
Однако Fe3+ и Сг3~ образуют более устойчивые комплексы с кислородсодержащими реагентами, чем с N- и S-содержащими лигандами (NH3 и H2S осаждают гидроксиды этих металлов). Однако все остальные ионы переходных металлов образуют труднорастворимые сульфиды и, соответственно, устойчивые хелаты с S-лигандами.
Большинство ионов переходных металлов образуют устойчивые цианидные комплексы, что позволяет легко маскировать эти катионы CN-ионами; исключение составляют Ti3+, Nb, Та, С г34.
Для хелатов, образованных двухзарядными катионами М2+, установлен следующий ряд устойчивости (ряд Ирвинга — Вильямса): Мп2+ < Fe2+ < Со24 < Ni2+ < Cu2+ > Zn2+.
Порядок расположения ионов в ряду практически нечувствителен к выбору лигандов при отсутствии специфичных стери- ческих эффектов.
В целом возрастание устойчивости комплексов происходит при переходе от ионов металлов с большим радиусом к ионам с маленьким радиусом, из чего следует, что ряд Ирвинга — Вильямса отражает влияние электростатических эффектов на величины констант образования комплексов.
Однако при переходе от иона Мп24 к Fe24 (d6), Со2+ (с/7), Ni2+ (с/8) и Си24 (сР) величина константы устойчивости резко возрастает. Для этих ионов наблюдается дополнительная стабилизация, пропорциональная энергии стабилизации полем лигандов (ЭСПЛ).
Однако существует одно важное исключение: устойчивость комплексов Си2* больше, чем комплексов Ni2+, несмотря на то, что у иона меди (II) на один электрон больше на разрыхляющих е-орбиталях.
Данная аномалия является следствием стабилизирующего влияния эффекта Яна — Теллера, который приводит к упрочнению связи металла с четырьмя лигандами, расположенными в экваториальной плоскости тетрагонально искаженного комплекса меди (II). Эта стабилизация повышает величину константы устойчивости комплекса. Соответственно лиганды, находящиеся в аксиальных позициях, связаны слабее.
Существенные отличия в устойчивости комплексных соединений катионов различных групп (А-катионы, Б-катионы и ионы переходных металлов) позволяют создавать групповые аналитические реагенты и применять метод маскировки.
Этот метод, используемый в технологии и в аналитической химии, состоит в том, что раствор, содержащий смесь катионов, обрабатывают двумя реагентами, один из которых — групповой — связывает ряд катионов в комплексы, маскируя их.
Благодаря этому второй реагент связывает в комплексы или осаждает только незамаскированные ионы и его действие становится более избирательным. А-катионы обычно маскируют фторидом, с которым они дают очень прочные комплексы или осадки; хорошо они маскируются также многими кислородсодержащими реагентами.
Переходные металлы чаще маскируют аминами. Для Б-кагионов и некоторых переходных металлов превосходным маскирующим реагентом является цианид-ион; успешно используются также серосодержащие лиганды (диэтилдитиокарбамат и др.), с которыми А-катионы практически не реагируют.
Кофакторы ферментов: ионы металлов и коферменты. Роль кофакторов в катализе
Кофермент — дополнительная группа, легко отделяемая от апофермента при диссоциации. Предполагают, что простетическая группа может быть связана с белком ковалентными и нековалентными связями. С другой стороны, химические связи между кофакторами и пептидными цепями могут быть относительно слабыми.
В таких случаях при выделении ферментов наблюдается полная диссоциация обеих частей, и белковый компонент лишается ферментативной активности. Типичными представителями являются витамины В1, В2, В6, РР, содержащие коферменты.
Многие двухвалентные металлы (Mg2+, Мn2+, Са2+), как будет показано далее, также выполняют роль кофакторов, хотя они не относятся ни К коферментам, ни к простетическим группам. Условно можно выделить две функции кофакторов: 1. участие в каталитическом превращении субстрата одним ферментным белком.
При этом кофактор может функционировать либо как катализатор, который регенерируется после каждого акта превращения субстрата, либо как косубстрат. В последнем случае регенерация исходной формы кофермента осуществляется другим ферментом в сопряжённой реакции.
2. Активация и перенос молекулы субстрата от одного фермента к другому.
В этом варианте субстрат реагирует с коферментом в активном центре фермента так, что образуется новое реакционноспособное производное субстрата, которое устойчиво в водной среде.
Затем образовавшееся производное субстрата связывается с другим ферментом, в активном центре которого и осуществляется каталитическое превращение субстрата с одновременной регенерацией кофактора.
17. Классификация коферментов по строению и функциям. По строению:
- —Алифатические (липоевая кислота) — ароматические (коэнзим Q) — гетероциклические (ТПФ, ПФ) — нуклеотиды (НАД, НАДФ, ФАД, ФМН)
- По функциям:
—переносчики протонов и электронов (НАД,ФАД. Ко Q) —переносчики Групп (ТПФ,ПФ,Ко А) — коферменты синтеза и изомеризации.
НАД и НАДФ, строение ок-й и вос-ой форм, участвующих в катализе.
Производные PP витамина. Биохимическая функция: дыхание, перенос водорода. Витамин РР входит в состав НАД или НАДФ, являющихся коферментами большого числа обратимо действующих в ОВР дегидрогеназ.
Показано, что ряд дегидрогеназ использует только НАД и НАДФ (соответственно малатдегидрогеназа и глюкозо-6-фосфатдегидрогеназа), другие могут катализировать ОВР в присутствии любого из них (например, глутаматдегидрогеназа).
В процессе биологического окисления НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновыми ферментами.
ФАД и ФМН.
Производные витамина B2.Биологическая функция дыхание, перенос водорода. Рибофлавин входит в состав флавиновых коферментов, в частности ФМН и ФАД, являющихся простетическими группами ферментов флавопротеинов.
Некоторые флавопротеины в дополнение к ФМН или ФАД содержат еще прочно связанные неорганические ионы, в частности железо или молибден, наделенные способностью катализировать транспорт электронов. Различают 2 типа химических реакций, катализируемых этими ферментами.
К первому относятся реакции, в которых фермент осуществляет прямое окисление с участием кислорода, т.е. дегидрирование (отщепление электронов и протонов) исходного субстрата или промежуточного метаболита. К ферментам этой группы относятся оксидазы L- и D-аминокислот, глициноксидаза, альдегидоксидаза, ксантиноксидаза и др.
Вторая группа реакций, катализируемых флавопротеинами, характеризуется переносом электронов и протонов не от исходного субстрата, а от восстановленных пиридиновых коферментов. Ферменты этой группы играют главную роль в биологическом окислении.
В каталитическом цикле изоаллоксазиновый остаток ФАД или ФМН подвергается обратимому восстановлению с присоединением электронов и атомов водорода к N1 и N10. ФМН синтезируется в организме животных из свободного рибофлавина и АТФ при участии специфического фермента рибофлавинкиназы: Образование ФАД в тканях также протекает при участии специфического АТФ-зависимого фермента ФМН-аденилилтрансферазы.
20. КОА, строение, роль.
Витамин В3, транспорт ацильных групп. Пантотеновая кислота входит в состав кофермента А, или коэнзима А (КоА).
Название ≪коэнзим А≫ (кофермент ацилирования) связано с тем, что это соединение участвует в ферментативных реакциях, катализирующих как активирование, так и перенос ацетильного радикала СН3СО; позже оказалось, что КоА активирует и переносит также другие кислотные остатки (ацилы).
Участвует в обмене веществ, в основных биохимических процессах, окисление и биосинтез высших жирных кислот, окислительное декарбоксилирование α-кетокислот, биосинтез фосфолипидов, стероидных гормонов, гема и гемоглобина, ацетилхолина и др.






