- Видео
- Химические свойства металлов
- Электронное строение металлов и их особенности
- Физические свойства
- Тест по теме
- Теги
- Электрический ток в металлах: подробное объяснение (формулы)
- Важно знать
- Классическая модель проводимости
- Выводы простым языком
- Материаловедение в машиностроении
- Ионная связь
- Ковалентная связь
- Металлическая связь
- Силы Ван-дер-Ваальса
- Лекция по Химии на тему "Металлы"
Многие металлы могут вступать в реакцию с кислородом. Обычно продуктами этих реакций являются оксиды, но есть и исключения, о которых вы узнаете на следующем уроке. Рассмотрим взаимодействие магния с кислородом.
КУДиР для ИП на ОСНО
Магний горит в кислороде, при этом образуется оксид магния:
2Mg + O2 = 2Mg+2O-2
Прием заявлений о запросе выплатного (пенсионного) дела
Рис. 1. Горение магния в кислороде
Атомы магния отдают свои внешние электроны атомам кислорода: два атома магния отдают по два электрона двум атомам кислорода. При этом магний выступает в роли восстановителя, а кислород – в роли окислителя.
Видео-опыт: “Горение магния”
Комбинированное золото в изящных кольцах
Обратите внимание!!! Серебро, золото и платина с кислородом не реагируют.
2. Взаимодействие с галогенами, образуются галогениды
Для металлов характерна реакция с галогенами. Продуктом такой реакции является галогенид металла, например, хлорид.
Рис. 2. Горение калия в хлоре
Калий сгорает в хлоре образованием хлорида калия:
Как найти объем в химии ℹ️
- 2К + Cl2 = 2K+1Cl-1
- Два атома калия отдают молекуле хлора по одному электрону. Калий, повышая степень окисления, играет роль восстановителя, а хлор, понижая степень окисления,- роль окислителя
- 3. Взаимодействие с серой
Многие металлы реагируют с серой с образованием сульфидов. В этих реакциях металлы также выступают в роли восстановителей, тогда как сера будет окислителем. Сера в сульфидах находится в степени окисления -2, т.е. она понижает свою степень окисления с 0 до -2.
Например, железо при нагревании реагирует с серой с образованием сульфида железа (II):
Fe + S = Fe+2S-2
Этилен (этен), получение, свойства, химические реакции
Рис. 3. Взаимодействие железа с серой
- Видео-опыт: “Взаимодействие цинка с серой”
- Металлы также могут реагировать с водородом, азотом и другими неметаллами при определенных условиях.
- Видео: «Самовоспламенение никеля на воздухе»
- 4. Взаимодействие с водой
- Металлы по — разному реагируют с водой:
Помните!!!
- Алюминий реагирует с водой подобно активным металлам, образуя основание:
- 2Al + 6H2O = 2Al(OH)3 + 3H2↑
- Видео-опыт: “Взаимодействие натрия с водой”
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe3O4 и водород: 3Fe+4H+12O−2 → Fe+2O−2⋅Fe+32O−23 + 4H2
- 5. Взаимодействие с кислотами
- Металлы особо реагируют с серной концентрированной и азотной кислотами:
- H2SO4 (конц.) + Me = соль + H2O + Х
| Щелочные и щелочноземельные | Fe, Cr, Al |
|
Металлы после водорода (при t) | Au, Pt | |
| X | H2S↑ могут S↓ или SO2↑ | 1)пассивируются на холоде; 2) при нагревании → SO2↑ | S↓ могут H2S илиSO2 | SO2↑ | — |
- H2SO4 (разб) + Zn = ZnSO4 + H2↑
- H2SO4 (разб) + Cu ≠
- 2H2SO4 (конц.) + Cu = CuSO4 + 2H2O + SO2↑
- Внимание!
- Pt, Au + H2SO4 (конц.) →реакции нет
- Al, Fe, Cr + H2SO4 (конц.) холодная→ пассивация
Видео
Химические свойства металлов
Металлы легко отдают электроны, т. е. являются восстановителями. Поэтому они легко реагируют с окислителями.
Вопросы
- Какие атомы являются окислителями?
- Как называются простые вещества, состоящие из атомов, которые способны принимать электроны?
Таким образом, металлы реагируют с неметаллами. В таких реакциях неметаллы, принимая электроны, приобретают обычно НИЗШУЮ степень окисления.
Рассмотрим пример. Пусть алюминий реагирует с серой:
Вопрос. Какой из этих химических элементов способен только отдавать электроны? Сколько электронов?
Алюминий — металл, имеющий на внешнем уровне 3 электрона (III группа!), поэтому он отдаёт 3 электрона:
Поскольку атом алюминия отдает электроны, атом серы принимает их.
Вопрос. Сколько электронов может принять атом серы до завершения внешнего уровня? Почему?
У атома серы на внешнем уровне 6 электронов (VI группа!), следовательно, этот атом принимает 2 электрона:
Таким образом, полученное соединение имеет состав:
В результате получаем уравнение реакции:
Задание 8.5. Составьте, рассуждая аналогично, уравнения реакций:
- кальций + хлор (Cl2);
- магний + азот (N2).
Составляя уравнения реакций, помните, что атом металла отдаёт все внешние электроны, а атом неметалла принимает столько электронов, сколько их не хватает до восьми.
Названия полученных в таких реакциях соединений всегда содержат суффикс ИД:
Корень слова в названии происходит от латинского названия неметалла (см. урок 2.4).
Металлы реагируют с растворами кислот (см. урок 2.2). При составлении уравнений подобных реакций и при определении возможности такой реакции следует пользоваться рядом напряжений (рядом активности) металлов:
- Металлы, стоящие в этом ряду до водорода, способны вытеснять водород из растворов кислот:
Задание 8.6. Составьте уравнения возможных реакций:
- магний + серная кислота;
- никель + соляная кислота;
- ртуть + соляная кислота.
- Все эти металлы в полученных соединениях двухвалентны.
- Реакция металла с кислотой возможна, если в результате её получается растворимая соль. Например, магний практически не реагирует с фосфорной кислотой, поскольку его поверхность быстро покрывается слоем нерастворимого фосфата:
- Металлы, стоящие после водорода, могут реагировать с некоторыми кислотами, но водород в этих реакциях не выделяется:
Задание 8.7. Какой из металлов — Ва, Mg, Fе, Рb, Сu — может реагировать с раствором серной кислоты? Почему? Составьте уравнения возможных реакций.
- Металлы реагируют с водой, если они активнее железа (железо также может реагировать с водой). При этом очень активные металлы (Li – Al) реагируют с водой при нормальных условиях или при небольшом нагревании по схеме:
- где х — валентность металла.
Задание 8.8. Составьте уравнения реакций по этой схеме для К, Nа, Са. Какие ещё металлы могут реагировать с водой подобным образом?
Возникает вопрос: почему алюминий практически не реагирует с водой? Действительно, мы кипятим воду в алюминиевой посуде, — и… ничего! Дело, в том, что поверхность алюминия защищена оксидной пленкой (условно — Al2O3).
Если её разрушить, то начнётся реакция алюминия с водой, причём довольно активная. Полезно знать, что эту плёнку разрушают ионы хлора Cl–.
А поскольку ионы алюминия небезопасны для здоровья, следует выполнять правило: в алюминиевой посуде нельзя хранить сильно солёные продукты!
Вопрос. Можно ли хранить в алюминиевой посуде кислые щи, компот?
- Менее активные металлы, которые стоят в ряду напряжений после алюминия, реагируют с водой в сильно измельчённом состоянии и при сильном нагревании (выше 100 °C) по схеме:
- Металлы, менее активные, чем железо, с водой не реагируют!
- Металлы реагируют с растворами солей. При этом более активные металлы вытесняют менее активный металл из раствора его соли:
Задание 8.9. Какие из следующих реакций возможны и почему:
- серебро + нитрат меди II;
- никель + нитрат свинца II;
- медь + нитрат ртути II;
- цинк + нитрат никеля II.
Составьте уравнения возможных реакций. Для невозможных поясните, почему они невозможны.
- Следует отметить (!), что очень активные металлы, которые при нормальных условиях реагируют с водой, не вытесняют другие металлы из растворов их солей, поскольку они реагируют с водой, а не с солью:
- А затем полученная щёлочь реагирует с солью:
- Поэтому реакция между сульфатом железа и натрием НЕ сопровождается вытеснением менее активного металла:
Электронное строение металлов и их особенности
Атомы металлов, также как, и неметаллов состоят из положительно заряженного ядра внутри которого находятся протоны и нейтроны, а по орбитам вокруг него движутся электроны. Однако, по сравнению с неметаллами, атомные радиусы металлов намного больше.
Это связано с тем, что валентные электроны атомов металлов (электроны внешнего энергетического уровня) расположены на значительном удалении от ядра и, как следствие, связаны с ним слабее.
По этой причине металлы характеризуются низкими потенциалами ионизации и легко отдают электроны (являются восстановителями в ОВР) при образовании химической связи.
Все металлы за исключением ртути представляют собой твердые вещества с атомной кристаллической решеткой. Рассмотрим строение металлов в кристаллическом состоянии. В атомах металлов имеются «свободные» электроны (электронный газ), которые могут перемещаться по кристаллу даже под действием слабых электрических полей, что обусловливает высокую электропроводимость металлов.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns1, ns2), р- элементы – металлы, расположенные в группах III – VI (ns2np1-4). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами.
Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d1-10ns2. Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов.
Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f1-14(n-1)d0-1ns2.
Физические свойства
Металлы отличаются от неметаллов характерными физическими свойствами:
- имеют металлический блеск;
- проводят электрический ток и тепло;
- не имеют запаха;
- обладают серебристо-серым цветом (исключение – медь и золото).
Благодаря пластичности и плавке металлы могут образовывать сплавы – смеси химических элементов. Большую часть сплавов составляют металлы, остальное – случайные примеси и специально вводимые вещества. Сплавы отличаются высокой прочностью, упругостью, хрупкостью. Широко применяются сплавы на основе железа (чёрные металлы) и алюминия (цветные металлы).
Высокую электропроводность обуславливают свободные электроны, перемещающиеся по кристаллической решётке под действием электрических полей. При нагревании электропроводность уменьшается.
Тест по теме
/10 Вопрос 1 из 10 Чем объясняются восстановительные свойства металлов? Наличием р-орбитали Наличием свободных электронов в кристаллической решётке Большим расстоянием между ядром и электронами Небольшим расстоянием между ядром и электронами Начать тест
Теги
Электрический ток в металлах: подробное объяснение (формулы)
Электрический ток в металлах представляет собой упорядоченное движение свободных электронов. Более подробно об этом читайте далее в нашей статье.
Важно знать
Как известно, электрический ток – это упорядоченный поток носителей электрического заряда. Носители – это заряженные частицы, способные свободно перемещаться во всем объеме тела.
В случае металлов этими частицами являются электроны, которые высвобождаются при образовании связи между атомами металла.
Известно, что металлы в твердом состоянии имеют кристаллическую структуру. Частицы в кристаллах расположены в определенном порядке, образуя пространственную решетку (кристалл).
Наконец, кристаллическая решетка металла образована положительными ионами, погруженными в “облако” хаотически движущихся так называемых свободных электронов, также называемых электронами проводимости.
В зависимости от валентности атомов металла, один атом может освободить от одного до трех электронов при образовании металлических связей. Число таких высвобожденных электронов непосредственно переводится в число носителей заряда.
Это является одним из факторов, влияющих на способность металла проводить электрический ток.
Доказательством того, что ток в металлах вызывается электронами, послужили эксперименты наших отечественных физиков Леонида Исааковича Мандельштама и Николая Дмитриевича Папалекси, а также американских физиков Бальфура Стюарта и Роберта Толмана.
Способность металла проводить электрический ток может быть описана физической величиной, называемой удельным электрическим сопротивлением. Эта физическая величина обозначается греческой буквой ρ (читается как “ро”). Единицей измерения удельного сопротивления является Ом · м, т.е. произведение Ом на метр.
Удельное сопротивление – это константа, которая характеризует материал и имеет различные значения для разных материалов. Например, удельное сопротивление меди составляет 1.72*10-8 Ом · м. Это означает, что электрическое сопротивление медного проводника длиной 1 метр и площадью поперечного сечения 1 м равно 1.72*10-8 Ом .
В целом, чем ниже удельное сопротивление материала, тем лучше он проводит электрический ток.
В таблице ниже приведены некоторые примеры удельного сопротивления часто используемых металлов.
| Металл | Удельное сопротивление (Ом · м) |
| Серебро | 1.59*10-8 |
| Медь | 1.72*10-8 |
| Алюминий | 2.82*10-8 |
| Вольфрам | 5.6*10-8 |
| Железо | 10*10-8 |
Удельное электрическое сопротивление может быть связано с микроскопическими свойствами материала. В частности, он зависит от концентрации носителей заряда и их подвижности.
Движение свободных электронов в металлах не является полностью “свободным”, поскольку во время их движении они взаимодействуют с другими электронами, и прежде всего с ионами кристаллической решетки. Специфика этого движения описывается так называемой классической моделью проводимости.
Основные предположения и выводы этой модели представлены в большом упрощении ниже.
Классическая модель проводимости
Без внешнего электрического поля электроны совершают тепловые хаотические движения, сталкиваясь друг с другом, а также сталкиваясь с ионами кристаллической решетки. В результате такого движения среднее положение электронов практически не меняется (см. рис. 1.).
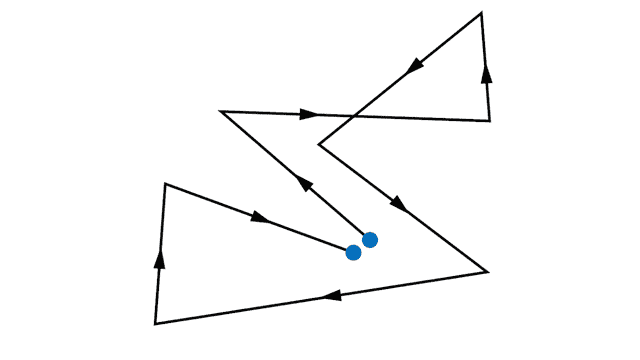 Рис. 1. Пример траектории электрона во время его хаотического теплового движения в металле
Рис. 1. Пример траектории электрона во время его хаотического теплового движения в металле
Из-за квантовых эффектов, и в частности из-за принципа запрета Паули, который не позволяет всем электронам занимать самое низкое энергетическое состояние, средняя скорость электронов в металлах, связанная с их хаотическим тепловым движением, больше, чем скорость частиц в классическом идеальном газе той же температуры. Она составляет порядка 10 м/с.
Если электрическое напряжение U приложено к концам проводника длиной L в нем появится электрическое поле с напряженностью E = U / L
Под действием этого внешнего поля, согласно второму закону динамики, электроны ускоряются: a = F / m,
где F = e*E – сила, с которой электрическое поле действует на электрон с зарядом e. Таким образом, ускорение электрона составляет: a = e*E / m .
Ускоренное движение электрона длится лишь довольно короткое время, пока он не столкнется с иономкристаллической решетки. В результате такого столкновения электрон теряет практически всю свою кинетическую энергию.
Однако замедленный электрон не остается в состоянии покоя – он снова ускоряется под действием электрического поля, снова сталкивается с одним из ионов из ионы кристаллической решетки и т.д.
Этот эффект добавляет к скорости тепловых движений дополнительную направленную среднюю скорость u, которая из-за отрицательного заряда электрона имеет направление, противоположное напряженности внешнего электрического поля. Эта скорость называется средней скоростью дрейфа (рис. 2).
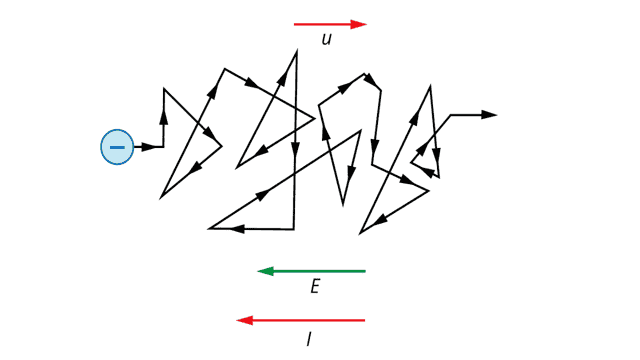 Рис. 2. Дрейф электрона под действием внешнего электрического поля
Рис. 2. Дрейф электрона под действием внешнего электрического поля
В проводнике начинает течь электрический ток с силой тока I (см. рисунок 3).
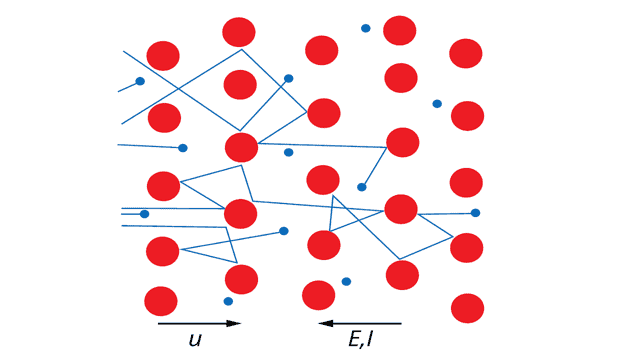 Рис. 3. Дрейфующие электроны сталкиваются с ионами кристаллической решетки
Рис. 3. Дрейфующие электроны сталкиваются с ионами кристаллической решетки
Предполагая, что движение электрона равномерно ускоряется между столкновениями с ионами решетки, с ускорением a = e*E / m , и предполагая, что в результате столкновения электрон передает всю свою кинетическую энергию кристаллической решетке, мы можем вычислить скорость, которую развивает электрон в своем свободном движении: v = a*τ . В этой формуле τ – средний интервал времени между последующими столкновениями дрейфующего электрона с ионами кристаллической решетки.
Поскольку при равномерно ускоренном движении без начальной скорости средняя скорость является средним арифметическим начальной (равной нулю) и конечной скоростью, то получаем: u = v / 2 = e*E*τ / 2*m .
Из полученной формулы следует, что скорость дрейфа, помимо внешнего электрического поля, определяется средним интервалом времени между столкновениями электронов с ионами решетки.
Этот параметр зависит от многих факторов (включая температуру, кристаллическую структуру металла, дефекты кристаллической структуры, примеси) и, как выясняется, существенно влияет на электрическое сопротивление материала.
Средняя дрейфовая скорость электронов составляет порядка 10-4 м/с. Она очень мала по сравнению со скоростью теплового движения, которая составляет порядка 106 м/с.
Классическая теория проводимости достаточно хорошо описывает явление электропроводности в металлах. Однако эта теория не может объяснить экспериментально наблюдаемую зависимость электрического сопротивления от температуры.
Причина упомянутой неудачи классической теории проводимости заключается в том, что она не учитывает влияние ионов решетки на движение электронов между столкновениями.
Более близкие к реальности результаты дает квантовая теория проводимости, которая описывает электроны как частицы, подверженные квантовой статистике, движущиеся в периодическом электрическом поле, создаваемом положительными ионами решетки.
Выводы простым языком
Отрицательный заряд всех свободных электронов по абсолютному значению равен положительному заряду всех ионов решётки. Поэтому в обычных условиях металл электрически нейтрален. Свободные электроны в нём движутся беспорядочно.
Но если в металле создать электрическое поле, то свободные электроны начнут двигаться направленно под действием электрических сил. Возникнет электрический ток.
Беспорядочное движение электронов при этом сохраняется, подобно тому как сохраняется беспорядочное движение в стайке мошкары, когда под действием ветра она перемещается в одном направлении.
« Скорость движения самих электронов в проводнике под действием электрического поля невелика – несколько миллиметров в секунду, а иногда и ещё меньше. Но как только в проводнике возникает электрическое поле, оно с огромной скоростью, близкой к скорости света в вакууме (300 000 км/c), распространяетcя по всей длине проводника. »
Перышкин А. В. Физика 8. – М.: Дрофа, 2010
Как пример, электрический сигнал, посланный, например, по проводам из Москвы во Владивосток (s = 8000 км), приходит туда примерно через 0,03 с.
Одновременно с распространением электрического поля все электроны начинают двигаться в одном направлении по всей длине проводника. Так, например, когда цепь электрической лампы замкнута, электроны в спирали лампы также движутся упорядоченно.
Сравнение электрического тока с потоком воды в водопроводной системе и распространения электрического поля с распространением давления воды поможет нам понять это.
Когда вода поднимается в резервуар для воды, давление (напор) воды очень быстро распространяется по всей системе водоснабжения. Когда мы включаем кран, вода уже находится под давлением и сразу же начинает течь.
Но вода, которая была в кране, течет, а вода из башни достигает крана гораздо позже, потому что вода движется с меньшей скоростью, чем распространяется давление.
Когда говорят о скорости распространения электрического тока в проводнике, то имеют в виду скорость распространения по проводнику электрического поля.
Материаловедение в машиностроении
В твердых телах между атомами действуют силы притяжения и отталкивания. Первые удерживают атомы вместе, при этом образуется целостный материал, вторые не дают атомам слиться. Твердые вещества существуют при равновесии сил притяжения и отталкивания.
Природа сил отталкивания одинакова во всех твердых веществах. Силы отталкивания возникают, когда атомы сближаются так, что орбиты их внешних электронов перекрываются. При этом положительные заряды ядер атомов уже не полностью экранируются, вследствие чего между ними возникают силы отталкивания.
В отличие от сил отталкивания, имеющих одинаковую природу, природа сил притяжения различна и именно она определяет свойства материала. Различают четыре вида связи: ионную, ковалентную, металлическую и связь Вандер-Ваальса.
Ионная связь
Ионная связь присуща соединениям, образованным разнородными атомами. Внешние электроны атомов одного элемента переходят на внешние орбиты атомов другого элемента, образуя устойчивые электронные конфигурации.
В качестве типичного примера вещества с ионным типом связи можно привести поваренную соль – NaCl. Натрий принадлежит к первой группе Периодической системы химических элементов Д. И. Менделеева, на его внешней орбите находится один электрон.
Хлор – элемент седьмой группы, на его внешней орбите расположено семь электронов. Переход одного электрона атома натрия на орбиту хлора приводит к образованию двух ионов с устойчивой конфигурацией, обладающих разными зарядами.
Положительный ион натрия получает устойчивую конфигурацию неона; отрицательный ион хлора – устойчивую конфигурацию аргона (восемь электронов на внешней орбите атома).
Межатомные силы притяжения – электростатические, ионная связь сильная.
Эта связь является направленной, так как перераспределение валентных электронов происходит между атомами одной молекулы (одним атомом натрия и одним атомом хлора). Ионный тип связи присущ неорганическим химическим соединениям.
Сильная связь определяет свойства веществ – высокую температуру плавления, высокий модуль упругости, низкий коэффициент теплового расширения, высокую твердость.
Строение твердого вещества с ионным типом связи характеризуется тем, что атомы в веществе располагаются строго упорядоченно, каждый положительный ион окружают только отрицательные ионы, и наоборот (рис. 1.1). Наиболее известный и широко распространенный материал с ионным типом связи – стекло, основой которого являются оксиды различных элементов.
Рис. 1.1. Кристаллическая решетка NaCl
Ковалентная связь
Ковалентная связь устанавливается в результате образования устойчивых соединений путем обобществления электронов определенными атомами.
Примером ковалентной связи может служить молекула газа, образованная двумя атомами, имеющими каждый но семь электронов на внешней орбите (например, хлор). Устойчивая конфигурация молекулы образуется в результате обобществления по одному электрону каждым из двух атомов (рис.
1.2). Образование устойчивых структур определяется правилом (8 – IV), где N – число электронов на внешней орбите (Лг < 4).
Ковалентный тип связи характерен для элементов IV, V, VI, VII подгруппы таблицы Менделеева – это углерод, кремний, германий и др. Так, для углерода число обобществленных атомов равно четырем. Примером модификации углерода является алмаз.
Ковалентная связь – направленная, так как каждый атом вступает во взаимодействие с вполне определенным числом соседних атомов. Сила ковалентной связи обычно достаточно велика вследствие ее направленного характера.
Ковалентные связи характерны, например, для пластмасс.
Рис. 1.2. Молекула хлора (схема)
Металлическая связь
Эта связь характерна для металлов – основных конструкционных машиностроительных материалов.
Атомы металлов имеют небольшое количество (один или два) внешних (валентных) электронов, которые слабо связаны с ядром. При сближении атомов электроны, находящиеся на внешних оболочках, теряют связь со своими атомами, они коллективизируются, т.е.
становятся достоянием всех атомов данного металла, могут свободно перемещаться между положительно заряженными ионами, образуя «электронный газ». Такие электроны называют электронами проводимости, или коллективизированными электронами, поскольку они принадлежат не какому-то конкретному атому, а являются общими для всех атомов.
Наличие электронного газа определяет свойства металла, принципиально отличающие его от неметаллов: высокие тепло- и электропроводность.
Положительно заряженные ионы располагаются на таком расстоянии друг от друга, что силы притяжения между отрицательно заряженными электронами и положительно заряженными ионами уравновешиваются силами отталкивания между ионами.
Металлическая связь является ненаправленной. Отсутствие сильных направленных связей между атомами металлов определяет одно из их важнейших, уникальных свойств – пластичность, т.е. способность пластически деформироваться, изменяя форму без разрушения. Поэтому при изготовлении металлопродукции широко применяют методы пластического деформирования – ковку, прокат, волочение.
Силы Ван-дер-Ваальса
Происхождение этих сил связано с тем, что атомы являются малыми диполями.
Среднее во времени пространственное распределение электронов в атоме симметрично относительно ядер, но в каждый конкретный момент центр отрицательных зарядов может не совпадать с ядром, имеющим положительный заряд, что и образует диполь (рис. 1.3).
Взаимодействие диполей приводит к появлению сил притяжения. Это взаимодействие несколько усиливается вследствие того, что наличие диполя, образованного одним атомом, способствует преобразованию в диполь соседнего атома.
Рис. 1.3. Силы Ван-дер-Ваальса. Взаимодействие диполей
Межатомные силы Ван-дер-Ваальса существуют во всех веществах наряду с рассмотренными выше силами межатомных связей. Они слабы и оказываются важными и значимыми, т.е. влияющими на свойства материала, только в отсутствие более сильных связей других типов. К таким материалам относятся полимеры – органические вещества, графит – неорганическое вещество.
Лекция по Химии на тему "Металлы"
- УЧЕБНАЯ
ДИСЦИПЛИНА: ХИМИЯ
Тема: Металлы - Задание №1
- Ознакомьтесь с лекционным материалом по
теме. - Задание №2
- Ответить на вопросы:
1.
Где расположены металлы в периодической системе химических элементов
Д.И.Менделеева?
2.
Каковы особенности строения атомов металлов?
3. В чём различие в строении внешнего энергетического уровня у металлов и
неметаллов?
4. Сколько наружных электронов имеют атомы металлов главных и побочных
подгрупп?
5. В каких формах могут находиться металлы в природе?
6. Как устроена кристаллическая решетка металлов?
7. Каковы физические свойства металлов?
8.
Как можно получить металлы из их соединений?
9. Как ведут себя атомы металлов в химических реакциях и почему?
10. Какие свойства – окислителей или восстановителей – проявляют металлы в
химических реакциях?
11. Расскажите об электрохимическом ряде напряжений металлов.
12. Перечислите реакции, в которые могут вступать металлы.
13. Каково значение металлов в жизни человека?
Лекция
1. Особенности
электронного строения металлов.
Металлы — это химические элементы, атомы которых отдают электроны внешнего (а
иногда предвнешнего) электронного слоя, превращаясь в положительные ионы.
Металлы – восстановители Ме0 – nе = Меn+.
Это обусловлено небольшим числом электронов внешнего слоя (в основном 1 — 3),
большим радиусом атомов, вследствие чего эти электроны слабо удерживаются
с ядром.
2. Положение
металлов в ПСХЭ.
Легко
увидеть, что большинство элементов ПСХЭ – металлы (92 из 114).
Металлы размещены в левом нижнем углу ПСХЭ. Это все элементы,
расположенные ниже диагонали В – Аt, даже
те у которых на внешнем слое 4 электрона ( Je, Sn, Pb),
5 электронов ( Sb, Di), 6 электронов ( Po), так
как они отличаются большим радиусом. Среди них есть s и p-элементы
– металлы главных подгрупп, а также d и f металлы,
образующие побочные подгруппы.
В
соответствии с местом, занимаемым в периодической системе, различают переходные
(элементы побочных подгрупп) и непереходные металлы (элементы главных
подгрупп). Металлы главных подгрупп характеризуются тем, что в их атомах
происходит последовательное заполнение электронных s- и р-подуровней. В атомах
металлов побочных подгрупп происходит достраивание d- и f-подуровней.
Закономерности в изменении
свойств элементов – металлов.
| Признаки сравнения | В главной подгруппе | В периоде |
| Число электронов на внешнем слое | не изменяется | увеличивается |
| Радиус атома | увеличивается | уменьшается |
| Электроотрицательность | уменьшается | увеличивается |
| Восстановительные свойства | усиливаются | уменьшаются |
| Металлические свойства | усиливаются | уменьшаются |
У элементов – металлов побочных подгрупп свойства чуть-чуть
другие.
В
побочных подгруппах (Cu, Ag, Au) – активность
элементов – металлов падает. Эта закономерность наблюдается и у элементов
второй побочной подгруппы Zn, Cd, Hg.
У элементов побочных подгрупп – это элементы 4-7 периодов – с увеличением
порядкового элемента радиус атомов изменятся мало, а величина заряда ядра
увеличивается значительно, поэтому прочность связи валентных электронов с ядром
усиливается, восстановительные свойства ослабевают.
3. Металлическая
химическая связь. Кристаллические решетки.
Связь в металлах между («атом-ионами» ) посредством (большого
количества не связанных с ядрами подвижных электронов) называется (металлической
связью).
Все
металлы являются кристаллическими телами, имеющими определенный тип
кристаллической решетки, состоящей из малоподвижных положительно заряженных
ионов, между которыми движутся свободные электроны (так называемый электронный
газ). Такой тип структуры называется металлической связью.
-
Тип решетки определяется формой элементарного геометрического тела,
многократное повторение которого по трем пространственным осям образует решетку
данного кристаллического тела. - Обобщим
сведения о типе химической связи, образуемой атомами металлов и строение
кристаллической решетки: -
— сравнительно небольшое количество электронов одновременно связывают
множество ядер, связь делаколизована; -
— валентные электроны свободно перемещаются по всему куску металла,
который в целом электронейтрален; -
— металлическая связь не обладает направляемостью и насыщенностью. - 4. Физические
свойства металлов -
В соответствие именно с таким строением металлы характеризуются общими
физическими свойствами.
а) твердость – все металлы кроме ртути, при обычных
условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом;
самый твердый хром – царапает стекло.
б) плотность. Металлы делятся на мягкие (5г/см³) и
тяжелые (меньше 5г/см³).
в) плавкость. Металлы делятся на легкоплавкие и
тугоплавкие.
г) электропроводность, теплопроводность металлов обусловлена
их строением. Хаотически движущиеся электроны под действием электрического
напряжения приобретают направленное движение, в результате чего возникает
электрический ток.
При повышении температуры амплитуда движения атомов и ионов, находящихся в
узлах кристаллической решетки резко возрастает, и это мешает движению
электронов, и электропроводность металлов падает.
д) металлический
блеск – электроны, заполняющие межатомное пространство отражают
световые лучи, а не пропускают как стекло. Поэтому все металлы в
кристаллическом состоянии имеют металлический блеск.
Для большинства металлов в
ровной степени рассеиваются все лучи видимой части спектра, поэтому они имеют
серебристо-белый цвет. Только золото и медь в большой степени поглощают
короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый
цвет.
Самые блестящие металлы – ртуть, серебро, палладий. В порошке все
металлы, кроме Al и Mg, теряют блеск и имеют
черный или темно-серый цвет.
е) пластичность. Механическое
воздействие на кристалл с металлической решеткой вызывает только смещение слоев
атомов и не сопровождается разрывом связи, и поэтому металл характеризуется
высокой пластичностью.
Некоторые металлы, например, железо, титан, олово и др. способны по достижении
определенных температур изменять кристаллическое строение. Это явление получило
название аллотропии или полиморфизма, а сами переходы от одного
кристаллического строения к другому называются аллотропическими или
полиморфными.
- 5. Химические
свойства металлов - Ряд
напряжений характеризует химические свойства металлов: чем меньше электродный
потенциал металла, тем больше его восстановительная способность. - А)
Взаимодействие с неметаллами (в названиях полученных
веществ окончание - -иды)
- 2Mg0+O20—>2Mg2+O2- (оксид магния)
- Fe0+S0—>Fe2+S2- (сульфиджелеза II)
- Б)
Взаимодействие с водой. Самые активные
металлы реагируют с водой при обычных условиях, и в результате
этих реакций образуются растворимые в воде основания и выделяется водород - 2Na + 2HOH =
2NaOH + H2 - 2Li0+2H2+O2– —>
2Li+O2-H+ + H20 - Менее
активные металлы реагируют с водой при
повышенной температуре с выделением водорода и образованием оксида
соответствующего
металла
Zn
+ H2O = ZnO +H2 - В)
Взаимодействие с растворами кислот. Происходит при соблюдении ряда условий - · Металл
должен находиться левее в ряду напряжений металлов; - · В
результате реакции должна образовываться растворимая соль, иначе металл
покроется осадком и доступ кислоты к металлу прекратиться; - · Для
этих реакций не рекомендуется использовать щелочные металлы, так как они
взаимодействуют с водой в растворе кислоты; - · По
особому взаимодействуют с металлами концентрированные азотная и серная кислоты; - 2H+Cl– +Zn0
→ Zn2+Cl2- +H20 - Г)
Взаимодействие с растворами солей. При этом соблюдаются следующие условия - · Металл
должен находиться в ряду напряжений левее металла, образующего соль; - · В
результате реакции должна образовываться растворимая соль, иначе металл
покроется осадком и доступ кислоты к металлу прекратиться; - · Для
этих реакций не рекомендуется использовать щелочные металлы, так как они
взаимодействуют с водой в растворе соли; - Fe0+Cu2+Cl2– →Fe2+Cl2– +Cu0
- Д)
Взаимодействие со щелочами (только амфотерные) - Be + 2NaOH + 2H2O
= Na2[Be(OH)4] + H2 - Магний
и щелочноземельные металлы с щелочами не реагируют. - Е)
Взаимодействие с оксидами металлов (металлотермия). - Некоторые
активные металлы способны вытеснять другие металлы из их оксидов при поджигании
смеси. - 2Al0 + Fe2O3 = Al2O3 +2Fe
- Ж) Коррозия (будет
рассмотрена на другом занятии). - 6. Способы
получения металлов
Существуют
несколько основных способов получения — металлов.
а) Пирометаллургия – это получение металлов из их
соединений при высоких температурах с помощью различных восстановителей (C, CO,
H2, Al, Mg и др.).
—
из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия
4Аl + ЗМnО2 = 2А12О3 + ЗМn
б) Гидрометаллургия – это получение металлов,
которое состоит из двух процессов: сначала природное соединение металла (оксид)
растворяют в кислоте, в результате чего получают соль металла. Затем из
полученного раствора необходимый металл вытесняют более активным металлом.
Например:
- CuO +
H2SO4 = CuSO4 + H2O, - CuSO4 +
Zn = ZnSO4 + Cu. - Обжигом
сульфидов металлов и последующим восстановлением образовавшихся оксидов
(например, углем):
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
в) Электрометаллургия – это получение металлов при
электролизе растворов или расплавов их соединений. Роль восстановителя при этом
играет электрический ток.
- СuСl2 →
Сu2+ 2Сl-
Катод (восстановление): Сu2+ — 2е- = Сu0 - Анод
(окисление): 2Cl- — 2е- = Сl°2






